Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.43 n.4 Ciudad de la Habana dic. 2009
ARTÍCULOS ORIGINALES
Estabilidad del colirio de pilocarpina 2 %
Stability of 2 % Pilocarpine eyedrops
Martha Botet GarcíaI; Caridad Margarita García PeñaII; Vivian Martínez EspinosaIII; Bárbara Moreno CorreosoIV
ILicenciada en Ciencias Farmacéuticas. Máster en Tecnología y Control de Medicamentos. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
IILicenciada en Ciencias Farmacéuticas. Máster en Tecnología y Control de Medicamentos. Investigador Agregado. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IIITécnico Medio en Tecnología Farmacéutica. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
IVTécnico Medio en Química. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
RESUMEN
Se desarrolló el estudio de estabilidad del colirio de pilocarpina 2 % y se determinó su fecha de vencimiento. Se emplearon los métodos de vida de estante y de estabilidad acelerada mediante cromatografía líquida de alta eficiencia, validados en el Centro de Investigación y Desarrollo de Medicamentos. El estudio de vida de estante se efectuó por un periodo de 24 meses a temperatura ambiente, mientras que en el estudio de estabilidad acelerada se sometió el producto a la influencia de la temperatura durante 6 meses. La formulación de pilocarpina 2 % cumplió con las especificaciones de calidad descritas en la farmacopea. Los resultados del estudio de estabilidad por vida de estante después de transcurridos los 24 meses indican que el producto mantiene los parámetros que determinan su calidad durante ese tiempo, y en los estudios acelerados no se observó degradación significativa del producto. Se establece 2 años como fecha de vencimiento en las condiciones señaladas.
Palabras clave: Pilocarpina, estudio acelerado, vida de estante, cromatografía líquida de alta eficiencia.
ABSTRACT
Authors carried out the study of 2 % Pilocarpine eyedrops stability and its expiry date was determined. Shelf life and accelerated stability methods were used by high-performance liquid chromatography, validated in Drugs Development and Research Center. Shelf life study was carried out during 24 months at room temperature, whereas in the accelerated stability study the product undergoes the temperature influence during 6 months. The 2 % Pilocarpine formula fulfilled with quality specifications described in Pharmacopeia. Results of stability by shelf life after 24 months suggest that product maintain the parameter determining its quality during that period and in accelerated studies there was not a significant degradation of product. The expiry date was of 2 years under the fixed conditions.
Key words: Pilocarpine accelerated study, shelf life, high-performance liquid chromatography.
INTRODUCCIÓN
El clorhidrato de pilocarpina es una amina terciaria, parasimpaticomimética que estimula directamente los receptores colinérgicos. Produce la contracción del músculo esfínter del iris, da lugar a la constricción del músculo pupilar (miosis), constricción del músculo ciliar (acomodación), lo que provoca el aumento de la acomodación y una reducción de la presión intraocular, asociada con un incremento del flujo de salida y un decremento del flujo de entrada del humor acuoso. Además también puede inhibir la secreción del humor acuoso.
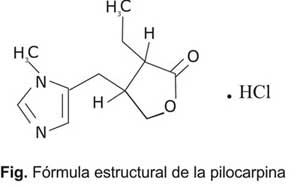
Su nombre genérico, pilocarpina, se corresponde con el nombre trivial del principio activo, pero el nombre químico es 2(3H)furonona, 3etildihidro4[(1metil1H-imidazol-5-il)metil], monoclorhidrato, (3Scis), la fórmula global y el peso molecular son C11H16N2O2 ·HCl y 244,7, respectivamente. En la figura se muestra la fórmula estructural del principio activo.1,2
La estabilidad de los productos farmacéuticos representa un importante eslabón en el desarrollo y formulación de toda forma terminada. De esta manera se puede definir las condiciones de almacenamiento en el envase propuesto y establecer la vida útil del producto farmacéutico. Estos estudios contemplan la conservación de la potencia, pureza, características organolépticas y su efectividad.3,4
El Centro para el Control Estatal de los Medicamentos (CECMED) exige para el registro de un nuevo medicamento la realización de los estudios de estabilidad. En el presente estudio se empleó un método analítico desarrollado y validado en el Centro de Investigación y Desarrollo de Medicamentos (CIDEM) para el estudio de estabilidad del producto debido a que en la USP 275 se realiza el análisis de valoración y disolución con condiciones cromatográficas diferentes.
El presente trabajo tuvo como objetivo realizar el estudio de estabilidad de una formulación de colirio de pilocarpina 2 % y determinar su fecha de vencimiento.
MÉTODOS
Para el desarrollo de este estudio se empleó como materia prima ilocarpina clorhidrato, perteneciente al lote 3005 del fabricante Bochringer Ingelheim, con una pureza de 99,5 %, la cual fue analizada sigún las especificaciones de calidad descritas en la monografía de la USP 27.
Este estudio se realizó por los métodos de vida de estante y estabilidad acelerada. Se emplearon muestras de los lotes 1020, 2003 y 2004, producidos en la Empresa Farmacéutica "Julio Trigo" (La Habana, Cuba) y envasados en frascos plásticos de polietileno de baja densidad por 5 mL (conformados, dosificados y sellados en la máquina Bottelpack, con tapas perforantes de polipropileno de alta densidad, prefabricados). La formulación del colirio emplea como sustancias auxiliares cloruro de benzalconio, fosfato de sodio monobásico dihidratado, fosfato de sodio dibásico anhidro.
En el estudio se empleó un cromatógrafo (KNAUER) con detector UV/VIS (KNAUER) ajustado a 215 nm, un dosificador (loop) de 20 µL e integrador (SHIMADZU CR 8 A). La separación se realizó isocráticamente sobre una columna Hypersil ODS, RP-18 (5 µm). La fase móvil consistió en una mezcla desgasificada de solución de KH2PO4 0,02 M, acetonitrilo (88:12) con una velocidad de flujo de 1,5 mL/min. El método analítico empleado fue validado demostrándose previamente que era específico, lineal, preciso y exacto en el intervalo de concentraciones estudiadas.6
Estabilidad acelerada
En los estudios de estabilidad acelerada se almacenaron las muestras de los lotes estudiados en un horno a temperatura controlada de 40 ºC y 75 % de humedad relativa; se valoraron al inicio, al mes, a los 2, 3 y 6 meses.
Estabilidad por vida de estante
En el estudio de estabilidad por vida de estante, los lotes estudiados se almacenaron a temperatura ambiente (30 ºC) y protegidos de la luz; se valoraron al inicio, a 3, 6, 9, 12, 18 y 24 meses de fabricados.
Estadística
Con el objetivo de realizar una comparación estadística entre los resultados se empleó el procesador estadístico Minitab 14.0.
RESULTADOS
Los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa, correspondiente a los lotes 1020, 2003 y 2004, se reportan en la tabla 1; se demuestra que el producto terminado no presenta cambios significativos.
Los resultados del estudio de vida de estante, al inicio, 3, 6, 9, 12, 18 y 24 meses, se muestran en la tabla 2; se observa que el producto terminado cumple con las especificaciones de calidad durante el estudio.
Tabla 2. Estudio de vida de estante del colirio de pilocarpina 2%
| Indicadores | Tiempo (meses) | Lotes | ||
| 1020 | 2003 | 2004 | ||
| Características organolépticas | 0 | Responde | Responde | Responde |
| 3 | Responde | Responde | Responde | |
| 6 | Responde | Responde | Responde | |
| 9 | Responde | Responde | Responde | |
| 12 | Responde | Responde | Responde | |
| 18 | Responde | Responde | Responde | |
| 24 | Responde | Responde | Responde | |
|
pH | 0 | 4,97 | 4,67 | 4,81 |
| 3 | 4,82 | 4,49 | 4,72 | |
| 6 | 4,56 | 4,12 | 4,48 | |
| 9 | 4,32 | 4,03 | 4,29 | |
| 12 | 4,28 | 3,91 | 4,18 | |
| 18 | 3,98 | 3,79 | 3,99 | |
| 24 | 3,89 | 3,63 | 3,78 | |
|
Valoración (%) | 0 | 101,4 | 104,8 | 105,6 |
| 3 | 100,3 | 103,6 | 104,5 | |
| 6 | 99,0 | 101,6 | 102,8 | |
| 9 | 97,9 | 100,2 | 101,0 | |
| 12 | 96,4 | 99,3 | 100,2 | |
| 18 | 95,8 | 98,1 | 99,6 | |
| 24 | 94,9 | 96,9 | 98,9 | |
| Esterilidad | 0 | Cumple | Cumple | Cumple |
| 24 | Cumple | Cumple | Cumple | |
Los límites para los indicadores determinados se corresponden con los descritos en la tabla 1.
DISCUSIÓN
El método analítico empleado para la cuantificación del principio activo en el estudio de estabilidad, fue validado demostrándose previamente que era específico, lineal, preciso y exacto en el intervalo de concentraciones estudiadas. Las sustancias auxiliares que componen el colirio: cloruro de benzalconio, fosfato de sodio monobásico dihidratado, fosfato de sodio dibásico anhidro, no interfirieron en la determinación del principio activo, ya que no se obtuvieron señales al mismo tiempo de retención del principio activo. El método analítico empleado permitió detectar separadamente el principio activo sin interferencias de los posibles productos de degradación, ya que los tiempos de retención son diferentes.6
Los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa, demuestran la estabilidad del producto. Durante el período evaluado, los 3 lotes analizados mantienen las características organolépticas, pH y la concentración del principio activo. Se demostró la estabilidad térmica del producto, ya que después de transcurridos 6 meses se mantuvo la concentración conforme con los límites establecidos en las especificaciones de calidad del producto terminado.2-4 No se observan productos de degradación del principio activo en el tiempo de duración del estudio, ya que no se evidencia el pico correspondiente al producto de degradación, al aplicar la técnica descrita y validada por Botet García y otros, en el 2007.6
De los resultados mostrados en la tabla 2 se infiere que el producto mantiene los parámetros que determinan su calidad, tanto en su etapa inicial como transcurridos 3, 6, 9, 12, 18 y 24 meses. Además, no se observan cambios significativos en los aspectos organolépticos, pH y la valoración durante el tiempo de almacenamiento estudiado, según lo reportado en la Regulación No. 16-2000: Buenas Prácticas de Fabricación de Productos Farmacéuticos, porque los valores de pH se encuentran dentro de los límites establecidos; no se observaron variaciones en las características organolépticas y la disminución del principio activo al comparar los valores iniciales y los valores finales fueron menores que el 5 %, valor establecido por el órgano regulador, para ser considerado como cambio significativo.3 No se observan productos de degradación del principio activo en el tiempo de duración del estudio, ya que no se evidencia el pico correspondiente al producto de degradación, al aplicar la técnica descrita y validada por Botet García y otros, en el 2007.6 A partir de estos resultados se proponen 2 años de validez, como tiempo de expiración, para la formulación de pilocarpina 2 % colirio, para lo que se emplearon como material de envase los frascos plásticos de polietileno de baja densidad por 5 mL (conformados, dosificados y sellados en la máquina Bottelpack, con tapas perforantes de polipropileno de alta densidad, prefabricados).2-4
Los resultados de los estudios de estabilidad acelerada y de vida de estante, demostraron la estabilidad física, química y microbiológica del producto por espacio de 24 meses a temperatura ambiente, ya que en todos los casos los resultados se encontraron dentro de los límites establecidos en las especificaciones de calidad del colirio de pilocarpina al 2 %.
REFERENCIAS BIBLIOGRÁFICAS
1. Martindale W. The extra Pharmacopoeia 28th ed. London: Pharmaceutical Press; 1989. p. 1224-6.
2. Vademécum Internacional. Especialidades Farmacéuticas y Biológicas. 7ma. ed. Buenos Aires: ECSA.; 2001.
3. Regulación No. 16-2000: Buenas Prácticas de Fabricación de Productos Farmacéuticos. La Habana: Centro Estatal para el Control de Medicamentos (CECMED); 2000.
4. United States Pharmacopoeial Convention. USP 29. Validation of Compendial Methods. 29 ed. Rockville: Mack Printing; 2006. p. 1256-8, 1982-4.
5. United States Pharmacopoeial Convention. USP 27. United States Pharmacopeia. 27 ed. Rockville: Mack Printing; 2004.
6. Botet García M, García Peña CM, Aylema Romero J, Rodríguez C, Martínez Espinosa V. Desarrollo de un método para el control de la calidad del colirio de pilocarpina 2 %. Rev Cubana Farm. 2007;41(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034 -75152007000200005&lng=es&nrm=iso&tlng=es
Recibido: 16 de julio de 2009.
Aprobado: 20 de agosto de 2009.
M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1605 entre Boyeros y Puentes Grandes, municipio Plaza de la Revolución, CP. 10 600, La Habana, Cuba.