Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.1 Ciudad de la Habana ene.-mar. 2010
PRODUCTOS NATURALES
Validación de la técnica para la determinación de catequina en tabletas de Rhizophora mangle L. por CLAR
Validation of the technique to assessment of tablets Catechin from Rhizophora mangle L. by HPLC
Luz María Sánchez PerreríaI; Betty Mancebo DorvignyII; Roberto Faure GarcíaIII; María del Carmen TraviesoIV
IDoctora en Ciencias. Licenciada en Química. Investigador Titular. Centro Nacional de Sanidad Agropecuaria (CENSA). San José de las Lajas, La Habana, Cuba.
IILicenciada en Farmacia. CENSA. San José de las Lajas, La Habana, Cuba.
IIIDoctor en Ciencias. Médico Veterinario. Investigador Titular. CENSA. San José de las Lajas, La Habana, Cuba.
IVLicenciada en Farmacia. Investigador Auxiliar. CENSA. San José de las Lajas, La Habana, Cuba.
RESUMEN
Se realizó la validación del método de cromatografía líquida de alta resolución para la determinación cuantitativa de catequina como sustancia marcador en las tabletas obtenidas a partir del extracto seco de las cortezas de Rhizophora mangle L., empleadas en el tratamiento de úlceras gastroduodenales. Considerando que el método se clasifica como tal para la determinación cuantitativa del compuesto mayoritario o ingrediente activo en formulaciones o materia prima, se evaluaron los parámetros: especificidad, linealidad, exactitud, sensibilidad y precisión expresada en sus 2 formas: repetibilidad y precisión intermedia. Los resultados obtenidos demostraron que el método empleado es confiable, pues permitió la determinación del compuesto en presencia de otras sustancias, incluyendo excipientes y sustancias auxiliares, y detectó la presencia de productos de degradación. Además, el procesamiento estadístico de los resultados evidenció la linealidad, precisión, sensibilidad y exactitud del método.
Palabras clave: Rhizophora mangle L., fracción acetato de etilo de polifenoles, catequina, cromatografía líquida de alta resolución, control de calidad, estudio de estabilidad.
ABSTRACT
Authors made the high-performance liquid chromatography method validation to the quantitative assessment of cathechin as a marker substance in tablets obtained from the bark of Rhizophora mangle L. dry extract used in gastroduodenal ulcers treatment. Considering that this method as such is classified to quantitative assessment of the major compound or active ingredient in formulae or raw material, the following parameters were assessed : linearity, accuracy, sensitivity and precision expressed in its two ways: repetition and intermediate precision. Results obtained showed that this method is reliable allowing the compound assessment in presence of other substances, including excipients and auxilliary substances and to detect the presence of degradation products. Also, the statistical processing of results evidenced the linearity, precision, sensitivity and accuracy of this method.
Key words: Rhizophora mangle L., ethyl-acetate fraction of polyphenols, cathechin, high-performance liquid chromatography, quality control, stability study.
INTRODUCCIÓN
Rhizophora mangle L. es un árbol de una alta distribución geográfica en el archipiélago cubano. En estudios previos se demostró la actividad del extracto seco de las cortezas de esta planta en el tratamiento de úlceras gastroduodenales.1-3 Por lo que se procedió a la obtención de formas terminadas sólidas para el tratamiento de úlceras gástricas y duodenales en humanos. En nuestro caso se obtuvieron 3 formulaciones sólidas: tabletas núcleo y fílmicas (gástricas) y entéricas (duodenales).
Del extracto seco activo se demostró la mayor actividad biológica de la fracción de acetato de etilo obtenida a partir del extracto total y se conoce por estudios previos, la composición química de esta fracción en compuesto polifenólicos monoméricos.4 Estos compuestos son: ácido gálico, epicatequina, catequina, ácido clorogénico y ácido elágico. En la forma de secado del extracto acuoso por spray drier constituye la catequina el compuesto mayoritario, al que se le han definido actividades biológicas, por lo que se empleará como sustancia marcador en la determinación de principios activos en las tabletas tanto para el control de calidad como para estudios de estabilidad.
El objetivo de este trabajo es validar el método analítico propuesto, el cual se clasifica como método para la determinación cuantitativa de ingrediente activo o compuesto mayoritario en formulaciones, materia prima y estudios de estabilidad de las tabletas.5,6
MÉTODOS
La sustancia de referencia catequina es de la firma Sigma. Los productos terminados en forma de tabletas, fueron elaborados en la Empresa PHARMALAB de Guatemala por personal del Centro Nacional de Sanidad Agropecuaria, CENSA.
Todos los reactivos utilizados fueron de calidad puro para análisis.
El desarrollo del método analítico por cromatografía líquida de alta resolución se realizó con sistemas de bomba isocrática Knauer, detector UV Knauer, con las siguientes condiciones cromatográficas:
Columna: LiChrosorb, RP-18, 5 µm, 125 x 4 mm d.i.
Fase móvil: MeOH: ácido acético 2 % (20:80 v/v)
Detector: ultravioleta variable a longitud de onda de 254 nm
Velocidad de flujo: 0,8 mL/min
Volumen de inyección: 20 µL
Sistema de detección acoplado a computadora con Programa BIOCHROM, para el análisis de tiempos de retención y área de los picos.
La solución de referencia se obtiene disolviendo catequina sustancia patrón en metanol para obtener una concentración de 1 mg/mL.
La obtención de la fracción de acetato de etilo se obtiene a partir de 20 tabletas en estudio trituradas, con la adición de 100 mL de agua destilada y con ayuda de calor a 60 ºC. A esta solución se le añaden 36 g de cloruro de sodio para precipitar a los polifenoles de mayor peso molecular. Se centrifuga a 3 500 rev/min durante 15 min y el sobrenadante se procede a su extracción sucesiva con acetato de etilo (3 extracciones). La fracción de acetato de etilo se lleva a sequedad en evaporador rotatorio y se disuelve en 10 mL de metanol para su inyección en cromatografía líquida de alta resolución (CLAR).
Especificidad-selectividad
Con el objetivo de evaluar la especificidad del método se utilizaron las muestras de sustancia de referencia, placebo y muestra (tabletas) sometida a condiciones drásticas como: hidrólisis ácida HCl 1 N, hidrólisis básica NaOH 1 N, oxidación H2O2 y termólisis a temperatura de 105 oC durante 1 h. Se realizó como primer paso el análisis de interferencia o no del placebo y de la matriz de las muestra en la determinación del marcador. Las tabletas son sometidas al mismo proceso de extracción y dilución, inyectando 20 µL de cada tipo de muestras por triplicado y se observó la presencia de picos interferentes con la detección del marcador, mediante la comparación de los cromatogramas de las muestras en estudio.
Todas las muestras se filtraron por filtro 0,45 µm e inyectaron por triplicado, observando la presencia de un nuevo pico y/o superposición de algún componente.
Linealidad
Para la determinación del analito como ingrediente activo de una formulación se recomienda un rango desde 50 hasta 150 % y con 5 o 7 puntos experimentales.
En nuestro caso como el método se aplicará para la determinación del analito en estudios de estabilidad se utilizó una curva de calibración en el rango de 0 hasta 120 %. El estudio de linealidad se realizó durante 3 o 4 días. Se empleará patrón de catequina puro en concentraciones que estén entre el 50 y el 150 % del valor promedio obtenido para el marcador en las tabletas. Se consideró en este estudio el valor medio de la concentración de catequina en las 3 tabletas, el que es de 0,31 mg cat/tab (100 %). Se emplearon 5 niveles de concentración con 3 réplicas por cada nivel. Se preparó catequina de 1 mg/mL de concentración y a partir de ella se obtuvieron el resto de los puntos de la curva.
Precisión
Se realizó el cálculo de la precisión del método expresada en sus 2 formas: repetibilidad, precisión intermedia. La repetibilidad se realizó sobre la base de: la pesada individual de 20 tabletas, calculando el peso promedio, constituyendo una muestra homogénea, la cual se sometió al proceso analítico descrito para la obtención de la fracción de acetato de etilo. De la solución de trabajo en metanol. Se realizaron 20 inyecciones de la muestra homogénea y se determinó el tiempo de retención (tr) y el área (a) del marcador.
Esto se realizó para determinar la dispersión de las medidas alrededor del valor medio, al analizar múltiples alícuotas de la muestra.
En nuestro caso se estudió solo las tabletas entéricas.
La precisión en condiciones intermedias se realizó con Igual muestra homogénea que en el estudio de repetibilidad pero inyectadas 6 veces por cada analista, en días diferentes (2 analistas, 2 días= 24 inyecciones).
Robustez (tolerancia). En este estudio se tomaron las variables: cambio de columnas, día de análisis y cambio de lotes de fase móvil.
Exactitud
Para el estudio de exactitud se empleó el método de recuperación, se realizó
Exactitud del método sobre el placebo (excipientes) como matriz. Para la exactitud del método se empleó el método de recuperación para lo cual se cargaron los placebos (tabletas placebos) con diferentes niveles de catequina. Se realizó el modelo de 5 réplicas para 3 concentraciones diferentes: 50, 100 y 150 %, y se determinó el porcentaje de recuperación, la desviación estándar y el coeficiente de variación. Se determinó la prueba t de Student para determinar diferencias significativas entre la recuperación baja, media y alta.
Exactitud del sistema sobre las tabletas como matriz. Se tomaron 3 muestras de 20 tabletas entéricas cada una como matriz y se procedió igual que lo descrito al efecto (100 %), basal; con otras 2 muestras se procedió para obtener el 50 y 75 %, con un número de réplicas de 5 inyecciones por cada nivel. Se empleó la prueba t de Student para buscar significación entre los valores de recuperación.
Sensibilidad (límite de detección y de cuantificación)
Se realizó una curva de calibración para la catequina en el rango en que se encuentra normalmente en la muestra (tabletas) (0,1-1 mg/mL). Se determinó la pendiente (m) de esta curva de calibración (concentración vs. A o tr) en este rango. Se realizó otra curva de calibración para concentraciones bajas del analito (0,02-0,1 mg/mL), inyectando cada punto de concentración por triplicado, determinando la ecuación de esta nueva recta (A= mx Conc. + b) y se extrapoló la respuesta a concentración igual a cero (el área es igual al intercepto b); se obtuvo un estimado de la respuesta del blanco Ybl. Se determinó la desviación estándar (S) para cada punto de la curva anterior, se calculó la recta correspondiente a concentración (A) vs. S, es decir, la ecuación S= m(A) + b, y se extrapoló la S a concentración igual a cero; se obtuvo el estimado Sbl, correspondiente a la desviación estándar del blanco. Se calculó el LD y el LQ para n' medidas individuales
Todos los resultados obtenidos fueron evaluados estadísticamente con la ayuda del programa Microcal Origin 5.0 para Windows.
RESULTADOS
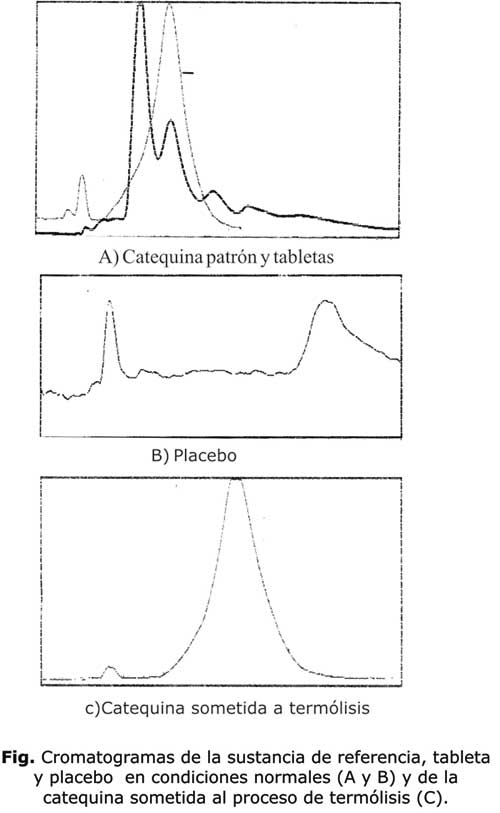
Como resultado del estudio de especificidad, los placebos no interfieren con la determinación de catequina, al no producir ninguna señal en esa zona, por lo que los excipientes y las sustancias auxiliares no interfieren en la determinación del marcador. En la figura se muestra el cromatograma de la sustancia de referencia posterior al proceso de termólisis, en la que se observa que no se modifica con respecto al patrón, así como los placebos fílmicos y entéricos. Sin embargo, en las tabletas: núcleo, fílmicas y entéricas aparece una fusión del pico de tiempo de retención de 8 min con el de catequina a 10,45 min, formándose una meseta.
El patrón de catequina no se descompone por la acción del peróxido de hidrógeno (H2O2). Al calcular la concentración de catequina obtenida después del proceso de oxidación os da un valor de 1,5 mg/ml, por lo que esto garantiza su no oxidación En el caso del placebo fílmico aparece un nuevo pico a tr= 11,90, lo que es una interferencia en la determinación de la catequina, así como otro nuevo pico a tr= 15,79. El placebo entérico
aparece un nuevo pico a tr= 3,86 y otro a tr 15,99. En las muestras de tabletas se repite la fusión del pico de tr de 8,6 con el de la catequina, formándose una meseta.
En los cromatogramas de tabletas fílmicas con respecto al cromatograma del patrón de catequina, así como el cromatograma de las muestra de tabletas fílmicas con respecto al patrón de catequina sometida al proceso de hidrólisis ácida, en este caso aparece la catequina a tr= 9,18, pero aparece un nuevo pico a tr= 15,70 minutos que puede tratarse de fluroglucinol.
Como resultado de la hidrólisis básica, en el caso del patrón de catequina aparece al igual que él la hidrólisis ácida un nuevo pico a tr= 14.86, por lo que esta produce productos de descomposición que no interfiere con la determinación del marcador.
En la tabla 1 se muestran los resultados del estudio de linealidad, en la que se destaca en la columna de la derecha los valores o criterios de aceptación.
Como puede apreciarse los resultados se encuentran dentro del límite establecido. La ecuación de la recta se expresa según: Y= 1345,34X + 5,2475
En la tabla 2 se muestran los resultados del estudio de repetibilidad. Como queda demostrado se observa una buena precisión (repetibilidad del método), con CV menores al 5 %.
En cuanto al RDS del área % este es menor que la precisión en condiciones intermedias, lo que coincide con lo establecido.7
Para calcular el rango crítico (rc) del área % se empleó la fórmula rc= f(n) . ds, donde f(n) está tabulado y se propone que se realicen 3 replicas (3 inyecciones) para una misma muestra el f(n)= 3,3
Por lo que rc= 23,34.
En cuanto a la precisión en condiciones intermedias, se muestra en la tabla 3. Se define que en la precisión en condiciones intermedias su CV debe ser igual o mayor que la repetibilidad. Por lo que el método posee una buena precisión, lo que fue confirmado por el método prueba F.
Tabla 3. Resultados de la precisión en condiciones intermedias
| Analista 1 | Día 1 | Día 2 | ||||
| Tr | A | A % | Tr | A | A % | |
| 1 | 9,17 | 623,52 | 75,9 | 9,32 | 403,09 | 85,1 |
| 2 | 9,17 | 700,82 | 76,3 | 8,01 | 903,63 | 89,6 |
| 3 | 9,18 | 835,64 | 83,3 | 9,17 | 787,38 | 92,2 |
| 4 | 9,18 | 894,85 | 84,1 | 8,19 | 770,2 | 91,5 |
| 5 | 9,18 | 770,78 | 84,5 | 9,18 | 755,88 | 91,9 |
| 6 | 9,17 | 745,22 | 85,3 | 9,37 | 731,44 | 89,1 |
| Analista 2 | Día 1 | Día 2 | ||||
| Tr | A | A % | Tr | A | A % | |
| 1 | 9,18 | 734,94 | 86,6 | 8,57 | 684,75 | 92,5 |
| 2 | 7,53 | 697,67 | 86,1 | 9,18 | 728,86 | 91,2 |
| 3 | 9,18 | 789,73 | 87,5 | 9,18 | 734,74 | 88,3 |
| 4 | 9,18 | 779,49 | 88,1 | 9,18 | 906,46 | 88,4 |
| 5 | 7,48 | 657,05 | 86,6 | 9,11 | 912,96 | 90,4 |
| 6 | 9,18 | 772,11 | 88,2 | 9,18 | 953,32 | 89,8 |
| Parámetros | Resultados | Límite |
| Coeficiente de variación | 4,95 % para el área 3,38 % para el tiempo de retención | CV ≤ 5 % |
| Pruebas de significación de Fisher | Fobt= 3,24 Ftab= 4,54 | Fobt < Ftab, no hay diferencia entre los analistas |
| Prueba de significación de t Student | tcal = 1,92 ttab= 2,23 | tcalc < tab, por lo que no hay diferencia entre los promedios |
En cuanto a la robustez se muestra en la tabla 4.
Se calcula la diferencia de media para cada parámetro en forma individual según las formulas descritas a tal efecto.
Para la aceptación de robustez debe cumplirse que la desviación estándar de tiempo de retención y área % del estudio de robustez sean menores que la desviaciones estándar Ö2 del estudio de precisión.
Ds tr < StrÖ2 del estudio de precisión
Ds A% < SA%Ö2 del estudio de precisión
Precisión en condiciones intermedias:
Dstr= 0,2755 < StrÖ2= 0,706293
Ds A%= 2,1401 < SA%Ö2= 6,1078
Por lo que el método presenta robustez.
En el estudio de exactitud se muestran los siguientes resultados:
Placebo 50 % (0,155 mg) del patrón de catequina:
Recobrado= 87,76 %
Placebo 100 % (0,31 mg) del patrón:
R= 96,45 %
Placebo 150 % (0,46 mg) del patrón:
R= 77,44 %
Recobrado medio para placebo Rm= 8,22 > 80 %
tobt= 0,52
ttab= 2,78 tobt < tab, por lo que el método tiene la exactitud requerida.
Los resultados de exactitud frente a la matriz se expresa en:
Tableta entérica + 0,155 mg catequina (50 %):
R= 95,89 %
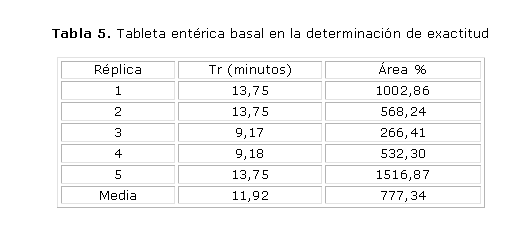
Tableta entérica basal (sin contaminar) (tabla 5).
Tableta entérica basal + 0,2325 mg catequina (75 %):
R= 137,57 %
Recobrado medio para tabletas entéricas= 116,73 % 80 % < R < 120 %
tobt= 0,296
t tab= 2,78 tobt < tab, por lo que el método tiene la exactitud requerida.
En el estudio de sensibilidad se encuentra como resultado que la curva patrón de catequina en el rango de la muestra 0,1-1 mg/mL, presenta una pendiente m= 457,7355 e intercepto b= -18,0272.
A= 457,7855 conc. + (-18,0272)
En la curva de patrón para valores bajos: 0, 02; 0,05; 0,08; 0,1 mg/ml, la ecuación de esta nueva recta resulta Y= 464,0544X 3,8867, es decir, A= 464,0544 conc. - 3,8867.
Determinando la respuesta para concentración= 0, se obtiene el estimado de Ybl= -3,8867. Determinando la ds para cada concentración y calculando la ecuación de regresión entre la concentración y la ds y extrapolando la ds a concentración= 0 se obtiene el estimado de Sbl correspondiente a la desviación estándar del blanco (curva de rango menor). S= mx + b. Sbl= 2,5516.
Límite de detección (Lt):
Lt= 0.004729 mg/mL= 0,002376 mg/tab
Límite de cuantificación (Lc):
Lc= 0,02728 mg/mL= 0,01364 mg/tab
DISCUSIÓN
El resultado obtenido del análisis de la muestra placebo, la solución de referencia y las muestras de productos terminados indica que los excipientes o sustancias auxiliares no interfieren en la determinación del marcador activo, con estos resultados se demuestran la especificidad del método para el control de calidad al no observarse picos cromatográficos del placebo cercano al tiempo de retención de la catequina. Sin embargo, se encontraron deformación del pico de la catequina en las muestras de tabletas sometidas a algunas condiciones drásticas, por lo que al emplear este método en estudios de estabilidad de las tabletas debe considerarse este resultado.
La curva de calibración resultó ser lineal en el rango de concentraciones analizadas, ya que los valores de los coeficientes de correlación y determinación resultaron mayores de 0,99. Además, al aplicar la prueba t de Student y obtener una expresión t calc > t tab, se comprobó que existe una correlación lineal entre los valores de «x» y «y». El coeficiente de variación de la pendiente fue menor o igual que el límite de este parámetro (< 2 %). En esto se considera lo planteado en las regulaciones donde los estimadores de regresión para un nivel de regresión a dado, generalmente a= 0,05 (5 %) son: coeficiente de correlación (r), coeficiente de determinación (r2), pendiente e intercepto.
En el estudio de precisión, el coeficiente de variación para la repetibilidad fue de 2,81 %, menor de 5 %.
Los resultados de precisión en condiciones intermedias demuestran que no existen diferencias significativas entre los resultados alcanzados por los analistas, ya que al aplicar la prueba de Fisher se obtuvo una Fexp < Ftab para una proporcionalidad de 0,05. AL realizar la prueba t de Student, el valor calculado resultó menor que el valor tabulado para el 95 % de confianza, lo que demostró que no existen diferencias significativas entre las medias de los analistas.
La robustez del método es adecuada debido a que no existieron diferencias significativas entre las medias de las áreas al cambiar condiciones como lote de fase móvil, día del ensayo y columna.
En cuanto a la exactitud se demostró que el método presenta buena exactitud tanto en el estudio sobre los placebos y en las tabletas como matriz con recuperados dentro de los establecidos, superiores al 80 % y de acuerdo con la prueba t de Student, con p= 0,05, lo cual indica que no existen diferencia entre la recuperación media y el 100 % de recuperación, lo que confirma la buena exactitud del método.
El método de CLAR propuesto presentó un límite de detección de 0,002376 mg/tab y un límite de cuantificación de 0,01364 mg/tab, lo que demuestra su sensibilidad en la determinación del marcador en las formas terminadas.
REFERENCIAS BIBLIOGRÁFICAS
1. Sánchez Luz Ma, Ruedas D, Gómez BC. Gastric antiulcer effect of Rhizophora mangle L. J Ethnopharmacol. 2001;77:1-3.
2. Sánchez Luz Ma, Batista NY, Rodríguez A, Farrada F, Bulnes C. Gastric and Duodenal Antiulcer Effects of Rhizophora mangle L. Pharmaceut Biol. 2004;42(3):225-9.
3. Berenguer B, Sánchez LM, Quilez A, Lopez-Barreiro M, de Haro O, Galvez J, Martin MJ. Protective and antioxidant effects of Rhizophora mangle L. against NSAID-induced gastric ulcers. J Ethnopharmacol. 2006 Jan 16; 103(2):194-200.
4. Sánchez Luz Ma., Lino Varcalcel; Arturo Escobar; Mario Noa. Polyphenol and phytosterols Composition in an antibacterial extract from Rhizophora mangle L´s bark. J Herbal Pharmacother. 2008;7(3-4):107-28.
5. United States Pharmacopeal Convention. The Standard of qualitySM. USP 28-NF 23. Second Supplement. Rockville: Mack Printing; 2005.
6. Quattrocchi OA, Abelaira S, Laba RF. Introducción al HPLC. Aplicación y Práctica. Buenos Aires: Artes Gráficas; 1992, p. 302 -28
7. Regulación 41/2007 CECMED. Organo Oficial Regulatorio. Centro para el Control Estatal de la Calidad de los Medicamentos. CECMED. Edición Ordinaria, La Habana, 23/04/07 año VI número 00-53.
Recibido: 18 de septiembre de 2009.
Aprobado: 21 de octubre de 2009.
Dra. C. Luz María Sánchez Perera. Centro Nacional de Sanidad Agropecuaria (CENSA), Apdo. 10, CP 32 700, San José de las Lajas. La Habana, Cuba. Correo electrónico: luzmaria@censa.edu.cu