My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515On-line version ISSN 1561-2988
Rev Cubana Farm vol.44 no.4 Ciudad de la Habana Oct.-Dec. 2010
ARTÍCULOS ORIGINALES
Validación del método analítico para el control de la calidad y estudio de estabilidad de fenilefrina 10 % colirio
Validation of an analytical method for quality control and stability study of 10 % Phenylephrine eyedrops
Raiza Monteagudo LiceaI; Caridad Margarita García PeñaII; Martha Botet GarcíaI; Yenilen Troche ConcepciónI; Téc. Yanet Montes de Oca PortoIII
IMáster en Tecnología y Control de Medicamentos. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
IIMáster en Tecnología y Control de Medicamentos. Investigadora Agregada. Centro de Investigación y Desarrollo de Medicamentos. (CIDEM). La Habana, Cuba.
IIITécnica en Química. CIDEM. La Habana, Cuba.
RESUMEN
La fenilefrina se emplea como midriático en exámenes de ojos y otros procedimientos oftálmicos. Se utiliza como vasoconstrictor con anestésicos locales. En este trabajo se validó un método analítico por cromatografía líquida de alta resolución para el control de la calidad y los estudios de estabilidad de la fenilefrina 10 % colirio. El método se basó en la separación del principio activo a través una columna cromatográfica Lichrosorb RP-18 (5 µm) (250 x 4 mm), con detección ultravioleta a 280 nm, para lo cual se empleó una fase móvil compuesta por una mezcla desgasificada de metanol:agua destilada (1:1), con 1,1 g de 1-octanosulfonato de sodio por litro ajustado a pH 3,0 con ácido fosfórico, con una velocidad de flujo de 1,0 mL/min. El método analítico resultó lineal, preciso, específico y exacto en el intervalo de concentraciones estudiadas.
Palabras clave: HPLC/métodos, fenilefrina, validación.
ABSTRACT
Phenylephrine is used like mydiatric in eye examinations and other ophthalmic procedures. It is used as vasoconstrictor with local anesthetic agents. In present paper a high ressolution liquid chromatography analytical method was validated to quality control and stability studies of 10 % Phenylephrine (eyedrops). Mathod was based in separation of active principle through a Lichrosorb RO-18 (5 µm) (250 x 4 mm) chromatography column with UV detection at 280 nm using a mobile phase composed by a non-gasified mixture of methanol distilled water (1:1) with 1.1 g of 1-sodium octane-sulphonate by liter adjusted to pH 3,0 with phosphoric acid at a flow speed of 1.0 mL/min. Analytical method was linear, accuracy, specific and exact in the interval of study concentrations.
Key words: HPLC/method, Phenylephrine, validation.
INTRODUCCIÓN
La fenilefrina clorhidrato es una fenolamina adrenérgica vasopresora con actividad simpático-mimética, provoca elevación de las presiones sanguíneas sistólica y diastólica al actuar directamente sobre las
células efectoras uniéndose a los receptores alfa fundamentalmente y producir vasoconstricción.1,2
El desarrollo de técnicas o métodos analíticos novedosos o la adecuación de algunos ya reportados constituye un problema cotidiano. Siempre que esto suceda se exige como parte integral del estudio, la validación del método en cuestión. La validación proporciona un alto grado de confianza y seguridad del proceso productivo o del método analítico, así como también en la calidad de los resultados.3-5
Los parámetros analíticos evaluados en la validación del método analítico, fueron exactitud, precisión, especificidad, robustez y linealidad.6
El objetivo del presente trabajo fue la validación de un método analítico para la determinación del principio activo en el colirio de fenilefrina 10 %, por cromatografía líquida de alta resolución (CLAR).
MÉTODOS
La sustancia de referencia química de fenilefrina fue suministrada por el grupo de sustancias de referencia del Centro de Investigación y Desarrollo de Medicamentos (CIDEM, La Habana, Cuba), la cual fue analizada por el método cromatográfico establecido para realizar el control de la calidad de la materia prima, con una pureza de 99,5 %. El producto terminado en forma de colirio, fue elaborado en la Empresa Farmacéutica "Julio Trigo", identificado como el lote 7001, fabricado en abril de 2007, con fecha de vencimiento abril de 2008, el cual cumplió con las especificaciones de calidad establecidas para el control de la calidad del colirio.
Todos los reactivos utilizados fueron de grado HPLC. En el ensayo se empleó un cromatógrafo (Knauer) con detector UV/VIS (Knauer) ajustado a 280 nm, un inyector con un loop de 20 µL e integrador (SHIMADZU CR 8 A). La separación se realizó isocráticamente empleando una columna Lichrosorb RP-18 (5 µm) (250 x 4 mm), con detección UV a 280 nm, para lo cual se empleó una fase móvil compuesta por una mezcla desgasificada de metanol:agua destilada (1:1), con 1,1 g de 1-octanosulfonato de sodio por litro ajustado a pH 3,0 con ácido fosfórico, con una velocidad de flujo de 1,0 mL/min.4,5
Para el análisis se disolvió una cantidad exacta de la sustancia de referencia química en diluente (metanol:agua destilada (1:1), a pH 3.0), de modo que se obtuviera una solución con una concentración final de 1 mg/mL.
Para el análisis de las muestras se tomó 1 mL de muestra, se trasvasó a volumétrico de 100 mL adicionándose diluente, se aplicó ultrasonido por 3 min y se completó volumen con diluente (concentración de trabajo 1 mg/mL de fenilefrina).
Validación del método analítico
La validación fue realizada según la categoría I (USP-30) y la Regulación 41-2007 del Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED), para la validación de métodos de análisis, en la que se evaluaron los parámetros que a continuación se describen:3,6
Linealidad
Para el análisis de la linealidad se realizó el modelo de 3 determinaciones para 5 concentraciones diferentes: 60, 80, 100,120, y 140 %. Se determinó la ecuación de la recta, el coeficiente de correlación, la prueba de significación estadística de la pendiente Sbrel (%), los coeficiente de variación de los factores de respuesta, ensayo de proporcionalidad.
Exactitud
Para el análisis de exactitud se realizó el modelo de 3 réplicas para 3 concentraciones diferentes: 80, 100, 120 %; se determinó el % de recuperación, la desviación estándar y el coeficiente de variación. Se aplicó además el ensayo de Gochran con vistas a comprobar si la variación de la concentración producía diferencias significativas en los resultados y la prueba de la t de Student para determinar diferencias significativas entre la recuperación media y el 100 %.
Precisión
Para el estudio de la precisión se aplicó el modelo de repetibilidad con 6 réplicas. Con ellas se determinaron los valores medios, la desviación estándar y el coeficiente de variación.
De igual manera para el ensayo de la precisión intermedia se utilizaron 3 valores deconcentración que correspondieron al 80, 100 y 120 % para 2 analistas y 3 días diferentes. Se aplicó la prueba de Fisher y de la t de Student para determinar si existían diferencias significativas entre los resultados al variar las condiciones de análisis.
Especificidad
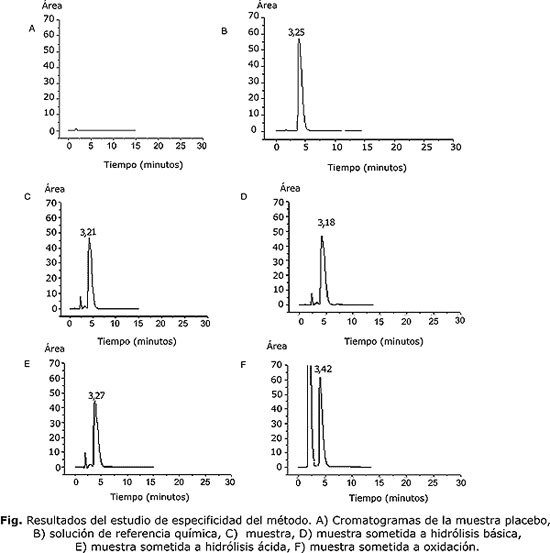
Para el estudio de especificidad se analizaron la sustancia de referencia de la fenilefrina, el placebo; las muestras de producto terminado y muestras sometidas a condiciones drásticas como hidrólisis ácida HCl 3 N, hidrólisis básica NaOH 3 N y oxidación H2O2 y a la luz durante 3 días.
Criterio de aceptación: no se debían obtener señales del placebo y de los productos de degradación en la zona de elusión del principio activo. Las áreas bajo las curvas del patrón y de la fenilefrina en el producto terminado debían ser similares.
RESULTADOS
La figura muestra los resultados del estudio de especificidad del método. Como se observa en el cromatograma correspondiente a la muestra placebo (A) no se obtuvo ninguna señal en la zona de interés, al ser comparado con la señal obtenida para la solución estándar de referencia (B) y de la muestra de fenilefrina colirio (C), lo cual indica que los excipientes o sustancias auxiliares de la solución no interfieren en la determinación del principio activo. En cuanto a las muestras sometidas a condiciones drásticas de hidrólisis básica, hidrólisis ácida y oxidación (cromatogramas D, E, F), la molécula resultó ser bastante estable, solo se pudo apreciar una ligera degradación por la disminución de la altura de los picos y la aparición de pequeños picos secundarios como posibles productos de degradación, el cual no interfiere en la determinación del principio activo.
En la tabla 1 se reportan los resultados de los estudios de la linealidad del sistema; el coeficiente de regresión lineal fue de 0,9993 y el coeficiente de variación del factor de respuesta resultó igual a 4,12 %.
Los resultados del estudio de precisión del método aparecen reportados en la tabla 2. En el estudio de repetibilidad realizado, la media obtenida fue de 99,4 % y el coeficiente de variación fue de 0,35 %, mientras que los valores de F calculadas y los valores de t calculadas fueron menores que los valores tabulados, para un 95 % de confianza, para cada uno de los niveles estudiados.
Tabla 2. Resultados del estudio de la precisión intermedia del método analítico
| Niveles | Analista 2 (%) | |||||
| Primer día | Segundo día | Tercer día | Primer día | Segundo día | Tercer día | |
| 80 % | 79,8 | 79,9 | 79,7 | 79,8 | 80,2 | 79,9 |
| 80,2 | 80,1 | 79,9 | 79,9 | 80,0 | 79,8 | |
| 79,9 | 80,2 | 80,0 | 80,1 | 80,1 | 80,1 | |
| 100 % | 99,7 | 99,9 | 99,4 | 99,9 | 99,7 | 99,9 |
| 100,2 | 100,1 | 99,7 | 100,1 | 99,5 | 99,8 | |
| 99,9 | 99,8 | 99,9 | 99,8 | 99,8 | 100,1 | |
| 120 % | 120,2 | 119,9 | 120,2 | 119,7 | 120,2 | 119,7 |
| 120,0 | 120,2 | 119,9 | 119,9 | 120,1 | 119,9 | |
| 119,9 | 120,0 | 119,7 | 120,1 | 119,8 | 120,2 | |
| Análisis estadístico | ||||||
| Prueba de Fischer | ||||||
| Prueba de significación de Fisher por analistas (Ftab (8/8; 0,05)= 3,44) | Prueba de significación de Fischer por día (Ftab (5/5; 0,05)= 5,05) | Limites | ||||
| Niveles | Días 1/2 | Días 2/3 | Días 1/3 | Fexp≤ Ftab | ||
| 80 | 1,47 | 80 | 1,78 | 1,36 | 1,31 | |
| 100 | 1,59 | 100 | 1,11 | 1,44 | 1,44 | |
| 120 | 1,25 | 120 | 1,27 | 2,07 | 2,06 | |
| Prueba de la t de Student | ||||||
| Prueba de significación de Student por analistas | Prueba de significación de Student por días | Limites | ||||
| Niveles | Días 1/2 | Días 2/3 | Días 1/3 | |||
| 80 | 0,38 | 80 | 1,40 | 2,01 | 0,53 | texp≤ ttab |
| 100 | 0,08 | 100 | 1,12 | 0,17 | 0,94 | |
| 120 | 0,63 | 120 | 0,57 | 0,75 | 0,30 | |
| Coeficiente de variación | ||||||
| Niveles | Analista 1 | Analista 2 | Limites | |||
| 80 | 0,22 | 0,18 | CV≤ 2,0 % | |||
| 100 | 0,24 | 0,19 | ||||
| 120 | 0,14 | 0,16 | ||||
tcal: t calculada; Fcal: F calculada; ttab: t tabulada; Fcal: F tabulada;
%: los datos corresponden al porcentaje de principio activo en la formulación.
DISCUSIÓN
Los resultados del estudio de especificidad del método (fig.), demuestran la especificidad del método al no presentarse interferencias de picos adicionales en la zona de elusión del producto principal, ya que los productos de degradación y los excipientes de la formulación presentan tiempos de retenciones diferentes al principio activo. En el cromatograma F se puede apreciar que existe una buena resolución entre los 2 picos los cuales se encuentran bien definidos sin cola y presentan una apariencia adecuada llegando todos a la línea base, no observándose interferencias de uno con otro, ya que los tiempos de retención de cada uno son diferentes. El método cromatográfico resultó ser específico pues permite cuantificar el principio activo después de la degradación de este en muestras de medicamento sin interferencias de excipientes y/o producto de degradación.3
Los resultados del estudio de linealidad muestran coeficientes de regresión y de determinación superiores a los exigidos, 0,99 y 0,98 respectivamente, demostrándose con el valor del coeficiente de correlación obtenido, cercano a la unidad, la existencia de correlación con una probabilidad elevada, así como el grado de relación entre las variables concentración y respuesta detectada por el equipo empleado. También el coeficiente de variación de los factores de respuesta y la desviación estándar relativa de la pendiente fueron inferiores al normado como máximo para estos indicadores: 5 y 2 %, respectivamente, ambos son considerados estimadores puntuales que permiten caracterizar la variabilidad. El valor obtenido del CVf permitió demostrar que existe variabilidad en la relación respuesta y concentración para cada nivel evaluado. El intervalo de confianza del intercepto incluye al cero, lo que permite excluir la significación del error del intercepto. Se demostró con estos resultados la linealidad del método propuesto.
En el estudio de la repetibilidad (tabla 2) realizado a una misma muestra, por el mismo analista, el mismo día, a través de seis réplicas, se alcanzó un coeficiente de variación adecuado (0,35 %), lo que demostró la buena precisión del método, observándose una variabilidad de los resultados dentro de los límites establecidos para los métodos cromatográficos: CV £ 2,0 %.6
Los valores que se obtienen en el estudio de precisión intermedia, de las pruebas de Fischer y de la t de Student, para el estudio de la precisión intermedia demostraron que no existían diferencias significativas entre las precisiones alcanzadas por los analistas en diferentes días para una probabilidad de 0,05 %, ya que el valor de Fcalculada es menor que la Ftabulada, este resultado permite establecer que las precisiones son similares (tabla 2). Al realizar la prueba de la t de Student, el valor calculado resultó menor que el tabulado, para una probabilidad de 0,05, lo cual demostró que no existían diferencias significativas entre las medias alcanzadas, con un nivel de significación de un 5 %.
Los valores de porcentaje de recobrado estuvieron dentro de los límites establecidos para los métodos cromatográficos (98-102 %) y los valores del coeficiente de variación para cada uno de los valores de concentración estudiados resultaron ser menor que el 2 %.4 En la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud al aplicar la prueba de Cochran, se obtuvo que G calculada fue menor que G tabulada para una probabilidad de 0,05, k= 3 y n= 3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes, lo que indica que la concentración no influye en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, con un coeficiente de variación de 0,98 %, se obtuvo una t calculada menor que t tabulada. 6 Los resultados demostraron la capacidad del método para dar resultados cercanos al valor verdadero, observándose una buena exactitud.
El método analítico, validado por CLAR, para la cuantificación del principio activo del colirio de fenilefrina 10 % para el control de la calidad y el estudio de estabilidad resultó ser lineal, preciso, exacto y específico, en el intervalo de concentraciones establecido del 60 al 140 %.
REFERENCIAS BIBLIOGRÁFICAS
1. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. Tomo II. 3ra ed. La Habana: Editorial Científico Técnica; 1994. p. 466-7. (Edición Revolucionaria).
2. PDR. Physician´s Desk Reference. 57 ed. New York: Inc at Montuale; 2003. p. 332, 2193, 2905, 3270.
3. United States Pharmacopoeial Convention. The National Formulary (NF 25). USP XXX: United States Pharmacopoeia. 30 ed. Rockville: Mack Printing; 2007. Versión electrónica en CD.
4. Quattrocchi OA, Laba RF. Introducción a la HPLC en Aplicación y práctica. Buenos Aires: Ed. Artes Gráficas Farro; 1992. p. 106-122, 284, 302-328.
5. Dierksneier G. Métodos cromatograficos. La Habana: Ed. Científico Técnica; 2005. p. 1-4, 256-412.
6. Validation of Analytical Procedures. Technical Requirements for the Registration of Pharmaceuticals for Human Use. Geneva: International Conference on Harmonization, ICH-Q2A; 1995.
Recibido: 8 de junio de 2010.
Aprobado: 17 de julio de 2010.
MSc. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1 605 entre Boyeros y Puentes Grandes. CP 10 600. Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu