Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.3 Ciudad de la Habana jul.-set. 2011
ARTÍCULO ESPECIAL
Proyecto Grannacional ALBASALUD para Centro Regulador de Medicamentos Esenciales de los países del ALBA-TCP
Grand-national Project ALBASALUD for Regulatory Center of Essential Drugs for the ALBA-TCP countries
Celeste Aurora Sánchez González
Doctora en Ciencias Farmacéuticas. Máster en Tecnología y Control de Medicamentos. Investigadora Titular. Centro para el Control Estatal de Medicamentos (CECMED). La Habana, Cuba.
RESUMEN
La Autoridad Reguladora de Medicamentos de Cuba, coordina un Proyecto de la Alianza Bolivariana para los pueblos de América-Tratado de Libre Comercio (ALBA-TCP), dirigido al desarrollo de un Centro Regulador para los países del ALBA como nuevo organismo regional de integración farmacéutica, en aras de contar con un Registro Grannacional válido en todos los países partes, como herramienta para facilitar el acceso a medicamentos esenciales de calidad. Esta investigación tuvo como objetivo diseñar y conducir desde el punto de vista técnico un proyecto para crear las bases legales y metodológicas del futuro centro y sus funciones básicas. Se emplearon técnicas de grupo nominal, puntos de referencia, consultas a expertos y se crearon metodologías específicas para planear y confeccionar los documentos necesarios. Se utilizaron lineamientos de organismos reguladores internacionales, cuadros básicos de medicamentos y reglamentación farmacéutica de los países participantes. Se desarrollaron y aplicaron documentos y estrategias para el trabajo del proyecto durante la etapa de preinversión, se definió el primer listado de medicamentos esenciales del ALBA y se aprobaron las fundamentales disposiciones legales y la reglamentación para las funciones de registro, vigilancia, inspecciones, laboratorios y liberación de lotes. El Proyecto Grannacional ALBASALUD "Centro Regulador de Medicamentos del ALBA-TCP" aplicado ha demostrado su eficiencia y capacidad para alcanzar los objetivos trazados mediante un trabajo científico-técnico con participación colectiva, que ha garantizado las disposiciones y lineamientos requeridos para sus funciones básicas y respaldo legal.
Palabras clave: iniciativas de integración farmacéutica, sistemas y centros de regulación de medicamentos, registro grannacional de medicamentos esenciales.
ABSTRACT
The Drug Regulatory Authority of Cuba is coordinating a Project of the Bolivarian Alliance for the Peoples of America- Free Trade Agreement (ALBA-TCP) aimed at developing a Regulatory Center that will operate as a new regional body of pharmaceutical integration for the ALBA countries. It will provide a Grand-national Register that will be valid for all the member states to facilitate the access to quality essential drugs. The objective of this research work was to design and to conduct a project from the technical viewpoint in order to lay down the legal and methodological basis of the future center and its main functions. Some techniques like nominal group, points of reference and expert consultation were used, and the specific methodologies to plan and to prepare the required documents were devised. The guidelines of international regulatory bodies, the basic groups of drugs and the pharmaceutical regulations of the participating countries were reviewed. Several documents and strategies for the project work in the pre-investment stage were developed, the first listing of essential drugs for the ALBA countries was defined and the main legal provisions and the regulation that states the functions of registering, surveillance, supervision, lab work and release of batches of the new entity were approved. The Grand-national Project ALBASALUD " Regulatory Center of Drugs for the ALBA-TCP" has proved its efficiency and capacities to achieve the set objectives through collective involvement-supported scientific and technical work that has guaranteed the required provisions and guidelines for the basic functions and the legal endorsement of the center.
Key words: pharmaceutical integration initiatives, systems and centers of drug regulation, grand-national register of essential drugs.
INTRODUCCIÓN
El Proyecto Grannacional para la creación de un Centro Regulador para el Registro Sanitario de los Medicamentos del ALBA destinados a emplearse en los programas priorizados de salud de los países miembros con vistas a facilitar el acceso de medicamentos esenciales con calidad, seguridad y eficacia demostradas es representativo de un altísimo nivel de compromiso político de los gobiernos y estados de la Alianza Bolivariana para los pueblos de América, Tratado de Libre Comercio (ALBA-TCP), para facilitar el intercambio común y fomentar el mutuo desarrollo a partir de la cooperación y la transferencia de conocimientos.
Como coordinador de este proyecto, clasificado como ALBASALUD fue designado el Centro para el Control Estatal de la Calidad de los Medicamentos de Cuba (CECMED), que ha sido evaluado en varias oportunidades con resultados satisfactorios por la Organización Mundial de la Salud (OMS); tiene certificado su Sistema de Gestión de la Calidad con la Norma ISO 9001:2000 desde el 2008, con seguimientos en el 2009 y 2010 con la Norma ISO 9001:2008 y que en julio de 2010 fue seleccionado como Autoridad Reguladora de Referencia para Las Américas por la Organización Panamericana de Salud (OPS). Este centro tiene entre sus antecedentes un proceso de reconocimiento de la reglamentación farmacéutica para el registro de medicamentos y biológicos con la Autoridad Nacional Reguladora de Medicamentos (ANR) de Venezuela, el Instituto Nacional de Higiene "Rafael Rangel". Sus especialistas colaboran activamente con la OMS y la OPS en diversas actividades de formación y desarrollo de lineamientos reguladores.
Los centros regionales para la regulación y control de medicamentos no tienen precedentes en el área latinoamericana, por lo que esta tarea constituye un reto. En la Unión Europea, sin embrago, funciona desde el 1995 la actual Agencia Europea de Medicamentos (EMA), que es el cuerpo de la Unión responsable de coordinar los recursos científicos existentes puestos a su disposición por lo estados miembros para la evaluación, supervisión y farmacovigilancia de los productos medicinales.1
Esta investigación se llevó a efecto con el objetivo general de diseñar y desarrollar un proyecto para preparar la base legal y técnico-metodológica de funcionamiento de un Centro Regulador de Medicamentos de los países del ALBA-TCP, con sede en Cuba, a cargo de otorgar un registro unificado y centralizado, válido en los países del ALBA y con los objetivos específicos de:
a) Estructurar un proyecto que responda al desarrollo de estas bases, en el que se le brinde participación a todos los países partes y que garantice la adecuada puesta en marcha del Centro Regulador.
b) Dotar al Centro Regulador de la base legal que le imprima la legitimidad necesaria como nueva figura regional del en torno regulador farmacéutico en armónica relación con las legislaciones de los países partes del ALBA y sus respectivas ARNs.
c) Desarrollar las políticas, bases reguladoras, metodologías y procedimientos fundamentales para conducir consistente y transparentemente las funciones técnicas básicas de regulación y control del centro, con la ordenada participación de las ARNs de los países partes en concordancia con el conocimiento científico actual, las necesidades y las posibilidades comunes.
MÉTODOS
Para el trabajo fueron utilizados los siguientes métodos:
· Organizativos para desarrollar la estructura del proyecto, su alcance, pautar el régimen de funcionamiento, el sistema participación de los países, la aprobación y publicación de sus resultados y el control de su avance.
· Técnica de grupo nominal para desarrollar y aprobar propuestas.
· Encuestas para establecer diagnósticos del nivel alcanzado por cada uno de los países en temas puntuales.
· Puntos de referencia (benchmarking), para comparar metodologías, disposiciones y regulaciones existentes en nuestros países y el mundo, las necesidades diagnosticadas y confeccionar las propuestas.
· Consultas a expertos y directivos para la confección, revisión, formular propuestas y validar resultados.
Los materiales empleados consistieron en lineamientos y pautas de organismos internacionales como la OMS y OPS, Conferencia Internacional de Armonización (ICH) y EMA, así como los Cuadros Básicos de Medicamentos y la legislación y regulaciones farmacéuticas vigentes en los 4 países con activa participación en el proyecto: Bolivia, Cuba, Nicaragua y Venezuela.
RESULTADOS
Para desarrollar el proyecto se estructuró un programa general y en él se definió una fase inicial de 24 meses de "preinversión", destinada a preparar las bases para el trabajo del Centro Regulador (ALBAmed en lo sucesivo) y de su interrelación con las ARNs de los países partes del ALBA-TCP. A esta etapa se refiere el presente artículo, la que una vez concluida dará paso a la puesta en marcha de ALBAmed en una sede provisional.
Los objetivos definidos para la pre-inversión incluyeron:
· Establecimiento de una estructura y metodología de trabajo del proyecto;
· Desarrollo de las bases legales y metodológicas consensuadas para el establecimiento y funcionamiento de ALBAmed y del Registro Grannacional del ALBA-TCP;
· Definición consensuada de mecanismos de trabajo que comprenden la toma de decisiones de ALBAmed;
· Pruebas piloto de funcionamiento de propuestas aprobadas.
Como resultado de la investigación realizada se elaboraron y aprobaron las "Pautas para el Funcionamiento del Proyecto Grannacional Centro Regulador de Medicamentos del Alba-TCP," en las que se definieron estructura, alcance, funciones, atribuciones, responsabilidades, conducta y régimen de trabajo del proyecto así como las medidas requeridas para lograr una adecuada coordinación y la ordenada participación de los países.
Fue aprobada la estructura de Coordinación del Proyecto con máximo nivel jerárquico en el Comité de Coordinación, integrado por la Coordinación General, en las figuras del coordinador general y la coordinadora técnica y por los coordinadores técnicos de país, nombrados oficialmente como responsables de la efectiva y oportuna participación de su país en las tareas del proyecto, de transmitir el punto de vista de país en los análisis, de la evaluación al interior del territorio del impacto de las propuestas en términos de beneficios e inconvenientes, y de la implementación de los acuerdos tomados. Se incluyeron representativos del Banco del ALBA y del Comité Ejecutivo de la Coordinación Permanente del ALBA-TCP, como se muestra en la figura 1.
Otro importante documento organizativo para el funcionamiento del proyecto fue el "Reglamento Preliminar para la Selección y Manejo de Expertos Externos y Comités de Expertos en el Centro Regulador de Medicamentos del ALBA-TCP", que dio continuidad a las pautas y se enfocó en la idoneidad técnica y científica, confidencialidad, ausencia de conflicto de intereses y transparencia que el trabajo con estos especialistas implica. Es aplicable durante la etapa de proyecto y también cuando ALBAmed inicie su funcionamiento.
Las reuniones, con ejecución en sede rotativa, se clasificaron en técnicas o talleres, para confeccionar propuestas de políticas, metodologías y procedimientos con la participación de expertos preferentemente de las ARNs y de Coordinación, para la aprobación de políticas, pautas y otras propuestas, a las que son invitados los representantes políticos de los países, como los directivos de los ministerios de Salud y funcionarios a cargo del ALBA.
Con los temas de regulación a abordar en la etapa fueron confeccionados la "Agenda Reguladora de la Fase de Pre-inversión y su Cronograma de Ejecución", y se diseñaron estrategias particulares para cumplimentar cada una en el tiempo fijado. La información a los países participantes sobre los pasos y progresos alcanzados en el proyecto se programó y ejecutó mediante Actas de las reuniones de coordinación e informes de las reuniones técnicas. El control y monitoreo de acuerdos se garantizó mediante el registro "Control Permanente de Acuerdos", objeto de revisión a intervalos y cuyos resultados y alertas se circularon periódicamente a todos los países. Tanto la Coordinación General como las coordinaciones técnicas de países rinden cuentas con un formato estandarizado en cada una de las reuniones de Coordinación.
La información pública del proyecto fue diseñada, aprobada y hospedada como un subdominio2 en el Sitio web del ALBA-TCP, en el Área de Salud. Por esta vía se ha dado a conocer qué es el Proyecto, sus objetivos, la composición del Comité de Coordinación, convocatorias de talleres y reuniones, principales resultados y respuestas a preguntas más frecuentes. Este espacio fue dotado de vínculos con las páginas web de cada una de las ARNs de los países participantes en el Proyecto: Unidad de Medicamentos de Bolivia (UNIMED), CECMED de Cuba, Ministerio de Salud de Nicaragua (MINSA), Instituto Nacional de Higiene "Rafael Rangel" (INH"RR") y Ministerio del Poder Popular para Salud de Venezuela y se cerró el lazo de conexión de acceso a la información con la instalación de vínculos con la de la web del proyecto en estas.
Las bases legales para el funcionamiento de ALBAmed quedaron definidas en 2 disposiciones legales fundamentales de carácter supranacional. La primera fue el "Tratado Constitutivo del Centro Regulador de Medicamentos del ALBA y del Registro Grannacional", el que una vez firmado por los presidentes de los países partes del ALBA, se ha de convertir en el instrumento jurídico de respaldo para el Centro y para el nuevo tipo de registro, que permita la autorización sanitaria de medicamentos y todas las demás acciones de control sanitario con validez en los estados partes. En él se definen las funciones del centro, su alcance, características principales y las relaciones con los países. En su elaboración se tomó en cuenta que brindara el amparo legal recomendado por OMS en las herramientas de evaluación que aplica a los Sistemas de Regulación, ARNs y las funciones básicas.3
La segunda fueron los estatutos del centro en el que se establecen su misión, visión, estructura y organización general, Junta Directiva y régimen disciplinario.
Un importante punto de partida para todo el trabajo referente a las bases técnicas de la regulación, fue la selección preliminar de los Medicamentos Esenciales del ALBA, definidos como los básicos e indispensables para satisfacer las necesidades de atención de salud de la población de los países ALBA, que responden a sus programas prioritarios, que han sido seleccionados sobre la base de su importancia en los diferentes niveles de atención de los Sistemas Públicos de Salud, a la evidencia de eficacia, seguridad y calidad comprobadas y a la relación costo/beneficio, que deben estar presentes en cantidades y formas de dosificación apropiadas y que contienen información suficiente para los Sistemas de Salud y para la Comunidad del ALBA. Al cierre de julio de 2010, el primer listado agrupó 319 ingredientes farmacéuticos activos en 489 especialidades farmacéuticas comunes en los cuadros básicos de dos o más de los 4 países participantes.4-7 Estos productos son potenciales tributarios del Registro Grannacional y por ello diana de todas las acciones de ALBAmed.
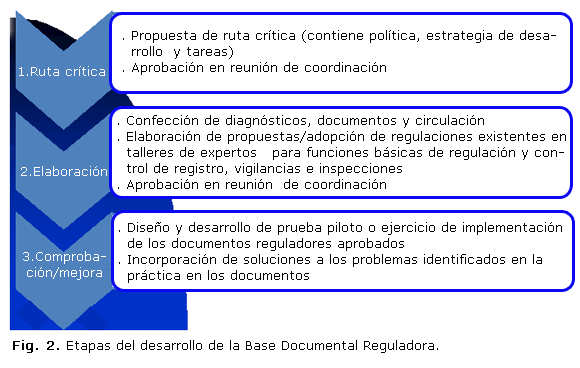
Para proyectar la documentación reguladora básica de cada función se estableció una ruta crítica encabezada por la política y la estrategia de cumplimiento y seguida de las regulaciones, requisitos, procedimientos y registros considerados indispensables para desarrollar en esta etapa del proyecto. La ruta es discutida y aprobada en las reuniones de Coordinación y cumplimentada y ampliada en talleres de expertos. La vía de construcción de los documentos técnicos fueron los talleres y ensayos pilotos para la utilización de las herramientas desarrolladas, a partir de los cuales se completará y resolverán las potenciales dificultades, como muestra la figura 2.
Para realizar los talleres de la documentación reguladora identificada para las funciones básicas de ALBAmed se desarrolló y aplicó la siguiente secuencia normalizada:
- Circulación de convocatoria y términos de referencia.
- Propuestas y selección de expertos.
- Agrupación de los expertos en equipos según experticia.
- Distribución de tareas a los equipos.
- Designación de responsables de equipos y de tareas específicas.
- Instrucción del trabajo a realizar y de los resultados esperados.
- Formulación y circulación de propuestas.
- Emisión de comentarios por los países.
- Evaluación de comentarios, confección de resúmenes y propuestas.
- Presentación de propuestas, análisis colectivo y adopción de acuerdos.
Las convocatorias para cada taller se han ajustado al Reglamento de Expertos aprobado, con términos de referencia y declaraciones de confidencialidad y de conflicto de intereses. Los expertos se proponen por las ARNs de cada país a través de sus coordinadores técnicos y se seleccionan por la Coordinación General del Proyecto según la experticia tanto de formación como experiencia documentada en su currículo vitae, presentado en un formato estandardizado.
Con esta organización, las reuniones de expertos se han caracterizado por un intenso trabajo preparativo que garantiza una mayor eficiencia en el empleo del tiempo ya que se presentan documentos confeccionados y circulados con anterioridad y enriquecidos con los criterios preliminares de cada país. Todas las propuestas requieren de su aprobación en una reunión de coordinación del proyecto, con los factores políticos.
Las bases reguladoras, requisitos y registros, documentación que se ha desarrollado en esta etapa, corresponden a las funciones de registro (con los criterios de intercambiabilidad terapéutica), vigilancia (de calidad, seguridad y eficacia), laboratorio, liberación de lotes e inspecciones.
Los resultados obtenidos se resumen en la tabla y de su análisis se deriva una amplia cobertura tomando en cuenta que nos encontramos en un estadio temprano y que a la fecha de terminación de este artículo aún continúa la fase de preinversión del proyecto. La base documental se continuará ampliando en la puesta en marcha siguiendo la espiral de la calidad.
Como parte de las acciones de mejora de la calidad se encuentran en curso pruebas pilotos para la evaluación de solicitudes de Registro Grannacional de Medicamentos del ALBA-TCP empleando regulaciones, procedimientos y registros confeccionados, para el Sistema de Vigilancia de Medicamentos (vigilancia de calidad y farmacovigilancia) y para ejercitar el trabajo conjunto con estudios de suficiencia interlaboratorios, simulacro de retirada de productos y otros, dirigidos a utilizar y mejorar las herramientas confeccionadas.
DISCUSIÓN
Varios elementos han sido particularmente útiles y característicos del proyecto, por lo que requieren ser destacados, entre ellos:
· Los diagnósticos han desempeñado una función relevante para identificar las diferencias entre los países, orientar las estrategias y elaborar una base metodológica capaz de cumplimentarse sosteniblemente por ALBAmed y por cada uno de los estados partes, encargados de implementar las decisiones sobre el Registro Grannacional de Medicamentos, entre otras.
· Los lineamientos de la OMS/OPS han servido de base para las regulaciones elaboradas en el proyecto y en algunos casos adoptados sin modificaciones, procediéndose a su traducción al castellano en los casos necesarios. Por la importancia concedida a esta iniciativa de integración regional, el proyecto ha sido insertado por OPS en la Red Panamericana de Armonización de la Reglamentación Farmacéutica (Red PARF).8
· Las reuniones con representantes y expertos de los diferentes países, han brindado un favorable foro para el intercambio de puntos de vista técnicos y políticos, formular propuestas y tomar decisiones.
Resulta relevante que a pesar de la falta de experiencia previa se ha logrado diseñar y poner en marcha un Proyecto atípico que ha aprovechado las fortalezas existentes en los países participantes para preparar las bases legales y técnicas del futuro Centro Regulador conforme el estado del arte actual.
En conclusión, el diseño del Proyecto Grannacional ALBASALUD "Centro Regulador de Medicamentos del ALBA-TCP", aplicado por el CECMED para la etapa de preinversión, ha demostrado su eficiencia y capacidad para alcanzar los objetivos trazados mediante un trabajo científico-técnico con participación colectiva que ha garantizado las disposiciones y lineamientos requeridos para sus funciones básicas y respaldo legal.
REFERENCIAS BIBLIOGRÁFICAS
1. EMA. Mission statement and legal role. [cited 2011 Marz 14]. Available from: http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000106.jsp&murl=menus/about_us/
about_us.jsp&mid=WC0b01ac0580028a44
2. ALBAmed. Proyecto Grannacional Centro Regulador de Medicamentos del ALBA. Portal del ALBA-TCP. [citado 14 Marz 2011]. Disponible en: http://www.salud.alianzabolivariana.org/
3. WHO. Practical Guidance for Conducting Review (bases on the WHO Data Collection Tool for the Review of Drug Regulatory Systems). WHO Technical Cooperation for Essential Drugs and Traditional Medicine. Regulatory Support Series, No. 12. Geneva: WHO; 2007.
4. Ministerio de Salud Pública. Cuadro Básico de Medicamentos de Cuba 2010. [citado 14 Marz 2011]. Disponible en: http://files.sld.cu/cdfc/files/2010/07/cbm-2010-868.pdf
5. Lista Nacional de Medicamentos Esenciales de Nicaragua. Acuerdo Ministerial No. 9-98, Managua: Nicaragua. Aprobada el 19 de enero de 1998. Publicada en La Gaceta No. 13 del 20 de enero de 1999.
6. MPPS, OPS y OMS. Formulario Terapéutico Nacional 2007. 3 ed. Caracas: Editorial FTN-MPPS; 2007.
7. Ministerio de Salud y Deportes. UNIMED. Lista Nacional de Medicamentos Esenciales LINAME 2008-2010. Resolución No. 0763. [citado 14 Marz 2011]. Disponible en: http://encrypted.google.com/search?hl=es&source= hp&biw=1419&bih=715&q=Lista+Nacional+de+Medicamentos+Esenciales+LINAME+2008 -2010.+Resoluci%C3%B3n+No.+0763&btnG=Buscar+con+ Google&aq=f&aqi=&aql=&oq=
8. PANDRH Steering Committee. [cited 14 Marz 2011]. Available from: http://new.paho.org/hq/index.php?option=com_content&task=view&id= 1601&Itemid=513
Recibido: 15 de febrero de 2011.
Aprobado: 8 de abril de 2011.
Dra. C. Celeste Aurora Sánchez González. Centro para el Control Estatal de Medicamentos (CECMED). Calle 200 No. 1 706, entre Ave. 17 y Ave. 19, Siboney, Playa. La Habana, Cuba. Correo electrónico: evareg@cecmed.sld.cu; sanchez.celeste@gmail.com