Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.3 Ciudad de la Habana jul.-set. 2011
Relación entre indicadores clínicos del espermograma y variables redox en infertilidad masculina
Association between clinical indicators of spermogram and redox variables in the male infertility
Akel MallokI, Gregorio Martínez-SánchezII, Rosa María Flores-SánchezIII, Celia Ángela Alonso-RodríguezIV
I Licenciado en Ciencias Farmacéuticas. Centro de Estudios para las Investigaciones y Evaluaciones Biológicas. Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
II Doctor en Ciencias Farmacéuticas. Investigador Titular. Medinat s.r.l. Ancona, Italia.
III Doctora en Medicina. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IV Maestra en Ciencias de Laboratorio Clínico. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
En conjunción a los factores convencionales que originan la infertilidad se ha identificado el estrés oxidativo, asociado como el factor causal que ocasiona daño al espermatozoide, pero los métodos para su determinación a nivel clínico no han sido desarrollados. El presente estudio tuvo como objetivo evaluar la existencia de una correlación entre indicadores globales del estado redox a muestras de suero sanguíneo, lisado de eritrocitos, plasma seminal y lisado de espermatozoides con la finalidad de identificar posibles biomarcadores. Se analizaron muestras que procedían de 31 pacientes con diagnóstico de infertilidad masculina y 30 voluntarios aparentemente sanos. Se confirmó que en todas las muestras analizadas los indicadores de daño a biomoléculas se encontraban significativamente (p< 0,01) incrementados en los pacientes cuando se compararon con el grupo control. Los indicadores de daño se acompañaron con bajos niveles de la capacidad antioxidante total en la fase lipídica y un desbalance en la actividad de las enzimas catalasa y superóxido dismutasa (relación catalasa/superóxido dismutasa 10 veces superior en plasma seminal de pacientes con respecto al valor control). El incremento de indicadores como malonindialdehído y organoperóxidos totales medidos en plasma seminal se correlacionaron con el incremento de indicadores de hipofunción espermática como movilidad y características morfológicas. El comportamiento de las variables redox en el plasma seminal resultó de gran valor diagnóstico y se propone para que sea usado en el seguimiento de intervenciones nutricionales o farmacológicas a estos pacientes.
Palabras clave: infertilidad masculina, estrés oxidativo, semen, sistema reproductor masculino.
ABSTRACT
In addition to the conventional factors originating infertility, the oxidative stress has been identified as the causative factor of spermatozoid damage; however, the methods for its clinical determination have not been developed yet. The present study was aimed at evaluating the correlation among the global redox state indicators of samples of blood serum, erythrocyte lysin, seminal plasma and sperm lysin in order to identify the possible biomarkers. Samples taken from 31 patients diagnosed with male infertility and 30 apparently health volunteers were analyzed. It was confirmed that all the samples had indicators of biomolecule damage which increased significantly (p< 0,01) in patients compared with the control group. The damage indicators comprised low total antioxidant capacity levels in the lipid phase and imbalance in the activity of enzymes catalase and superoxide dismutase (catalase/superoxide dismustase ratio is 10 times higher in seminal plasma of patients when compared to that of the controls). The increase of total malonindialdehyde and organoperoxide measured in the seminal plasma correlated with the increase of sperm hypofunction indicators such as mobility and morphological characteristics. The behaviour of redox variables in the seminal plasma had great diagnostic value and was submitted as a proposal for use in the follow-up of nutritional or pharmacological interventions in these patients.
Key words: male infertility, oxidative stress, semen, male reproductive system.
INTRODUCCIÓN
La especie humana tiene un bajo potencial reproductivo, y al considerar que la fecundidad mensual máxima de una pareja menor de 30 años de edad no llega al 30 %, se estima que al final del primer año el 80 % de las parejas ha logrado un embarazo y el 90 % a los 18 meses. Al promediar los diferentes estudios epidemiológicos, la tasa de infertilidad masculina y femenina está en el 15 %. En cuanto a la infertilidad masculina, su incidencia pura es del 33 % y se aumenta el 20 % cuando coexiste con otras afecciones.1 Los valores de referencia del espermograma en los casos de infertilidad masculina corresponden a población fértil pero no indican fertilidad o infertilidad masculina, ya que hombres con valores por debajo de ellos pueden conseguir gestaciones.
La adquisición de la capacidad fértil del espermatozoide eyaculado es un proceso complejo que aún no está del todo esclarecido y que se conoce como capacitación.2 En él intervienen las células de Sertoli y el epitelio del epidídimo, los cuales se encargan de secretar hormonas y enzimas que son necesarias para que este tenga lugar.3 En este proceso también desempeñan una función decisiva las especies reactivas del oxígeno (ERO). Recientemente se ha podido comprobar que la producción bajo condiciones fisiológicas y controlada de estas es de vital importancia para que se produzca la capacitación del espermatozoide.4 En este proceso también intervienen otros mecanismos que están regulados por ERO como es el influjo de calcio, el aumento del adenosina monofosfato cíclico (AMPc), la fosforilación de proteínas, entre otros.5
Por otra parte, se conoce que las ERO pueden incidir negativamente sobre la fertilidad masculina, mediante 2 mecanismos fundamentales: el daño que estas provocan a la membrana espermática, lo cual da lugar a una reducción de la motilidad y capacidad del espermatozoide de fusionarse con el óvulo, y el daño que ejercen directamente sobre el ADN espermático, donde las ERO afectan la genómica paternal del embrión.6
El diagnóstico clínico de una serie de marcadores del sistema antioxidantes/pro-oxidantes constituye una herramienta de gran utilidad que puede contribuir a la interpretación de los procesos fisiológicos y patológicos que tienen lugar en el organismo. Aunque estos métodos no están aún establecidos a nivel de laboratorio clínico existen cada vez más evidencias que de contar con estos se abrirían nuevas oportunidades en el conocimiento de la fisiopatología de la infertilidad así como en las estrategias de intervención.
Teniendo en cuenta estos elementos, el presente trabajo tuvo como objetivo evaluar la existencia de una correlación entre indicadores globales del estado redox a muestras de suero sanguíneo, lisado de eritrocitos, plasma seminal y lisado de espermatozoides con la finalidad de identificar posibles biomarcadores.
MÉTODOS
Se realizó un estudio prospectivo, comparativo unicéntrico de pacientes y voluntarios que acudieron a la consulta de infertilidad del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" de La Habana en el periodo comprendido de 8:00 a.m. a 4:00 p.m. del 1ro. de septiembre al 30 de noviembre de 2009. Se incluyeron sujetos aparentemente sanos con paternidad probada y pacientes con diagnóstico de infertilidad masculina, de edades comprendidas entre 20 y 35 años y que mostraban su voluntariedad a través de su consentimiento informado de forma oral y escrita para participar en el estudio. Se excluyeron sujetos con: 1) antecedentes de alguna enfermedad aguda o crónica (urogenital, hepática, metabólico-endocrina, cardiovascular, neurológica, del sistema inmune, respiratoria, entre otras); 2) tratamiento farmacológico o consumo de algún suplemento nutricional, 3) participación en otro estudio clínico o utilización de algún fármaco en fase de experimentación; 4) la no voluntariedad del sujeto para participar en el estudio; 5) solo para los voluntarios sanos: parámetros del espermograma alterados (motilidad, viabilidad, infiltrado de leucocitos, pH, concentración espermática). Los criterios de salida fueron: negativa del sujeto a continuar en el estudio, fallecimiento o aparición de enfermedad psiquiátrica.
El protocolo de investigación fue sometido a discusión por los investigadores participantes y a su revisión y aprobación por el comité de ética y revisión institucional (Hospital Clinicoquirúrgico "Hermanos Ameijeiras"). El protocolo se ejecutó solo después de su aprobación y cumplía los procedimientos éticos para las investigaciones médicas en seres humanos establecidos en la Declaración de Helsinki emanada por la Asamblea Médica Mundial.7
Además de considerar la información de la Historia Clínica a los pacientes se les realizó una entrevista estructurada, que permitió obtener datos generales para el formulario de recogida de datos. Las variables que se recogieron en el formulario fueron las siguientes: número de inclusión, número de historia clínica, nombres y apellidos, género, etnia, edad, peso, talla, presión arterial, grado de escolaridad, hábitos tóxicos, actividad física, antecedentes patológicos, consumo de fármacos o suplementos y hábitos alimentarios.
Se analizaron 30 muestras de semen de sujetos aparentemente sanos y 31 pacientes con diagnóstico de infertilidad del género masculino, las cuales fueron obtenidas mediante masturbación sin el empleo de algún tipo de lubricante y con 4 días de abstinencia eyaculatoria. Posteriormente las muestras fueron centrifugadas a 800 g × 10 min. El sobrenadante (líquido seminal) fue separado del sedimento (espermatozoides), este último re-suspendido en solución de cloruro de sodio 0,9 % y centrifugado nuevamente. Una vez culminado este segundo proceso de centrifugación se separó el sobrenadante y las células (sedimento) fueron re-suspendidas en agua desionizada para lisarlas por shock osmótico.8
A los individuos en ayunas se les tomaron muestras de sangre por punción venosa; la sangre se centrifugó a 3 000 g por 10 min; se tomó una muestras de suero y 50 µL de del sedimento eritrocitario; este último de le adicionó 1 mL de solución de cloruro de sodio 0,9 %; se agitó suavemente y se centrifugó; una vez culminado este segundo proceso de centrifugación se separó el sobrenadante y las células (sedimento) fueron re-suspendidas en agua desionizada para lisarlas por shock osmótico. Todas las muestras fueron almacenadas a -70 ºC hasta el momento de las determinaciones bioquímicas.
En este estudio se determinaron los siguientes marcadores de estrés oxidativo en muestras de suero, lisado de eritrocitos, líquido seminal y lisado de espermatozoides de pacientes y controles: superóxido dismutasa (SOD), catalasa (CAT), malonildialdehído (MDA), hidroperóxidos totales (ROOH), productos avanzados de la oxidación de proteínas (PAOP), potencial de peroxidación (PP), capacidad reductora de hierro férrico en plasma (FRAP), glutatión reducido (GSH), proteínas totales (PT).
La determinación de la actividad de la SOD se realizó por el método que emplea el pirogallol, el cual en medio básico se auto-oxida generando en el medio de reacción el radical O2·-, de esta forma la reacción radicalaria se propaga, acelerando la auto-oxidación del pirogallol, cuya forma oxidada absorbe la luz a 420 nm.9 Por convenio se tomó 1 U de SOD como la cantidad de enzima que inhibió en un 50 % la reacción de auto-oxidación del pirogallol a 25 ºC y pH= 8,2. Los resultados se expresaron como unidades por mililitro por minuto (U/mL/min). Para la determinación de CAT la técnica utilizada se fundamentó en la variación de la DO (l= 240 nm) que tiene lugar durante la descomposición del H2O2 por la CAT. La actividad enzimática se siguió a 25 ºC a pH 7,0 y se reportó en unidades por litro por minuto (U/L/min).10
El MDA se midió utilizando el método colorimétrico que emplea el 1-metil-2-fenil indol como cromógeno. La condensación de una molécula de MDA con 2 moléculas de 1-metil-2-fenil indol, bajo condiciones de acidez da como resultado la formación de un cromóforo con una absorbancia máxima de 586 nm. Se utilizó una curva patrón de 1, 1,3,3-tetraetoxipropano para calcular las concentraciones finales.11 Para la determinación de ROOH se utilizó el método del Fe/xilenol naranja que forma un cromógeno con los ROOH detectable por medición espectrofotométrica a 560 nm.12 Para la determinación de PAOP se siguió la transformación de los iones yodo a yodo diatómico que provocan los PAOP con consecuente cambio de DO a 340 nm. Se utilizó como patrón la cloramina T y los resultados se expresaron como µM de cloramina T.13
La determinación del PP consistió en inducir los procesos de peroxidación por catálisis con Cu²+ (2 mM), incubando la muestra por 24 h a 37 ºC, se midió la formación de MDA antes y después de la inducción. Para los cálculos se restó, para cada muestra, el valor de la determinación de MDA correspondiente a las 24 h con la determinada a las 0 h.14 Para las determinaciones de FRAP se midió la capacidad de la muestra para reducir el hierro férrico a ferroso. A un pH bajo se colocó en el medio de reacción el complejo Fe3+-TPTZ; este complejo en presencia de agentes reductores se reduce a Fe2+-TPTZ que desarrolla un color azul intenso con un máximo de absorción de 593 nm. Las condiciones de ensayo favorecieron la reducción del complejo y estaban ajustadas para que la formación de color solo ocurriera por efecto de la muestra que se añadía.15
El contenido de glutatión reducido se determinó utilizando un método espectrofotométrico. Este se basó en la determinación de un cromóforo que absorbe a 412 nm el ácido-2-nitro-5-tiobenzoico, que se forma de la reacción entre el ácido 5,5`-ditiobis-(2-nitrobenzoico) (DTNB) con los grupos SH del GSH. Para estimar el contenido de GSH se estableció una curva patrón con cantidades conocidas de GSH.16 La determinación de proteínas totales se realizó por el método de azul de Coommasie; el producto de esta reacción es detectable espectrofotométricamente y tiene un máximo de absorción a una longitud de onda de 595 nm.17
La determinación de hemoglobina se realizó en los lisados de eritrocitos, para tomarlo como valor de corrección de las mediciones ejecutadas en este fluido. El método utilizado fue el de Drabkin.18
Variables del espermograma: movilidad, morfología, viabilidad, concentración espermática, pH e infiltrado de leucocitos. La movilidad espermática fue determinada basándose en la clasificación sugerida por la OMS.19 Con el propósito de determinar la viabilidad espermática se utilizó el método de exclusión de la eosina.20 Se añadieron 50 µL del colorante a una dilución 1:2 de semen en solución amortiguadora fosfato, tras agitarse suavemente por unos segundos se tomaron 50 µL de la muestra y se extendieron sobre un cubreobjetos, tras la incubación a 37 ºC durante 30 min, se fijó la preparación y se cuantificaron los espermatozoides que excluían a la eosina, a estos se les consideró vivos en el momento de la fijación, ya que los espermatozoides muertos exhiben una coloración rosada al no excluir a la eosina. Se contabilizaron al microscopio (100x). La morfología espermática fue determinada basándose en la clasificación sugerida por la OMS.19 La cuantificación de los leucocitos se determinó a través del procedimiento para la cuantificación de células peroxidasa positivas;21 se utilizó una solución de benzidina al 0,012 % y H2O2 al 0,038 % diluidos en etanol al 50 % de agua bidestilada; a 20 µL de esta solución se le añadieron 20 µL de semen, se colocaron en un hemocitómetro y se contaron las células que adquirieron una tonalidad parda (células peroxidasa positivas). La concentración espermática y pH del semen fue analizado según los procedimientos descritos en el manual de métodos de la OMS.19
El análisis exploratorio de los datos se realizó un análisis para detectar puntos aberrantes (outliers). Los datos experimentales fueron sometidos a un análisis descriptivo donde se estimaron parámetros: media y desviación estándar. Posteriormente se realizó un ensayo para comprobar la normalidad y homogeneidad de varianza (prueba de Levene).
Para determinar diferencias estadísticas en una variable en cuestión se utilizó un ensayo de análisis de varianza ANOVA I que se continuó con el ensayo de Duncan; una vez comprobada que la distribución de los datos generados se ajustaba a una distribución normal, se realizó un análisis de regresión y correlación con el objetivo de determinar el grado de asociación entre las variables estudiadas (se analizó mediante el coeficiente de Pearson).
RESULTADOS
La muestra de pacientes con diagnóstico de infertilidad masculina (n= 31) y un número similar de individuos controles fue caracterizada desde el punto de vista general, de sus hábitos de vida y exposición a tóxicos o fármacos. La mediana de la edad de los pacientes estudiados fue de 34 años (min. 21 años-max. 46 años), mientras que la de los controles fue 33 años (min. 20 años-max. 44 años), para este indicador no se encontraron diferencias significativas (p> 0,05) entre las proporciones entre pacientes y controles. Por otra parte, la mayor proporción de sujetos tanto controles como pacientes pertenecían al grupo étnico blanco (60); las proporciones menores correspondieron a negros (22 %) y mestizos (18 %). No se encontraron diferencias significativas (p> 0,05) en las proporciones étnicas de pacientes y controles. La distribución según el grado de escolaridad de la población estudiada se comportó con niveles superiores a 9 grado para todos los involucrados. Tanto entre pacientes como entre los controles el porcentaje mayor se ubicó en el nivel de 12 grado (57 %); le siguió el nivel universitario (25 %), el técnico medio (11 %) y el de noveno grado (5 %). No se encontraron diferencias significativas (p>0,05) en las proporciones de los grados de escolaridad de pacientes y controles.
Al analizar algunos indicadores de los estilos de vida de los pacientes y controles se encontró que una proporción del 37 % de los individuos tenían una actividad física activa, mientras un 38% muestra una actividad física moderada y un 25 % entraban en la categoría de sedentarios. No se encontraron diferencias significativas (p> 0,05) entre las proporciones de grupos de pacientes y sujetos controles para este indicador. En los hábitos dietéticos se destacó un consumo de café (mediana total 1 vez al día, min. 0, máx. 4) superior a la de té (mediana total 0 vez al día, min. 0, max. 2). En relación con el consumo de alimentos fritos la frecuencia en ambos grupos fue de 3 veces al día y el tipo de grasa se distribuyó de manera general en un 49 % para el uso de aceites vegetales y el 51 % en el uso combinado de aceites vegetales y grasa de origen animal. No se encontraron diferencias significativas (p> 0,05) entre las proporciones y frecuencias de consumo de estos alimentos entre grupos de pacientes y sujetos controles.
El consumo de alcohol, la exposición al sol, altas temperaturas y riesgo químico fue significativamente mayor entre el grupo de pacientes comparado con la proporción de los sujetos controles. Entre los pacientes, 7 (23 %) eran hipertensos, 3 (10 %) eran alérgicos y 1 (3 %) padecía de glaucoma. De los hipertensos, 3 (10 %) seguían tratamiento con enalapril, para la alergia y 2 (6 %) seguían tratamiento con difenidramina. La frecuencia de hipertensión entre los controles fue de 5 (17 %) sin diferencias significativas (p> 0,05) con respecto a la proporción encontrada en el grupo de pacientes. Entre los controles no se detectaron casos de alergia u otras afecciones.
Los resultados del análisis del semen, muestran de forma global que el grupo de pacientes se encontraba por debajo del intervalo de referencia en cuanto a la movilidad A y la movilidad A + B. En este mismo grupo de individuos no se detectaron sujetos con un volumen eyaculado inferior a 2 mL. Los parámetros fuera del intervalo de referencia en el grupo de pacientes correspondieron a: 13 individuos que presentaban una concentración espermática inferior, 24 presentaron una movilidad A inferior, 5 presentaron valores de leucocitos incrementados, 2 tenían valores superiores de células inmaduras. El grupo de sujetos controles se comportó dentro del intervalo establecido como referencia en el laboratorio (tabla 1).
Los indicadores del ambiente redox fueron analizados en diferentes muestras; los valores de estos indicadores en suero, lisado de eritrocitos, líquido espermático y lisado de células espermáticas se muestran en las tabla 2 y 3. En suero (tabla 1), a excepción de los valores de malonialdialdehído e hidroperóxidos totales, todos los indicadores del ambiente redox mostraron diferencias significativas (p< 0,01) entre pacientes y controles. Todos los indicadores del ambiente redox medidos en lisado de eritrocitos (tabla 2) fueron significativamente diferentes entre pacientes y controles. Los indicadores de daño a biomoléculas (MDA, PAOP y ROOH) se encontraron significativamente (p< 0,05) elevados en los pacientes infértiles.
Los indicadores globales de capacidad antioxidante (FRAP y PP) indican una disminución significativa (para FRAP p< 0,05; para PP p< 0,01) de la capacidad antioxidante tanto en la fase hidrosoluble (FRAP) como liposoluble (PP). La concentración intraeritrocitaria de GSH se encontró significativamente (p< 0,05) disminuida en los pacientes, entre tanto la actividad de las enzimas CAT y SOD se halló significativamente (p< 0,01) elevada, y su relación CAT/SOD en los pacientes superó en el 100 % el valor hallado en el grupo control.
Todos los indicadores del ambiente redox medidos en lisado de células espermáticas (tabla 3) fueron significativamente diferentes entre pacientes y controles. Los indicadores de daño a biomoléculas (MDA, PAOP y ROOH) se encontraron significativamente (p< 0,01) elevados en los pacientes infértiles. El indicador global de capacidad antioxidante en fase liposoluble (PP) indicó una disminución significativa (p< 0,05). Por otra parte, el indicador global FRAP mostró un aumento significativo (p< 0,05) de la capacidad antioxidante en la fase hidrosoluble que coincide con un aumento significativo (p< 0,01) de la concentración intra-espermática de GSH. Tanto la actividad de las enzimas CAT y SOD se encontró significativamente (p< 0,01) elevada en los pacientes y su relación CAT/SOD superó en un 2,5 veces el valor encontrado en el grupo control.
Los indicadores del ambiente redox medidos en el plasma seminal (tabla 3) evidenciaron que los indicadores de daño a biomoléculas (MDA, PAOP y ROOH) se encontraron significativamente (p< 0,01) elevados en los pacientes infértiles. El indicador global PP indicó una disminución significativa (p< 0,01) de la capacidad antioxidante en la fase liposoluble. Por otra parte, el indicador FRAP no se modificó, mientras que existió un aumento significativo (p< 0,05) de la concentración de GSH. La actividad de la enzima SOD no se modificó mientras que la actividad CAT se encontró significativamente (p< 0,01) elevada en los pacientes y la relación CAT/SOD superó en un 10 veces el valor hallado en el grupo control.
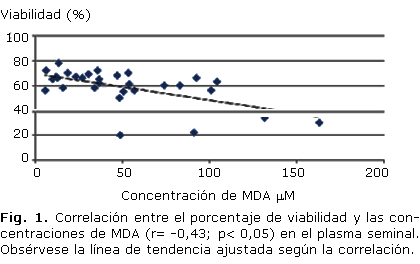
El resultado del análisis de correlación múltiple evidenció que no existía correlación entre las variables determinadas en el espermograma y las variables redox estudiadas en lisado de células seminales. Por otra parte, las correlaciones significativas entre las variables redox determinadas en el plasma seminal y las variables del espermograma fueron entre el porcentaje de movilidad A y las concentraciones de MDA (r= -0,39, p< 0,05); porcentaje de movilidad A y las concentraciones de ROOH (r= -0,37, p< 0,05); el porcentaje de viabilidad y las concentraciones de MDA (r= -0,43, p< 0,05) (Fig. 1); porcentaje de morfología y las concentraciones de ROOH (r= -0,38, p< 0,05).
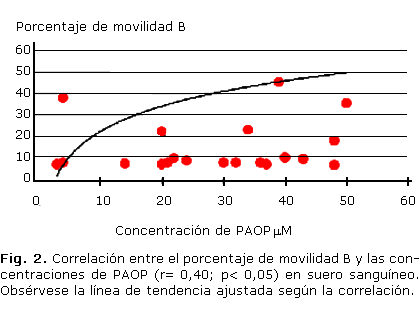
El resultado del análisis de correlación múltiple entre las variables determinadas en el espermograma y las variables del ambiente redox estudiadas en lisado de eritrocitos evidenció correlaciones significativas entre las concentraciones de GSH (r= 0,32, p< 0,05) y el porcentaje de movilidad A. Por otra parte, las correlaciones significativas entre las variables redox determinadas en el suero y las variables del espermograma fueron entre la concentración espermática y las concentraciones de PAOP (r= 0,37, p< 0,05); el porcentaje de movilidad B y las concentraciones de PAOP (r= 0,40, p< 0,05) (Fig. 2).
DISCUSIÓN
En los últimos años con el hallazgo de nuevos conocimientos acerca de los procesos involucrados en la capacidad de fertilización de las células sexuales masculinas, han emergidos nuevos parámetros a tener en cuenta a la hora de evaluar sus potencialidades en el humano.22 Se plantea, por parte de la OMS, que estos parámetros deben ser incluidos en los estudios de fertilidad masculina. Indicadores como la fragmentación del ADN, la apoptosis de células sexuales y el EO deben ser necesariamente tomados en consideración. Todos ellos son el reflejo de la existencia de factores de riesgo o procesos fisiopatológicos que inciden notablemente sobre un problema de salud como es la infertilidad masculina. Su interpretación puede influir decisivamente sobre el diagnóstico precoz de dicha problemática.23
Los indicadores redox de diferentes fluidos en pacientes infértiles del sexo masculino no han sido suficientemente estudiados, ni los métodos se han establecido como rutina para el diagnóstico clínico. La muestra poblacional seleccionada para el estudio se enmarcó mayoritariamente (87 %) entre las edades de 20-39 en correspondencia con el periodo de mayor fecundidad. El grupo de individuos tomados como control se correspondió en cuanto a las proporciones etarias con el grupo de pacientes. Los niveles de escolaridad que predominaron en la muestra fueron de 12 grado, seguidos por los universitarios, distribución en correspondencia con el nivel escolar de la población objeto de estudio.
Los estilos de vida pueden tener una gran repercusión en la salud humana, es por ello que se exploraron varios indicadores relacionados en los pacientes y se compararon con el grupo de sujetos controles. La actividad física activa y moderada predominó en ambos grupos, lo cual está en correspondencia con la edad de este grupo poblacional que es generalmente activo laboralmente por lo que también es activo físicamente.
En cuanto al consumo de café y té no se encontraron diferencias entre los grupos en estudio y predominó el consumo de café sobre el té, lo cual se corresponde con los hábitos nutricionales de la población cubana. El de alimentos fritos de manera regular estuvo presente en todos los individuos estudiados y predominó el consumo de grasas mixtas (vegetal y animal) para el proceso de fritura; estos hábitos también se corresponden con la conducta nutricional de la población cubana. El consumo de alcohol y la exposición a riesgos ambientales fue significativamente superior (p< 0,05) en los pacientes. Al aplicar las técnicas tradicionales de diagnóstico del espermograma las variables más afectadas en los pacientes se correspondieron con la baja movilidad de los espermatozoides.
Durante la pasada década, las ERO y otras moléculas reactivas han emergido como importantes reguladores de una multitud de procesos fisiológicos y fisiopatológicos. Al principio de su descubrimiento se tenía el criterio que estas moléculas de vida efímera y alta reactividad ejercían solamente efectos perjudiciales sobre las células y tejidos del organismo. Pero estos conceptos fueron reevaluados bajo condiciones fisiológicas luego del descubrimiento de la producción endógena de estas sustancias y la existencia de mecanismos antioxidantes enzimáticos. Estos descubrimientos propiciaron la evolución del concepto de estrés oxidativo, sobre todo del conocimiento acerca de su impacto en los organismos vivos que utilizan el oxígeno como forma de obtener energía metabólicamente aprovechable.24
El diagnóstico clínico de una serie de marcadores del sistema antioxidantes/pro-oxidantes constituye una herramienta de gran utilidad que puede contribuir a la interpretación de los procesos fisiológicos y fisiopatológicos que tienen lugar en el organismo. En el presente estudio los indicadores determinados permitirán contar con un banco de valores de referencia para posteriores estudios de este tipo en consultas de fertilidad.
De manera general se encontró un alto grado de daño oxidativo a las biomoléculas en todos los fluidos de los pacientes analizados comparados con el grupo control. Los lípidos de la membrana del espermatozoide constituyen componentes de gran importancia desde el punto de vista estructural y funcional. Los fosfolípidos (FL) de las células espermáticas son mayoritariamente ácidos grasos poliinsaturados (AGPI) de cadena larga pertenecientes a las series n-3 y n-6 cuyas proporciones varían según la especie.25
El alto grado de insaturación de los FL contribuye al movimiento celular y metabolismo lipídico, además confiere suficiente fluidez a la membrana plasmática del espermatozoide necesaria para los procesos de fusión con el óvulo; la proporción de AGPI está relacionada con la calidad del semen en diferentes especies, particularmente el contenido de ácido docosahexanoico (DHA) ha sido asociado con la concentración de espermatozoides y su motilidad en el hombre y otros mamíferos; una reducción de la capacidad fértil durante el envejecimiento ha sido atribuida a una disminución de la proporción de AGPI de los FL de membrana.26 Sin embargo, altas concentraciones de AGPI incrementan la susceptibilidad de la célula de sufrir un daño oxidativo inducido por ERO, lo cual se considera una causa de infertilidad masculina.27 Las ERO pueden sustraer un átomo de hidrógeno de los AGPI y conducir a reacciones en cadena como la peroxidación lipídica (POL).1 Sin embargo, concentraciones moderadas de ERO desempeñan una función importante en la regulación de varias funciones espermáticas como la capacitación y la reacción acrosomal.1,26 Los procesos de POL llevan a la formación de numerosos derivados tóxicos como son los hidroperóxidos, los 4-hidroxialquenales y el MDA.28 Uno de los métodos más utilizados para evaluar el grado de peroxidación de la membrana del espermatozoide y lípidos contenidos en el plasma seminal es la cuantificación espectrofotométrica de MDA.29 En el presente trabajo se cuantificó la concentración de MDA como un marcador de daño a biomoléculas en todos los fluidos; en la población estudiada los valores de este indicador son significativamente más elevados en lisado de eritrocitos (p< 0,05) y muy elevados (p< 0,01) en el lisado de espermatozoides y el plasma seminal comparados con los valores controles.
La elevada concentración de AGPI en la membrana celular propicia la ocurrencia de un daño oxidativo y por tanto, una mayor generación de productos de la POL, estos resultados están en correspondencia con los trastornos en la movilidad espermática detectada en los pacientes. Otras de las moléculas mayoritarias que se forman durante la POL y la proteica en su etapa inicial son los ROOH.30 Con respecto a este indicador, se puede observar un comportamiento similar al del MDA, siendo los ROOH significativamente más elevados en lisado de eritrocitos (p< 0,05) y muy elevados (p< 0,01) en el lisado de espermatozoides y el plasma seminal comparados con los valores controles. Para obtener el lisado de espermatozoides, estos fueron primeramente separados del plasma seminal mediante centrifugación, posteriormente resuspendidos en suero fisiológico, nuevamente centrifugados y finalmente lisados por choque osmótico con agua desionizada, durante este proceso pudo haberse incrementado la concentración de hidroperóxidos totales, entre los cuales se encuentra el H2O2. Según hallazgos experimentales de Mahfouz y otros, 2010,31 durante los procesos convencionales de centrifugación se produce una activación de la actividad de la enzima SOD, con lo cual se genera mayor cantidad de H2O2; esta hipótesis también puede justificar que en el lisado exista una mayor concentración de ROOH y está en concordancia con los resultados experimentales referentes a la actividad enzimática de la SOD, los cuales son descritos más adelante.
Otra de las moléculas que son susceptibles al ataque oxidativo por parte de las ERO son las proteínas. El radical ·OH es capaz de oxidar los grupos sulfihidrilos e interactuar con varios aminoácidos con lo cual genera daños puntuales en las proteínas. Los PAOP son el resultado de procesos de fragmentación, entrecruzamiento y agregación de estas biomoléculas como consecuencia de su oxidación.32 En el caso de los PAOP, estos provienen mayoritariamente de proteínas clorinadas y por tanto, son indicativos de procesos inflamatorios en los que intervienen los macrófagos activados; PAOP se encontró significativamente incrementado en todos los fluidos analizados; lo anterior es indicativo de la ocurrencia de procesos inflamatorios agudos o crónicos en este tipo de pacientes. Se conoce que el semen eyaculado es rico en fibrinógeno, que por la acción de enzimas presentes en el mismo es convertido a fibrina, la cual le brinda la consistencia necesaria al semen para que este pueda transportar los espermatozoides hacia el sitio de la fecundación. Además existen otras proteínas como la albúmina, la carnitina y algunos aminoácidos los cuales también son susceptibles a la oxidación; adicionalmente la fuente generadora principal de ERO en el semen son los leucocitos, de esta forma las proteínas del plasma del semen están más expuestas que las que forman parte del espermatozoide.
Otro importante daño oxidativo que tiene lugar en las proteínas, es la oxidación de los grupos amino de los aminoácidos a grupos carbonilo; los aminoácidos más sensibles son el triptófano, tirosina, fenilalanina, metionina y cisterna. Por el ataque de las ERO se producen entrecruzamientos de cadenas polipeptídicas y fragmentación de las proteínas que llevan a la pérdida de su función biológica, aunque en condiciones basales estos procesos son regulados por las defensas antioxidantes y los mecanismos reparadores,1 por lo que no repercuten considerablemente sobre la supervivencia celular.
Los indicadores de daño a biomoléculas son el reflejo del balance de los procesos pro-oxidantes/antioxidantes que tienen lugar en el organismo en condiciones basales; las células y los tejidos deben poseer un estado redox estable, lo cual es garantizado por el equilibrio que existe entre los procesos de generación y eliminación de ERO. Sin embargo, la señalización redox celular requiere que ocurra un desequilibrio temporal y controlado de estos procesos. La existencia de un EO moderado no crónico contribuye al adecuado funcionamiento y señalización celular.33
La determinación de la actividad de enzimas antioxidantes constituye otro biomarcador de importancia en el estudio del ambiente redox celular. La SOD y la CAT son dos enzimas fundamentales del sistema antioxidante; la primera de ellas dismuta el radical O2·- en H2O2 y este a su vez es convertido en agua y oxígeno mediante la acción de la CAT. Ambas están presentes tanto en el espermatozoide como en el plasma seminal, aunque difieren en su distribución; cabe destacar que la GPx representa otro miembro de la triada enzimática antioxidante del semen. Esta enzima está localizada en el interior de los testículos, la próstata, las vesículas seminales, las vías deferentes, el epidídimo, el plasma seminal y el espermatozoide.34
En todos los fluidos analizados (excepto la actividad SOD en plasma seminal) se evidenció un incremento de la actividad de ambas enzimas en los pacientes, en el caso de suero sanguíneo y lisado de eritrocitos el balance CAT/SOD se mantiene a nivel del grupo control, lo cual indica que a pesar del incremento en la actividad enzimática se logra un equilibrio.
No obstante el incremento de la actividad enzimática en lisado de células espermáticas y plasma seminal muestran un índice CAT/SOD superior al del grupo control (10 veces superior en plasma seminal y 2,5 veces superior en células espermáticas), lo anterior es por una actividad CAT superior al de SOD, lo cual indica una alteración en la homeostasia del peróxido de hidrógeno a este nivel. Es conocida la función fisiológica que desempeña el H2O2 en la capacitación espermática,35 por tanto este ambiente redox alterado puede ser la causa de la inmadurez espermática en estos pacientes.
El hecho de que en el lisado de espermatozoides la actividad de la SOD sea significativamente (p< 0,05) mayor que en el plasma seminal, puede deberse a que en este trabajo se ha determinado la actividad de SOD total. Desde el punto de vista filogenético existen 2 familias de esta enzima, la Cu/Zn-SOD y la Fe/Mn-SOD. La primera de ellas se localiza en el interior celular al igual que la manganeso dependiente de localización mitocondrial, mientras que la hierro dependiente se localiza en la membrana de células eucariotas, mientras que solo existe un isotipo extracelular responsable de la dismutación del radical O2·- en los fluidos extracelulares. Todos los miembros de esta familia de proteínas dismutan este radical con una eficiencia similar.4
Las concentraciones de GSH fueron diferentes en todos los fluidos entre pacientes y controles; en general en plasma sanguíneo y lisado de eritrocitos las concentraciones de GSH resultaron inferiores a la de individuos controles, lo cual es indicativo de sus bajas reservas de este antioxidante de fase soluble. Por otra parte, tanto el plasma seminal como en lisado de eritrocitos los valores de GSH son significativamente (p< 0,01) elevados en células espermáticas y (p< 0,05) en plasma seminal. Se debe aclarar que el papel primario del GSH no es actuar capturando directamente radicales libres, en un ambiente altamente oxidante, como el presente. En el plasma seminal y células espermáticas una alta concentración de GSH podría tener una función oxidante, debido a que los radicales -SH generados por la interacción GSH-radicales libres pueden ser más nocivos que los radicales que le dieron origen.36
Los resultados experimentales sugieren que existe una mayor susceptibilidad a la peroxidación lipídica (PP) en todos los fluidos analizados, lo cual es indicativo de una deficiencia de los sistemas antioxidantes de fase lipídica en estos pacientes. El a-tocoferol es el antioxidante más importante en las membranas biológicas, este es fundamental en el mantenimiento de la integralidad y estabilidad de estas al proteger los AGPI de la peroxidación.37 En tanto, el ácido ascórbico, los uratos y flavonoides contenidos en el plasma seminal son la principal defensa antioxidante que se encuentra en contacto con los fluidos extracelulares de los testículos y el epidídimo una vez que el espermatozoide es eyaculado.6
En el caso de FRAP los resultados mostraron una disminución en suero sanguíneo y lisado de eritrocitos, indicativo de una deficiencia de antioxidantes solubles a nivel sistémico. En contraste con estos resultados se observó un incremento significativo de los valores FRAP en lisado de células seminales y plasma seminal. En el caso del plasma seminal se encontró un coeficiente de correlación de 0,52 (p< 0,05) entre el incremento del valor FRAP y el incremento del valor GSH; este hecho está probablemente relacionado con una concentración patológica de antioxidantes en el fluido seminal y en el interior de los espermatozoides, resultado que coincide con la elevación de los valores de GSH en el lisado de células y plasma celular.
En condiciones fisiológicas, una vez que el espermatozoide es eyaculado experimenta una serie de procesos que contribuyen a potenciar su capacidad fértil, entre estos se encuentran los cambios de fluidez de la membrana espermática, condicionado por la modificación en el contenido de fosfolípidos. En este proceso tienen una activa participación las ERO mediante mecanismos que aún no están del todo esclarecido, lo que sí se conoce es que activan cascadas de fosforilación de proteínas, producen aumento del AMPc, y otros eventos moleculares que inciden sobre la fluidez de la membrana acrosomal y flagelar.38 Pero a la vez, puede producirse la peroxidación de los fosfolípidos y con ello generarse derivados tóxicos para la célula como es el MDA. En varios estudios se ha reportado que existe una correlación negativa entre las concentraciones de este tipo de derivados de la POL y la viabilidad celular. Los resultados experimentales de este trabajo están en concordancia con los hallazgos reportados por la literatura internacional.5
Según los resultados de este trabajo, en la medida que se incrementó la concentración de MDA se apreció una disminución en la movilidad (%A) y la viabilidad de las células espermáticas. La elevación de la concentración de organoperóxidos estuvo relacionada con la disminución de la movilidad (%A) en los pacientes y un incremento de los trastornos morfológicos de los espermatozoides; valores superiores a 100 µM de OT en plasma seminal coincidieron con una disminución por debajo del 30 % en el porcentaje de movilidad A (intervalo patológico). Tanto las variables MDA como OT son indicativas de lesiones oxidativas; es razonable que en un ambiente oxidativo como el detectado para los pacientes los niveles de daño encontrados provoquen trastornos funcionales a los espermatozoides.
Por otra parte, una baja concentración de GSH en eritrocitos coincidió con una reducción en la movilidad espermática. Los incrementos del biomarcador de daño a proteínas PAOP correlacionaron matemáticamente con el porcentaje de movilidad B y la viabilidad, pero desde el punto de vista biológico el sentido de esta correlación debe interpretarse como que al incrementar PAOP en la generalidad de los casos los porcentajes de viabilidad de las muestras de la mayoría de los pacientes se encontraron por debajo del 70 % y el porcentaje de movilidad B por debajo del 30 %, lo cual significa que el aumento del PAOP permite ubicar al paciente en el intervalo patológico; el análisis anterior refuerza el criterio que a medida que es mayor el daño oxidativo a la membrana se ve más comprometida la vida celular.
Los resultados de este trabajo impactarán positivamente sobre el conocimiento científico que día a día se genera en el campo relativo a la investigación de la función que desempeña el estrés oxidativo sobre los procesos fisiológicos y fisiopatológicos que tienen lugar en el organismo. De manera general se obtuvieron evidencias de que en todos los fluidos analizados están presente el daño oxidativo en los pacientes con infertilidad masculina, atendiendo a los requisitos establecidos para la selección de un biomarcador clínico; se considera que la determinación de los indicadores redox en plasma seminal podría ser la mejor elección para un seguimiento de los pacientes. Lo anterior se basa en los criterios de que la toma de la muestra, a pesar de tener los inconvenientes de su obtención por masturbación, es una muestra de la cual ya se dispone una vez que es necesario obtenerla para el espermograma, lo que aventaja las determinaciones en suero sanguíneo y lisado de eritrocitos. Por otra parte, la obtención del lisado de espermatozoides es más trabajosa desde el punto de vista experimental y adicionalmente en el plasma seminal se producen en estado patológico el incremento altamente significativo de las variables de daño a biomoléculas MDA, PAOP y ROOH que están correlacionadas con los daños funcionales a los pacientes.
El seguimiento del ambiente redox en pacientes con infertilidad masculina, permitiría monitorear las correcciones en los estilos de vidas, niveles de exposición ambiental, que se decidan hacer en este tipo de pacientes. Atendiendo a los antecedentes de esta muestra poblacional se evidencia que en una primera fase se debe proceder a la eliminación de los hábitos tóxicos (alcohol, fundamentalmente), la promoción de la actividad física y también podría resultar interesante la intervención con antioxidantes fundamentalmente que aporten antioxidantes de fase liposoluble.
Teniendo en cuenta los resultados, a partir del desarrollo experimental empleado, se puede concluir: la existencia de una correlación significativa entre los indicadores redox en suero, lisado de eritrocitos, plasma seminal procedente de pacientes infértiles e individuos aparentemente sanos con cambios funcionales y morfológicos del espermograma. La mayor parte de los indicadores redox analizados en los fluidos biológicos estudiados indican la existencia de un ambiente redox alterado en este tipo de pacientes. La validación de la metodología de trabajo experimental establecida para el análisis del plasma seminal y el lisado de células espermáticas permite proponerla como referencia en el estudio de pacientes infértiles sometidos a una intervención nutricional o farmacológica. El análisis del ambiente redox en el fluido seminal en forma de rutina en los pacientes con sospecha de infertilidad resulta de gran valor clínico, por los resultados obtenidos en esta investigación.
En estudios futuros sería de gran interés determinar otros indicadores del sistema redox como la relación GSH/GSSG y GPx/GR, por las implicaciones de la concentración de peróxido de hidrógeno en la fisiopatología de la infertilidad masculina; determinar el porcentaje de fragmentación del ADN u otro indicador de daño al ADN (ej. ensayo COMETA) como medida de la integridad del material genético en espermatozoides de pacientes infértiles y sujetos controles, y utilizar la batería de ensayos redox en el seguimiento de terapias antioxidantes correctivas.
REFERENCIAS BIBLIOGRÁFICAS
1. Saalu LC. The incriminating role of reactive oxygen species in idiopathic male infertility: an evidence based evaluation. Pak J Biol Sci [Internet] 2010 [cited2010 Nov 6]; 13(9):413-422. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20973394
2. O'Flaherty C, de Lamirande E, Gagnon C. Reactive oxygen species and protein kinases modulate the level of phospho-MEK-like proteins during human sperm capacitation. Biol Reprod [Internet] 2005 [ cited 2010 Nov 1]; 73(1):94-105. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15772258
3. Hung AJ, King P, Schlegel PN. Uniform testicular maturation arrest: a unique subset of men with nonobstructive azoospermia. J Urol [Internet] 2007 [cited 2010 Nov 16]; 178(2):608-612; discussion 612. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17570432
4. de Lamirande E, Lamothe G. Levels of semenogelin in human spermatozoa decrease during capacitation: involvement of reactive oxygen species and zinc. Hum Reprod [Internet] 2010 [cited 2010 Nov 3]; 25(7):1619-1630. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20501468
5. de Lamirande E, Lamothe G, Villemure M. Control of superoxide and nitric oxide formation during human sperm capacitation. Free Radic Biol Med [Internet] 2009 [cited 2010 Nov 1]; 46(10):1420-1427. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=19268528
6. Tremellen K. Oxidative stress and male infertility—a clinical perspective. Hum Reprod Update [Internet] 2008 [cited 2010 Nov 5]; 14(3):243-258. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18281241
7. WMA. World Medical Association Declaration of Helsinki. Ethical Principles for Medical Research Involving Human Subjects. Adopted by the 18th WMA General Assembly, Helsinki, Finland, June 1964: J Int Bioethique. 2004;12:124-9.
8. Kasimanickam R, Pelzer KD, Kasimanickam V, Swecker WS, Thatcher CD. Association of classical semen parameters, sperm DNA fragmentation index, lipid peroxidation and antioxidant enzymatic activity of semen in ram-lambs. Theriogenology [Internet] 2006 [cited 2010 Nov 1]; 65(7):1407-1421. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16188307
9. Marklund S, ed. Pyrogallol autooxidation. Boca Raton, FL: CRC; 1985.
10. Aebi H. Catalase in vitro. Methods Enzymol [Internet] 1984 [cited 2010 Nov 5]; 105:121-126. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=6727660
11. Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation products: malonaldehyde and 4-hydroxynonenal. Methods Enzymol [Internet] 1990 [cited 2010 Nov 7]; 186:407-421. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=2233308
12. Nourooz-Zadeh J. Ferrous ion oxidation in presence of xylenol orange for detection of lipid hydroperoxides in plasma. Methods Enzymol [Internet] 1999 [cited 2010 Nov 7]; 300:58-62. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9919509
13. Witko-Sarsat V, Nguyen-Khoa T, Jungers P, Drueke TB, Descamps-Latscha B. Advanced oxidation protein products as a novel molecular basis of oxidative stress in uraemia. Nephrol Dial Transplant [Internet] 1999 [cited 2010 Nov 9]; 14 Suppl 1:76-78. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=10048460
14. Ozdemirler G, Mehmetcik G, Oztezcan S, Toker G, Sivas A, Uysal M. Peroxidation potential and antioxidant activity of serum in patients with diabetes mellitus and myocard infarction. Horm Metab Res [Internet] 1995 [cited 2010 Nov 5]; 27(4):194-196. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=7750904
15. Benzie IF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay. Anal Biochem [Internet] 1996 [cited 2010 Nov 6]; 239(1):70-76. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8660627
16. Camera E, Picardo M. Analytical methods to investigate glutathione and related compounds in biological and pathological processes. J Chromatogr B Analyt Technol Biomed Life Sci [Internet] 2002 [cited 2010 Nov 9]; 781(1-2):181-206. Available from:http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12450659
17. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem [Internet] 1976 [cited 2010 Nov 3]; 72:248-254. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=942051
18. Drabkin DL. The standardization of hemoglobin measurement. Am J Med Sci [Internet] 1949 [cited 2010 Nov 6]; 217(6):710. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18210406
19. WHO. Laboratory Manual for the Examination of Human Semen and Semen-Cervical Mucus Interaction. 5 ed. Cambridge, UK: Cambridge University Press; [Internet] 2010 [cited 2010 Nov 6]. Available from: http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf
20. Marmor D, Grob-Menendez F. [Flagellar anomalies in routine spermatozoa cytograms]. J Gynecol Obstet Biol Reprod (Paris) [Internet] 1990 [cited 2010 Nov 6]; 19(2):181-185. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2324440?dopt=Citation
21. Politch JA, Wolff H, Hill JA, Anderson DJ. Comparison of methods to enumerate white blood cells in semen. Fertil Steril [Internet] 1993 [cited 2010 Nov 4]; 60(2):372-375. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=8393411
22. Aziz N, Agarwal A. Evaluation of sperm damage: beyond the World Health Organization criteria. Fertil Steril [Internet] 2008 [cited 2010 Nov 6]; 90(3):484-485. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17953944
23. Aziz N, Said T, Paasch U, Agarwal A. The relationship between human sperm apoptosis, morphology and the sperm deformity index. Hum Reprod [Internet] 2007 [cited 2010 Nov 6]; 22(5):1413-1419. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17303629
24. Thomas SR, Witting PK, Drummond GR. Redox control of endothelial function and dysfunction: molecular mechanisms and therapeutic opportunities. Antioxid Redox Signal [Internet] 2008 [cited 2010 Nov 6]; 10(10):1713-1765. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18707220
25. Zalata AA, Christophe AB, Depuydt CE, Schoonjans F, Comhaire FH. The fatty acid composition of phospholipids of spermatozoa from infertile patients. Mol Hum Reprod [Internet] 1998 [cited 2010 Nov 6]; 4(2):111-118. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=9542967
26. Gliozzi TM, Zaniboni L, Maldjian A, Luzi F, Maertens L, Cerolini S. Quality and lipid composition of spermatozoa in rabbits fed DHA and vitamin E rich diets. Theriogenology [Internet] 2009 [cited 2010 Nov 5]; 71(6):910-919. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=19121864
27. Hwang K, Lipshultz LI, Lamb DJ. Use of Diagnostic Testing to Detect Infertility. Curr Urol Rep [Internet] 2010 [cited 2010 Nov 6]. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=21088937
28. Blazovics A. [From free radicals to science of nutrition]. Orv Hetil [Internet] 2009 [cited 2010 Nov 8]; 150(2):53-63. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=19103556
29. Tavilani H, Doosti M, Saeidi H. Malondialdehyde levels in sperm and seminal plasma of asthenozoospermic and its relationship with semen parameters. Clin Chim Acta [Internet] 2005 [cited 2010 Nov 6]; 356(1-2):199-203. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15936318
30. Rodrigues JK, Dib LA, Ferriani RA, Jordao Junior AA, Navarro PA. [Serum markers of oxidative stress and assisted reproduction procedures results in infertile patients with polycystic ovary syndrome and controls]. Rev Bras Ginecol Obstet [Internet] 2010 [cited 2010 Nov 7]; 32(3):118-125. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20512258
31. Mahfouz RZ, du Plessis SS, Aziz N, Sharma R, Sabanegh E, Agarwal A. Sperm viability, apoptosis, and intracellular reactive oxygen species levels in human spermatozoa before and after induction of oxidative stress. Fertil Steril [Internet] 2010 [cited 2010 Nov 1]; 93(3):814-821. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=19100530
32. Witko-Sarsat V, Gausson V, Descamps-Latscha B. Are advanced oxidation protein products potential uremic toxins? Kidney Int Suppl [Internet] 2003 [cited 2010 Nov 8]; (84):S11-14. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=12694298
33. Droge W, Schipper HM. Oxidative stress and aberrant signaling in aging and cognitive decline. Aging Cell [Internet] 2007 [cited 2010 Nov 6]; 6(3):361-370. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17517043
34. Vernet P, Aitken RJ, Drevet JR. Antioxidant strategies in the epididymis. Mol Cell Endocrinol [Internet] 2004 [cited 2010 Nov 3]; 216(1-2):31-39. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=15109742
35. Bansal AK, Bilaspuri GS. Impacts of oxidative stress and antioxidants on semen functions. Vet Med Int [Internet] 2010 [cited 2010 Nov 6]; 2010. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20871827
36. Rebrin I, Sohal RS. Pro-oxidant shift in glutathione redox state during aging. Adv Drug Deliv Rev [Internet] 2008 [cited 2010 Nov 6]; 60(13-14):1545-1552. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18652861
37. Cornelli U. Antioxidant use in nutraceuticals. Clin Dermatol [Internet] 2009 [cited 2010 Nov 6]; 27(2):175-194. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=19167999
38. Moustafa MH, Sharma RK, Thornton J, Mascha E, Abdel-Hafez MA, Thomas AJ, Jr., Agarwal A. Relationship between ROS production, apoptosis and DNA denaturation in spermatozoa from patients examined for infertility. Hum Reprod [Internet] 2004 [cited 2010 Nov 6]; 19(1):129-138. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=14688171
Recibido: 22 de febrero de 2011.
Aprobado: 29 de abril de 2011.
Dr. C. Gregorio Martínez-Sánchez. Instituto de Farmacia y Alimentos (IFAL). Universidad de La Habana. Avenida 23 No. 21 425 e/ 214 y 222, La Coronela, La Lisa, La Habana, Cuba. Correo electrónico: gregorcuba@yahoo.it