Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.4 Ciudad de la Habana oct.-dic. 2011
ARTÍCULO ORIGINAL
Desarrollo de dorzolamida al 2 % solución oftálmica para el tratamiento de la presión intraocular
Development of 2 % dorzalamide eye solution for treatment of intraocular hypertension
Armando Gato del Monte,I Martha Gómez Carril,II Iván Morales Lacarrere,III Jaqueline Aylema Romero Díaz,IV Addis Bellma Menéndez,V Martha Botet GarcíaVI
I Máster en Ciencias en Tecnología y Control de Medicamentos. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
II Máster en Ciencias en Tecnología y Control de Medicamentos. Investigadora Auxiliar. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
III Licenciado en Farmacia. Investigador Agregado. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IV Licenciada en Biología. Investigador aspirante. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
V Máster en Fisiología Animal. Investigadora Agregada. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
VI Máster en Ciencias en Tecnología y Control de Medicamentos. Empresa Laboratorio Farmacéutico "Julio Trigo". La Habana, Cuba.
RESUMEN
El desarrollo de una solución oftálmica de dorzolamida al 2 % para el tratamiento de pacientes con hipertensión ocular: glaucoma de ángulo abierto, glaucoma seudoexfoliativo y otros glaucomas secundarios de ángulo abierto, se inició con el estudio de los componentes de la formulación sustituyendo algunos excipientes en el medicamento de los declarados en la literatura revisada, y se estudiaron las propiedades físicas, químicas, biológicas, microbiológicas y reológicas durante los estudios de preformulación. Se desarrolló una técnica analítica para el producto terminado. Se elaboraron 3 lotes de la formulación y se almacenaron en frascos plásticos de polietileno de baja densidad con Master Batch de 5 mL de capacidad, producidos in situ por una llenadora Bottle Pack, los cuales para el estudio de la estabilidad de la dorzolamida, se expusieron durante 24 meses a temperatura ambiente 30 ± 2 °C y 6 meses a temperatura acelerada de 40 ± 2 ºC con 75 % de humedad relativa, según los requerimientos establecidos por el Centro Estatal para el Control de Medicamentos. Al inicio y final del estudio microbiológico se comprobó la esterilidad en cada uno de los lotes; se obtuvieron resultados satisfactorios. El medicamento al cumplir con todos los parámetros de calidad descritos está registrado en el órgano regulador cubano para ser utilizado con seguridad en el tratamiento de las enfermedades al cual está destinado. Este medicamento está siendo producido a nivel industrial y comercializado.
Palabras clave: dorzolamida, estabilidad, reología.
ABSTRACT
The development of a 2 % dorzolamide eye solution to treat patients with ocular hypertension, having open angle glaucoma, pseudoexfoliative glaucoma and other secondary open-angle glaucoma began with the study of the formulation components by replacing some excipients stated in the reviewed literature, and the physical, chemical, biological, microbiological and rheological properties were analyzed during the pre-formulation studies. An analytical technique was devised for the finished product. Three batches of formulation were prepared and then stored in low density polyethylene flasks with Master Batch of 5 ml capacity, manufactured in situ by the Bottle Pack filler. These reservoirs were exposed at 30 ± 2 °C room temperature for 24 months and at 40 ± 2 ºC accelerated temperature for 6 months and relative humidity of 75 %, according to the requirements set by the State Center for Drug Control. At the beginning and at the end of the microbiological study, there was proved the sterility of each batch, the achieved results were satisfactory. After complying with all described quality parameters, the drug was registered in the Cuban regulatory body for its safe use in the treatment of the above-mentioned diseases. This drug is being manufactured at industrial level and thus marketed.
Key words: dorzolamide, stability, rheology.
INTRODUCCIÓN
El glaucoma comprende un complejo de entidades patológicas que tienen en común un aumento de la presión intraocular, capaz de producir degeneración de la pupila óptica y defectos en el campo visual.1 Es la segunda causa de ceguera y la más común de ceguera irreversible en el mundo.2 La presión intraocular está determinada por el balance entre la producción del humor acuoso dentro del ojo y el drenaje fuera del ojo a través de la malla trabecular.
El glaucoma se produce porque el ojo ha sido dañado por una infección, inflamación, tumor, una gran catarata o cualquier trastorno ocular que interfiera con el drenaje de fluido desde la cámara anterior. El tratamiento del glaucoma depende de su causa,3,4 y el propósito del tratamiento del glaucoma es reducir la presión intraocular.
La dorzolamida es un inhibidor de la anhidrasa carbónica formulada para el uso oftalmológico.3 Es una sulfonamida que se utiliza para el tratamiento de glaucoma y aunque se administre tópicamente, se absorbe en forma sistémica, seguida por una fase de eliminación lenta con un tiempo de vida media de alrededor de 4 meses.5
El Centro de Investigación y Desarrollo de Medicamentos (CIDEM), desarrolla entre sus líneas investigativas medicamentos para la "Operación Milagro" y uno de estos es la dorzolamida al 2 %, por lo que el objetivo de este trabajo fue desarrollar un colirio que cumpliera con todos los requerimientos de calidad para esta forma farmacéutica y proporcionara el efecto terapéutico deseado sin efectos adversos al paciente.
MÉTODOS
El estudio tecnológico de la formulación que se presenta, parte del análisis del principio activo de la firma REGATIVES, S.L de España, por la USP 32,6 así como de los excipientes que intervienen en la formulación.
Se prepararon 3 ensayos preliminares utilizando el principio activo, una solución tampón que consistió en ácido cítrico monohidratado/citrato trisódico dihidratado cuyo pH estuviese en el rango de 5 y 6, cloruro de benzalconio, manitol y HPMC F4M (hidroxipropilmetilceulosa). Se usaron estos componentes en sustitución de los recomendados en la literatura.
Se utilizó la HPMC F4M al 0,1 % para el estudio de la estabilidad química y física de la formulación durante 3 meses en cuanto a las características organolépticas, concentración del principio activo, el pH, así como a las propiedades viscosimétricas, fluidimétricas, irritabilidad oftálmica y efectividad del preservativo. Con la formulación de estudio se desarrolló y se validó la técnica analítica en el CIDEM, empleándose la linealidad, precisión, especificidad y exactitud de método.
Para el estudio reológico se emplearon equipos de la firma "Haake", entre estos: un reómetro, modelo RV 20, acoplado a un ordenador mediante un equipo Rheocontroller, modelo RC 20, utilizado como interfase y un ultratermostato, modelo F3, para controlar la temperatura de los ensayos. La corridas se realizaron en un intervalo de gradientes de velocidad comprendido entre 0 y 600 s-1, en un tiempo de 7 min, igual para la curva ascendente como para la descendente, programándose 100 puntos de medición para cada una, utilizando el sistema M5 y el sensor de cilindros concéntricos NV estándar, a una temperatura controlada de 25±0,1ºC, con el auxilio del programa Rot 2,3; también de la firma Haake (Instruction Manual. Software Rotation. Version 2.3. Haake Mess-Technik GmbH. Co. Germany).
La efectividad antimicrobiana fue estudiada utilizando los ensayos generales de la USP 326 y los microorganismos estándar como: Las S. aureus, P. aeruginosa, E. coli, C. albicans y A. niger, a concentraciones de 500 000 a 1 000 000 de m.o./mL. Estos se analizaron inmediatamente después de contaminado el medicamento y a los 7, 14, 21 y 28 días, se fueron observando los resultados obtenidos.
Se determinó la irritabilidad oftálmica en los 3 lotes utilizando conejos albinos de Nueva Zelanda machos de 1,8 a 2,0 kg de peso corporal procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), los cuales fueron mantenidos durante el ensayo en la sala con temperatura controlada de 22 ± 2 ºC y ciclo de luz-oscuridad 12/12 h. La alimentación consistió en dieta estándar para conejos CMO 1400 proveniente del CENPALAB y agua acidulada a libre demanda. El ensayo se realizó según la norma No. 405 de la OECD.7 Se le instilaron 0,1 mL de la sustancia en el ojo derecho de los animales. El ojo izquierdo fue tomado como control, ambos ojos fueron examinados a la 1, 24, 48 y 72 h de la aplicación inicial.
Se elaboraron 3 lotes pilotos (07001, 07002 y 07003) de 5 L cada uno en la Empresa Laboratorio Farmacéutico "Julio Trigo" con la formulación diseñada. El material de envase empleado fue producido in situ durante la elaboración del medicamento y también respondieron a las especificaciones de calidad para los frascos plásticos de polietileno de baja densidad con Master Batch y de 5 mL de capacidad, utilizando para su conformación y llenado la máquina Bottle Pack.
La estabilidad se llevó a cabo por el método acelerado y por vida de estante. Las condiciones utilizadas en el método acelerado están contempladas en el Proyecto de Regulación de los Requerimientos sobre los Estudios de Estabilidad establecidos por el Centro Estatal para el Control de Medicamentos (CECMED) (40 ± 2 ºC, 75 % de humedad relativa);8 se valoraron las muestras al inicio, 1, 2, 3 y 6 meses. En el estudio de estabilidad por vida de estante se almacenaron las muestras a temperatura ambiente (30 ± 2 ºC), se protegieron de la luz y se valoraron al inicio, 3, 6, 9, 12, 18 y 24 meses.
RESULTADOS
Los análisis físico-químicos realizados a los 3 lotes del escalado piloto cumplieron con las especificaciones de calidad de la técnica analítica desarrollada por el Departamento de Estabilidad del CIDEM, y con los análisis microbiológicos reportados en la USP 32.
La tabla 1 muestra los estudios de estabilidad del medicamento por el método acelerado a 40 ± 2 ºC, 75 % de humedad relativa durante 6 meses.
Tabla 1. Resultados del estudio de estabilidad acelerada a la temperatura de 40 ± 2 ºC,
75 % de humedad relativa
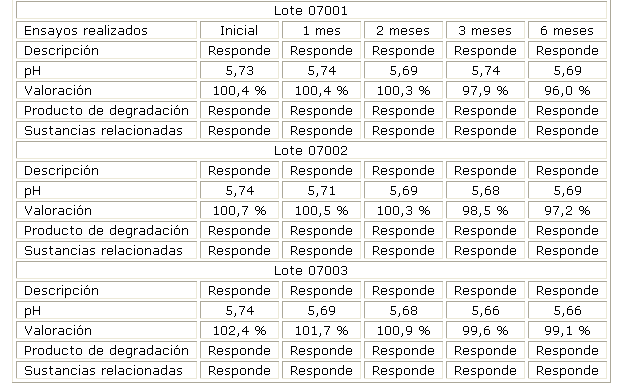
En la tabla 2 se presentan los resultados del estudio de estabilidad físico-químico por el método de vida de estante (30 ± 2 ºC) durante 24 meses.
Tabla 2. Resultados del estudio de estabilidad por vida de estante (30 ± 2 ºC)
| Lote 07001 | |||||||
| Ensayos realizados | Inicial (01/08) | 3 mes (02/08) | 6 meses (03/08) | 9 meses (10/08) | 12 meses (01/09) | 18 meses (07/09) | 24 meses (01/10) |
| Descripción | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| pH | 5,74 | 5,70 | 5,66 | 5,62 | 5,59 | 5,30 | 5,59 |
| Valoración | 100,4 % | 99,2 % | 98,0 % | 97,9 % | 97,5 % | 97,1 % | 97,0 % |
| Contenido de preservo | 94,4 % | - | - | - | - | - | 93,0 % (0,070 mg/mL) |
| Esterilidad | Responde | - | - | - | - | - | Responde |
| Producto de degradación | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| Sustancias relacionadas | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| Lote 07002 | |||||||
| Descripción | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| pH | 5,74 | 5,72 | 5,69 | 5,60 | 5,52 | 5,58 | 5,61 |
| Valoración | 100,7 % | 99,7 % | 99,0 % | 98,9 % | 98,4 % | 98,4 % | 98,4 % |
| Contenido de preservo | 92,0 % (0,069 mg/mL) | - | - | - | - | - | 91,5 % (0,0686 mg/mL) |
| Esterilidad | Responde | - | - | - | - | - | Responde |
| Producto de degradación | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| Sustancias relacionadas | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| Lote 07003 | |||||||
| Descripción | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
| pH | 5,70 | 5,70 | 5,71 | 5,60 | 5,43 | 5,28 | 5,59 |
| Valoración | 102,4 % | 101,4 % | 98,3 % | 98,3 % | 98,1 % | 98,0 % | 97,6 % |
| Contenido de preservo | 94,4 % (0,071 mg/mL) | - | - | - | - | - | 93,8 % (0,0708 mg/mL) |
| Esterilidad | Responde | - | - | - | - | - | Responde |
| Producto de degradación | Responde | Responde | Responde | Responde | Responde | Responde | Responde |
En la tabla 3 se observa que las muestras se contaminaron en la primera siembra, en la que germinaron algunos microorganismos, pero al cabo de los 7 días no hubo germinación de ninguno de los microorganismos contaminantes. Este comportamiento ocurrió igualmente a los 24 meses del estudio.
La tabla 4 muestra que el medicamento es no irritante en las estructuras oculares del ojo en el conejo. Estas se observaron a la luz blanca para detectar presencia de eritema, edema y secreciones anormales, además de la reacción del iris a la luz, seguido del examen de la cornea por la tinción con fluoresceína y ante la luz de lámpara UV.
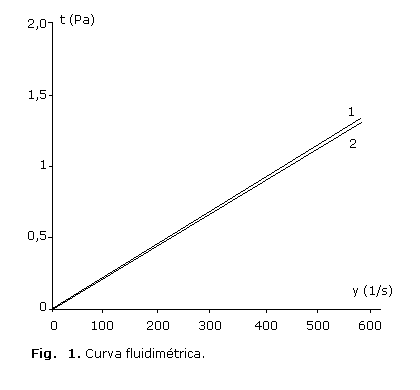
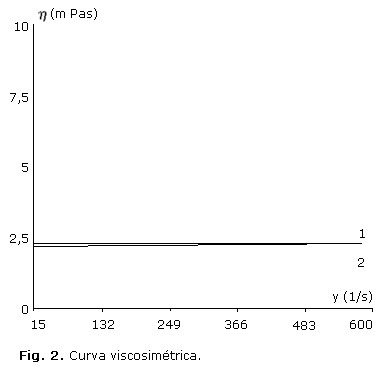
En la figura 1 se representa la curva fluidimétrica correspondiente a un flujo newtoniano de la solución, y en la figura 2 se muestra la viscosidad del producto o la curva viscosimétrica al inicio y transcurrido los 24 meses.
DISCUSIÓN
El medicamento desarrollado utilizando HPMC F4M y ácido cítrico monohidratado/citrato trisódico dihidratado para uso farmacéutico, cumplió con los requerimientos de calidad en los 3 lotes pilotos al inicio y transcurridos los 24 meses de estudios, almacenado en el envase propuesto.
Los estudios de estabilidad por 6 meses de las muestras conservadas a temperatura de 40 ± 2 ºC, 75% de humedad relativa (tabla 1) y 24 meses a temperaturas de 30 ± 2 ºC, muestran que las formulaciones responden a las características organolépticas (tabla 2). La concentración del principio activo se encuentra entre los límites establecidos (90,0-110,0 %) y no se observaron productos de degradación en el tiempo de estudio, al igual que el pH, que se mantuvo en el rango de 5,0-6,0 dado por la buena capacidad del sistema tampón utilizado. Esto demuestra que la formulación de clorhidrato de dorzolamida es estable en las condiciones estudiadas. La técnica de análisis desarrollada en el CIDEM9 para la determinación del principio activo mostró que es específica y precisa cumpliendo con los criterios de linealidad y exactitud.
Los estudios de efectividad del preservo demuestran que el producto se comporta favorablemente ante la prueba de efectividad del agente antimicrobiano utilizado. Las muestras se contaminaron y en la primera siembra, que se realiza inmediatamente después de la contaminación, no germinó ningún microorganismo (tabla 3), por lo que queda demostrado que la concentración del preservo utilizada en la formulación es adecuada para evitar crecimiento microbiano durante la preparación tecnológica del fármaco y en el período de almacenamiento, lo cual indica la eficacia de la concentración del preservo.
El índice de irritación ocular para el producto ensayado se corresponde con una clasificación de no irritante (tabla 4). El producto produjo cambios leves en cornea que desaparecieron a las 48 horas para el lote 7002. En los animales administrados con los lotes 7001 y 7003 permanecían 2 animales con lesiones corneales grado 1, que involucraban una pequeña área de la córnea, lo cual resultó no significativo. Estos resultados avalan el empleo de la formulación de dorzolamida 2 % sobre las estructuras oculares.
Las curvas fluidimétricas caracterizan a la solución como un producto newtoniano, tanto la inicial (1), como transcurrido 24 meses (2) (Fig. 1). La buena estabilidad reológica quedó demostrada, ya que después de 24 meses, ambas curvan están prácticamente superpuestas.
De la misma manera se manifiesta la curva viscosimétrica (Fig. 2), es decir, que transcurrido 24 meses, ambas curvas se presentan prácticamente superpuestas en dos rectas paralelas al eje de los gradientes de velocidad (g), ya que la preparación presenta un flujo característico de los cuerpos Newtonianos. La solución oftálmica diseñada presenta una viscosidad estable durante 24 meses a temperatura ambiente, ascendente a 2,2 ± 0,2 mPas.
El medicamento al cumplir con todos los parámetros de calidad descritos está registrado en el órgano regulador cubano para ser utilizado con seguridad en el tratamiento de las enfermedades al cual está destinado. Este medicamento está siendo producido a nivel industrial y comercializado.
Agradecimientos
A los técnicos Odalys Achón, Micaela Couret Trápaga y Marisleidis Vegué el agradecimiento por haber participado con su experiencia al desarrollo de esta publicación.
REFERENCIAS BIBLIOGRÁFICAS
1. Moreno LP, Herrera FR. Medicamentos contraindicados en el glaucoma. Rev Cubana Med Genet Integr. 2000;16(3):295-303.
2. Marchetti A, Magar R, An P, Nichol M. Clinical and economic impact of new trends in glaucoma treatment. Medscape Gen Med. 2001;3:3.
3. Khaw PT, Shah P, Elkington AR. Glaucoma-1: Diagnosis. BMJ. 2004;328:97-99.
4. Khaw P T, Shah P, Elkington AR. Glaucoma-2: Treatment. BMJ. 2004;328:156-8.
5. Demailly Ph. Biodisponibilité des medicaments hypotonisants. J Français d'Ophthalmol. 2000:23:5.
6. United States Pharmacopoeial Convention. USP XXII. The National Formulary 27. User Guide Dorzolamide Hydrochloride, microbiological test. Rockville: Staff Liaison; 2009. [Monographic in CD-ROM].
7. OECD Guideline for Testing of Chemical Acute eye irritation/corrosion. No. 405 Adopted 2002.
8. CECMED. Requerimientos de los Estudios de Estabilidad para el Registro de Productos Farmacéuticos nuevos y conocidos. Proyecto de Regulación. La Habana, Septiembre, 1999.
9. Romero A. Determinación de dorzolamida colirio. Técnica No. PT 08003. 2006.
Recibido: 25 de mayo de 2011.
Aprobado: 30 de junio de 2011.
MSc. Armando Gato del Monte. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave 26, No. 1 605 entre Boyeros y Calzada de Puentes Grandes, CP 10 600, municipio Plaza de la Revolución, La Habana, Cuba.