Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.4 Ciudad de la Habana oct.-dic. 2011
ARTÍCULO ORIGINAL
Estabilización de disoluciones acuosas de riboflavina por solapamiento espectral
Stabilization of aqueous solution of Riboflavin by spectral overlapping
Cecilia Gallardo Cabrera
Doctora en Ciencias Químicas. Química Farmacéutica. Asistente. Facultad de Química Farmacéutica, Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Se evaluó la fotoestabilización de la riboflavina en disolución acuosa a través de solapamiento espectral. En estudios previos se determinó que la longitud de onda a 445 nm promueve la degradación de la riboflavina, por eso se escogieron los colorantes que mejor eficiencia de absorción presentaran a esta longitud de onda. El estudio de fotoprotección consistió en determinar y comparar las constantes de velocidad (k0) de las reacciones de fotodegradación de la riboflavina en disoluciones (80 µM) en presencia y ausencia de colorantes a diferentes concentraciones: tartrazina (40, 58, 71 y 187 µM), amarillo ocaso (80, 160, 442 y 1 600 µM) y amarillo de quinoleína (80,133, 160 y 1 600 µM). Las cinéticas se realizaron irradiando las muestras en una cámara de simulación solar a 250 W.m-2, a diferentes tiempos y cuantificando la riboflavina residual, mediante cromatografía líquida de alta resolución. Las constantes de velocidad (k0) se determinaron mediante el método integral. En ausencia de colorantes la fotodegradación de la riboflavina obedece a una cinética de orden cero (k0= 0,0012 mg.mL-1×min-1) con un 79,9 % de degradación tras 20 min de exposición a la luz. En presencia de colorantes la estabilidad de la riboflavina mejora significativamente con el aumento de la concentración del colorante empleado; sin embargo, se encontró que el amarillo de quinoleína a bajas concentraciones (< 160 µM) incrementó la degradación de la riboflavina, mientras que en la concentración más alta estudiada, redujo 6 veces la k0, lo cual sugiere que interacciones químicas se están llevando a cabo. La mayor fotoprotección se obtuvo con el amarillo ocaso a la concentración legal permitida, donde la concentración de la riboflavina se mantuvo inalterada tras 30 min de irradiación. El estudio muestra que debido a la alta capacidad fotosensibilizante de la riboflavina, la técnica de fotoprotección por solapamiento espectral no se pueda usar de forma genérica, pues no solo se puede esperar un efecto fisicoquímico de solapamiento sino que pueden generarse interacciones fotoquímicas.
Palabras clave: riboflavina, fotodegradación, fotoestabilización, solapamiento espectral.
ABSTRACT
The photostabilization of Riboflavin (RF) in aqueous solution was evaluated through spectral overlap. Previous studies established that wavelength at 445nm promoted RF degradation; hence dyes that exhibited high absorption performance at 445 nm were selected. The photoprotection study consisted in determining and comparing the rate constants (k0) of the RF photodegradation reactions in solutions (80 µM), both in presence and absence of dyes at different concentrations: tartrazine (40, 58, 71 y 187 µM), sunset yellow (80, 160, 442 y 1 600 µM) and quinoline yellow (80, 133, 160 y 1600 µM).The kinetics were estimated by irradiating the samples in a solar simulation chamber at 250 W×m-2 and at different times; then the residual RF was quantified by HPLC method. The rate constants (k0) were determined by the integral method. When dyes are absent, the RF photodegradation is due to zero order kinetics (k0= 0.0012 mg×mL-1×min-1) with 79.9 % degradation after 20 min of exposure to light. When dyes are present, the RF stability improves significantly with increasing concentration of the dye; however, it was found that quinoline yellow at low concentrations (<160 µM) increased the EF degradation, whereas at the highest studied concentration, k0 was reduced 6 times, suggesting that chemical interactions occurred. Most photoprotection was obtained from the sunset yellow at allowable concentration where RF concentration was unchanged after 30 min of irradiation. The study showed that the high photosensitizing capacity of riboflavin hindered the generic use of photoprotective technique through spectral overlapping, because physical-chemical effect of overlapping may be expected in addition to occurrence of photochemical interactions.
Key words: Riboflavin, photodegradation, photostabilization, spectral overlap.
INTRODUCCIÓN
La importancia bioquímica de la riboflavina (RF) radica en ser parte de la estructura de las coenzimas flavin-mono-nucleótido (FMN) y del flavin-adenin-dinucleótido (FAD), indispensables para la actividad enzimática de las flavoproteínas en procesos metabólicos de oxido-reducción.1
La RF es una de las vitaminas más fotolábiles, se ha encontrado que en disoluciones acuosas (pH: 5,0) a 27 °C se degrada a razón de 1,2 % por mes en condiciones normales de luz visible.2,3 Por otra parte, la RF es una molécula fotosensibilizadora, que conlleva a alteraciones químicas de otras moléculas codisueltas, como es el caso del ácido fólico, vitaminas A, C, D y E, y aminoácidos como la histidina, triptófano y metionina.4,5 Por estas dos razones es importante buscar estrategias para mejorar su estabilidad frente a la luz.
En este trabajo se plantea el método de solapamiento espectral6 para evaluar la estabilización de la RF en disolución acuosa, utilizando colorantes farmacéuticamente aprobados, cuyos espectros de absorción presenten superposición de la longitud de onda crítica de la RF que promueve su degradación (445 nm).7
MÉTODOS
Materiales
RF base fue adquirida de Bell Chem Ltda; amarillo de quinoleína (E104), tartrazina (E102) y amarillo ocaso (E110) se adquirieron de una empresa nacional Colorquímica S.A. El fosfato de potasio dibásico y monobásico fueron obtenidos de J.T. Baker, y el acetonitrilo grado cromatografía líquida de alta resolución (CLAR) fue adquirido de Merck. El agua para CLAR se obtuvo de un equipo Millipore.
Preparación de muestras
Todos los ensayos se realizaron con una disolución de RF a una concentración fija de 80 µM preparada en solución amortiguadora de fosfato pH 5,0 (20 µM). El efecto de los colorantes se evaluó a cuatro niveles de concentraciones: tartrazina (40, 58, 71 y 187 µM), amarillo ocaso (80, 160, 442 y 1 600 µM) y amarillo de quinoleína (80, 133, 160 y 1 600 µM). Durante la preparación, estas disoluciones se protegieron de la luz y se almacenaron en la oscuridad hasta su irradiación. En todos los colorantes se incluyó la concentración máxima permitida en alimentos por la legislación colombiana.8
Determinación del coeficiente de extinción
El coeficiente de extinción molar (e) a 445 nm y a pH 5,0 de los colorantes seleccionados y de la RF fue determinado usando un espectrofotómetro Carey 50 con celdas de cuarzo de 1 cm de ancho. Se analizaron por triplicado disoluciones de concentraciones crecientes en solución amortiguadora de fosfato pH 5,0 de cada una de las sustancias. El e se obtuvo a partir del rango de concentración que obedece a un incremento lineal en la absorbancia usando la ecuación de Lambert-Beer.
Condiciones de irradiación
Los ensayos de irradiación se realizaron en una cámara de simulación solar (SOLARBOX 1500e), provista de una lámpara de xenón. En estudios preliminares se determinó que la intensidad de luz más adecuada para seguir la fotodegradación es de 250 W.m-2 donde se alcanza aproximadamente un 80 % de degradación en 20 min. Los envases usados fueron viales de vidrio, y se envasó 10 mL de disolución en cada uno. La temperatura de superficie de la cámara fue de 50 ºC.
Determinación de constantes de velocidad
Se realizaron cinéticas de descomposición con las muestras preparadas como se indica anteriormente, y se determinó por CLAR las concentraciones de RF y de colorante remanente a los 0, 3, 5, 7, 10 y 15, 20, 25, 30 min de exposición en el simulador solar. Luego por método integral se determinó el orden de reacción y la constante de velocidad.
Método cromatografía líquida de alta resolución
El método CLAR fue desarrollado y validado en un trabajo previo.7 Se empleó un cromatógrafo Schimadzu, con detector de arreglo de diodos. Se usó una columna LichrocartRP-18 (5 µm) (250 x 4,6 mm). La fase móvil se compuso de acetonitrilo/solución amortiguadora de fosfato pH 3,0, en una relación 15/85 durante los primeros 10 min, y luego se aplicó un gradiente lineal por 2 min hasta 30/70; esta relación se mantuvo por 8 min para completar 20 min de la corrida, aun flujo de 1 mL/min. La detección se realizó a 254 nm. Se realizó una curva de calibración usando estándar secundario de RF y materia prima para los colorantes. El arreglo de diodos permitió la identificación de los productos de degradación de la RF por similitud del espectro UV-V con la RF y los productos de degradación del colorante.
RESULTADOS
El estudio se realizó a pH 5,0 porque es el pH de mayor estabilidad de la RF.9 Los coeficientes de extinción a 445 nm en solución amortiguadora de fosfato pH 5,0 fueron: RF 10 834 M-1cm-1, tartrazina 18677M-1cm-1, amarillo de quinoleína 12 140 M-1cm-1 y amarillo ocaso12 025 M-1cm-1.
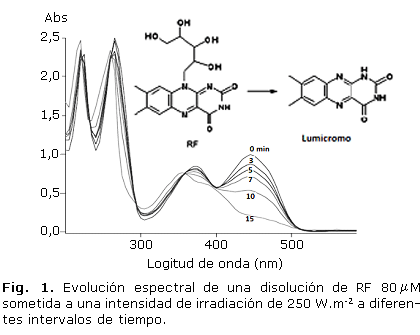
El producto mayoritario formado es el lumicromo, que fue observado por espectroscopia UV (Fig. 1), y que eluye a 19 min en el método CLAR. Su identificación se realizó comparando el espectro UV con lo reportado en la literatura (máximos de absorción: 220, 260, 350 y 385nm.10,11
La fotodegradación de la RF sigue una cinética de orden cero y dicho orden se mantiene en presencia de los colorantes. El efecto fotoestabilizador buscado en este estudio se observaría por la reducción de la constante de velocidad de degradación de la RF (k0); en la tabla 1se puede establecer este efecto protector comparando la k0 del control (disolución de RF en ausencia de colorantes) y la k0 obtenida de la disolución de RF a la misma concentración (80 µM) en presencia de cada uno de los 3 colorantes estudiados.
Para el caso de tartrazina, al comparar las k0 (tabla 1) se puede observar que se presenta un efecto fotoprotector, que no varía de forma significativa a las diferentes concentraciones de tartrazina estudiadas, a pesar de que la absorbancia sí varíe sustancialmente.
Tabla 1. Constantes de velocidad de fotólisis de la RF (80 µM) y % de degradación en
ausencia y presencia de colorantes
| | | | | % de degradación |
| Control | - | 0,747 | 1,2 | 79,9 |
| | 40 | 0,747 | 0,6 | 40,7 |
| 58 | 1,083 | 0,6 | 41,0 | |
| 71 | 1,326 | 0,6 | 38,8 | |
| 187 § | 3,493 | 0,4 | 32,0 | |
| | 80 | 0,971 | 1,7 | 91,6 * |
| 133 § | 1,615 | 1,4 | 98,5 | |
| 160 | 1,942 | 1,5 | 97,1 | |
| 1600 | 2,270 | 0,2 | 12,1 | |
| | 80 | 0,962 | 0,7 | 55,5 |
| 160 | 1,924 | 0,4 | 30,3 | |
| 442 § | 5,315 | 0,06 | 0,0 | |
| 1 600 | >5,00 | 0,01 | 0,0 |
* Tiempo de irradiación de 15 min.
Tiempo de irradiación de 30 min.
Disolución de RF (80 µM) en ausencia de colorantes.
§ Concentración máxima permitida en la legislación colombiana.
La capacidad fotoestabilizadora del amarillo de quinoleína es cuestionable, dado que a bajas concentraciones se observa un aumento en la k0 (tabla 1) y en la figura 2 se muestra que a los 15 min desaparece drásticamente la RF; mientras que a la concentración más alta se observa una disminución en la k0.
El amarillo ocaso reduce la k0 a órdenes de 10-5, con porcentaje de degradación de RF mínimos a los 30 min de irradiación.
El método cromatográfico también permitió el análisis de la estabilidad de los colorantes bajo las mismas condiciones de irradiación. Los resultados muestran que los colorantes solos no presentan degradación (tabla 2), mientras que en presencia de RF muestran un grado de fotodescomposición que varía en cada colorante y con la concentración, siendo el amarillo de quinoleína el que presentó la mayor descomposición.
DISCUSIÓN
Los resultados evidencian que la fotoprotección por solapamiento espectral es una estrategia efectiva para proteger la RF en disolución. Sin embargo, también se evidenció la importancia de elegir correctamente el colorante, ya que no sólo se puede presentar competencia en la absorción de la luz a 445 nm entre la RF y los colorantes, sino que también se pueden presentar interacciones químicas, debido al alto poder fotosensibilizador de la RF; por ejemplo, si se comparan los resultados de la tartrazina a 58 µM, del amarillo de quinoleína y del amarillo ocaso a 80 µM cuya absorción está entre 0,962-1,083 (tabla 1), se esperaría que por solapamiento espectral se diera el mismo efecto fotoprotector, lo cual se observó para el caso de tartrazina y amarillo ocaso, donde la ko se redujo a la mitad; pero en presencia de quinoleína la k0 se aumentó de 1,2 a 1,7x10-3mg.mL-1min-1. Resultados similares se encuentran al comparar las concentraciones del segundo nivel en los tres colorantes (71, 133 y 160 µM respectivamente), lo cual indica que con la quinoleína se está presentando una interacción química, probablemente una acción fotosensibilizadora por parte de la RF sobre el colorante, que explicaría también la alta degradación de la quinoleína en presencia de RF (tabla 2), encontrado en el análisis por CLAR (Fig. 2) (a, b, c).
La inesperada fotoprotección de la quinoleína a altas concentraciones lleva a formular la hipótesis de que posiblemente las impurezas y/o productos de degradación del colorante tengan un efecto protector sobre la RF; sin embargo, es necesario investigar a profundidad cuál es la interacción de la RF con el amarrillo de quinoleína.
Por otra parte, sólo el colorante amarillo ocaso muestra un comportamiento ajustado a lo esperado, la protección es directamente proporcional a la concentración empleada e incluso es el único que presenta un efecto fotoprotector significativo a la concentración legal permitida (442 µM), adicionalmente es un colorante estable a la fotodegradación y fotosensibilización por RF (tabla 2), lo que lo convierte en una alternativa útil en la estabilización de formulaciones líquidas de RF.
Finalmente, el estudio muestra que debido a la alta capacidad fotosensibilizante de la RF, la técnica de fotoprotección por solapamiento espectral no se pueda usar de forma genérica, pues no solo se puede esperar un efecto fisicoquímico de solapamiento sino que pueden generarse interacciones fotoquímicas.
Agradecimientos
Los autores agradecen la colaboración de William Ortiz-Cala, Beatriz Castañeda Ruiz, Sandra Vallejo Vanegas y Juan David Posada Trujillo, estudiantes de Química Farmacéutica de la Universidad de Antioquia, y el apoyo financiero recibido desde el CODI-Universidad de Antioquia, al Laboratorio Especializado de Análisis (LEA) y a Colorquímica S.A.
REFERENCIAS BIBLIOGRÁFICAS
1. Florez J, Armijo J, Mediavilla A. Farmacología humana. 4 ed. Barcelona: Editorial Masson SA; 2003. p. 1021-2.
2. Villaseñor MJ. Nuevos métodos fotométricos y electroquímicos de determinación de colorantes amarillos en alimentos. [Tesis]. Cuenca (España): Universidad de Castilla-La Mancha; 1995.
3. Ahmad I, Fasihullah Q, Vaid HM. Effect of light intensity and wavelengths on photodegradation reactions of riboflavin in aqueous solution. J Photochem Photobiol B. 2006;82:21-7.
4. De La Rochette A, Birlouez-Arango I, Silva E, Moliere P. Advanced glycation end products as UVA Photosensitizers of Tryptophan and Ascorbic Acid: Consequences for the Lens. Biochim Biophys Acta, Gen Subj. 2003;1621(3):235-41.
5. Choe E, Huang R, Mind D. Chemical Reactions and Stability of Riboflavin in Foods. J Food Sci. 2005;70:28-35.
6. Crowley PJ. Excipients as stabilizers. Pharm Sci Technol Today.1999;2(6):237-43
7. Guzmán CP. Evaluación y aplicación de técnicas para estabilizar la riboflavina en preparaciones farmacéuticas. [Disertación]. Medellín (Colombia): Universidad de Antioquia; 2008.
8. Listado de aditivos en los alimentos para consumo humano. Resolución 10593. República de Colombia, Julio 16, 1985.
9. Ahmad I, Fasihullah Q, Noor A, Ansari I, Ali Q. Photolysis of riboflavin in aqueous solution: a kinetic study. Int J Pharm. 2004;280(1-2):199-208.
10. Sikorska E, Khemlinskii I. Photophysics of 1-Methyllumichrome. J Photochem Photobiol A: Chemistry. 2004;162:193-201.
11. Sirkoski M, Sirkoska E, Khemlinskii I, González R, Bourdelande J, Siemiarczuk A. Photophysics of lumichrome on cellulose. J Photochem Photobiol A: Chemistry. 2003;156:267-71.
Recibido: 25 de mayo de 2011.
Aprobado: 30 de junio de 2011.
Dra. Cecilia Gallardo. Grupo de Estudios de Estabilidad de Medicamentos, Cosméticos y Alimentos. Facultad de Química Farmacéutica, Universidad de Antioquia, Calle 67 No. 53-108, Medellín, Colombia.