Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.4 Ciudad de la Habana oct.-dic. 2011
PRODUCTO NATURAL
Estabilidad acelerada de un gel de Rhizophora mangle L. (mangle rojo) para heridas y quemaduras
Accelerated stability of a Rhizophora mangle L. (red mangrove) gel for wounds and burns
Dulce María Soler Roger,I Yanet Rodríguez Perdomo,II Tania Pérez Bueno,III Yamilka Riverón Alemán,IV Iván Gastón Morales LacarrereV
I Doctora en Ciencias. Licenciada en Ciencias Farmacéuticas. Investigadora Auxiliar. Centro Nacional de Sanidad Agropecuaria (CENSA). Mayabeque, Cuba.
II Licenciada en Radioquímica. Investigadora Agregada. Centro Nacional de Sanidad Agropecuaria (CENSA). Mayabeque, Cuba.
III Doctora en Ciencias. Ingeniera Química. Investigadora Auxiliar. Centro Nacional de Sanidad Agropecuaria (CENSA). Mayabeque, Cuba.
IV Licenciada en Microbiología. Máster en Microbiología Veterinaria. Especialista. Centro Nacional de Sanidad Agropecuaria (CENSA). Mayabeque, Cuba.
V Licenciado en Ciencias Farmacéuticas. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
RESUMEN
El objetivo del presente trabajo fue evaluar la estabilidad acelerada de un gel de Rhizophora mangle L. (mangle rojo) en dos condiciones de almacenamiento. Los 3 lotes pilotos producidos (GM01, GM02 y GM03) se almacenaron a dos temperaturas: 40 ± 2 °C durante 3 meses y 25 ± 2 °C durante 6 meses. Se realizó una evaluación de indicadores de estabilidad físico-química y microbiológica a tiempo 0, 1, 2 y 3 meses y a tiempo 0, 1, 2, 3 y 6 meses para cada una de las dos condiciones ensayadas respectivamente. Todos los lotes almacenados en ambas temperaturas mostraron estables las características organolépticas y la extensibilidad, el pH estuvo entre 6 y 7 y la reología confirmó un fluido no newtoniano del tipo Herschel Bulkley en los tiempos evaluados. La concentración mínima inhibitoria permaneció entre 8 y 10 mg/mL y la concentración de taninos entre 13 a 30 mg/g; todos los lotes se mantuvieron dentro del límite microbiano. El gel demostró tener buena estabilidad en condiciones aceleradas de temperatura, aspecto que es necesario confirmar en un próximo estudio de estabilidad en anaquel.
Palabras clave: estabilidad acelerada, Rhizophora mangle L., mangle rojo, gel.
ABSTRACT
The objective of the present paper was to evaluate the accelerated stability of a Rhizophora mangle L. (red mangrove) gel under 2 storage conditions. The three pilot batches (GM01, GM02 and GM03) were stored at two temperature settings: 40 ± 2 °C for three months and 25 ± 2 °C for 6 months. One physical-chemical and microbiological evaluation was performed in two periods of time: at the months 0, 1, 2 and 3 for the first and at the months 0, 1, 2, 3 y 6 for the second tested storage condition. All the batches stored at both temperatures showed stable organoleptic characteristics and extensibility, the pH ranged from 6 to 7 and rheology confirmed a non-Newtonian fluid of Herschel Bulkley-type in the evaluated periods of time. The minimum inhibitory concentration remained 8 to 10 mg/mL whereas the tannin concentration ranged 13 to 30 mg/g. All the batches were within the allowable microbial limits. The red mangrove gel showed good stability under accelerated temperatures, but this is an aspect that requires to be confirmed in a future on-shelf stability study.
Key words: accelerated stability, Rhizophora mangle L., red mangrove, gel.
INTRODUCCIÓN
Los manglares ocupan el 4,8 % de la superficie terrestre total de la Isla de Cuba y el 26 % de la superficie total de bosques.1 Dentro de los tipos de mangles que existen, R. mangle L. o mangle rojo es un árbol que tiene una alta distribución geográfica en el archipiélago cubano.2 El extracto acuoso de la corteza de mangle rojo presenta propiedades farmacológicas como antiséptico y acelerador de la curación de heridas, 3-5 atribuidas a la compleja composición química que posee, donde predominan los polifenoles (54,78 %), representados en su mayoría por taninos poliméricos (80 %) y taninos hidrolizables (20 %).6,7
Basado en estas propiedades, previamente se desarrolló una formulación líquida para uso tópico, registrada en el Centro para el Control Estatal de Medicamentos (CECMED) como CIKRON-H,8 la cual presentó limitaciones en su aplicación debido al escurrimiento del producto en las heridas, por lo que era necesario aplicarlo cada 24 h. Lo anterior, unido a la necesidad de mejorar la presentación del producto final, motivó el desarrollo de un nuevo producto semisólido en forma de gel tópico.
Los semisólidos son portadores de fármacos que son liberados por vía tópica a través de la piel, la córnea, el tejido rectal, la mucosa nasal, la vagina, el tejido bucal, la membrana de la uretra y el revestimiento externo del oído. La piel es uno de los órganos más fácilmente accesible del cuerpo humano para la administración tópica y constituye la ruta principal del sistema de liberación tópica de fármacos. Estos productos medicinales que se aplican a la piel o las mucosas para mejorar o restaurar una función fundamental de la piel o para alterar farmacológicamente una acción en los tejidos, se conocen como tópicos o dermatológicos.9 Dentro de ellos, los geles pueden formar una película fácilmente lavable en la piel debido a sus propiedades no grasientas. Además, debido a su comportamiento reológico, pueden adherirse a la superficie de aplicación por un periodo suficientemente amplio, que ayuda a prolongar la liberación del fármaco en el sitio de aplicación.10,11
Para obtener un éxito terapéutico en el desarrollo de nuevas formulaciones en la Industria Farmacéutica, la forma farmacéutica debe ser estable, lo que hace que la evaluación de la estabilidad sea un factor fundamental. Esta puede medirse a través de un estudio de estabilidad acelerada, que tiene por objeto verificar, en condiciones específicas y controladas, la capacidad de un producto para mantener las mismas características y propiedades durante su vida útil.12-15
Tomando en cuenta los estudios realizados con la formulación líquida,16 y como parte del desarrollo del gel de R. mangle L. para el tratamiento de heridas y quemaduras, constituye el objetivo de este trabajo evaluar la estabilidad acelerada en dos condiciones de almacenamiento.
MÉTODOS
Los 3 lotes pilotos producidos se identificaron como GM01, GM02 y GM03 y se envasaron en tubos colapsibles de aluminio con laqueado interior de capacidad de 25 g, inyector sellado de membrana de aluminio y tapa plástica de polietileno de alta densidad con perforador. Se produjeron con la misma formulación, proceso de fabricación y condiciones de envase que se propone para circular en el mercado.
Se almacenaron en dos condiciones de temperatura: a 40 ± 2 °C durante 3 meses y a 25 ± 2 °C durante 6 meses, y se realizó una evaluación de indicadores de estabilidad físico-química y microbiológica a tiempo 0, 1, 2 y 3 meses y a tiempo 0, 1, 2, 3 y 6 meses para cada una de las dos condiciones ensayadas respectivamente.
Características organolépticas. Se evaluó la apariencia física en cuanto a olor, color, textura (homogénea o no homogénea) y consistencia (fluida, semiviscosa o viscosa) mediante la utilización de los órganos sensoriales.
Extensibilidad. Se le realizaron 3 réplicas a cada lote en cada uno de los tiempos evaluados. La extensibilidad se midió utilizando placas de cristal (20 x 20 cm); se situó la placa inferior sobre una hoja de papel milimetrado a la que se le trazaron diagonales y se colocó una muestra de 2 g de gel sobre el punto de intersección. Se ubicó la placa superior durante 1 min y se tomaron los valores de los 8 radios formados.17 El área de extensibilidad (AE) se calculó según la siguiente expresión:
AE= p (rp)2
donde:
rp: radio promedio de las 8 mediciones (mm).
pH. Se determinó con un pH-metro PH M83 AUTOCAL pH METER y se consideró como límite de aceptación 6-7 según las características propias del extracto empleado en la elaboración del gel.
Reología. Se realizó en un roto viscosímetro HAAKE de cilindros concéntricos, que lleva acoplado el sistema M5/SV2 y utiliza un programa computadorizado ROT.23 versión 2.3 HAAKE. Se trabajó en un ambiente termostatado a 25 °C. El gradiente de velocidad empleado fue de 0 a 440 s-1, con una duración de 2 min y la velocidad de cizalla fue de 0-200 Pa. Se realizaron mediciones tras el aumento y la disminución de la velocidad de deformación con el objetivo de obtener las curvas ascendentes y descendentes de los gráficos de fluidez. Se graficó la tensión de cizalla t (Pa) vs. velocidad de cizalla g (s-1).
Contenido de taninos totales (TT). Se realizó mediante una precipitación cuantitativa de los taninos con albúmina sérica y su posterior determinación colorimétrica con cloruro férrico.18
Actividad antimicrobiana. Se determinó la mínima concentración del producto (formulado a 30 mg/mL de sólidos solubles totales) que es capaz de inhibir el crecimiento de la cepa de Sthaphylococcus aureus ATCC 29740 en un período de 24 h.19
Límite microbiano. Se procedió según lo establecido por la USP 29, para determinar el conteo total de microorganismos viables aerobios por el método de placa vertida o número más probable (NMP).20
Análisis estadístico. Se usó el paquete estadístico STATGRAPHICS PLUS version 5.1 (Statistical Graphics Corp., EUA) para señalar la existencia o no de diferencia significativa entre los lotes con respecto al pH, el contenido de taninos y la extensibilidad.
RESULTADOS
Los resultados de la evaluación inicial realizada a los tres lotes mostraron una buena reproducibilidad tecnológica y todos cumplieron con las especificaciones de calidad establecidas. En las dos condiciones de almacenamiento se observó una constancia en la apariencia de los geles, sin que se observaran signos de inestabilidad física. Todos los lotes se mantuvieron como geles de un color pardo rojizo oscuro, brillantes, homogéneos, de olor característico y consistencia viscosa.
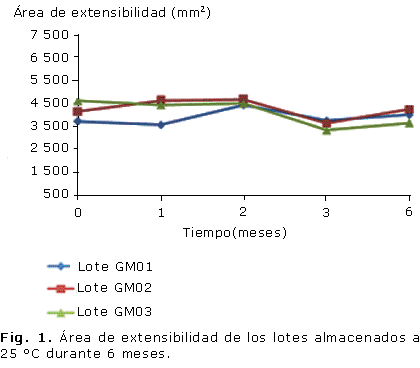
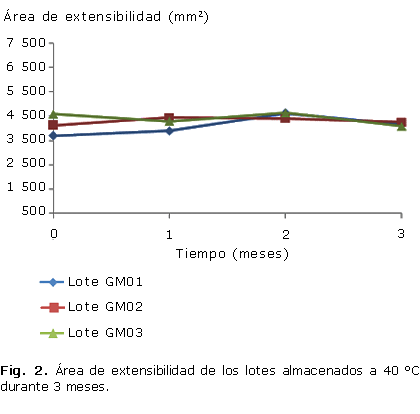
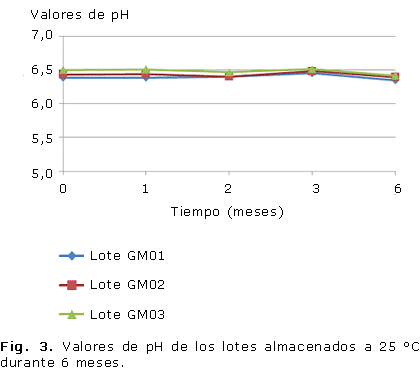
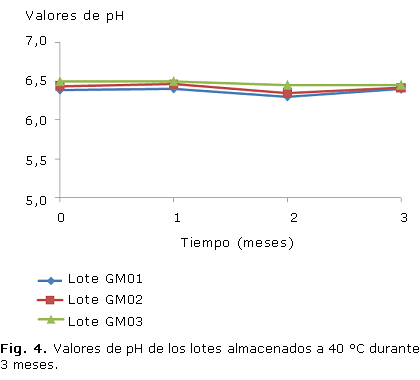
Todos los lotes se caracterizaron por grandes áreas de extensibilidad, mantenidas en todos los tiempos y condiciones que se evaluaron (Fig. 1, 2), al igual que el pH, que permaneció inalterable en un rango entre 6 y 7 (Fig. 3, 4).
El estudio reológico, como indicador de estabilidad física, evidenció que los 3 lotes mostraron un fluido newtoniano de tipo plástico no ideal, correspondiendo a un modelo Herschel Bulkley durante las condiciones del estudio.
Todos los lotes mantuvieron el contenido de taninos dentro de los límites de aceptación (13-30 mg/g) y la concentración mínima inhibitoria (CMI) estuvo entre 8 y 10 mg/mL durante el período evaluado (tabla).
Los 3 lotes almacenados en las dos condiciones de temperatura cumplieron con el límite microbiano en todos los tiempos evaluados, aspecto que garantiza que no exista contaminación microbiana en el gel.
DISCUSIÓN
Aunque los resultados de los estudios acelerados no son siempre predictivos de los cambios físicos, contribuyen a predecir el periodo de validez bajo condiciones normales de almacenamiento.21
La estabilidad de los productos farmacéuticos depende de factores ambientales, como temperatura, humedad y luz, y de factores relacionados con el producto entre los que sobresalen las propiedades físico-químicas del principio activo y de los excipientes, la forma farmacéutica y su composición, los procesos de fabricación y la naturaleza y propiedades del envase utilizado.21
Por tal motivo, este estudio se realizó en el envase final propuesto ya que la selección del envase constituye una decisión trascendental del programa de acondicionamiento de un medicamento, que contribuyó a que el límite microbiano de todos los lotes se mantuviera dentro de las especificaciones establecidas por la USP 29.20 Aunque todas las funciones del acondicionamiento son importantes, puede decirse que la protección es el factor crítico puesto que incide sobre la estabilidad del propio medicamento.22-24 Estos requerimientos no se brindan en las Pharmacopeas; la adecuación de un material en particular como envase, se establece normalmente a través de estudios de estabilidad en el cual el material está en contacto con el fármaco en cuestión.25-27
La mayoría de los geles presentan estructuras que no llegan a alcanzar el equilibrio; los diferentes métodos de elaboración y las condiciones influyen en el estado del gel. El gel se estabiliza físicamente conforme tiende hacia el equilibrio, lo cual confiere gran importancia a la apariencia del gel que debe ser considerada en el análisis de las propiedades físicas.28 En este sentido, todos los lotes mantuvieron inalterables las características organolépticas; resulta llamativa la apariencia brillante y el color color pardo rojizo oscuro del gel resultante, debido fundamentalmente a la presencia de los taninos en el extracto acuoso de mangle rojo.7 En cuanto a las áreas de extensibilidad, todos los lotes se mantuvieron dentro del límite establecido (3 000 y 5 000 mm2), solo se observó diferencia significativa (p £ 0,05) del lote uno con respecto al resto en el tiempo de un mes a temperatura de almacenamiento de 25 °C, aspecto que puede estar dado por la propia variabilidad del método.
En el diseño de un gel es indispensable seleccionar la formulación que presente características organolépticas y reológicas idóneas para su administración tópica, es decir, con extensibilidad y textura apropiadas. Es importante asegurarse de que la preparación sea estéticamente aceptable para el paciente y fácil de usar.29 Los lotes de gel evaluados mantuvieron una consistencia en un término medio, necesario para garantizar una adecuada aplicación y permanencia en el sitio de acción.
El pH de todos los lotes fue estable durante las condiciones evaluadas y no se manifestaron diferencias significativas entre los lotes a los diferentes tiempos en las dos condiciones de almacenamiento, lo anterior garantiza que el gel no provoque irritación en el momento de su aplicación y además, constituye un indicador de estabilidad física.21,30 En las preparaciones tópicas el pH debe ser neutro o débilmente ácido, lo más parecido al de la piel.28
En el análisis reológico se observó un comportamiento característico de los geles en todos los lotes. Las propiedades reológicas deben proporcionar al preparado una adecuada extensibilidad y adaptabilidad a la superficie y cavidades cutáneas.28
El indicador de contenido de TT constituye un elemento importante que está relacionado con las propiedades farmacológicas como antiséptico y acelerador de la curación de heridas del extracto acuoso de la corteza de mangle rojo que compone el gel.3-5 Estos polifenoles son los principios activos de esta formulación,7 por lo que Travieso y otros (2011) validaron un método cuantitativo confiable no solo para los estudios de estabilidad, sino en los controles de proceso del producto intermedio y en el control de calidad del producto final.18 Para tal efecto, estandarizaron un método basado en la precipitación con proteínas de los compuestos fenólicos sugerido por Hagerman y Butler.31 Este método fue validado posteriormente para su uso en la evaluación de formulaciones líquidas,32 y fue utilizado en el estudio de estabilidad en estante del CIKRON-H.33
Al comparar estos resultados entre lotes, se observó que el lote 3 difirió del resto en todos los tiempos evaluados (p £ 0,05), sin embargo todos los resultados se mantuvieron entre 13-30 mg/g. De igual forma, la variación de TT de los lotes a los diferentes tiempos y temperaturas ensayados se mantuvo dentro del límite de especificación establecido para este indicador de calidad.
La CMI, en microbiología, es la concentración más baja de un antimicrobiano que inhibe el crecimiento visible de un microorganismo después de su incubación, es importante en diagnósticos de laboratorio para confirmar la resistencia de microorganismos a un agente antimicrobiano y además para monitorear la actividad de los nuevos agentes antimicrobianos.34 Se observó un incremento de la CMI hasta 10 mg/mL a los 6 meses de estabilidad en 25 °C, a pesar de no observarse cambios significativos en los TT. En este sentido, la caracterización química realizada al extracto acuoso de la corteza de R. mangle reveló la presencia de polifenoles o taninos totales (54,78 %), representados en su mayoría por taninos poliméricos (80 %) y taninos hidrolizables (20 %); se destaca la presencia en estos últimos de epicatequina, catequina, ácido clorogénico, ácido gálico y ácido elágico, además se encontraron galotaninos y elagitaninos. De las estructuras no tánicas, se refiere la presencia de carbohidratos (17,5 %) libres y enlazados (xilosa, ramnosa, glucosa, fucosa, arabinosa, manosa y galactosa); ácidos grasos (4,0 %) de cadena larga, saturados e insaturados, desde C 10:0 hasta C 24:0; fitoesteroles (0,0285 %), representados por estigmasterol, sitoesterol y posiblemente campesterol; componentes volátiles o semivolátiles (70 compuestos) (0,0205 %) y aromas o aceites esenciales no volátiles.35
Aunque se demostró, que la fracción de taninos poliméricos, componente mayoritario, contribuyó con el mayor aporte a la actividad antimicrobiana del extracto de mangle frente a Bacillus subtilis y Staphylococcus aureus, todos los grupos químicos presentes en este mostraron también esta actividad.36 Por este motivo, el incremento del valor de la CMI no solo depende de la concentración de TT, aunque sí en mayor medida.
Armenteros y Ginorio (1999) informan inhibición del crecimiento de Staphilococcus aureus y Streptococcus agalactiae en presencia de extractos de mangle rojo a 8 mg/mL y de Candida albicans y Pseudomona aeruginosa a concentración de 10 mg/mL, lo que coincide con los valores de CMI obtenidos en este estudio.37
Durante el período analizado (3 y 6 meses) para 40 y 25 °C respectivamente, todos los lotes del gel almacenados en el envase final propuesto permanecieron estables, o sea, todos los indicadores físico-químicos y microbiológicos evaluados se mantuvieron dentro de los límites de aceptación establecidos en cada uno. Lo anterior es un indicio de que el producto diseñado en forma de gel debe tener buena estabilidad en anaquel, aspecto que es necesario confirmar en un próximo estudio de estabilidad en condiciones reales de almacenamiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Principales ecosistemas frágiles cubanos: manglares. [Internet] 2008 [citado Feb 2010]. Disponible en: http://www.medioambiente.cu/ecosistemas_manglares.asp
2. Suman D. Situación de los manglares en América Latina y la Cuenca del Caribe. El ecosistema de manglar en América Latina y en la Cuenca del Caribe: su manejo y conservación. Miami: Rosenstiel School of Marine and Atmospheric Science; 1994. p. 1-10.
3. Melchor G, Fernández O, Alvarez E, Fragas I, Lobo E. Evaluación del efecto antiséptico in vivo del CIKRON-H. Rev Mex Cien Farm. 2001;32(2):25-32.
4. Fernández O, Capdevila JZ, Dalla G, Melchor G. Efficacy of Rhizophora mangle aqueous bark extract in the healing of open surgical wounds. Fitoter. 2002;73(7/8):564-8.
5. Bulnes C, Fernandez O, Navarro D, Marrero E, Rueda D, Figueroa O, Melchor G, Proenza T. Healing effect of a red mangrove extract on open aseptic wounds in rats. Rev Salud Anim. 2001;23(2):102-8.
6. Sánchez LM, Escobar A, Valcárcel L. Caracterización preliminar de la materia prima de Rhizophora mangle L. en la obtención de productos farmacéuticos procedentes de tres zonas geográficas de Cuba. Rev Salud Anim. 2005;27(2):115-23.
7. Sánchez LM, Valcárcel L, Escobar A, Noa M. Polyphenol and phytosterols composition in an antibacterial extract from Rhizophora mangle L´s bark. J Herbal Pharmacother. 2006;6:5.
8. Marrero E. Phytopharmaceuticals as therapeutic tools for veterinary and human therapy: Research on natural health products developed at CENSA, Havana, Cuba. In: Capasso A (ed). Recent Developments in Medicinal Plant Research. 2007. Available from: http://www.censa.edu.cu/blog/emf/wp-content/uploads/2009/10/115-marrero-e-capitulo14-libro-capasso-2007.pdf
9. Rashmi MS. Topical Gel: A Review. Latest reviews. 2008;6(3):244-9. Available from: http://www.pharmainfo.net/reviews/topical-gel-review
10. Shivhare UD, Jain KB, Mathur VB, Bhusari KP, Roy AA. Formulation development and evaluation of Diclofenac sodium gel using water soluble polyacrylamide polymer. Digest J Nanomat Biostruct. 2009;4(2):285-90.
11. Gupta A, Mishra AK, Singh AK, Gupta V, Bansal P. Formulation and evaluation of topical gel of diclofenac sodium using different polymers. [Internet]. Drug Invention Today 2010 [cited 2010 Jun].;2(5):250-3. Available from: http://ditonline.info/article/view/2378
12. Alves MP, Funck, JAB, Bittencourt CF, Silva MAS. Desenvolvimento e avaliação da estabilidade de bases dermatológicas não iônicas para incorporação de fármacos. Rev Pharm Tech (Ed. port.). 1999;3(2):40-5.
13. Zanin SMW, Miguel MD, Chimelli M, Dalmaz AC. Parâmetros físicos no estudo da estabilidade das emulsões. Vis Acad. 2001;2(2):47-58.
14. Brasil. Guia de Estabilidade de Produtos Cosméticos. Anvisa. 2004;1:52.
15. Zunino GPA. Farmácia Magistral no contexto da saúde. Pharm Bras. 2007; 10(59-60):44-8.
16. Escobar A, Pérez T, Riverón Y, Sánchez LM, Fernández O, Marrero E. Estabilidad en condiciones drásticas del CIKRON-H. Rev Salud Anim [Internet]. 2008 Abr [citado 14 Mar 2010]; 30(1):25-31. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0253-570X2008000100004&lng=es
17. PN/L/CP/003/00 Determinación del índice de extensibilidad. [Internet] 2008 [citado Sept 2009]. Disponible en: http://www.rentasoft.es/Compufarma/Formulacion/PN_L_CP_003_00.pdf
18. Travieso MC, Betancourt A, Escobar A, Linares A, Rodríguez Y, Pérez T. Validación del método de cuantificación de taninos totales en formulaciones semisólidas de Rhizophora mangle L. (mangle rojo). Rev Cubana Plant Med [Internel]. 2011[citado Mar 2011]; 16(1). Disponible en: http://bvs.sld.cu/revistas/pla/vol16_1_11/pla09111.htm
19. Daguet GL, Chabbert VA. Técnicas en Bacteriología. Barcelona: Editorial Jims, 1977. p. 135-53.
20. United States Pharmacopeia Convention USP XXIX. United States Pharmacopeial Convention. 29 ed. Rockville: Mack Printing; 2006. p. 2503-8.
21. Regulación 23-2000. Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. CECMED. Cuba. 2000. Disponible en: http://www.cecmed.sld.cu/Docs/RegFarm/DRA/LicProd/1992-2000/Reg/Reg_23-00.pdf
22. Soriano MC, Sánchez-Lafuente C, Alvarez-Fuentes J, Holgado MA. Acondicionamiento de medicamentos: funciones y tipos de envasado. Industria Farmacéutica. 2000;15(3):95-101.
23. Ratna V. Stability of drugs: Packaging and stability. [en línea] 2005 [cited 2010 marzo]. Available from: http://www.pharmainfo.net/free-books/stability-drugs?page=4961
24. Shabir GA. Review of Pharmaceutical Product Stability, Packaging and the ICH Guidelines. Am Pharm Rev. 2008;11(1):139-41.
25. World Health Organization. WHO Technical Report Series, No. 902, Annex 9. Guidelines on packaging for pharmaceutical products. 2002: 119-146. Available from: http://whqlibdoc.who.int/trs/WHO_TRS_902.pdf#page=129
26. Rodríguez Leyes EA, Sierra Pérez RC, González Canavaciolo VL, Marrero Delange D, Vicente Murillo R. Estudio de estabilidad acelerada del ingrediente activo D-004 en diferentes envases. Rev Cubana Plant Med [Internet]. 2009 Sep [citado 17 Ene 2010]; 14(3):54-60. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962009000300008&lng=es
27. Suárez Pérez Y, García Pulpeiro O, Cueto León M. Estabilidad acelerada del ungüento QL. Rev Cubana Farm [Internet]. 2008 Abr [citado 17 Ene 2010]; 42(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152008000100010&lng=es
28. Muñoz M. Síntesis y caracterización de geles como vehículos de meloxicam y acetato de vitamina E de aplicación tópica terapéutica y cosmética. Tesis doctoral. [Internet] 2005 [citado Feb de 2009]. Disponible en: http://digibug.ugr.es/bitstream/10481 /560/1/15381870.pdf
29. Welin BK, Neelissen JAM, Bergenstah B. The effects of the rheological behavior of the topical anesthesic formulation on the release permeation rates of the active compound. Eur J Pharm Sci. 2001;13(3):309-18.
30. Marquele-Oliveira F, Fonseca YM, de Freitas O, Fonseca MJV. Development of topical functionalized formulations added with propolis extract: Stability, cutaneous absorption and in vivo studies. Int J Pharm. 2007;342:40-8.
31. Hagerman AE, Butler LG. Protein precipitation method for the quantitative determination of tannins. J Agricult Food Chem. 1978;26(4):809-12.
32. Travieso MC, Hechavarría OL, Betancourt AB, Frontera M, Miranda I. Validación del método de determinación de taninos totales en productos naturales vegetales. Rev Protección Veg. 1998;13(3):189-94.
33. Escobar A, Pérez T, Riverón Y, Melchor G, Sánchez LM, Fernández O, et al. Estabilidad en vida de estante del CIKRON-H. Rev Salud Anim. [Internet]. 2008 Abr [citado 14 Mar 2010]; 30(1):32-38. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0253-570X2008000100005&lng=es
34. Andrews JM. Determination of minimum inhibitory concentrations. J Antimicrob Chemother. 2001;4(Suppl 1):5-16.
35. Sánchez LM, Melchor G, Alvarez S, Bulnes C. Caracterización química y toxicológica de una formulación cicatrizante de Rhizophora mangle L. Rev Salud Anim. 1998;20(2):69-72.
36. Sánchez LM, Armenteros M, Varcárcel L. Actividad antimicrobiana de los principales grupos químicos presentes en Rhizophora mangle L. Rev Salud Anim. 2000;22(3):174-9.
37. Armenteros M, Ginorio MC. Determination of the minimum inhibitory concentration of Rizophora mangle L. (Red mangrove) against different microorganisms. Rev Salud Anim. 1999;1(2):135.
Recibido: 2 de mayo de 2011.
Aprobado: 18 de junio de 2011.
Dra. C. Dulce María Soler Roger. Centro Nacional de Sanidad Agropecuaria (CENSA). Carretera de Jamaica y Autopista Nacional. San José de Las Lajas. Mayabeque, Cuba. Correo electrónico: dmler@censa.edu.cu