Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.46 no.1 Ciudad de la Habana ene.-mar. 2012
ARTÍCULO ORIGINAL
Separación de fosfolípidos mediante la aplicación de fuerzas centrífugas
Separation of phospholipids by the application of centrifuge strengths
Dra. C. Elaine Díaz Casañas, Ing. Guillermo Hughes Pereira-Cabral, MSc. Wilma Alfonso Lorenzo
Centro Nacional de Sanidad Agropecuaria (CENSA). San José de las Lajas, Mayabeque, Cuba.
RESUMEN
Introducción: la separación centrífuga es muy utilizada para la obtención de productos farmacéuticos y biotecnológicos. Es la separación o concentración de fosfolípidos o ambas una de estas aplicaciones.
Objetivo: seleccionar y evaluar el uso de diferentes separadores centrífugos así como el establecimiento de sus condiciones de operación, para la obtención de un concentrado de una mezcla fosfolipídica típica.
Métodos: se realizó la caracterización física de la suspensión a tratar para seleccionar el tipo de centrífuga más adecuada y se determinaron las condiciones de operación de esta. Se evaluó además la composición de las mezclas fosfolípidicas obtenidas en cada caso.
Resultados: se obtuvo que tanto una centrifuga de discos como una tubular son competentes para lograr la concentración de fosfolípidos, con una composición que puede ser utilizada para la formulación de liposomas, cosméticos y medicamentos.
Conclusiones: Teniendo en cuenta la competencia de ambas centrífugas para rendir una mezcla fosfolipídica específica y los similares rendimientos en la separación, la mejor elección es una centrífuga tubular vertical por ser más económica y sencilla en su operación que la de discos.
Palabras clave: centrifugación, fosfolípidos.
ABSTRACT
Introduction: centrifuge separation is very useful for obtaining pharmaceutical and biotechnological products. One of these applications is the separation and/or concentration of phospholipids.
Objective: to evaluate the use of different centrifuge separators, as well as the establishment of their operation conditions in order to obtain a typical phospholipidic mixture concentrate.
Methods: a physical characterization of the suspension to be treated was made for selecting the most adequate kind of centrifuge and its operational conditions were determined. The composition of the phospholipidic mixtures in every case was also evaluated
Results: both the disk and the tubular centrifuges turned to be fit for reaching the phospholipids concentration; hence the composition can be used for the formulation of liposomes, cosmetics and drugs.
Conclusions: Given the adequacy of both centrifuges for reaching a specific phospholipidic mixture and their similar performances in the separation process, the best choice will be the vertical tubular centrifuge since it is less expensive and simpler in operation than the disk centrifuge.
Key words: centrifugation, phospholipids.
INTRODUCCIÓN
La separación centrífuga ha sido una práctica habitual dentro de la Industria Químico Farmacéutica por más de 100 años. Su simplicidad, además del excelente desempeño de la técnica, continúa ganando nuevos usuarios. Su aplicación original, fue en el procesamiento de alimentos, especialmente en la separación de crema de leche. Hoy es muy utilizada para la obtención de productos farmacéuticos, biotecnológicos y biomasa. Dentro de estas últimas aplicaciones está la separación y/o concentración de macromoléculas procedentes de diferentes procesos de obtención.
El caso de la separación y/o concentración de fosfolípidos es una de las aplicaciones de la centrifugación. Los fosfolípidos son lípidos complejos, compuestos de 1,2-diacilglicerol y un enlace fosfodiéster que une el esqueleto del glicerol a alguna base, generalmente nitrogenada, tal como la colina, serina o etanolamina.1 Ellos tienen innumerables aplicaciones, destacándose en la formulación de medicamentos2 (surfactantes pulmonares), liposomas, cosméticos, alimentos, entre muchas otras.2-4 Son las moléculas más abundantes de la membrana citoplasmática y las principales constitutivas de la doble capa lipídica de la membrana celular.5
Tomando en consideración la utilidad e importancia que tienen estas macromoléculas, se han desarrollado varias alternativas6,7 para su obtención, utilizando pulmones de cerdo y de conejo como fuente natural. El objetivo de este trabajo consistió en seleccionar y evaluar el uso de diferentes separadores centrífugos así como el establecimiento de sus condiciones de operación, para la obtención de un concentrado de una mezcla fosfolípidica típica.
MÉTODOS
Caracterización de la suspensión a centrifugar (prueba de decantación)
Para caracterizar los líquidos del proceso, se tomaron muestras representativas que se sometieron a análisis físico-químico, que permitieron determinar las fases y la distribución porcentual de estas en una centrífuga de mesa con tubos aforados. Se colocó un volumen conocido de suspensión (10 cm3) y se procedió a centrifugar a más de 1000 s-1 durante diversos intervalos de tiempo, hasta obtener el grado de separación deseado.8 Así se conoció la lectura de volúmenes de fase y por ende, se calculó el porcentaje volumétrico de cada fase, así como su densidad aparente.
Selección del separador centrífugo y sus condiciones de operación
La elección de la alternativa de separación apropiada exige el conocimiento de un conjunto de propiedades físicas del sólido de interés y su suspensión; pero, además, se deben tener en cuenta las recomendaciones de los diversos fabricantes sobre la factibilidad de empleo de unos equipos u otros en dependencia de dichas características. Para la selección del separador centrífugo, fue necesario auxiliarse de los diagramas que expone la literatura8-10 de acuerdo con el tipo de separador, tamaño de partículas y concentración de sólidos en la suspensión a emplear.
Para centrífugas de discos. De los resultados de las pruebas de laboratorio realizadas, se determinó el tiempo de centrifugación requerido, a un factor centrífugo dado (G), para alcanzar la «transparencia» deseada. Por lo tanto, se pudo estimar un tiempo de residencia para la centrífuga piloto al operarla a la máxima velocidad, que permitía lograr la densidad de trabajo de alimentación.10
Conociendo el volumen del líquido a retener en el rotor se pudo hacer una estimación de la velocidad de flujo de alimentación de la centrifuga piloto y con ello determinar el tiempo entre dos descargas de sólidos.
Para centrífugas tubulares verticales. Se realizó un diseño de experimentos que consistió en evaluar a tres condiciones de flujo de alimentación diferentes (100, 200 y 300 cm3/min) y volumen de 40 dm3 de suspensión a procesar. Se evaluaron los rendimientos de cada variante en cuatro corridas. Se realizó una comparación estadística11 entre las diferentes condiciones y entre los dos tipos de centrífuga.
Evaluación de la composición bioquímica
El principio activo obtenido se caracterizó según los siguientes análisis: La determinación de fosfolípidos totales se realizó según el método de Barttlet.12 La composición de fosfolípidos individuales fue medida por cromatografía en placa delgada13 y los fosfolípidos disaturados a través del método de Mason y otros.14
RESULTADOS
Caracterización de la suspensión a centrifugar
En la tabla 1 se muestran los resultados de la caracterización de la suspensión.
Las densidades aparentes de cada fase son:
- Densidad aparente de la suspensión: 1,014 g/cm3
- Densidad aparente del sólido centrifugado: 1,164 g/cm3
- Densidad aparente del sobrenadante: 0,999 g/cm3
Selección del separador centrífugo y sus condiciones de operación
Con los resultados del laboratorio y el empleo de los nomogramas y las ecuaciones brindadas por el fabricante de la centrífuga de discos (ALFA LAVAL) de que se dispone, se estimó el tiempo de residencia (20 s) operando a la máxima velocidad que permitía la densidad de trabajo de la alimentación. Conociendo el volumen del líquido retenible en el rotor (0,12 dm3), se pudo hacer una estimación de la velocidad de flujo de alimentación (160-200 cm3/min.); a partir de ese flujo se determinó el tiempo entre dos descargas de sólido que fue de 43 min. En estas condiciones se efectuaron 4 corridas experimentales de centrifugación que indicaron un rendimiento de 30,09 % ± 6,38.
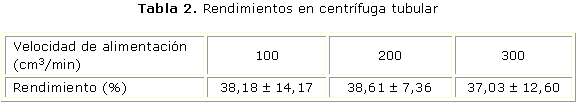
En el caso de la centrífuga tubular (CEPA), los resultados de la evaluación de las diferentes velocidades de flujo de alimentación se muestran en la tabla 2.
Evaluación de la composición de la mezcla fosfolipídica
Estos resultados se muestran en la tabla 3.
DISCUSIÓN
El porcentaje volumétrico de sólidos de la suspensión es de 0,83 % (tabla 1). La "transparencia" deseada se logró en 180 segundos en la centrífuga de laboratorio, este corto tiempo de separación se debe a las diferencias de densidades entre las fases, que si bien no son grandes, si actuó como un factor importante en el proceso de separación.
Esta separación de la mezcla fosfolipídica alcanza cierto nivel de complejidad dada su baja granulometría (0,05-10 mm) y los bajos niveles de concentración (0,83 %) de sólidos. De acuerdo a estas características se recomienda el empleo de centrífugas sedimentadoras.
Las centrífugas tubulares verticales y las centrífugas de discos poseen características promisorias para esta separación. En el caso de las de discos permiten manipular concentraciones volumétricas de sólidos menores del 10 %;15 para partículas tan pequeñas como 0,5 mm, las tubulares verticales admiten tamaños de partículas tan pequeñas como 0,1 mm y concentraciones volumétricas de sólidos menores de un 2 %.
Para la centrifuga tubular vertical no existió diferencias estadísticamente significativas (p> 0,05) en la comparación entre los grupos (tabla 2). Se eligió la velocidad de flujo de alimentación de 200 cm3/min.
Comparando el resultado de ambas centrifugas en esta condición, no se encontró diferencias estadísticamente significativas (p> 0,05) en relación con los rendimientos, estos no son elevados, sin embargo, ambas centrífugas logran separar una fracción de fosfolípidos que no difiere notablemente en su composición bioquímica (tabla 3), por lo que se puede elegir cualquiera de ellas para separar una mezcla rica en fosfatidilcolina y dipalmitoilfosfatidilcolina, que son precisamente los fosfolípidos más empleados en las preparaciones de surfactantes pulmonares2 y liposomas.16,17
Desde el punto de vista de operación las centrifugas tubulares son más sencillas y además menos costosas que las de discos que necesitan mayor destreza de los operarios para su manejo e higienización
Teniendo en cuenta la competencia de ambas centrífugas para rendir una mezcla fosfolipídica específica y los similares rendimientos en la separación, la mejor elección es una centrífuga tubular vertical por ser más económica y sencilla en su operación que la de discos.
REFERENCIAS BIBLIOGRÁFICAS
1. Fosfolípidos. Biopsicología.net. Disponible en: http://www.biopsicologia.net/fichas/page_745.html
2. Manzanares D, Díaz E, Alfonso W, Escobar A, Colomé H, Muñoz MC, Noa M, Rabell S, Hidalgo O. Surfactante pulmonar natural porcino. República de Cuba, Patente A 61 K 35/42. 1997.
3. Pasqualí RC, Bregni C, Serrao R. Geometría de micelas y otros agregados de sustancias anfifílicas. Acta Farm Bonaerense 2005;24(1):19-30.
4. Gong H, Jiang D, Lawrence A, González-Félix M, Pérez-Velásquez M. Nuevos avances en el estudio de fosfolípidos nutrimentales para camarón. In: Cruz Suárez, LE, Ricque Marie D, Nieto López MG, Villareal D, Scholz U, González M. Avances en Nutrición Acuícola VII. Memorias del VII Simposium Internacional de Nutrición Acuícola. 16-19 Noviembre, 2004. Hermosillo, Sonora, México.
5. Valdez Valencia AF. Lípidos. Disponible en: http://www.monografias.com/trabajos16/lipidos/lipidos.shtml
6. Alfonso W, Díaz E, Manzanares D. Estudio comparativo de dos métodos de obtención del principio activo de un agente tensoactivo pulmonar. Tecnol Ciencia. 2001;16(2):77-83.
7. Travieso MC, Díaz E, Villoch A, Pérez A, Fraga V, González D. Obtención de un candidato a material de referencia interno para el método biológico de gazapos inmaduros. Rev Salud Animal. 2006;28(2):79-84.
8. C&D INGENIERIA. C&D-CENTRIFUGAS & DECANTERS. Ingeniería en separación. Disponible en: http://www.centrifugesdecanter.com.ar&index
9. Dream R. Centrifugation and its application in the biotechnology industry. Pharmaceutics Eng. 1992;Nov-Dec:45-52.
10. García J. La centrifugación en la industria químico farmacéutica. SINTEFARMA (Revista electrónica) 2001;7(1). Disponible en: http://bvs.sld.cu/revistas/sint/vol7_1_01/sint0401.htm
11. STATGRAPHICS Plus, Versión 5.1, Abril, 2002. Disponible en: http://www.statgraphics.com/
12. Bartlett GR. Phosphorus assay in column chromatography. J Biol Chem. 1959;234:466-8.
13. Travieso MC, Betancourt A. Evaluation of two sources of phospholipids to manufacture a reference standard for biochemical assay of TLC. Rev Cubana Quím. 2001;13(2).
14. Mason RJ, Nellenbogen J, Clements JA. Isolation of disaturated phosphatydilcholine with osmium tetraoxide. J Lipids Res. 1976;17:281-4.
15. Norton V, Wilkie W. Clarifying Centrifuge Operation and Selection. Chemical Enginnering Progress. Copyrigth American Institute of Chemical Engineers. 2004;100(8). Available from: http://www.aiche.org/CEP/Issues/2004-08/index.aspx
16. Gelabert YE, Díaz R. Nuevas alternativas de inmovilización de activos antioxidantes. Rev Cubana Invest Bioméd. 2001;20(1):70-2.
17. Moscoso J, Echevarria L. Liposome Preparation Method. WIPO Patent WO/2007/063156, 2007.
Recibido: 12 de octubre de 2010.
Aprobado: 25 de noviembre de 2010.
Elaine Díaz Casañas. Centro Nacional de Sanidad Agropecuaria (CENSA). Carretera de Jamaica y Autopista Nacional. San José de Las Lajas, Apartado 10, Mayabeque, Cuba. Correo electrónico: elaine@censa.edu.cu