Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.46 no.2 Ciudad de la Habana abr.-jun. 2012
ARTÍCULO ORIGINAL
Desarrollo tecnológico de cisplatino solución inyectable
Technological development of injectable cisplatin solution
MSc. Armando Gato del Monte, Dr. C. Alejandro Saúl Padrón Yaquis
Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana. Cuba.
RESUMEN
Objetivo: desarrollar una formulación de cisplatino a una concentración de 1 mg/mL, estableciendo el procedimiento de preparación de la solución, para ser administrada por vía parenteral, con buena estabilidad física, química, biológica y microbiológica.
Métodos: se prepararon variantes en dos formulaciones de cisplatino: una solución con tampón de acetato y otra sin el empleo de solución tampón, a las cuales se les siguió su estabilidad física y química durante 3 meses. En las formulaciones se empleó materia prima de la firma IMPEX SA, con una potencia de 99,74 %, según certificado de análisis del fabricante. Se realizaron tres lotes a escala piloto de cisplatino 10 mg en bulbos 10 R ámbar y tres lotes de cisplatino 50 mg en bulbos 50 H ámbar, empleándose una dosis de 1 mg/mL. Se usaron excipientes que le confieren isotonía y estabilidad a la formulación con ácido clorhídrico 0,1 N y como vehículo, agua para inyección. Por cromatografía líquida de alta resolución se evaluó la estabilidad para determinar la fecha de vencimiento del medicamento. Por métodos biológicos se determinó la ausencia de pirógenos y por métodos microbiológicos, la esterilidad.
Resultados: en ambas formulaciones no hubo diferencias en los resultados físicos y químicos, por lo que se realizó el escalado industrial con la segunda formulación. Durante 12 meses el cisplatino 10 y 50 mg soluciones presentó buena estabilidad físico-química, comportándose sus concentraciones entre 90,0 y 105,0 % y el pH entre 3,5-6,5 a temperatura ambiente.
Conclusiones: Las formulaciones de cisplatino 10 y 50 mg presentan las especificaciones de calidad físico-químicas, microbiológicas y biológicas informadas por 12 meses a temperatura ambiente. Este medicamento al cumplir con todos los parámetros de calidad, está registrado en el órgano regulador cubano para ser utilizado con seguridad en pacientes.
Palabras clave: cisplatino, estabilidad, citostáticos.
ABSTRACT
Objective: to develop a cisplatin formulation at 1mg/mL concentration by setting the solution preparation procedure for parenteral administration, with good physical, chemical, biological and microbiological stability.
Methods: two formulation variants of cisplatin: one solution with and the other without acetate buffer. Both were followed in terms of physical and chemical stability for 3 months. The formulations used raw material from IMPEX SA company, which has 99.74 % power as certified by the manufacturer analysis. Three batches of 10mg cistoplatin at pilot scale in amber 10 R vials, 3 batches of 50 mg cisplatin in amber 50 H vials and the dose was 1mg/ml. Excipients were used to give isotony and stability to the formulation with 0.1 N chlorhydric acid and injection water for vehicle. The high performance liquid chromatography allowed evaluating the stability to determine the expiry date of the drug. The biological and microbiological methods determined lack of pyrogens and sterility respectively.
Results: both formulations showed no differences in physical and chemical results, so the second formulation was used at industrial scale. During 12 months, 10 and 50 mg cisplatin solutions exhibited good physical and chemical stability, ranging its concentrations from 90.0 to 105.0 % whereas pH was 3.5 to 6.5 at room temperature.
Conclusions: 10 and 50mg cisplatin formulations have the physical-chemical, microbiological and biological specifications reported in 12 months at room temperature. Since this drug meets all the quality parameters, the Cuban regulatory agency registers it as a safe drug for patients.
Key words: cisplatin, stability, cytostatics.
INTRODUCCIÓN
El cisplatino (cis-diaminodicloroplatino), se sintetizó en 1845 y sus propiedades citotóxicas se informaron en 1967.1 El efecto antitumoral de los compuestos de platino fue identificado por primera vez en 1965 por Rosenberg. Se pudo comprobar entonces cómo los electrodos de platino interrumpían el crecimiento de la bacteria E. coli.2-4
Fue el primer preparado de platino que se empleó en clínica humana para el tratamiento del cáncer.5
Es un polvo amarillo cristalino, ligeramente soluble en agua, escasamente soluble en dimetilformamida y prácticamente insoluble en alcohol.6 Sus soluciones acuosas presentan un alto grado de inestabilidad con rápida degradación del complejo.7 El rango de pH de las soluciones es entre 3,5 y 6,5.
Se encontró que la descomposición es primordialmente debida a la formación reversible de cis-diaminoacuocloroplatino, con la extensión de dependiente que es la descomposición en el fármaco de la concentración del ion cloruro.8
El cisplatino está indicado para el tratamiento paliativo en tumores testiculares y de ovario metastásicos, cáncer avanzado de vejiga y carcinoma de células escamosas de cabeza y cuello. Puede utilizarse en monoterapia o en asociación con otros agentes citostáticos en gran variedad de esquemas posológicos y combinación con otros fármacos según los diversos tipos de tumores. Entre las combinaciones quimioterapéuticas con otro antineoplásico las más frecuentes son con ciclofosfamida, bleomicina, doxorubicina o vinblastina. En otros tumores como los del área de cabeza y cuello, esófago, osteosarcoma, cáncer microcítico y no microcítico de pulmón se han logrado significativos avances.
El producto terminado aparece como oficial en la BP 2010 como solución estéril en vehículo acuoso,9 así como en la USP en forma de liofilizado.
El objetivo del trabajo es desarrollar una formulación de cisplatino a una concentración de 1 mg/mL, estableciendo el procedimiento de preparación de la solución para ser administrada por vía parenteral, con buena estabilidad física, química, biológica y microbiológica.
MÉTODOS
Se prepararon variantes en dos formulaciones de cisplatino; una solución con tampón de acetato y otra sin el empleo de solución tampón a las cuales se les siguió su estabilidad física y química durante 3 meses.
En la formulación de cisplatino se empleó materia prima de la firma IMPEX SA, con una potencia de 99,74 %, según certificado de análisis emitido por el fabricante. Se realizaron tres lotes a escala piloto de cisplatino 10 mg (04001, 04002, 04003 con fechas de fabricación 10/04) y tres lotes de cisplatino 50 mg (04001, 04002 con fechas de fabricación 10/04 y el lote 05001 con fecha de fabricación 01/05) empleándose una dosis de 1 mg/mL; además se utilizaron excipientes que le confieren isofonía y estabilidad a la formulación con ácido clorhídrico 0,1 N para el ajuste del pH, utilizando un pH-metro Mettler Toledo, y como vehículo, agua para inyección.
Se utilizaron aisladores en las áreas clasificadas para los escalados del producto, los que permitieron tener el control estricto de la ausencia de microorganismos aeróbicos y anaeróbicos por hisopado de paredes y exposición de placas expuestas con nutrientes previamente preparados, así como se garantizaron la protección del hombre y del medio ambiente.
Por cromatografía líquida de alta resolución se avaluó la estabilidad del producto terminado a la temperatura de almacenamiento establecida para determinar la fecha de vencimiento del medicamento. Por métodos biológicos se determinó la ausencia de pirógenos y por métodos microbiológicos la esterilidad.
El escalado e introducción de los lotes industriales se realizó en la UCTB Planta de Citostáticos del Centro de Investigación y Desarrollo de Medicamentos, la cual cuenta con instalaciones que cumplen con las Buenas Prácticas y posee licencia renovada de producción No. 001-08-1M Resolución 07/08, otorgada el 11 de febrero de 2008 por el Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED), además posee la licencia ambiental No. 3999 del Ministerio de Ciencia Tecnología y Medio Ambiente.
Se usaron bulbos de 10 y 50 mL de capacidad nominal, de calidad hidrolítica I y color ámbar, con tapones de goma butílica y sellos de aluminio anodizado de Ø 20 mm, respectivamente.
La filtración de la solución se realizó a través de un filtro cápsula de acetato de celulosa 0,2 µm, cuya integridad se comprobó antes y después de esta operación con el empleo de un equipo Sartochek Junior, Alemania. El volumen dosificado por bulbo fue de 10,5 y 50,5 mL del medicamento respectivamente.
Ensayo de pirógenos
Para el estudio de la ausencia de pirógenos se utilizaron conejos sanos procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) de la raza NZB con peso promedio entre 1,8-2,0 kg, alimentados con pienso conejita, los que fueron ubicados en condiciones de temperatura entre 20 ± 2 °C y humedad relativa entre 50-60 %. Además, los niveles de ruido en el local se mantuvieren bajos. Los animales fueron ubicados en jaulas individuales para facilitar su manejo. Después de 90 min en el local, se realizó la primera toma de temperatura rectal y a los 30 min siguientes la segunda toma, utilizando un termómetro clínico, para proceder inmediatamente a la inyección de 10 mL/kg de peso corporal de solución de 0,27 mg/mL en la vena marginal de la oreja del conejo.10
Ensayo de esterilidad
Para la determinación de la esterilidad el producto terminado se preparó e incubó en distintos medios de cultivo a las temperaturas entre 22,5 ± 2,5 y 32,5 ± 2,5 °C por períodos de 7 y 14 días. Se empleó el método de filtración por membrana, descrito en los métodos generales de la USP 33.6
Ensayo de estabilidad
El estudio se realizó para ambas presentaciones por el método acelerado por 6 meses a 40 ± 2 °C, y por vida de estante por un período de 12 meses a temperatura ambiente de 30 ± 2 ºC, durante el cual se cuantificó al cisplatino según las especificaciones de calidad descritas en la BP 2010. Para ello se utilizó la cromatografía líquida de alta resolución, método selectivo y específico, el cual se basa en la detección del principio activo en presencia de sus productos de degradación.
Se utilizó un cromatógrafo marca KNAUER equipado con un detector espectrofotométrico a longitud de onda de 220 nm y una columna amino Lichrosorb de 10 µm, en dimensiones de 25 cm x 4,6 mm. La fase móvil empleada consistió en una solución de agua-acetonitrilo (10:90).
Para la determinación de la concentración de cisplatino en el producto terminado, se prepararon tres soluciones:
1. Solución de sustancia química de referencia de cisplatino a una concentración de 0,1 % p/v en solución al 0,9 % p/v de cloruro de sodio.
2. Solución muestra a una concentración de 0,1 % p/v en solución al 0,9 % p/v de cloruro de sodio.
3. Solución de sustancia química de referencia de cisplatino 0,05 % y transplatino 0,005 % p/v en solución al 0,9 % de cloruro de sodio.
El volumen de inyección en el cromatógrafo líquido fue 20 µL y la velocidad de flujo, 1,5 mL/min.
RESULTADOS
A los 3 meses del estudio de estabilidad de las dos variantes tecnológicas en la que en una se empleó una solución tampón de acetato a pH 5,5 ± 0,2 y en la otra no se utilizó solución tampón, no hubo diferencias en los resultados físicos y químicos obtenidos, por lo que se decidió realizar el escalado industrial con la segunda formulación, para los estudios de estabilidad acelerada y por vida de estante.
En las tablas 1 y 2 se muestra el control de calidad del cisplatino 10 mg y 50 mg, soluciones inyectables, en el que se evaluaron las características organolépticas, el pH, la presencia de productos de degradación, la esterilidad, la ausencia de pirógenos y la concentración del principio activo.
Las tablas 3 y 4 muestran los estudios de estabilidad del medicamento por el método acelerado a 40 ± 2 ºC, 75 % de humedad relativa, durante 6 meses.
En las tablas 5 y 6 se presentan los resultados del estudio de estabilidad físico-químico por el método de vida de estante (30 ± 2 ºC) durante 12 meses de estudio.
Al inicio y final del estudio, la esterilidad de los 6 lotes de las formulaciones de cisplatino 10 y 50 mg, cumplieron satisfactoriamente, ya que no se observó desarrollo microbiano.
En el ensayo para determinar la presencia de pirógenos en el medicamento inyectable, no se detectó aumento de la temperatura en los animales en las tres mediciones realizadas por cada lote y el promedio de estas no superó los límites establecidos en la USP XXII.
Los lotes de cisplatino 10 y 50 mg solución que se obtuvieron a escala piloto cumplieron con las especificaciones de calidad de la USP 33 y USP XXII, y a los 12 meses las soluciones inyectables de los seis lotes en su envase primario resultaron ser estériles y apirogénicas.
DISCUSIÓN
Las soluciones de cisplatino en medio acuoso son inestables, y durante los ensayos preliminares se pudo comprobar que la presencia de iones Cl- que aporta el cloruro de sodio como isotonizante y el ácido clorhídrico para el ajuste del pH de la solución, permitió obtener una formulación estable durante los 3 meses de estudio debido a la alta concentración de este ion que mantiene el equilibrio del fármaco en medio acuoso, por lo que se descartó la formulación con solución tampón.
Estas observaciones están de acuerdo con el mecanismo de descomposición hidrolítica reversible propuesto en la literatura.8
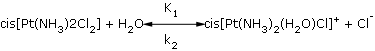
donde:
cis[Pt(NH3)2(H2 0)Cl]+, cis[Pt(NH3)2Cl2] y Cl-: concentraciones del fármaco degradado, fármaco intacto y el ion cloruro.
K1: constante de disociación de la reacción de primer orden de la reacción directa.
K2: constante de disociación inversa de la reacción de segundo orden.
Por lo tanto, basado en esto, se desarrolló la formulación de la solución inyectable de cisplatino 1 mg/mL (tablas 1 y 2), lo que demuestra que el producto respondió a los controles físico-químicos, biológicos y microbiológicos especificados en la BP 2010, USP XXII y USP 33, respectivamente.
En el estudio de estabilidad acelerada a 40 ± 2 °C y 75 % de humedad relativa (tablas 3 y 4), no se manifiestan afectación de la estabilidad de las formulaciones, ya que no se produjo cambios apreciables en esta. No se observó disminución en el contenido del principio activo en más de un 5,0 % en los lotes, igualmente no se detectaron cambios en la coloración que afectaran las características organolépticas, ni se observó la aparición de productos de degradación.
A los lotes 04001, 04002, 04003 (cisplatino 10 mg) y 04001, 04002, 05001 (cisplatino 50 mg) se les siguió el estudio de vida útil, almacenados a temperatura ambiente, 30 ± 2 °C (tablas 5 y 6); la estabilidad de estos hasta los 12 meses de fabricación, muestran que los parámetros de calidad se mantienen dentro de las especificaciones establecidas para el producto.
Estos resultados hacen que se proponga como fecha de vencimiento para el producto de 12 meses a temperatura ambiente para ambas dosis y presentaciones.
Los seis lotes se analizaron física, química, biológica y microbiológicamente a los 12 meses de almacenados a temperatura ambiente, y estos respondieron a las exigencias de calidad que plantea la BP 2010, para ser utilizado en la terapia del cáncer para los cuales se desarrollaron ambos medicamentos.
Con todos lo resultados se confeccionó y entregó el expediente de registro al CECMED, el cual fue aprobado por un período de validez de 12 meses bajo las condiciones de almacenamiento propuestas.
AGRADECIMIENTOS
A Yohania Navarro Prendes, Matilde Torres García, Berta López Peláez, Azorys Ramos de Lázaro, Amarilys Sánchez, Dania Estrada Álvarez, el más sincero agradecimiento por haber participado con su experiencia al desarrollo de esta publicación.
REFERENCIAS BIBLIOGRÁFICAS
1. United States Patent No. 4,915,956. Liquid cisplatin formulations. Rosemont: Lyphomed, Inc.; April 10, 1990.
2. Rosenberg B, Van Camp L, Krigas T. Discovery of anti-tumor activity. Nature. 1965;205:698-9.
3. Rosenberg B, Van Camp L, Trasko JE, Mansour VH. Cross-linking of complementary strands of compounds: a new class of potent antitumor agents Nature. 1969;222:385-6.
4. Rosenberg B, Van Camp L. The successful regression of large solid sarcoma 180 tumors by platinum compounds. Cancer Res. 1970 Jun;30(6):1799-802.
5. Nippon Kayaku Pharmaceuticals Group. Cisplatinum injection, an anticancer preparation. Tokio: Nippon Kayaku Pharmaceuticals Group; 2009. p. 1-44.
6. USP 33-NF 28. The United States Pharmaceutical. The National Formulary. User Guide Cisplatin, sterility test. [Monografia in CD-ROM]. Rockville, MD: United Pharmacopoeial Convention, Inc.; 2010. p. 2522.
7. United States Patent No. 4,889,724. Stable aqueous cisplatin solutions. Teva: Pharmaceutical Industries Ltd.; December 26, 1989.
8. Grene RG, Chatterji DC, Hiranaka PK, Gallelli JF. Stability of cisplatin in aqueous solution. Am J Hosp Pharm. 1979 Jan;36(1):38-43.
9. British Pharmacopoeia 2010. Vol. III. Cisplatin injection. London: The Stationary Office; p. 2505.
10. USP XXII-NF-XVII. The United States Pharmacopeia. The National Formulary. Pyrogen. Rockville, MD: United Pharmacopoeial Convention, Inc.; 1990. p. 1515.
Recibido: 28 de noviembre de 2011.
Aprobado: 19 de enero de 2012.
Armando Gato del Monte. Centro de Investigación y Desarrollo de Medicamentos (CIDEM).19 de Mayo No. 13, Esq. Amezaga. Plaza de la Revolución, La Habana. Cuba. Correo electrónico: armandogm@infomed.sld.cu













