Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.46 no.4 Ciudad de la Habana oct.-dic. 2012
PRODUCTO NATURAL
Efecto de extractos de la esponja calcarea Leucetta aff. floridana sobre el ciclo de líneas celulares leucemoides
Effect of extracts from the calcareous sponge Leucetta aff. floridana on the cell cycle of leukemoid cell lines
Dr. Cs. Diana Margarita Márquez Fernández,I MSc. Mariano Eliecer Acosta Lobo,II MSc. María Elena Márquez Fernández,III Dr. Cs. Alejandro Martínez Martínez,I Dr. Cs. Edna Judith Márquez Fernández,III Dr. Cs. Mauricio Camargo GuerreroIV
I Universidad de Antioquia. Medellín, Colombia.
II Fundación Universitaria Autónoma de las Américas Medellín, Colombia.
III Universidad Nacional de Colombia. Sede Medellín. Medellín, Colombia.
VI Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: la esponja Leucetta aff. floridana produce compuestos con actividad antiproliferativa diferencial en células tumorales de pulmón y mama, la cual no ha sido explorada en otras líneas tumorales y se desconoce si su potencial antiproliferativo está relacionado con la progresión de células a través del ciclo celular.
Objetivo: evaluar el potencial antiproliferativo, anticlonogénico y el efecto sobre el ciclo celular de los extractos hexánico y metanólico de la esponja Leucetta aff. floridana del Caribe colombiano en las líneas celulares leucemoides Jurkat y K562.
Métodos: la viabilidad y proliferación celular se determinaron mediante el ensayo de azul de tripano a 0, 24, 48, 72 y 96 h. La eficiencia de clonación y el efecto sobre el ciclo celular se evaluaron a 10 y 100 µg/mL. Los datos se analizaron usando ANOVA multifactorial y la prueba Tukey.
Resultados: el extracto hexánico presentó actividad antiproliferativa en ambas líneas celulares siendo Jurkat más sensible que K562, lo cual se corroboró con los ensayos de clonogenicidad. Este extracto también mostró un efecto de acumulación de células Sub-G1 dependiente de la dosis, el cual fue diferencial entre las dos líneas celulares. La duración del tratamiento con el extracto hexánico no fue significativa para las células K562 pero sí para la línea celular Jurkat. Además, el porcentaje de acumulación de las células Sub-G1 fue mayor para células K562 comparado con Jurkat. El extracto metanólico presentó un efecto antiproliferativo similar al hexánico, pero fue más potente con la menor concentración (10 µg/mL) en la clonogenicidad de K562. El efecto sobre el ciclo celular, también fue similar al hexánico, pero la duración del tratamiento no fue significativa en la acumulación de células en Sub-G1.
Conclusiones: los resultados muestran el potencial diferencial de los extractos sobre el ciclo celular de las líneas leucemoides evaluadas.
Palabras clave: clonogenicidad, ciclo celular, citotoxicidad, esponjas marinas colombianas.
ABSTRACT
Introduction: Leucetta aff. floridana sponge produces compounds with differential antiproliferative activity on lung and breast cancer. Nevertheless, this activity in other tumour cell lines has not yet been tested and it remains unknown whether its antiproliferative potential is correlated with the cell progression through cell cycle or not.
Objective: To evaluate the antiproliferative and anticlonogenic potential and the effect of methanolic and hexanic extracts of sponge L. aff. floridana from the Colombian Caribbean region on the cell cycle of Jurkat and K562 leukemoid cell lines.
Methods: The viability and antiproliferative effect were determined using trypan blue assay at 0, 24, 48, 72 and 96 hours. Clongenicity and effect on cell cycle were assayed at 10 and 100 µg/mL Data obtained were analyzed using multifactorial ANOVA and Tukey's test.
Results: The hexanic extract presented antiproliferative activity in both Jurkat and K652 cell lines; Jurkat being more sensitive than K652. These results were confirmed by clongenicity assays. The hexanic extract also showed its effect on the dose-dependent accumulation of Sub-G1 cells, although it was different in the two cell lines. The duration of the treatment with the hexanic extract was not significant for K562 cell line, but it was for Jurkat cells. Additionally, the percentage of cell accumulation in Sub-G1 was higher in K562 than in Jurkat cells. The methanolic extract showed antiproliferative effect similar to that of the hexanic extract, but more potent at the lowest concentration (10 µg/mL) in K652 cell line clonegenicity. The effect on cell cycle was also similar to that of the hexanic extract, but in this case the duration of treatment was not significant in the cell accumulation in Sub-G1.
Conclusions: Altogether these results show the differential potential of the extracts on the cell cycle of the evaluated leukemoid cell lines.
Key words: clonegenicity, cell cycle, cytotoxicity, Colombian marine sponges.
INTRODUCCIÓN
La esponja marina Leucetta aff. floridana de la clase Calcárea habita en aguas superficiales en zonas tropicales y constituye una de las cinco especies del género Leucetta.1 Los estudios químicos preliminares de los extractos metanólico, clorofórmico y hexánico de esta especie, revelaron la presencia de esteroles no identificados2 y actividad antimicrobiana contra Escherichia coli, Staphyloccocus aureus y Candida albicans.3 Un estudio más reciente mostró que los compuestos presentes en las fracciones obtenidas del extracto etanólico mostraban actividad antiproliferativa en líneas tumorales de pulmón (A549), colon (HT29) y mama (MDA-MB-231).4 El análisis químico de las fracciones obtenidas del etanólico reveló la presencia de compuestos con potencial efecto antiproliferativo tales como el ácido hexadecanoico, el ácido-9-hexadecenoico y el ácido 9,12,15-octadecatrienoico. De manera adicional, se reportó por primera vez la presencia de nueve ácidos grasos C15-C20 en esta especie que clasifican como ácidos saturados, saturados-ramificados e insaturados.4
El estudio también mostró una actividad antiproliferativa diferencial de los compuestos de L. aff. floridana en las tres líneas tumorales de pulmón, cáncer y mama.4 Sin embargo, esta actividad no ha sido explorada en otras líneas tumorales y se desconoce si este potencial antiproliferativo está relacionado con la progresión de células a través del ciclo celular. Esta información es importante en el tamizaje preliminar de compuestos aislados de nuevas fuentes biológicas en el desarrollo de fármacos para el tratamiento de células cancerosas quimiorresistentes.
Con el propósito de obtener evidencias sobre el potencial antiproliferativo, anticlonogénico y efecto sobre el ciclo celular se evaluaron los extractos hexánico y metanólico de la esponja L. aff floridana del Caribe colombiano en líneas celulares leucemoides Jurkat y K562.
MÉTODOS
Recolección y clasificación taxonómica de la esponja
Las muestras de la especie L. aff. floridana fueron recolectadas mediante buceo autónomo en el Golfo de Urabá (Colombia) a una profundidad de 15-21 m en el 2002; luego se limpiaron cuidadosamente y posteriormente se conservaron a una temperatura de 4 ºC y protegidas de la luz. La especie fue identificada por el doctor Sven Zea, y una parte de la muestra se encuentra en el Laboratorio de Productos Naturales de la Universidad de Antioquia.
Preparación de los extractos
Cada muestra de esponja húmeda fue cortada en pequeños pedazos, y posteriormente extraída exhaustivamente con solventes de diferente polaridad (metanol y n-hexano). El extracto fue filtrado y posteriormente evaporado a sequedad con presión reducida y agitación constante a una temperatura menor a 40 ºC. Los extractos secos obtenidos se conservaron refrigerados, protegidos de humedad y luz.
Cultivos celulares
Todos los ensayos biológicos se realizaron en cultivos exponenciales de las líneas celulares leucemoides humanas Jurkat (linfoide, ATCC TIB-152) y K-562 (mieloide, ATCC CCL-243), ampliamente utilizadas a nivel internacional. Los cultivos celulares se mantuvieron y propagaron a 37 ºC en atmósfera húmeda con 5 % de CO2, en medio de cultivo RPMI 1640 (Sigma), suplementado con suero bovino fetal (10 %) (Sigma), penicilina (100 mg/mL), estreptomicina (100 µg/mL) y L-glutamina (200 µM) (Sigma).
Evaluación de viabilidad y proliferación celular
Se evaluó a través del ensayo de azul de tripano mediante conteos celulares periódicos a las 24, 48, 72 y 96 h después de una siembra inicial de 0,75-1,0 × 105 células/mL en cultivos cuadruplicados. El porcentaje de viabilidad se calculó mediante el método estándar de conteo en 40X del número de células vivas (no coloreadas) sobre el número total de células (células no coloreadas o dañadas + células coloreadas) × 100. Los controles negativos fueron los cultivos paralelos expuestos a los solventes hexano y metanol al 1 %, durante los tiempos mencionados. Los resultados se informaron como porcentaje de viabilidad con respecto al control, y mediante el programa Stat Graphics Plus 4.1 se realizó un análisis de varianza (ANOVA). Simultáneamente se evaluó la proliferación celular a los mismos tiempos indicados, y a las concentraciones de 0,1, 1, 10 y 100 µg/mL de medio.
Evaluación de clonogenicidad
De los resultados obtenidos en los ensayos de viabilidad y proliferación, se escogieron las concentraciones de 10 y 100 µg/mL para los tratamientos de eficiencia de clonación en agar blando para células no adherentes, el cual permite determinar el número de células capaces de formar colonias y por tanto, estimar la capacidad de formar colonias. El procedimiento realizado con cada línea celular, consistió en lo siguiente: después de tratamientos de 0, 24, 48 y 72 h, se sembraron alícuotas de cada línea celular a bajas densidades (1 000 células/mL) sobre una capa delgada (4 mm) de agar blando (Sigma A7002) al 0,4 %. Luego de 10-12 días de incubación se contabilizaron las colonias presentes en 10 campos al azar, en cada caja de Petri de 60 mm. Los controles negativos de cada experimento con los solventes evaluados, permitieron calcular la eficiencia de clonación relativa. El conteo se realizó bajo microscopio invertido a una magnificación de 40X.
Evaluación de efectos en el ciclo celular
El efecto de los extractos sobre la distribución de fases del ciclo celular, se evaluó en experimentos duplicados independientes, a las mismas concentraciones (10 y 100 µg/mL) empleadas en los ensayos de clonogenicidad pero únicamente a las 72 y 96 h de tratamiento. Las células colectadas fueron fijadas con etanol (70 %), tratadas con RNAsa (Sigma), teñidas con yoduro de propidio (Sigma) y leídas en citómetro de flujo Coulter Epics (canal FL3). Los resultados obtenidos fueron automáticamente graficados con base en el registro de 10 000 eventos por muestra vs. cantidad relativa de DNA por célula. Para la comparación por pares de tratamiento se utilizó la prueba de Tukey, y los análisis de significancias de efectos entre líneas celulares, concentraciones de extractos y duraciones de los tratamientos, se realizaron mediante ANOVAS multifactoriales, previa verificación de los supuestos de normalidad y homogeneidad de varianza.
RESULTADOS
Determinación de la IC50 de los extractos hexánico y metanólico
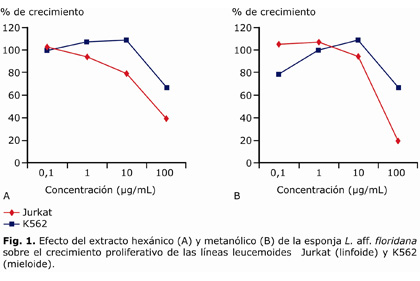
Los resultados mostraron que el extracto hexánico disminuyó 20 y 61 % la proliferación de células Jurkat a las concentraciones de 10 y 100 µg/mL, respectivamente; mientras el crecimiento de las células K562 se disminuyó en un 40 % solamente a la concentración de 100 µg/mL (Fig. 1) (A). De otro lado, el extracto metanólico disminuyó 80 y 31 % la proliferación de células Jurkat y K562 respectivamente, en la concentración de 100 µg/mL (Fig. 1) (B). De estas evaluaciones, se obtuvo que la IC50 del extracto hexánico fue de 66 µg/mL y del extracto metanólico 60 µg/mL para células Jurkat, y mayor de 100 µg/mL para células K562 con ambos extractos.
Ensayo de clonabilidad en suspensión
Estos resultados mostraron que el extracto hexánico disminuyó la clonabilidad de las células Jurkat al 80 y 40 % con las concentraciones de 10 y 100 µg/mL, respectivamente a las 24 h después del tratamiento (Fig. 2) (A). Las células K562 redujeron su eficiencia de clonación al 8 y 60 % a las 24 h después del tratamiento con las mismas concentraciones (Fig. 2) (B). Además, a las 48 h ambas concentraciones redujeron la clonabilidad en un 60 %. Por otro lado, el extracto metanólico disminuyó la clonabilidad de células Jurkat al 60 y 40 % en las concentraciones de 10 y 100 µg/mL, respectivamente (Fig. 3) (A). Con ambas concentraciones las células K562 redujeron su eficiencia de clonación al 40 % a las 24 h de tratamiento (Fig. 3) (B).
Efecto del extracto hexánico sobre el ciclo celular
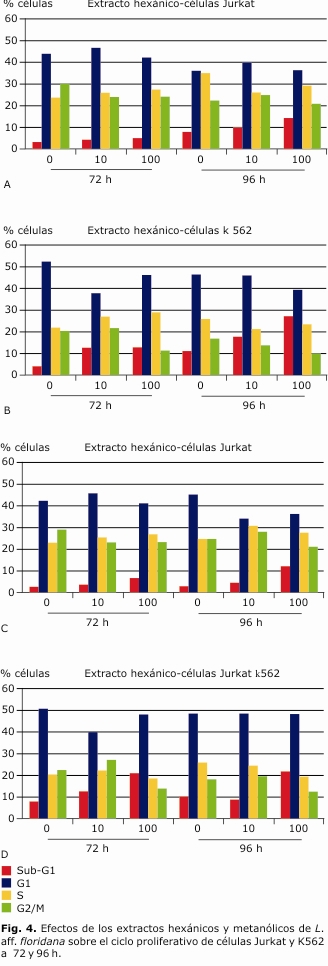
Los análisis de varianza utilizados para contrastar el efecto de los tratamientos en cada fase del ciclo celular, mostraron que el extracto hexánico promovió la acumulación gradual de células Sub-G1 en las dos concentraciones evaluadas (tabla 1, Fig. 4) (A) y (B). Las diferencias en el porcentaje de células Sub-G1 fueron significativas en los dos tipos celulares (Jurkat y K562), la duración de los tratamientos (T) y las dosis del extracto, pero las interacciones entre estos factores no fueron significativas (tabla 1, Fig. 4) (A) y ( B).
Las células K562 mostraron un porcentaje significativamente mayor de acumulación (13,9 %) que las células Jurkat (6,5 %) en esa subfase. Adicionalmente, para las células Jurkat, la acumulación a las 96 h fue significativamente mayor que a las 72 h (F1,5: 21,42; p= 0,044), mientras que para las células K562 no hubo diferencias en los mismos períodos (F1,5: 9,40; p= 0,092) (Fig. 4) (A) y (B). La comparación por pares de tratamientos utilizando la prueba de Tukey, indicó que el porcentaje de células Sub-G1 en la concentración de 100 µg/mL fue significativamente mayor que en los controles (diferencia: -8,5, intervalo ± 5,921).
Efecto de extracto metanólico sobre el ciclo celular
El extracto metanólico mostró efecto similar al del extracto hexánico, excepto que las diferencias en el porcentaje celular en Sub-G1 no cambió respecto a la duración de los tratamientos en ambas líneas celulares (tabla 2, Fig. 4) (C) y (D). En la concentración de 100 µg/mL de este extracto, la fracción Sub-G1 fue significativamente mayor que en los controles (diferencia: -9,6; intervalo ± 8,538). De otro lado, y aunque la duración de los tratamientos no generó efectos significativos, si se observó efecto de las concentraciones en la acumulación en Sub-G1, siendo significativamente mayor a 100 µg/mL que con 10 µg/mL (diferencia: -8,05, intervalo ± 4,732).
DISCUSIÓN
Los resultados más relevantes de este trabajo indican que los extractos hexánico y metanólico de la esponja L. aff. floridana mostraron actividades antiproliferativa y anticlonogénica relacionadas con un efecto de acumulación de células en Sub-G1 en ambas líneas celulares.
El efecto antiproliferativo de ambos extractos fue mayor en células Jurkat (IC50: y 60 µg/mL para los extractos hexánico y metanólico, respectivamente) que en células K562 (> 100 µg/mL para ambos extractos), lo que refleja una sensibilidad diferencial de las líneas celulares a los componentes presentes en los extractos. Un resultado similar se encontró con las líneas tumorales de mama, colon y pulmón en que también se detectó un efecto diferencial entre las líneas celulares.4
Los datos muestran que el extracto hexánico afectó la capacidad de clonación de las células Jurkaty en menor proporción a las células K562, mientras que el extracto metanólico afectó ambas líneas celulares leucemoides. Estos resultados concuerdan con los ensayos de citotoxicidad, excepto en las células K562, en que el bajo efecto sobre la proliferación a corto plazo contrasta con el potente efecto anticlonogénico observado (Fig. 3) (B). Esta discrepancia, podría indicar que el extracto metanólico no genera una muerte celular inmediata (no detectada con azul de tripano) sino un daño latente que afecta la capacidad de las células para formar colonias posteriormente. Cabe recordar que la viabilidad celular evaluada mediante exclusión de colorante vital, se asocia primordialmente con daños a nivel de permeabilidad de membrana, pero no descarta otro tipo de efectos biológicos. De ahí que existan varias metodologías para evaluar viabilidad celular paralelas a la laboriosa, pero informativa prueba de clonogenicidad.
Por otro lado, el efecto sobre el ciclo celular mostró acumulación en la fase Sub-G1 en ambas líneas leucemoides, en modo dependiente de la concentración y el tiempo, y mayor en células K562 que en Jurkat, aun en el extracto hexánico en el que parece menor la inhibición de la proliferación. Cabe anotar que la derivación de células hacia Sub-G1 no parece estar asociada a efectos sobre las fases G1, S y G2/M; sin embargo, la información obtenida por citometría de flujo no permite diferenciar si las células afectadas en cada fase ingresan a Sub-G1 o si lo hacen luego de transitar por las otras fases.
También cabría pensar que la acumulación de células en Sub-G1 podría reflejar daños relacionados con el desensamble de microtúbulos requerido para continuar al siguiente ciclo celular, mecanismo informado para algunos compuestos citotóxicos obtenidos de fuentes marinas, especialmente esponjas.5 No obstante los anteriores informes, la actividad antibacteriana de los extractos de la esponja L. aff. floridana,3 sugiere un mecanismo diferente al desensamble del huso mitótico, sin descartar que pueda ejercer algún efecto sobre el citoesqueleto celular.
Otra explicación alternativa es que la acumulación celular en la fase Sub-G1 sea una fracción específica de células proapoptóticas.6 Esta idea está apoyada en estudios realizados en fracciones obtenidas a partir del extracto etanólico de L. aff. floridana en que se evidenció la presencia de alcaloides y ácidos grasos con potencial actividad inhibitoria de la Topoisomerasa I.4,7Al respecto, se ha descrito que el ácido hexadecanoico (ácido palmítico) tiene actividad citotóxica selectiva contra células de leucemia humana entre 12,5 y 50 µg/mL e induce apoptosis en la línea celular leucémica MOLT-4 a una concentración de 50 µg/mL y además presenta actividad antitumoral in vivo en ratones.8 De manera adicional, se ha mostrado que el alcaloide imidazólico naamina aislado de la esponja Leucetta chagosensis produce bloqueo del ciclo celular en la fase G1 en células A431 a una concentración de 1,56 µM por activación sostenida de la señal extracelular regulada por la quinasa ERK.9
En resumen, los resultados muestran que la actividad antiproliferativa y anticlonogénica de los extractos afectan la cinética de proliferación celular en ambas líneas leucemoides. Sin embargo, estos extractos con alta complejidad desde el punto de vista químico, requieren de estudios adicionales para identificar el o los compuestos responsables de la actividad biológica observada.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al taxónomo doctor Sven Zea, profesor de la Universidad Nacional de Colombia por la identificación de la esponja. También agradecen el apoyo financiero del Proyecto de Sostenibilidad del Grupo de Genética de Poblaciones y Mutacarcinogénesis de la Universidad de Antioquia y a la Dirección de Investigaciones de la Universidad Nacional de Colombia Sede Medellín (DIME) por la financiación de este proyecto (Código 30802948).
REFERENCIAS BIBLIOGRÁFICAS
1. Borojevic R, Boury-Esnault N, Manuel M, Vacelet J. Order Clathrinida Hartman, 1958. In: Hooper JNA, van Soest RWM, eds. System porífera: A guide to the classification of sponges. New York: Kluwer Academic/Plenum Publishers; 2002. p. 1141-52.
2. Bergmann W. Comparative biochemical studies on the lipids of marine invertebrates, with special reference to the sterols. J Mar Res. 1949;8:137-76.
3. Galeano E, Martínez A. Antimicrobial activity of marine sponges from Uraba` Gulf, Colombian Caribbean region. J Mycol Med. 2007;17:21-4.
4. Márquez DM, Thomas O, Martínez A, Márquez EJ. Antiproliferative effect of extracts and fractions from the calcareous sponge Leucetta aff. floridana from the Colombian Caribbean. Lat Am J Pharm. 2011;30:683-9.
5. Carnero A. Targeting the cell cycle for cancer therapy. Br J Cancer. 2002;87:129-33.
6. James RD, Jones DA, Aalbersberg W, Ireland CM. Naamidine A intensifies the phosphotransferase activity of extracellular signal-regulated kinases causing A-431 cells to arrest in G1. Mol. Cancer Ther. 2003;2:747-51.
7. Márquez D. Estudio químico y evaluación biológica de esponjas marinas del Caribe Colombiano. [Tesis de Doctorado]. Medellín, Colombia: Universidad de Antioquia: 2010. 122 p.
8. Harada H, Yamashita U, Kurihara< H, Fukushi E, Kawabata J, Kamei Y. Antitumor activity of palmitic acid found as a selective cytotoxic substance in a marine red alga. Anticancer Res. 2002;22:2587-90.
9. Dunbar DC, Rimoldi JM, Clark AM, Kelly M, Hamann MT. Anti-cryptococcal and nitric oxide synthase inhibitory imidazole alkaloids from the calcareous sponge Leucetta cf chagosensis. Tetrahedron. 2000;56:8795-8.
Recibido: 5 de abril de 2012.
Aprobado: 2 de junio de 2012.
Diana Margarita Márquez Fernández. Universidad de Antioquia. Calle 57 No. 53-108, Bloque 2, Laboratorio 131. Apartado Aéreo 1226. Medellín, Colombia. Correo electrónico: dmarquez@farmacia.udea.edu.co