My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515
Rev Cubana Farm vol.47 no.4 Ciudad de la Habana Dec. 2013
ARTÍCULO ORIGINAL
Determinación simultánea de clorhidrato de dorzolamida y maleato de timolol en el colirio
Simultaneous determination of Dorzolamide Chlorhydrate and Timolol Maleate
Lic. Jacqueline Aylema Romero Díaz, Lic. Marisleydi Begue David, MSc. Armando Gato del Monte
Centro de Investigación y Desarrollo de Medicamentos. La Habana, Cuba.
RESUMEN
Objetivo: desarrollar y validar un método analítico por cromatografía líquida de alta resolución, aplicable al control de la calidad y estudio de estabilidad de dorzolamida 2 % y timolol 0,5 % en el colirio.
Métodos: para cuantificar simultáneamente los dos principios activos en el producto terminado, la separación se realizó a través de una columna cromatográfica Luna RP-18 (5 µm) (250 x 4 mm), con un detector de arreglo de fotodiodos a 254 y 295 nm, empleando un gradiente con fase móvil A compuesta por acetonitrilo: buffer fosfato pH 2,5: metanol (5:85:10) y fase móvil B: metanol, y la cuantificación de este frente a una muestra de referencia con el método del estándar externo.
Resultados: en el estudio de linealidad, los coeficientes de correlación y de determinación obtenidos estuvieron por encima de 0,99 y 0,98 respectivamente. Los porcentajes de recobrado fueron de 99,57 para la dorzolamida y 99,93 para el timolol, con un coeficiente de variación para ambos principios activos inferior al 2 %. En el estudio de repetibilidad realizado, las medias obtenidas fueron de 99,1 % para la dorzolamida y 100,4 % para el timolol, y los coeficientes de variación se encontraron dentro de los límites. En el estudio de precisión intermedia, los valores de p resultaron ser mayores que 0,05, para cada uno de los niveles estudiados
Conclusiones: el método analítico desarrollado resulta lineal, preciso, específico y exacto en el rango de concentraciones estudiadas, el cual se establece para el control de la calidad y el estudio de estabilidad del producto terminado ya que no existen métodos analíticos informados para estos fines.
Palabras clave: validación, dorzolamida, timolol.
ABSTRACT
Objective: to develop and validate an analytical high-performance liquid chromatography method applicable to quality control and to stability study of 2 % Dorzolamide plus 0.5 %
Timolol eye drops.
Methods: to simultaneously quantify both active principles in the finished product, separation was made through a Luna RP-18 (5 µm) (250 x 4 mm) column chromatography, with photodiode array detector at 254 nm an 295nm using a gradient with mobile phase A composed of acetonitrile: phosphate buffer pH 2.5: methanol (5:85:10) and mobile phase B: methanol and the quantification of this front to a reference sample using the external standard method.
Results: in the linearity study, the correlation and determination coefficients were above 0.99 and 0.98 respectively. The percentages of having recovered were 99.57 for Dorzolamide and 99.93 for Timolol, with a variation coefficient for both active principles under 2 %. In the repeatability study, the means were 99.1 for Dorzolamide and 100.4 % for Timolol and the variation coefficients were within the set limits. In the study of intermediate precision, p values were higher than 0.05 for each of the studied levels.
Conclusions: the developed analytical method was linear, precise, specific and accurate in the range of study concentrations; it is established for the quality control and stability study of the finished product since there were not analytical methods designed for these aims.
Key words: validation, Dorzolamide, Timolol.
INTRODUCCIÓN
La combinación de dorzolamida y timolol se usa para tratar las afecciones de los ojos, incluyendo glaucoma e hipertensión ocular, en la que un aumento de la presión puede llevar a la pérdida gradual de la visión.1
La dorzolamida es un inhibidor de la anhidrasa carbónica y el timolol un antagonista de receptores beta adrenérgicos;2 la combinación de ambos tiene un efecto aditivo en la disminución de la presión intraocular.1
El referido medicamento se usa en aquellos pacientes cuya condición no ha respondido a otro tipo de medicamentos. La combinación de dorzolamida y timolol disminuye la presión en el ojo al reducir la producción de líquidos naturales en el ojo.
En la literatura se refieren métodos de análisis para el clorhidrato de dorzolamida materia prima y para el maleato de timolol en el colirio.3 Sin embargo, no se informan métodos por cromatografía líquida de alta resolución (CLAR), para la determinación simultánea de dorzolamida y timolol en el colirio.
La CLAR le brinda la posibilidad al analista de emplear esta herramienta para solucionar los inconvenientes de los métodos espectrofotométricos en los estudios de estabilidad, pues además de presentar una alta sensibilidad y exactitud, es en esencia un método separativo; lo que permite medir con gran selectividad el compuesto deseado, siempre y cuando se encuentre un sistema cromatográfico que asegure una adecuada separación.4,5
La validación es el proceso establecido para la obtención de pruebas documentadas de que el método es lo suficientemente fiable para producir el resultado esperado.6,7
Este trabajo tiene el objetivo desarrollar y validar un método analítico por cromatografía líquida de alta resolución, aplicable al control de la calidad y estudio de estabilidad de dorzolamida 2 % y timolol 0,5 % en el colirio.
MÉTODOS
Las sustancias de referencia química de clorhidrato de dorzolamida y maleato de timolol se suministraron por el grupo de sustancias de referencia del Centro de Investigación y Desarrollo de Medicamentos (CIDEM, La Habana, Cuba), las cuales se analizaron por los métodos cromatográficos establecidos7 para realizar el control de la calidad de cada una de las materias primas, con una pureza de 99,0 y 99,6 %, respectivamente. El producto terminado en forma de colirio, se elaboró en la Empresa Farmacéutica «Julio Trigo», identificado como el lote 09002, fabricado en diciembre del 2009, que cumplió con las especificaciones de calidad establecidas para el control de la calidad de los colirios.
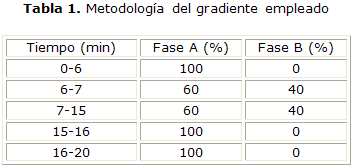
Para la determinación de los principios activos, se utilizó un sistema cromatográfico compuesto por una bomba Smartline-1000 conectada a un detector de Arreglo de Fotodiodos 2600 (Knauer, Alemania.), con un volumen de inyección de 20 µL y la señal procesada por el software ClarityChrom. La fase móvil óptima, luego de realizar diferentes combinaciones de las informadas en la literatura, para la materia prima en el caso del clorhidrato de dorzolamida y para el colirio de maleato de timolol, consistió en una mezcla desgasificada de acetonitrilo:buffer fosfato pH 2,5:metanol (5:85:10) (v/v/v) como fase móvil A y metanol como fase móvil B. Para la separación cromatográfica se utilizó una columna de Luna, 5 µm RP C18, 250 x 4,0 mm. Se establecieron longitudes de onda de 254 y 295 nm. La elución se realizó mediante el gradiente que se muestra en la tabla 1.
Los reactivos utilizados fueron de calidad analítica.
Preparación de la muestra: se preparó una solución que contenía 100 µg/mL de dorzolamida y 25 µg/mL de timolol en fase móvil A.
Preparación de la sustancia de referencia química timolol más dorzolamida: se prepararon dos soluciones A y B.
Preparación de la muestra placebo: se preparó una solución que contenía los excipientes declarados para la formulación en estudio, respetando las proporciones propuestas por el fabricante sin añadir los ingredientes activos.
- Solución A: se pesaron 17,1 mg de muestra de referencia de maleato de timolol y se transfirió a un matraz aforado de 25 mL; se añadieron 10 mL de fase móvil A y se aplicó ultrasonido por 10 min hasta disolución. Se completó el volumen con fase móvil A y se homogenizó.
- Solución B: se pesaron 11,12 mg de muestra de referencia de clorhidrato de dorzolamida y se trasvasó a un matraz aforado de 100 mL; se añadieron 20 mL de fase móvil A y se aplicó ultrasonido durante 10 min hasta disolución. Se transfirieron 5 mL exactamente medidos de la solución A y se completó el volumen con fase móvil A.
VALIDACIÓN DEL MÉTODO ANALÍTICO
La validación fue realizada según la categoría II de la USP 30 y la Regulación 41/2007 Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED); se evaluaron los parámetros que a continuación se describen:
Linealidad: se prepararon placebos, los cuales se cargaron con 5 concentraciones diferentes: 60, 80, 100,120, y 140 % de cada uno de los principios activos a cuantificar; se realizaron tres determinaciones para cada uno de los niveles. Se determinaron las ecuaciones de las rectas, los coeficientes de correlación, las pruebas de significación estadística de significación de la pendiente Sb rel (%) y los coeficientes de variación de los factores de respuesta.
Exactitud: se realizaron tres réplicas con muestras placebo cargadas con 3 concentraciones diferentes: 80, 100, 120 %, de cada uno de los metabolitos a cuantificar; se determinaron los % de recuperación, las desviaciones estándar y los coeficientes de variación. Se determinaron además las pruebas de Cochram con vistas a comprobar si la variación de la concentración produce diferencias significativas en los resultados y las pruebas de la t de Student para la determinación de las diferencias significativas entre la recuperación media y el 100 %.
Precisión: se realizaron seis réplicas para el estudio de repetibilidad para la dorzolamida y el timolol con placebos cargados con la concentración equivalente al 100 % para cada uno de los metabolitos a evaluar. Con ellas se determinaron los valores medios, la desviación estándar y el coeficiente de variación.
De igual manera para los ensayos de la precisión intermedia se utilizaron 3 niveles de concentración que corresponden al 80, 100 y 120 %, para 2 analistas y 3 días diferentes. Se utilizó el programa estadístico Stargraphic plus versión 4,1 para determinar si existían diferencias significativas entre los resultados al variar las condiciones de análisis.
Especificidad: se analizaron la sustancia de referencia de dorzolamida, la sustancia de referencia de timolol, el placebo sin timolol y sin dorzolamida, el placebo sin timolol y con dorzolamida, el placebo con timolol y sin dorzolamida; las muestras de producto terminado y muestras sometidas a condiciones drásticas como: hidrólisis ácida HCl 5 N, hidrólisis básica NaOH 1 N, oxidación con peróxido de hidrógeno y exposición a la luz solar. No deben obtenerse señales de los placebos y de los productos de degradación en la zona de elución del principio activo a cuantificar. Las áreas bajo las curvas de los patrones, así como los tiempos de retención de los principios activos a cuantificar, en el producto terminado deben ser similares.
Límite de detección y cuantificación: además de las concentraciones utilizadas en la linealidad, se trabajaron con concentraciones menores: 10, 20 y 30 % de cada uno de los principios activos a cuantificar por triplicado. Se realizaron las curvas de respuesta (mAU) vs. concentración (µg/mL) y desviación estándar vs. concentración y en ambos casos se extrapoló la respuesta a concentración cero y se obtuvo un estimado de la respuesta blanco. Además se analizaron por triplicado placebos cargados con cantidades cercanas a los límites calculados. Se determinó media y desviación estándar.
RESULTADOS
En la tabla 2 se presentan los resultados del estudio de la linealidad del sistema; para la dorzolamida y el timolol.
Los resultados del estudio de precisión del método desarrollado aparecen informados en las tablas 3, 4 y 5. En el estudio de repetibilidad realizado para la dorzolamida y el timolol, las medias obtenidas fueron de 99,1 y 100,4 % y los coeficientes de variación fueron de 0,66 y 0,33 %, respectivamente. En el estudio de precisión intermedia los valores de p resultaron ser mayores que 0.05, para cada uno de los niveles estudiados; también se identificaron grupos homogéneos formados por las medias obtenidas en los diferentes días. La comparación entre las medias obtenidas por los diferentes analistas mostró valores de p de 0,96; 0,65 y 0,70 para el 80, 100 y 120 % de la concentración de dorzolamida respectivamente. En el caso del timolol los valores fueron de 0,37; 0,66 y 0,08.
La figura muestra los resultados obtenidos en el estudio de especificidad del método. El pico correspondiente a la dorzolamida posee un tiempo de retención de 5,35 min y el del timolol de 10,5 min. Como se observa en el cromatograma correspondiente a la muestra placebo, no se obtuvo ninguna señal en las zonas de interés, al ser comparado con la señal obtenida para las soluciones estándar de referencias y de la muestra de colirio, lo cual indica que los excipientes o sustancias auxiliares de la solución no interfieren en la determinación de los principios activos. En cuanto a las muestras sometidas a condiciones drásticas de oxidación, hidrólisis ácida, hidrólisis básica y exposición a la luz, se aprecia degradación por la disminución de la altura de los picos de los principios activos, pero no se observa la aparición de picos secundarios, excepto en el caso de las muestras degradadas por oxidación, en las que se observa un pico a los 2,0 min que corresponde al peróxido utilizado en el tratamiento de las muestras.
En la tabla 5 aparecen informados los resultados del estudio de exactitud. Para la dorzolamida, la recuperación media fue de 99,57 % y el valor de t experimental (1,57) y de G experimental (0,545) resultaron menores que los valores tabulados, t tabulada 2,03 para un 95 % de confianza y G tabulada 0,797 para un 95 % de confianza, k= 3 y n= 3. Mientras que para el timolol, la recuperación media fue de 99,93 % y el valor de t experimental (0,96) y de G experimental (0,641) resultaron menores que los valores tabulados para un 95 % de confianza.
El límite de cuantificación fue de 1,708 y 0,347 µg/mL para la dorzolamida y el timolol respectivamente. En cuanto al límite de detección resultó 1,258 y 0,316 µg/mL. La recuperación promedio fue de 99,15 % con una DE de 0,21 % para la dorzolamida y de 98,5 % con una desviación estándar de 0,86 % para el timolol.
DISCUSIÓN
Según lo informado en la literatura en el caso de la dorzolamida en solución alcalina puede aparecer el diateroisómero cis y en condiciones de extrema alcalinidad aparece además un derivado del ácido sulfónico, productos de degradación que se incrementan cuando se almacena a elevadas temperaturas. También está reportado que la exposición a la luz provoca la aparición de un análogo de la dorzolamida desacetilado.8 En este estudio se observa una disminución del pico en ambos casos, pero los productos de degradación no interfieren en la determinación del principio activo.
El timolol pierde potencia al ser expuesto a la luz ultravioleta y ante condiciones oxidantes. Los mecanismos de degradación propuestos son: (i) la pérdida de un grupo éter, (ii) su reordenamiento obteniéndose el isotimolol, (iii) la oxidación de la molécula y posterior pérdida del grupo éter.8 Este último puede ser el que se evidencia en la muestra tratada con peróxido donde desaparece la señal correspondiente al timolol .Ante el resto de las condiciones estudiadas se observa degradación del compuesto por disminución del pico correspondiente al principio activo, pero al igual que para la dorzolamida los productos de degradación que se forman no interfieren en la cuantificación del mismo.
Los resultados obtenidos (Fig.), demuestran que este método es específico.
Los resultados de los estudios de linealidad muestran coeficientes de correlación y de determinación superiores a los exigidos, 0,99 y 0,98 respectivamente, lo que demuestra con el valor del coeficiente de correlación obtenido, cercano a la unidad, la existencia de correlación con una probabilidad elevada, así como el grado de relación entre las variables concentración y respuesta detectada por el equipo empleado. También el coeficiente de variación de los factores de respuesta y la desviación estándar relativa de la pendiente fueron inferiores al normado como máximo para estos indicadores: 5 y 2 %, respectivamente; ambos son considerados estimadores puntuales que permiten caracterizar la variabilidad. El valor obtenido de los coeficientes de variación de los factores de respuesta, permite demostrar que existe variabilidad en la relación respuesta y concentración para cada nivel evaluado. El intervalo de confianza del intercepto incluye al cero, lo que permite excluir la significación del error del intercepto. Se demuestra con los resultados obtenidos la linealidad del método propuesto.
En los estudios de la repetibilidad realizado a una misma muestra, por el mismo analista, el mismo día, a través de seis réplicas, se alcanzaron coeficientes de variación de 0.66 % para la dorzolamida y 0.33 % para el timolol, mostrando que la variabilidad de los resultados se encuentra dentro de los límites establecidos para los métodos cromatográficos: CV£ 2,0 %.
En los estudios de precisión intermedia (tablas 3 y 4) los p-valores comprueban la importancia estadística de cada uno de los factores (días y analistas). Dado que ningún p-valor es inferior a 0.05, ninguno de los factores o interacciones tienen efecto estadísticamente significativo en la variable concentración. Además se aplica un procedimiento de comparación múltiple para determinar las medias que son significativamente diferentes unas de otras (procedimiento de las menores diferencias significativas de Fisher), lo cual demuestra que no hay diferencias estadísticamente significativas entre las medias obtenidas, los diferentes días, para un nivel de confianza del 95,0 %.
También se compararon las medias obtenidas por los diferentes analistas, y los valores de p obtenidos para cada nivel de concentración resultaron mayores que 0,05.
Los valores de porcentaje de recobro estuvieron dentro de los límites establecidos para los métodos cromatográficos (98-102 %) y los valores del coeficiente de variación para cada uno de los niveles de concentración estudiados resultaron ser menor que el 2 %. En la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud al aplicar la prueba de Cochran se obtuvo que las G experimentales fueron menores que la G tabulada para un 95 % de confianza, k= 3 y n= 3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes, lo que indica que la concentración no influye en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, los coeficientes de variación fueron: dorzolamida de 0,83 % y timolol de 0,21 %, los valores de t experimental resultaron menores que la t tabulada. En el rango seleccionado en el estudio de exactitud, los valores de porcentaje de recobro están dentro de los límites establecidos para los métodos cromatográficos (98-102 %) y los valores del coeficiente de variación, para cada uno de los niveles de concentración estudiados, fueron menores que el 2 %.
El método fue suficientemente sensible para el propósito con que fue desarrollado, pues es capaz de cuantificar una cantidad equivalente al 99,99 % de degradación en el caso de la dorzolamida y 98,61 % para el timolol.
El método analítico desarrollado y validado para el control de la calidad y el estudio de estabilidad del colirio de dorzolamida clorhidrato y timolol maleato en el colirio al 2 y 0,5 % respectivamente, resultó lineal, preciso, específico y exacto.
REFERENCIAS BIBLIOGRÁFICAS
1. Toris CB, Zhan GL, Yablonski ME. Effects on aqueous flow of dorzolamide combined with either timolol or acetazolamide. lamide. J Glaucoma. 2004;13 (3):210-5.
2. Kiland JA, Gabelt BT, Kaufman PL. Studies on the mechanism of action of timolol and on the effects of suppression and redirection of aqueous flow on outflow facility. Exp Eye Res. 2004;78(3):639-51.
3. Farmacopea de los Estados Unidos. USP 34. The United States Pharmacopeial Convention. Versión electrónica. New York: Pharm Convention; 2011.
4. Dierksneier G. Métodos cromatograficos. La Habana: Ed. Científico-Técnica; 2005. p. 1-4, 256-412.
5. Guidance for Industry. Analytical Procedures and Methods Validation Chemistry, Manufacturing, and Controls Documentation. New York: FDA/Center For Drug Evaluation and Research; 2001.
6. International Conference on Harmonization. Validation of Analytical Procedures. Technical Requirements for the Registration of Pharmaceuticals For Human Use. Geneva: ICH-Q2A; 1995.
7. Farmacopea de los Estados Unidos. USP 30. The United States Pharmacopeial Convention. Versión electrónica. New York: Pharm Convention; 2007.
8. Colectivo de autores. Analytical Profiles of Drug Substances. vol 16. New Jersey: Klaus Florey,1987.
Recibido: 24 de junio de 2013.
Aprobado: 29 de agosto de 2013.
Jacqueline Aylema Romero Díaz. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1605 entre Boyeros y Puentes Grandes. CP 10600. Plaza de la Revolución, La Habana, Cuba.