Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.47 no.4 Ciudad de la Habana dic. 2013
PRODUCTO NATURAL
Evaluación de la actividad antioxidante de extractos de Palicourea guianensis (Rubiaceae)
Evaluation of antioxidant activity of Palicourea guianensis (Rubiaceae) extracts
Lic. Lina Marcela Giraldo Vásquez, Dr. C. Luz Stella Ramírez Aristizabal
Universidad Tecnológica de Pereira. Pereira-Risaralda, Colombia.
RESUMEN
Introducción: la proliferación de radicales libres en el cuerpo humano induce daños oxidativos a las biomoléculas que provocan daños a nivel celular y generan diversas anomalías en el organismo, como arterosclerosis, envejecimiento y cáncer. Actualmente, la búsqueda por moléculas con características antioxidantes es cada vez mayor, donde las plantas representan una de las principales fuentes de compuestos.
Objetivo: determinar la actividad antioxidante y el contenido de fenoles de los extractos de diferentes polaridades de la parte aérea de la especie Palicourea guianensis (Rubiaceae).
Métodos: para la evaluación de la actividad biológica, se calcularon los valores de concentración media inhibitoria (IC50) de los extractos más activos mediante los métodos de captura de electrones DPPH (2,2-difenil-1-picrilhidracilo) y ABTS (ácido 2,2'azinobis-(3-etilbenzotiazolina)-6-sulfónico). Adicionalmente, se determinó la concentración de fenoles totales presentes en los extractos a través del método de Folin-Ciocalteu.
Resultados: los extractos en acetato de etilo (PgAEF) y en agua (PgAF) presentaron mayor actividad antioxidante con valores de IC50 de 5 207 y 3 912 mg/L respectivamente. Asimismo, se observó una relación directamente proporcional entre la concentración de fenoles totales presentes en los extractos y la actividad antioxidante exhibida.
Conclusiones: las especies de la familia Rubiaceae, especialmente P. guianensis, son una fuente promisoria e importante de metabolitos secundarios con capacidad antioxidante, por lo cual se requieren de mayores estudios que permitan identificar dichas sustancias e integrarlas a programas de terapia antioxidante en el área de la salud.
Palabras clave: actividad antioxidante, Palicourea guianensis, DPPH, ABTS, Folin-Ciocalteu.
ABSTRACT
Introduction: the proliferation of free radicals in the human body induces oxidative damage to biomolecules that cause damage at the cellular level and can generate various abnormalities in the body, such as atherosclerosis, aging and cancer. Currently, the search for molecules with antioxidant properties is increasing, where the plants are a major source of compounds.
Objective: to determine the antioxidant activity and phenolic content of extracts of different polarities from the aerial part of Palicourea guianensis (Rubiaceae) species.
Methods: for evaluation of the biological activity, the values of the mean inhibitory concentration (IC50) of the most active extracts were estimated by the methods of electron capture DPPH (2,2-diphenyl-1-picrylhidracyl) and ABTS (2,2'azinobis-(3-ethylbenzothiazoline)-6-sulfonic acid). Additionally, the total phenol concentration present in the extracts was determined using the Folin-Ciocalteu reagent.
Results: the extracts in ethyl acetate (PgAEF) and in water (PgAF) showed higher antioxidant activity with IC50 values of 5 207 and 3 912 mg/L respectively. Furthermore, there was direct relationship between the concentration of total phenols present in the extracts and the antioxidant activity.
Conclusions: Rubiaceae family species, especially P. guianensis are a promising and important source of secondary metabolites with antioxidant capacity, so further studies are required to identify these substances and integrate them to the antioxidant therapy programs of the health areas.
Key words: antioxidant activity, Palicourea guianensis, DPPH, ABTS, Folin-Ciocalteu.
INTRODUCCIÓN
En las últimas décadas se han logrado avances significativos para obtener sustancias químicas o biológicas que sean menos tóxicas para el ambiente, el hombre, y más selectivas respecto a los propósitos que se persiguen. Uno de esos propósitos es encontrar formas naturales de prevenir la proliferación de radicales libres en el cuerpo humano, pues se ha demostrado que dichos radicales libres pueden inducir daños oxidativos a las biomoléculas y estos daños pueden causar diversas anomalías en el organismo, como arterosclerosis, envejecimiento, cáncer e incluso llegar a provocar daño a nivel celular.1 Esto ha despertado gran interés en la obtención de productos de origen natural que contribuyan al desarrollo de nuevos antioxidantes, que permitan combatir la proliferación de radicales libres en el organismo y que al mismo tiempo sean compatibles con el medio ambiente.
Por este motivo se desarrolló el presente estudio, centrado en la investigación de la planta Palicourea guianensis, una especie distribuida en países como México, Colombia, Venezuela, Brazil, Bolivia y Las Antillas.2 Esta pertenece a la familia Rubiaceae, del género Palicourea. Colombia es el país con mayor número de especies de este género con cerca de 130, presentes en todas las regiones y altitudes hasta las zonas de páramo; su mayor diversificación se localiza en la región andina entre los 1 000 y 2 000 m de altitud.3 Con este estudio se pretende contribuir con el conocimiento de las especies de este género, pues tanto la familia Rubiaceae, como el género Palicourea, presentan antecedentes en diferentes actividades biológicas, como antimicrobiana y antimicótica,4,5 razón por la cual se espera encontrar resultados positivos en la actividad antioxidante evaluada.
Constituye objetivo de este trabajo determinar la actividad antioxidante y el contenido de fenoles de los extractos de diferentes polaridades de la parte aérea de la especie Palicourea guianensis (Rubiaceae).
MÉTODOS
MATERIAL VEGETAL
Las hojas de P. guianensis se colectaron en el jardín botánico de la Universidad Tecnológica de Pereira el 24 de abril de 2009 y una muestra de este material fue enviado al Herbario Nacional de Colombia, en donde fue identificada con el registro COL 519790.
El material recolectado se dejó secar a temperatura ambiente por 8 días. Posterior a esto, se secó en estufa a 50 °C durante 2 h;6 finalmente las hojas secas se molieron y almacenaron.
OBTENCIÓN DE LOS EXTRACTOS
Se homogeneizaron 600 g del material almacenado, se dividió en 6 porciones de 100 g para facilitar la extracción. A cada porción se adicionó 6 L de metanol en porciones sucesivas de 1 L y se extrajo en el ultrasonido durante 20 min (Fisher Scientific, modelo FS60H). Finalmente se filtró a gravedad y se redujo el volumen mediante rotaevaporación hasta un total de 1,8 L. El extracto obtenido en metanol fue llevado a 2 L adicionando agua y fue fraccionado a través de extracciones líquido-líquido con diferentes solventes, obteniendo los extractos en: n-hexano, diclorometano, acetato de etilo y acuoso. Posteriormente se fraccionó el extracto acuoso con el empleo de una columna de DIAION HP-20, y se obtuvo un total de 17 fracciones.
DETERMINACIÓN DE FENOLES TOTALES
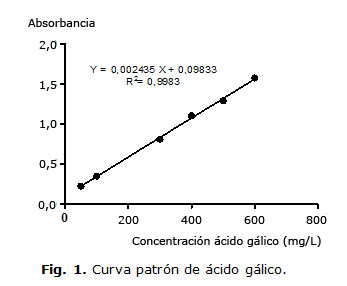
A cada una de las muestras se aplicó el siguiente procedimiento:7,8 50 µL de muestra más 250 µL de reactivo de Folin-Ciocalteu 1 N. Después de 1 min, se adicionó 750 µL Na2CO3 al 20 % (p/v) y se aforó a 5,0 mL con agua. Luego de 30 min de incubación a 25 °C, se midió absorbancia a 760 nm y se comparó con una curva de calibración usando soluciones patrón de ácido gálico (50-600 mg/L). El contenido de fenoles totales se determinó como los equivalentes de ácido gálico (GAE, miligramo de ácido gálico/gramo de extracto), y los valores se presentaron como la media de los datos del análisis realizado por triplicado.
DETERMINACIÓN DE LA ACTIVIDAD ANTIOXIDANTE
La evaluación de la capacidad de captura del radical libre DPPH se realizó según el método planteado por Brand-Williams y otros.9 La determinación de los porcentajes de inhibición de las muestras evaluadas se realizó según la expresión matemática:7
![]()
donde:
Am: absorbancia de las muestras
Abm: absorbancia del blanco de muestra
Ar: absorbancia de las soluciones de referencia
Abr: absorbancia del blanco de referencia.
La determinación de la actividad inhibidora del catión radical del ácido 2,2'azinobis-(3-etilbenzotiazolina)-6-sulfónico (ABTS•+) se realizó siguiendo metodología desarrollada por Re y otros10 y descrita por Kuskoski y otros,11 con algunas modificaciones, pues el ensayo de ABTS original estaba basado en la activación de la metmioglobina con peróxido de hidrógeno en presencia de ABTS para producir el catión radical en presencia o ausencia de antioxidantes. Este método ha sido criticado con la base de que antioxidantes con una acción rápida pueden contribuir a la reducción del radical ferrilo mioglobina, interfiriendo así con los resultados; un formato más apropiado para este ensayo es la técnica de decoloración del radical que es generado en su forma estable antes de entrar en contacto con el antioxidante a evaluar. La técnica mejorada para la generación de ABTS•+ comprende la producción directa del ABTS azul verdoso a través de la reacción entre el ABTS y persulfato potásico y posterior a esto, la reacción entre el radical formado y el antioxidante que se quiere evaluar.10
Posteriormente se calcularon los porcentajes de inhibición para cada muestra evaluada haciendo uso de la misma expresión matemática empleada para el análisis de la capacidad de captura del radical DPPH•.7
Los porcentajes de inhibición encontrados para cada una de las muestras se graficaron contra la concentración de extracto evaluado, y a partir de las ecuaciones obtenidas se determinó el valor de la concentración media inhibitoria (IC50) de cada extracto para cada metodología empleada.
RESULTADOS
DETERMINACIÓN DE FENOLES TOTALES
A partir de la curva patrón de ácido gálico, se determinó la concentración de fenoles totales presentes en las muestras (Fig. 1).
Los extractos en acetato de etilo (PgAEF) y en agua (PgAF) registraron una mayor concentración de fenoles totales (tabla 1).
CAPACIDAD DE CAPTURA DEL RADICAL LIBRE DPPH
Los extractos PgAEF y PgAF son los más activos pues necesitan de una menor cantidad de extracto para inhibir el 50 % del radical DPPH empleado en la evaluación (tabla 2).
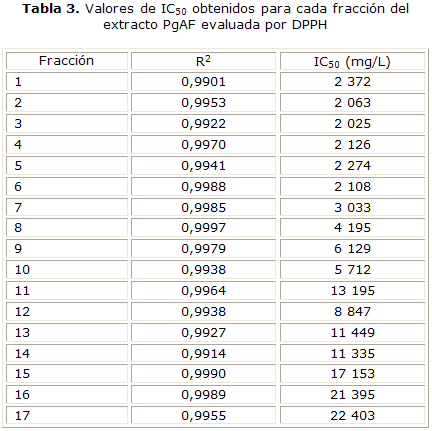
Las fracciones más activas corresponden a PgAF-2 y PgAF-3 pues presentaron los menores valores de IC50, mientras que las fracciones PgAF-16 y PgAF-17 corresponden a las menos activas debido a sus altos valores de IC50 (tabla 3).
ACTIVIDAD INHIBIDORA DEL CATIÓN RADICAL DEL ÁCIDO 2,2'AZINOBIS-(3-ETILBENZOTIAZOLINA)-6-SULFÓNICO (ABTS•+)
Los resultados obtenidos se trataron de igual manera. Los extractos presentan un comportamiento similar al encontrado al realizar la evaluación empleando el radical libre DPPH, de igual manera los extractos PgAEF y PgAF fueron los más activos en esta determinación (tabla 2).
En la figura 2 se puede observar la correlación existente entre la actividad evidenciada por los extractos y la concentración de fenoles totales presentes en estos, lo que permite atribuir la actividad encontrada a dichos compuestos.
El ANOVA realizado para la actividad antioxidante de las concentraciones evaluadas de los extractos de P. guianensis Rubiaceae, frente a los dos métodos empleados, muestra la existencia de diferencias significativas entre ambos, debidas posiblemente a la naturaleza de los reactivos y a la diferencia entre la estabilidad de cada uno de los radicales empleados.
DISCUSIÓN
Los extractos PgAEF y PgAF presentaron mayor poder antioxidante con valores de IC50 de 5207 mg/L y 3912 mg/L respectivamente (tabla 2). Así mismo, las fracciones del extracto PgAF de la PgAF-1 a la PgAF-7 lograron una mayor decoloración del radical DPPH (tabla 3), lo que se evidencia en los bajos valores de IC50 presentados por dichas fracciones, pues necesitan de una menor concentración de la muestra para inhibir el 50 % del radical libre DPPH; esto indica que estas fracciones son las responsables de la actividad antioxidante presentada por el extracto PgAF que al ser fraccionado concentró compuestos activos en las primeras fracciones.
En general, el efecto antiradical aumenta conforme aumenta la concentración de extracto evaluado. Adicionalmente, para alcanzar una inhibición del radical ABTS del 50 %, es necesaria una concentración de extracto más baja que las concentraciones necesarias para inhibir el 50 % del radical DPPH (tabla 2). Sin embargo, la técnica del ABTS no permite discriminar extractos que contienen buenos compuestos antioxidantes como la gran mayoría de técnicas. Esto se debe a la estabilidad del reactivo ABTS•+, una estructura completamente plana que reacciona fácilmente con reductores mediante un mecanismo SET (Single Electron Transfer) y(o) HAT (Hydrogen Atom Transfer),12 lo cual hace que los ensayos con el ABTS sean poco confiables y de baja reproducibilidad, por lo que no es recomendable realizarlos sin otro método de captura de electrones, con el cual se pueda corroborar los resultados obtenidos.
La correlación directa entre la concentración de fenoles totales presentes en cada extracto y la actividad antioxidante evidenciada por cada uno de estos mediante los métodos de captura de electrones empleados (tabla 2), coincide con numerosos estudios mostrados en la literatura científica referentes a los compuestos fenólicos como antioxidantes que actúan con una variada gama de mecanismos.13 Adicionalmente, los antioxidantes fenólicos son moléculas que en pequeñas concentraciones protegen a las biomoléculas (fosfolípidos, ácidos nucleicos) del daño provocado por radicales libres[14]. Lo cierto es que la naturaleza de los radicales libres los hace muy reactivos; sin embargo, los compuestos fenólicos son capaces, al colisionar con ellos, de cederles un electrón o un hidrógeno, estabilizándolos y evitando así el inicio o la propagación del daño oxidativo.15,16
En conclusión, las especies de la familia Rubiaceae, especialmente P. guianensis, son una fuente promisoria e importante de metabolitos secundarios con capacidad antioxidante, por lo cual se requieren de mayores estudios que permitan identificar dichas sustancias e integrarlas a programas de terapia antioxidante en el área de la salud.
Agradecimientos
Los autores desean agradecer a la Universidad Tecnológica de Pereira, a través del Grupo de Investigación Polifenoles-UTP, por el apoyo financiero para la desarrollo de la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Yamaguchi T, Takamura H, Matoba T, Terao J. HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-Diphenyl-2-picrylhydrazyl. Biosci Biotechnol Biochem. 1998;62(6):1201-4.
2. Sánchez PE. Flórula del Parque Nacional Cahuita. San José (Costa Rica): Editorial Universidad Estatal a Distancia; 2000. p. 5-343.
3. Mendoza H, Ramírez BR, Jiménez LC. Rubiaceae de Colombia, Guía ilustrada de géneros. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt; 2004. p. 1-48.
4. Niño J, Narváez DM, Mosquera OM, Correa YM. Antibacterial, antifungal and cytotoxic activities of eight Asteraceae and two rubiaceae plants from Colombian biodiversity. Brazilian Journal of Microbiology. 2006. 37: 566-70.
5. Suffredini IB, Barradas ML, Varella AD, Younes RN. Antibacterial Activity of Brazilian Amazon Plant Extracts. Braz J Infect Dis. 2006;10:400-2.
6. Carvajal-Rojas L, Hata-Uribe Y, Sierra-Martínez N, Rueda-Niño D. Análisis fitoquímico preliminar de hojas, tallos y semillas de Cupatá (Strychnos schultesiana Krukoff). Rev Colombiana Forestal. 2009;12:161-70.
7. Alvarez E, Jimenez OJ, Posada CM, Rojano BA, Gil JH, Garcia CM, Durango DL. Actividad antioxidante y contenido fenólico de los extractos provenientes de las bayas de dos especies del género Vismia (guttiferae). Vitae. 2008;15(1):165-72.
8. Singleton VL, Orthofer R, Lamuela-Raventos RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin Ciocalteu Reagent. Methods Enzymol. 1999;299:152-78.
9. Brand-Williams W, Cuvelier M, Berset C. Use of a free radical method to evaluate antioxidant activity. Lebensmittel-Wissen-chaft Und Technologie. 1995;28:25-30.
10. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biol Med. 1999;26(9):1231-7.
11. Kuskoski EM, Asuero AG, Troncoso AM, García-Parilla MC, Fett R. Actividad antioxidante de pigmentos antiocianicos. Bras Ciencia y Tecnología de los Alimentos. 2004;24(4):691-3.
12. Mesa-Vanegas AM, GaviriaI CA, CardonaI F, Sáez-Vega JA, Trujillo SB, Rojano BA. Actividad antioxidante y contenido de fenoles totales de algunas especies del género Calophyllum. Laboratorio de Ciencias de los Alimentos. Escuela de Química. Universidad Nacional de Colombia Sede Medellín 2009 [citado 14 Jul 2011]. Disponible en: http://bvs.sld.cu/revistas/pla/vol_15_2_10/pla03210.htm
13. Schwarz K, Huang SW, German J, Tiersch B, Hartmann J, Frankel EN. Activities of antioxidants are affected by colloidal properties of oil in water and water in oil emulsions and bulh oils. J Agri Food Chem. 2000;48:4874-82.
14. Halliwell B. How to characterize a biological antioxidant. Free Radical Res Commun. 1990;9:1-32.
15. Frei B, Higdon JV. Antioxidant activity of tea polyphenols in vivo: evidence from animal studies. J Nutr. 2003;133:3275S-84S.
16. Avello M, Valladares R, Ordóñez JL. Antioxidant capacity of Aristotelia chilensis (Molina) Stuntz. Rev Cubana Plant Med. 2008 [cited 14 Jul 2011];13(4). Available from: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962008000400002&lng=es
Recibido: 8 de julio de 2013.
Aprobado: 22 de agosto de 2013.
Lina Marcela Giraldo Vásquez. Universidad Tecnológica de Pereira. Pereira-Risaralda, Colombia. Correo electrónico: limagiraldo@utp.edu.co