Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.48 no.1 Ciudad de la Habana ene.-mar. 2014
ARTÍCULO ORIGINAL
Empleo de la Tarjeta Amarilla y el Formato NOM220 para las notificaciones de sospechas de reacciones adversas a medicamentos
Use of Yellow Card and of NOM220 Format for reporting of suspected adverse drug reactions
MSc. Lourdes Cristina Carrillo-Alarcón,I DrC. Héctor A. Ponce Monter,II MSc. Erika López López,I MSc. Patricia Velázquez Alvarado,II DrC. Mario I. OrtizII
I Subdirección de Coordinación de Investigación en Salud de los Servicios de Salud de Hidalgo. Pachuca, Hidalgo, México.
II Instituto de Ciencias de la Salud. Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo, México.
RESUMEN
Introducción: la notificación de reacciones adversas a medicamentos es una obligación a nivel mundial. Aunque se han establecido muchas metodologías para esta acción, en la actualidad existen problemas.
Objetivo: determinar la frecuencia de sospecha de reacciones adversas a la administración de medicamentos en pacientes y comparar la accesibilidad del llenado del formato de la NOM220 de la Secretaría de Salud y la Tarjeta Amarilla propuesta por la Organización Mundial de la Salud.
Métodos: estudio transversal y observacional. Participaron 50 médicos responsables de las clínicas de diabetes del Estado de Hidalgo. Inicialmente, los médicos fueron capacitados para identificar las sospechas de reacciones adversas a la administración de medicamentos en los pacientes atendidos. Se realizó un diseño cruzado, en el que el 50 % de los médicos utilizaron por tres meses el formato de la NOM220 y 50 % la Tarjeta Amarilla. Después intercambiaron formatos y los utilizaron durante los tres meses siguientes. Al cabo de este periodo, respondieron un cuestionario para determinar la utilidad, claridad, tiempo de llenado y practicidad de ambos formatos. Se realizó estadística descriptiva y análisis bivariado para determinar los factores asociados a las sospecha de reacciones adversas a medicamentos, con el software SPSS (versión 17).
Resultados: se registraron 46 sospechas de reacciones adversas a medicamentos en 46 pacientes con el formato de la NOM220 y 78 sospechas de reacciones adversas a medicamentos con la Tarjeta Amarilla en 78 pacientes. Todas las sospechas de reacciones adversas a la administración de medicamentos fueron tipo A. Los médicos recomiendan la utilización de la Tarjeta Amarilla, consideran claro el formato, sencillo, legible, fácil de llenar, entendible y accesible (p< 0,05).
Conclusiones: los resultados permiten proponer la Tarjeta Amarilla como una alternativa más accesible para la notificación de sospechas de reacciones adversas a medicamentos, o se hagan adecuaciones al formato de la NOM220.
Palabras clave: notificación de sospecha de reacción adversa a medicamentos, farmacovigilancia, diabetes mellitus, México.
ABSTRACT
Introduction: the reporting of adverse drug reactions is a global obligation. Although many methods have been implemented, there are still problems at present.
Objective: to determine the frequency of suspected adverse reactions in patients and to compare the access to filling out the NOM220 formats of the Secretaría de Salud and the Yellow Card suggested by the World Health Organization.
Methods: a cross-sectional and observational study was made. Fifty physicians responsible for the diabetes clinics in the state of Hidalgo participated in the study. First, the physicians were trained to identify the suspected adverse drug reactions in their patients. A crossover design was created where 50 % of physicians used the NOM220 format and 50 % the Yellow Card. Three months later, they exchanged the formats and used them during the following three months. After this period, questionnaire was administered to determine the usefulness, clarity, filling out time and convenience of the formats. Descriptive statistics and bivariate analyses were applied to determine the factors associated with the suspected adverse drug reactions with SPSS software (version 17).
Results: a total of 46 suspected adverse reactions were registered in 46 patients using NOM220 format and 78 with the Yellow Card in 78 patients. All the suspected adverse reactions were type A. The physicians recommended the use of Yellow Card since they considered that it is practical, simple, readable, understandable, accessible and requires less time to fill it out (p< 0.05).
Conclusions: the results allow selecting the Yellow Card as the most accessible choice for reporting suspected drug adverse reactions; additionally, they suggest that adjustments should be also made in the NOM220 format.
Key words: Report of suspected adverse reactions, pharmacovigilance, diabetes mellitus, Mexico.
INTRODUCCIÓN
La epidemia de focomelia causada por la talidomida en recién nacidos de la Alemania Federal, mostró la importancia del estudio de los efectos adversos a medicamentos.1 Una sospecha de reacciones adversas a medicamentos (SRAM) es el efecto perjudicial o indeseado que se sospeche se presentó después de la administración de la dosis medicamentosa utilizada para la profilaxis, diagnóstico o tratamiento de cualquier enfermedad. A pesar de que las investigaciones demuestran la eficacia e inocuidad del principio activo, es posible se presente una reacción en cualquier fase posterior.2
La farmacovigilancia orienta su estudio al uso de los medicamentos en las poblaciones3 para identificar y valorar efectos del uso agudo y crónico de los tratamientos farmacológicos,4 promueve el uso racional de los medicamentos; incluso, suspender el uso de algún medicamento cuando existe un alto riesgo en la población.5 Diversas organizaciones exhortan a todos los profesionales de la salud a notificar las SRAM;6-8 así como a los agentes que utilizan el medicamento: el titular de la autorización de comercialización, las autoridades sanitarias, el médico, el farmacéutico, el paciente y el evaluador de las notificaciones de SRAM.9
La OMS propuso el formato de la Tarjeta Amarilla (TA) y es utilizada principalmente en países europeos.10 En México, la norma NOM220-SSA1-2002, sobre la instalación y operación de la farmacovigilancia, es de observancia obligatoria en el territorio mexicano para las instituciones y profesionales de la salud, titulares del registro sanitario, unidades de investigación clínica que realizan estudios con medicamentos, los comercializadores de medicamentos y remedios herbolarios.9
Toda SRAM detectada en México debe ser reportada. En 2007, el Centro Nacional de Farmacovigilancia de la Comisión Federal para la Protección contra Riesgos Sanitarios de México, recibió 15 728 notificaciones de SRAM.11 El 49,7 % provenía de la Industria Químico-Farmacéutica; el 19,4 % de centros estatales; el 14,6 % de estudios clínicos de la Industria Químico-Farmacéutica; el 13,7 % de centros institucionales; el 2,2 % de estudios clínicos; el 0,3 % de los profesionales de la salud y cerca del 0,01 % de pacientes. Estas cifras denotan problemas para notificar la SRAM.
En tal sentido, se ha estimado que la falta de reporte espontáneo de SRAM puede ser de hasta el 90 %.12 Esto puede ocurrir debido a las barreras que lo impiden, como son los factores personales y profesionales, la actitud del médico para reportar la SRAM, la falta de disponibilidad de la TA o formatos para el reporte, entre otros.13 Varias agencias y centros hospitalarios siguen buscado el más eficaz y confiable sistema de reporte de SRAM a medicamentos, ya que este es un factor determinante para un adecuado programa de farmacovigilancia.14
Existe evidencia de que la incidencia de SRAM aumenta con el número de medicamentos que se usan, polifarmacia y con los antecedentes patológicos personales.15-17 Tal es el caso de los pacientes con diabetes mellitus (DM), los cuales pueden estar polimedicados.18 En este sentido, el tratamiento farmacológico de la diabetes incluye el uso de sulfonilureas, biguanidas, tiazolidindionas, entre otros. Varios hipoglucemiantes han sido retirados del mercado (después de varios años de haber estado a la venta) por la presencia de reacciones adversas severas y fatales; por ejemplo, la fenformina, la troglitazona y la rosiglitazona. Por este motivo, es de suma importancia el realizar una farmacovigilancia activa en este tipo de pacientes.19-21
En este sentido, el objetivo del estudio fue determinar la frecuencia de SRAM en los pacientes con DM y comparar la accesibilidad del llenado del formato de la NOM220 de la Secretaría de Salud y la Tarjeta Amarilla propuesta por la Organización Mundial de la Salud.
MÉTODOS
Se realizó un estudio transversal, prospectivo, abierto y observacional, el cual se efectuó en dos fases. Se seleccionaron a 50 médicos responsables de las clínicas de diabetes de los servicios de salud del Estado de Hidalgo (CDSSH), de las 12 jurisdicciones sanitarias de este estado de México. Se les dio a conocer el objetivo del proyecto, el cual fue revisado, comentado y aprobado por el Comité de Ética y Bioseguridad de los Servicios de Salud de Hidalgo. Se les pidió su colaboración y quienes aceptaron participar fueron capacitados para identificar SRAM en sus pacientes; además se les explicó el llenado de dos formatos.
Se crearon dos grupos, el 50 % utilizó el formato de la TA y el resto la NOM-220 durante los tres meses posteriores. Al cabo de esta fecha los médicos entregaron los formatos llenados y se intercambió de formato. La ejecución del estudio se realizó durante el primer semestre del 2012.
Al finalizar este periodo, se recolectaron los formatos utilizados y ambos grupos respondieron un cuestionario sobre el tiempo de llenado, la claridad de los ítems a contestar, qué tan entendible les había parecido cada uno, cuál encontraron más complejo y cuál fue más accesible para su llenado, cuál era más factible para su manejo.
Los registros fueron enviados a la coordinación de investigación de los SSH para la captura y se concentraron en una base de datos para su procesamiento estadístico y hacer una descripción del tipo y comportamiento de las SRAM. Se realizó un análisis bivariado para determinar los factores asociados a las SRAM, con el software SPSS (versión 17).
RESULTADOS
PRIMERA FASE. LLENADO DE LA TA Y DEL FORMATO DE LA NOM220 POR LOS MÉDICOS DE LAS CDSSH
Formato de reporte de SRAM de acuerdo con la NOM220. Se registraron 46 SRAM en 46 pacientes. Los promedios de la edad y peso de los pacientes fueron de 46,2 ± 19,2 años y 67,0 ± 13,6 kg, respectivamente. El 78,3 % correspondió a mujeres. En la tabla 1 se presentan las SRAM registradas por los médicos con el formato de la NOM220. Con respecto a las consecuencias del evento, 41 pacientes (89,1 %) tuvieron recuperación sin secuela, 3 (6,5 %) se recuperaron con secuela y en 2 registros (4,3 %) no se cuenta con el dato.
Asimismo se observan los fármacos responsables de las SRAM. Del total de los reportes, 40 de los medicamentos (87,0 %) fueron administrados por vía oral, 4 (8,7 %) por vía intramuscular, 1 (2,2 %) por vía intravenosa. En el 63,0 % de los casos se retiró el medicamento y en el 34,8 % (16) no se retiró.
En 41 pacientes (89,1 %) desapareció la SRAM al suspender o terminar el tratamiento y en 2 (4,3 %) no desapareció al retirar o finalizar su tratamiento. En 7 pacientes (15,2 %) se disminuyó la dosis y en 39 (84,8 %) no se disminuyó. En 31 pacientes (67,4 %) se cambió la farmacoterapia y en 15 (32,6 %) no se cambió.
En este sentido, en 14 pacientes (30,4 %) reapareció la SRAM, en 23 (50 %) no reapareció y en 9 (19,5 %) se desconoce el dato. Aunque en 16 pacientes no se retiró el medicamento, los médicos reportaron que en 7 (15,2 %) pacientes en los que no se retiró el medicamento persistió la SRAM.
En total, 30 pacientes (65,2 %) estuvieron recibiendo farmacoterapia concomitante y 16 (34,8 %) solo el medicamento indicado.
Formato de reporte de SRAM de acuerdo con la TA. Se registraron 78 SRAM en 78 pacientes (tabla 1). Los promedios de la edad y peso de los pacientes fueron de 51,3 ± 17,6 años y 61,7 ± 15,9 kg, respectivamente. De los pacientes, 47 fueron femeninos (60,3 %). Con respecto a las consecuencias del evento, 71 pacientes (91,0 %) presentó recuperación sin secuela y en 7 registros (9,0 %) no se cuenta con el dato.
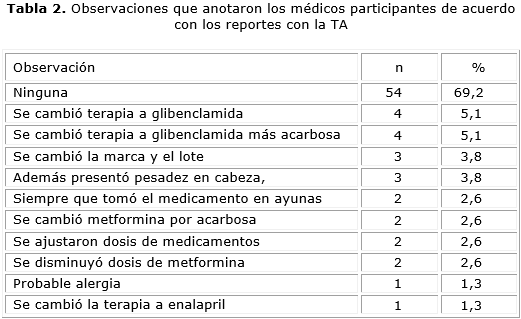
En cuanto a la severidad de la SRAM, 61 (78,2 %) fueron catalogadas como leves, 12 (15,4 %) como moderadas, y en 5 (6,4 %) casos no se registró el dato. En el 69 % de los reportes, no se manifiesta alguna observacion, solo en el 5 %. En las observaciones realizadas en este formato solo el 20,5 % cambió de terapia y el 10 % manifiesta cambió de lotes o agregó sobre la sintomatología del paciente (tabla 2).
SEGUNDA FASE. OPINIÓN DE MÉDICOS EN EL LLENADO DE LA TA Y DEL FORMATO DE LA NOM220
Participaron en el estudio 15 médicos generales, 8 del género femenino (53,3 %), con un promedio de edad de 33,8 ± 6,4 años. En relación con la claridad, facilidad y otros aspectos para el llenado del formato de SRAM (tabla 3), podemos observar que existió una diferencia significativa de los comentarios de los médicos entre ambos formatos (p< 0,05). Los participantes refirieron un tiempo promedio de llenado del formato de la NOM220 de 10,4 ± 6,3 min vs. los 7,9 ± 3,3 min en el llenado de la TA (p= 0,067). Catorce médicos (93,3 %) refirieron que la TA es más fácil llenar (los mismos que mencionaron que la más difícil de llenar fue el formato de la NOM220); 15 médicos (100 %) recomendaron la utilización de la TA para el reporte espontáneo de SRAM. Algunas de las razones por esta recomendación fueron: seis médicos refirieron que es más práctica, entendible y concreta; cinco que es más sencilla, clara, legible, entendible y requiere menos tiempo; y un médico que es más clara y sencilla, además se facilita debido a la carga de trabajo, pero la de NOM220 tiene más datos.
Finalmente, la tabla 4 incorpora las principales SRAM según el fármaco prescrito y lo que la literatura reporta al respecto.
DISCUSIÓN
La OMS sugiere que los profesionales de la salud deben ser la principal fuente de información en farmacovigilancia y fomenta la sistematización de la notificación espontánea de SRAM; sin embargo, existe evidencia del subregistro de estas. En médicos generales, la tasa de subregistro de SRAM oscila entre 36 y 99 %.12 En México, solo el 0,3 % de los profesionales de la salud notifican SRAM.11 En Hidalgo, previo al estudio, no había registro de SRAM en las CDSSH y se observó que los reportes de estas con TA fueron casi el doble de los realizados con la NOM220. Los reportes espontáneos de SRAM con la TA, han aumentado a partir de la promoción de su utilización, importancia y disponibilidad.29-31
La problemática del paciente con DM, es que existen otras comorbilidades. La incidencia de SRAM se incrementa conforme al número de medicamentos prescritos y la edad.16,18,31 La prevalencia reportada de SRAM en pacientes psiquiátricos que en promedio recibían 5,3 ± 1,1 medicamentos (rango de 4 a 8), fue de 4,46 %, de un total de 721 regímenes terapéuticos prescritos.20
Respecto al tipo de SRAM, con el formato oficial se reportó principalmente dolor epigástrico, náuseas, vómito, inflamación de los labios y mareo. Mientras que con la TA fueron náuseas, mareo, vómito, tos seca, dolor abdominal, rubicundez y taquicardia, principalmente. La mayoría de las SRAM reportadas con ambos formatos, son reacciones que se producen como consecuencia de las extensiones de sus efectos farmacológicos (exceso de una o varias de las acciones farmacológicas de la sustancia en cuestión); por tanto, dependen de la dosis y por ende, son previsibles. La mayoría de SRAM reportadas son leves, y un porcentaje mínimo resulta severas.24 En el presente estudio, el 15,4 % de las SRAM fueron leves. De acuerdo con la literatura farmacológica, son reacciones conocidas que producen los medicamentos reportados (tabla 4). Aparecen con mayor frecuencia, pero generalmente no revisten gravedad, se considera reacciones adversas de tipo A.32 Entre ellas, el captopril, el cual se ha identificado que más del 70 % de sus efectos adversos son leves.15 Sin embargo, al observar la tabla 1, los resultados sugieren que la posición que ocupa y el porcentaje dependen más del formato físico (NOM220 vs. TA) que de la severidad de la reacción adversa. Esto se aprecia con varios fármacos, y en especial con la metformina.
Con respecto a la segunda fase del estudio, que se refiere a la claridad, facilidad y otros aspectos relacionados con el llenado del formato NOM220 y de la TA (tabla 3), existen diferencias significativas con respecto al uso de ambos formatos. Más del 60 % de los médicos consideran más claro, sencillo, legible y accesible el formato de la TA. Existe evidencia de los determinantes del subregistro de SRAM, entre ellos, se han sugerido la insuficiente educación farmacológica en los médicos, la frecuente prescripción irracional de medicamentos, la sobrecarga de información y de trabajo en sus centros laborales, la proliferación de nuevos medicamentos, y la actitud ante la SRAM, entre otros.13,33
Debido a los comentarios favorables que obtuvo la TA por parte de los participantes, se recomienda se acepte su uso para la notificación de SRAM en México o en su caso se realicen adecuaciones al formato de la NOM220 para hacerlo más factible con el médico.
En el presente estudio, el llenado del formato presentó varios datos perdidos. Los médicos, aún no identifican el valor que tiene el correcto llenado para prevenir que las manifestaciones reportadas sean un falso positivo.34 La calidad del llenado del reporte, permite una adecuada evaluación de las señales de seguridad de los medicamentos, fortalece el sistema de farmacovigilancia e identifica la frecuencia de falta de cumplimiento terapéutico debido a la presencia de SRAM.35,36
Una de las limitaciones del presente estudio consiste en que la identificación de las SRAM dependió exclusivamente del criterio de un único evaluador. Sin embargo, hasta donde se conoce, es el primer reporte realizado en las CDSSH de los Servicios de Salud distribuidas en todo el Estado de Hidalgo, encargadas de atender exclusivamente a pacientes diabéticos del Estado.
Los resultados permiten proponer la TA como una alternativa más accesible para la notificación de SRAM o se hagan adecuaciones al formato de la NOM220.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Agradecimientos
A los doctores Marco Antonio García Martínez y Marisa Ibarra, y a los médicos responsables de las CDSSH, por el interés y disposición en la realización del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Sigala C, Nelle H, Halabe J. El resurgimiento de la talidomida. Rev Fac Med UNAM. 2001;44(5):212-5.
2. Rodríguez-Betancourt JL, García-Vigil JL, Giral-Barnés C, Hernández-Santillán D, Jasso-Gutiérrez L. Farmacovigilancia II. Las reacciones adversas y el Programa Internacional de Monitoreo de los Medicamentos. Rev Med IMSS. 2004;42(5):419-23.
3. Bénichou C. Introduction. Adverse Drug Reactions. A practical guide to diagnosis and management. Paris: Wiley; 1999. p. xiii-xiv.
4. Uppsala Monitoring Centre. Vigilancia de la seguridad de los medicamentos. Guía para la instalación y puesta en funcionamiento de un centro de farmacovigilancia [monografía en internet]. Suecia: UMC/OMS; 2001 [citado 13 Ag 2012]. Disponible en: http://who-umc.org/graphics/24751.pdf
5. García-Rosas R, Haro-García L, Consideraciones generales sobre la farmacovigilancia. Rev Med IMSS. 2002;40(2):173-9.
6. Agencia Española de Medicamentos y Productos Sanitarios. Transmisión electrónica de sospechas de reacciones adversas de medicamentos de uso humano. España, 2013 [citado 13 Sept 2013]. Disponible en: http://www.aemps.gob.es/oficinaVirtual/usoHum/farmacovig/transmi-electronica.htm
7. Organización Mundial de la Salud. La Farmacovigilancia: Garantía de seguridad en el uso de los medicamentos. Perspectivas políticas de la OMS sobre medicamentos. Ginebra: Organización Mundial de la Salud; 2004. p. 1-6.
8. Secretaria de Salud. NORMA Oficial Mexicana NOM-220-SSA1-2002, Instalación y operación de la farmacovigilancia. México. 2012 [citado 13 Abr 2012]. Disponible en: http://www.salud.gob.mx/unidades/cdi/nom/220ssa102.html
9. Organización Panamericana de la Salud. Buenas Prácticas de Farmacovigilancia para las Américas. Washington, DC: OPS; 2011 [citado 13 May 2013]. Disponible en: http://apps.who.int/medicinedocs/documents/s18625es/s18625es.pdf
10. Morales DM, Ruiz AI, Morgado CC, González FX. Farmacovigilancia en Chile y el mundo. Rev Chil Infectol 2002 [citado 11 Abr 2012];19(1):S42-S45. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182002019100008&lng=es&nrm=iso&tlng=es
11. Comisión Federal para la Protección contra Riesgos Sanitarios. 4to. Boletín Informativo Farmacovigilancia. México: COFEPRIS; 2010 [citado 13 May 2013]. Disponible en: http://www.cofepris.gob.mx/AZ/Paginas/Farmacovigilancia/Boletin-Informativo.aspx
12. Hazell L, Shakir SA. Under-reporting of adverse drug reactions: a systematic review. Drug Saf. 2006;29(5):385-96.
13. López-González E, Herdeiro MT, Figueiras A. Determinants of Under-Reporting of Adverse Drug Reactions, A Systematic. Rev Drug Saf. 2009;32(1):19-31.
14. Banerjee AK, Ingate S. Web-based patient-reported outcomes in drug safety and risk management: challenges and opportunities? Drug Saf. 2012 Jun 1;35(6):437-46.
15. Rodríguez Duque R, Jiménez López G, Fernández Manchón E, González Delgado BE. Caracterización de las reacciones adversas medicamentosas en ancianos, Cuba 2003-2005. Rev Cubana Farm. 2007;41(3):1-11.
16. Hilmer SH. The dilemma of polypharmacy. Aust Prescr. 2008;31:2-3.
17. Machado-Alba JE, Moncada-Escobar JC. Reacciones adversas medicamentosas en pacientes que consultaron a instituciones prestadoras de servicios en Pereira, Colombia. Rev Salud Pública. 2006;8(2):200-8.
18. Munger MA. Polypharmacy and Combination Therapy in the Management of Hypertension in Elderly Patients with Co-Morbid Diabetes Meliitus. Drugs Aging. 2010;27(11):871-83.
19. Girardin E, Vial T, Pham E, Evreux JC. Hypoglycemia induced by oral hypoglycemic agents. Records of the French Regional Pharmacovigilance Centers 1985-1990. Ann Med Interne (Paris). 1992;143(1):11-7.
20. Wysowski DK, Armstrong G, Governale L. Rapid increase in the use of oral antidiabetic drugs in the United States, 1990-2001. Diabetes Care. 2003 Jun;26(6):1852-5.
21. Berthet S, Olivier P, Montastruc JL, Lapeyre-Mestre M. Drug safety of rosiglitazone and pioglitazone in France: a study using the French pharmacovigilance database. BMC Clin Pharmacol. 2011 May 24;11:5.
22. Caterson ID. Endocrine Diseases. In: Speight TM, Holford NHG, editors. Avery's Drug Treatment. 4th ed. New Zeland: Adis International; 1997. p. 156-68.
23. Tracy JW, Webster LT. Drugs used in the chemotherapy of protozoal infections: Malaria. In: Hardman JE, Limbird RW, editors. Goodman & Gilman's. The Pharmacological Basis of Therapeutics, 10th ed. New York: McGraw-Hill; 2001. p. 1069-95.
24. O'Brien AAJ, Bulpitt CJ. Hypertensive Diseases. In: Speight TM, Holford NHG, editors. Avery's Drug Treatment. 4th ed. New Zeland: Adis International; 1997. p. 75-87.
25. Davis SN, Granner DK. Insulin, oral hypoglycemic agents, and the pharmacology of the andocrine pancreas. In: Hardman JE, Limbird RW, editors. Goodman & Gilman's. The Pharmacological Basis of Therapeutics. 10th ed. New York: McGraw-Hill; 2001. p. 1679-714.
26. Campos-Sepúlveda AE, Martínez-Enríquez ME, Mendoza-Patiño N. Quinolonas Rev Fac Med UNAM. 2008;51:173-7.
27. Piedad J, Rickards H, Besaq FM, Cavanna AE. Benefical and adverse psychotropic effects of antiepileptic drugs in patients with epilepsy: a summary of prevalence, undrlyng mechanisms and data limitations. CNS Drugs. 2012;26:319-35.
28. Rodríguez-Carranza R. Vademécum Académico de Medicamentos. México, DF: Ed. McGraw-Hill Interamericana; 1999. p. 78-85.
29. Heeley E, Riley J, Layton D, Wilton LV, Shakir SA. Prescription-event monitoring and reporting of adverse drug reactions. Lancet. 2001;358:1872-3.
30. Tapia-Moreno VA. Detección, control y seguimiento de reacciones adversas a medicamentos (RAMS) en pacientes de la tercera edad diabéticos polimedicados del área de consulta externa del Hospital del IESS-RIOBAMBA [tesis]. Quito: Escuela Superior Politécnica De Chimborazo; 2011.
31. Ortiz MI, Ponce-Monter HA, Fernández-Martínez E, Macías A, Izquierdo-Vega JA, Sánchez-Gutiérrez M, et al. Pharmacovigilance of psychoactive medications in a Mexican psychiatric hospital. Proc West Pharmacol Soc. 2010;53:44-5.
32. Rawlins MD, Thompson JW. Pathogenesis of adverse drug reactions. In: Davies DM, ed. Textbook of adverse drug reactions. Oxford: Oxford University Press; 1977. p. 44.
33. Rodríguez-Carranza R, Vidrio H, Campos-Sepúlveda E. La enseñanza de la farmacología en las escuelas de medicina, situación actual. Gac Méd Méx. 2008;6:463-72.
34. Begaud B, Moride Y, Tubert-Bitter P. False-positives in spontaneous reporting: should we worry about them? Br J Clin Pharmacol. 1994;38:401-4.
35. Lizcano L, Magaldi L. Farmacovigilancia del Midazolam en pacientes sometidos a estudios gastroscópicos. Arch Venezolanos Farmacol Terapéut 2001;20(2):139-42.
36. Mino-León D, Reyes-Morales H, Galván-Plata ME, Ponce-Monter H, Palma-Aguirre JA, Amato D, et al. Drug treatment of hypertension: compliance and adverse reactions in a cohort of hypertensive patients in a primary care setting. Rev Invest Clin. 2007;59(1):8-14.
Recibido: 16 de septiembre de 2013.
Aprobado: 30 de octubre de 2013.
Lourdes Cristina Carrillo-Alarcón. Subdirección de Coordinación de Investigación de los Servicios de Salud de Hidalgo. Pachuca, Hidalgo, México. Correo electrónico: clourdes.carrillo@yahoo.com.mx