Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.48 no.1 Ciudad de la Habana ene.-mar. 2014
PRODUCTO NATURAL
Efectos de extractos de Neopetrosia rosariensis sobre mieloperoxidasa y elastasa con la utilización del modelo neutrófilos
Effects of extracts from Neopetrosia rosariensis on myeloperoxidase and on elastase by using the neutrophil model
MSc. Marlene Durán Lengua,I DrC. Ricardo Gaitán Ibarra,II Dra. Larissa Cano DuránIII
I Facultad de Ingeniería. Universidad de Cartagena. Cartagena de Indias, Colombia.
II Facultad de Ciencias Farmacéuticas. Universidad de Cartagena. Cartagena de Indias, Colombia.
III Hospital E.S.E. Viterbo, Caldas, Colombia.
RESUMEN
Introducción: los neutrófilos son la primera línea de defensa, los cuales liberan su contenido granular, constituido entre otros por enzimas generadoras de especies reactivas del oxígeno como mieloperoxidasa y enzimas proteolíticas como la elastasa, que degradan elastina y colágeno.
Objetivo: evaluar la toxicidad de los extractos de la esponja marina Neopetrosia rosariensis y su acción como inhibidores de la desgranulación del neutrófilo, e inhibición de la actividad catalítica de la elastasa de neutrófilos humanos.
Métodos: se determinó la toxicidad por el método de exclusión del colorante azul de tripano. Se evaluó la desgranulación por la disminución del porcentaje de liberación de la mieloperoxidasa, y se determinó la inhibición de la actividad catalítica de la elastasa de neutrófilos humanos por la reducción de la actividad de la enzima de un sustrato específico.
Resultados: los extractos presentaron baja toxicidad a las concentraciones evaluadas, con porcentaje de viabilidad celular superior al 80 %, incluso a la concentración más alta utilizada (25 µg/mL). También presentaron actividad inhibitoria de la liberación de mieloperoxidasa, concentrándose el efecto en los extractos más polares (metanólico total y parcial) y la inhibición de la actividad de la elastasa en los de más baja polaridad (hexano y diclorometano parcial), a concentraciones de 10 y 25 µg/mL, acorde con la naturaleza lipofílica del sitio activo de la enzima.
Conclusiones: los resultados en los extractos evaluados son promisorios, teniendo en cuenta que cada muestra representa una mezcla compleja de compuestos activos entre 10 y 25 µg/mL, lo que resulta de mucho interés para continuar con su fraccionamiento como agentes potenciales para la posible terapia de enfermedades que presentan procesos inflamatorios.
Palabras clave: actividad antiinflamatoria, Neopetrosia rosariensis, neutrófilo polimorfonuclear mieloperoxidasa y elastasa.
ABSTRACT
Introduction: neutrophils are the first line of defense, releasing their granular contents made up of reactive oxygen species-generating enzymes such as myeloperoxidase and proteolytic enzymes such as elastase, which degrade elastin and collagen.
Objective: to evaluate toxicity of marine sponge Neopetrosia rosariensis extracts and their action as inhibitors of neutrophil degranulation and inhibition of the catalytic activity of human neutrophil elastase.
Method: the cytotoxicity was assessed by Trypan blue exclusion test of cell viability. Degranulation inhibition was evaluated by reduction of myeloperoxidase release percentage and inhibition of catalytic activity of elastase was determined by reduction of enzyme activity on specific substrate.
Results: the extracts exhibited low toxicity at the evaluated concentrations, with cellular viability percentage exceeding 80 % even at the highest concentration (25 µg/mL). They also showed inhibitory action of myeloperoxidase release, the greatest effect being concentrated on the most polar extracts (total and partial methanolic). The inhibition of the elastase activity was mostly found in the lowest polarity extracts (hexane and partial dichloromethane) at concentrations of 10 and 25 µg/mL, according to the hydrophobic character of the active site of the enzyme.
Conclusions: these results of the evaluated extracts are encouraging, considering each extract represents a complex mixture of active compounds of 10-25 µg/mL. This arouses great interest to continue their fractioning as potential agents for possible therapy of inflammatory processes.
Key words: antinflammaroty activity, Neopetrosia rosariensis, polymorphonuclear myeloperoxidase and elastase.
INTRODUCCIÓN
Los neutrófilos (PMN) son células fagocíticas involucradas en mecanismos de defensa contra infecciones, las cuales pueden causar inflamación. Se ha demostrado que pequeñas moléculas de formil metil leucil fenilalanina (fMLP), de origen bacteriano, actúan como potentes quimiotácticos para células fagocíticas; esta actividad trae como consecuencia liberación de especies reactivas del oxígeno (ERO)1 y enzimas proteolíticas como la elastasa, que degrada elastina y colágeno2 las cuales tienen una función importante en el desarrollo, evolución y respuesta de muchas enfermedades.3
El receptor formil péptido (FPR), media funciones críticas en leucocitos, que incluyen la activación de la fagocitosis, adhesión, migración, quimiotaxis y actividades bactericidas por medio de la desgranulación de PMN y el estallido respiratorio, con liberación de ERO.4,5 Aunque estas funciones son consideradas benéficas, la producción excesiva de compuestos oxidantes causa daño al tejido durante el proceso inflamatorio. Por lo tanto, desarrollar o descubrir moléculas capaces de limitar la función del FPR, es de gran importancia para el desarrollo de nuevos agentes antiinflamatorios.6
Los productos naturales obtenidos de la fauna marina son una fuente de químicos diversos que han sido utilizados para el diseño y desarrollo de nuevos agentes con potencial terapéutico.7Compuestos obtenidos de esponjas marinas, han mostrado actividad antiinflamatoria; de Lufariella variabilis se aislaron manoalide y lufariellolide, moléculas que tienen potente actividad antiinflamatoria a través de la inhibición reversible e irreversible respectivamente, de la fosfolipasa A2.8,9 El género Neopetrosia es abundante en el mar Caribe colombiano, y la especie rosariensis es considerada endémica en el Caribe colombiano (Islas del Rosario),;se ha estudiado poco como fuente de metabolitos con potencial terapéutico. Estudios previo, logró evidenciar por primera vez su actividad antiinflamatoria, in vivo y su efecto sobre algunos mediadores de la inflamación.10
En este trabajo se evaluó la actividad inhibidora de desgranulación de mieloperoxidasa (MPO) y el efecto inhibidor de elastasa de neutrófilos humanos (EHN), utilizando el modelo del PMN,4 como aporte a la elucidación del mecanismo de acción de los metabolitos presentes en esta especie.
MÉTODOS
RECOLECCIÓN Y PREPARACIÓN DE LOS EXTRACTOS DE LAS ESPONJAS MARINAS
La esponja marina Neopetrosia rosariensis se recolectó en marzo del 2009, en las Islas del Rosario (Cartagena, Colombia) a profundidades entre 4-20 m. utilizando equipo de buceo autónomo. Los especímenes se identificaron hasta la categoría de especie por el doctor Sven Zea, biólogo marino del Departamento de Biología de la Universidad Nacional de Colombia. Ejemplares de esta esponja se encuentran depositados en el Instituto de Investigaciones Marinas y Costeras (INVEMAR), Santa Marta, Colombia, codificado como INV-POR 1107.
El material animal se transportó al laboratorio en condiciones de baja temperatura; una vez allí se lavó con agua destilada, picado y liofilizado. El material obtenido fue pulverizado y extraído con metanol a temperatura ambiente hasta agotamiento del material. La solución metanólica filtrada y concentrada a presión reducida, tomó características de suspensión acuosa de color pardo, que constituyó el extracto metanólico total (EMT), una parte se diluyó en H2O y se sometió a partición en hexano (400 mL x 3, EH) y diclorometano (400 mL × 3, ED). El remanente constituyó la solución metanólica parcial (EMP). Todas las soluciones se concentraron a presión reducida, obteniéndose los correspondientes extractos EMT, EH, ED y EMP. Para los ensayos se utilizaron concentraciones de 0,5; 1; 5; 10; 25 y 50 µg/mL.
SEPARACIÓN DE NEUTRÓFILOS HUMANOS
Los neutrófilos se obtuvieron de voluntarios sanos a partir de sangre venosa en tubos con heparina a concentraciones de 0,1 mg/mL de sangre total, luego de una sedimentación espontánea por 30 min, el plasma es recolectado y adicionado cuidadosamente sobre ficoll-histopaque 1 077 g/mL, el cual actúa por gradiente de densidad a una proporción 1:2 v/v y sometido a una centrifugación de 400 g por 20 min; el sobrenadante se descartó, los PMN en el sedimento se resuspendieron en 0,5 mL de PBS y se trataron con cloruro de amonio 0,83 % pH 7,2 para lisar los eritrocitos contaminantes. Posterior a este tratamiento, los PMN se lavaron tres veces con solución amortiguadora (PBS) pH 7,3 adicionados con 0,50 mM de glucosa, y resuspendido a una concentración final de 2 × 106 células/mL.
CITOTOXICIDAD
La determinación de citotoxicidad se realizó por el método de exclusión del azul trípano, el cual se basa en el hecho de que una célula inviable es incapaz de excluir de su citoplasma el colorante azul trípano, debido a que ha perdido la integridad de su membrana plasmática, lo que permite su identificación a través de microscopia óptica. Una suspensión de 2 × 106 PMN en PBS se expusieron a las concentraciones de 1, 5, 10, 25 y 50 µg/mL de los extractos de N. rosariensis por 30 min, transcurrido este tiempo, se adicionó el colorante azul trípano a una concentración de 0,4 %; el conteo del número de células teñidas en función del total de 200 células observadas con un objetivo de 40X, permitió calcular el porcentaje de supervivencia. Estos ensayos se realizaron por triplicado, y los resultados se expresaron como porcentaje de muerte celular.11,12
EVALUACIÓN DE LA DESGRANULACIÓN POR LIBERACIÓN DE MPO
El efecto inhibidor se evidenció por la disminución de la liberación de la MPO por exposición de 2 × 106 PMN a las diferentes concentraciones de los extractos evaluados en presencia de un inductor de la exocitosis, fMLP.13,14 La MPO liberada por los PMN, actúa sobre el H2O2 en presencia del ion cloruro (Cl-), generando ácido hipocloroso (HClO), este oxida la o-dianisidina, que adquiere una coloración ámbar proporcional a la cantidad de enzima presente; este compuesto coloreado se midió en un espectrofotómetro a una longitud de onda de 492 nm15 en un lector de microplacas TECAN A 5082. El control de 100 % de desgranulación consistió en 2 × 106 PMN/mL en PBS, activados con citocalasina B, y estimulados con fMLP. Las determinaciones se hicieron por triplicado y se realizaron tres réplicas de cada ensayo.
DETERMINACIÓN DE LA INHIBICIÓN DE ELASTASA DE NEUTRÓFILOS HUMANOS (EHN)
Los PMN fueron inducidos a exocitosis, activados por citocalasina B y estimulados con fMLP; la elastasa liberada a partir de 2,5 × 106 PMN, en 200 µL de PBS (microplaca), fue expuesta a las diferentes concentraciones de los extractos determinando su actividad por hidrólisis del sustrato succinil-l-alanil-l-alanil-l-vanil-p-nitroanilida (SAAVNA), con la consiguiente liberación del cromóforo (p-nitroanilida-pNA). La elastasa fue expuesta a las diferentes concentraciones de los extractos por 10 min, posteriormente se adicionó 10 µM SAAVNA y se incubó por 30 min a 37 ºC, y se realizó la lectura de las absorbancias en un lector de microplaca TECAM 5082 a una longitud de onda de 405 nm. El control de 100 % de actividad consistió en 2,5 × 106 PMN con el mismo tratamiento pero sin adición de los extractos.13,16,17
Este ensayo se controló con 0,5 µM de fenilbutazona en agua destilada estéril, el cual mostró una inhibición de la enzima de 95 %.18,19 Los ensayos se hicieron por triplicado y se realizaron tres repeticiones para cada ensayo.
ANÁLISIS ESTADÍSTICO
Los resultados se analizaron con el GraphPad Prism version 5.00 for Windows, (GraphPad Software, San Diego California, USA) y se presentan como la media ± error estándar (EE) de tres experimentos independientes. En todos los casos se consideró significativa una p< 0,05. Las diferencias significativas entre las diferentes concentraciones de los extractos se analizaron por la prueba de ANOVA, seguida de la prueba de Tukey de comparaciones múltiples para determinar diferencias estadísticas entre los grupos de tratamiento en cada ensayo.
RESULTADOS
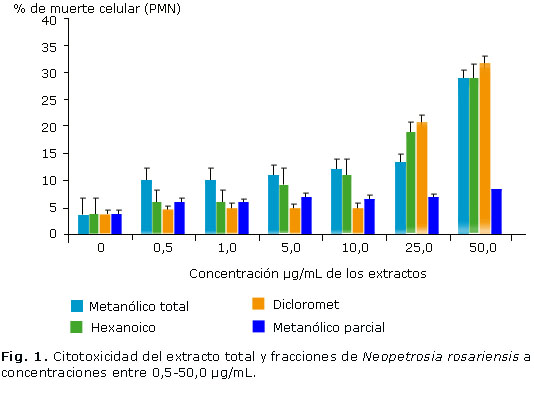
La citotoxicidad presentó valores alrededor del 30 % para cada extracto a la concentración más alta (50 µg/mL). A concentraciones inferiores, el porcentaje de muerte celular no fue superior al 20 %.
Los extractos parciales mostraron mayores porcentajes de muerte celular para el modelo PMN, principalmente el ED con porcentaje de muerte ligeramente superior al 30 % a la máxima concentración de ensayo (50 µg/mL), mientras que EMP presentó la mayor viabilidad celular con porcentajes de muerte celular que no superaron el 10 % y que se mantuvo constante a las diferentes concentraciones de ensayo (Fig. 1).
En general, los ensayos de citotoxicidad realizados en PMN, permitieron establecer las condiciones de trabajo a 0,5; 1; 5; 10 y 25 µg/mL.
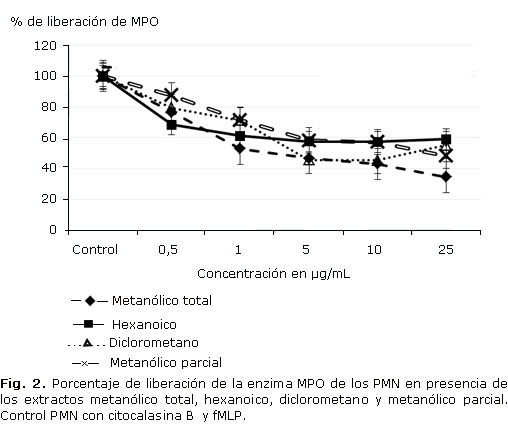
La liberación de MPO a las concentraciones de los extractos evaluados se observa en la figura 2, con diferencias estadísticas significativas a las concentraciones evaluadas. Se encontraron que todos los extractos inhibieron la liberación de la MPO desde las concentraciones más bajas; los extractos metanólicos resultaron los de mayor inhibición, con valores alrededor de 65 y 50 % respectivamente, observándose un efecto dependiente de la concentración. Resulta paradójica la diferencia significativa en las inhibiciones halladas entre el extracto total y los parciales, lo cual puede ser explicado como un efecto sinérgico entre las moléculas presentes en el extracto total.
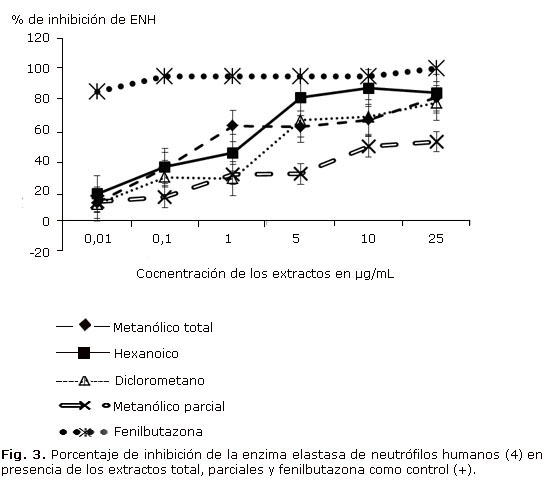
Los porcentajes de inhibición de elastasa, presentaron diferencias estadísticas significativas a las concentraciones evaluadas para cada uno de los extractos (Fig. 3), lo cual indicando que el extracto metanólico total y los parciales de hexano diclorometano y metanólico presentan inhibición de la enzima elastasa de una manera dependiente de la concentración; se destaca principalmente la actividad de EH, ED y MT, lo que indica que la actividad inhibidora de elastasa, podría estar asociada a componentes de baja a mediana polaridad principalmente, lo cual estaría de acuerdo con el entorno lipofílico característico del sitio activo de la enzima. El porcentaje fue calculado en presencia de un control (PMN tratados con citocalasina B y fMLP), este representó el 100 %de actividad enzimática.
DISCUSION
En estudios realizados en esponjas marinas han sido aislados compuestos inhibidores de la desgranulación de PMN (variabilina petrospongiolido M, cacospongiolido B y bolinaquinona). La variabilina inhibe en un modelo similar la desgranulación en un 36 %,20 cifra que comparada con la informada en este trabajo, hace de estos extractos una fuente de compuestos inhibidores interesantes.
Teniendo en cuenta que hubo inhibición de la exocitosis, se podría concluir que los extractos de esta esponja marina, podrían actuar inhibiendo la desgranulación de los PMN; las concentraciones inhibitorias encontradas fueron muy inferiores a las reportadas en la literatura para compuestos peptídicos obtenidos de plantas.21
Estas sustancias podrían ser inhibidores de la formación de especies oxidantes, pues al bloquear la liberación de MPO inhiben de manera indirecta la formación de estos productos, hecho que se relacionó con la actividad antiinflamatoria informada para la esponja marina Clathria lissosclera.22 La inhibición de liberación de MPO disminuye la formación de ERO, esto podría relacionarse con efectos dañinos en procesos inflamatorios prolongados y que justifican, en parte, el efecto mostrado por estos extractos en estudios previos.10
Diterpenos aislados de esponja Chelonaplysilla violácea, inhibieron moderadamente la producción de anión superoxido en PMN estimulados con fMLP.23 Otros compuestos petrocortina aislado de esponja del genero Petrosia sp, mostró propiedades antiinflamatorias por inhibición del factor de necrosis tumoral a (FNTa) y óxido nítrico provenientes de macrófagos.24
Los extractos parciales en diclorometano y hexano presentaron porcentajes de inhibición de la enzima elastasa con valores superiores al 80 %, por lo que algunos de los compuestos presentes prometen ser activos en procesos inflamatorios caracterizados por concentraciones elevadas de esta enzima, como sucede en el caso del enfisema pulmonar y fibrosis quística entre otros.25 Al respecto deben ser considerados para investigaciones más profundas los extractos con inhibición superior al 80 %.13
En conclusión, los resultados en los extractos evaluados son promisorios, teniendo en cuenta que cada muestra representa una mezcla compleja de compuestos activos entre 10 y 25 µg/mL, lo que resulta de mucho interés para continuar con su fraccionamiento como agentes potenciales para la posible terapia de enfermedades que presentan procesos inflamatorios.
Agradecimientos
Al doctor Sven Zea de INVEMAR por la recolección e identificación de las esponjas marinas. Este trabajo fue financiado por Colciencias, Bogotá, Colombia, con el código 1107-05130-95 y la Universidad de Cartagena.
REFERENCIAS BIBLIOGRÁFICAS
1. Lungarella G, Cavarra E, Lucattelli M, Martorana PA. The dual role of neutrophil elastase in lung destruction and repair. Intern J Biochem Cell Biol. 2008;40(6-7):1287-96.
2. Kobayashi SD, Voyich JM, DeLeo FR. Regulation of the neutrophil-mediated inflammatory response to infection. Microbes and Infection. 2003;5(14):1337-44.
3. Vodovotz Y, Constantine G, Rubin J, Csete M, Voit EO, An G. Mechanistic simulations of inflammation: current state and future prospects. Mathematical Biosciences. 2009;217(1):1-10.
4. Le Y, Gong W, Tiffany HL, Tumanov A, Nedospasov S, Shen W, et al. Amyloid (beta) 42 activates a G-protein-coupled chemoattractant receptor, FPR-like-1. J Soc Neuroscience. 2001;21(2):RC123.
5. Selvatici R, Falzarano S, Mollica A, Spisani S. Signal transduction pathways triggered by selective formylpeptide analogues in human neutrophils. Eur J Pharmacol. 2006;534(1-3):1-11.
6. Le Y, Iribarren P, Zhou Y, Gong W, Hu J, Zhang X, et al. Silencing the formylpeptide receptor FPR by short-interfering RNA. Molecular Pharmacology. 2004;66(4):1022-8.
7. Bartolotta S, Scuteri M, Hick A, Palermo J, Rodriguez Brasco M, Hajdu E, et al. Evaluation of genotoxic biomarkers in extracts of marine sponges from Argentinean South Sea. J Exper Marine Biol Ecol. 2009;369(2):144-7.
8. Kernan M, Faulkner D, Parkanyi L, Clardy J, De Carvalho M, Jacobs R. Luffolide, a novel anti-inflammatory terpene from the spongeLuffariella sp. Cell Mol Life Sci. 1989;45(4):388-90.
9. Alcaraz MJ, Paya M. Marine sponge metabolites for the control of inflammatory diseases. Curr Opin Invest Drugs. 2006;7(11):974-9.
10. Franco LA, Macareno JL, Ocampo YC, Pájaro IB, Gaitán R. Marine sponges of the genus neopetrosia with anti-inflammatory activity. Latin Am J Pharm. 2012;31:976-83.
11. Strober W. Trypan blue exclusion test of cell viability. Curr Protocols Immunol. 2001:A. 3B. 1-A. 3B. 2.
12. Soto E, Limón A, Ortega A, Vega R. Características morfológicas y electrofisiológicas de las neuronas del ganglio vestibular en cultivo. Gac Méd Méx. 2002;138(1):1-13.
13. Johansson S, Göransson U, Luijendijk T, Backlund A, Claeson P, Bohlin L. A neutrophil multitarget functional bioassay to detect anti-inflammatory natural products. J Natural Products. 2002;65(1):32-41.
14. Edelson PJ, Cohn ZA. Peroxidase-mediated mammalian cell cytotoxicity. J Exper Med. 1973;138(1):318-23.
15. Henson PM, Zanolari B, Schwartzman NA, Hong SR. Intracellular control of human neutrophil secretion. J Immunol. 1978;121(3):851-5.
16. Siedle B, Gustavsson L, Johansson S, Murillo R, Castro V, Bohlin L, et al. The effect of sesquiterpene lactones on the release of human neutrophil elastase. Biochemical Pharmacol. 2003;65(5):897-903.
17. Kanashiro A, Souza JG, Kabeya LM, Azzolini A, Lucisano-Valim YM. Elastase release by stimulated neutrophils inhibited by flavonoids: importance of the catechol group. Zeitschrift fur Naturforschung C-Journal of Biosciences. 2007;62(5-6):357-61.
18. Lentini A, Ternai B, Ghosh P. Synthetic inhibitors of human granulocyte elastase, Part 4. Inhibition of human granulocyte elastase and cathepsin G by non-steroidal anti-inflammatory drugs (NSAID) s. Biochem Inter. 1987;15(6):1069.
19. Kang K, Bae SJ, Kim WM, Lee DH, Cho U, Lee MH, et al. Molecular characteristics of the inhibition of human neutrophil elastase by nonsteroidal antiinflammatory drugs. Exper Mol Med. 2000;32(3):146.
20. Escrig V, Ubeda A, Ferrandiz M, Darias J, Sanchez J, Alcaraz M, et al. Variabilin: a dual inhibitor of human secretory and cytosolic phospholipase A2 with anti-inflammatory activity. J Pharmacol Exper Therap. 1997;282(1):123-31.
21. Johansson S. Studies on cytotoxic and neutrophil challenging polypeptides and cardiac glycosides of plant origin. Uppsala University; 2001.
22. Keyzers RA. The isolation of biologically active secondary metabolites from New Zealand marine organisms [[PhD Thesis]. New Zealand: Victoria University of Wellington; 2003. p. 163-7.
23. Keyzers RA, Davies-Coleman MT. Anti-inflammatory metabolites from marine sponges. Chem Soc Rev. 2005;34(4):355-65.
24. Hong S, Kim SH, Rhee MH, Kim AR, Jung JH, Chun T, et al. In vitro anti-inflammatory and pro-aggregative effects of a lipid compound, petrocortyne A, from marine sponges. Naunyn-Schmiedeberg's Arch Pharmacol. 2003;368(6):448-56.
25. Shapiro S. Proteinases in chronic obstructive pulmonary disease. Biochemical Society Transact. 2002;30:98-102.
Recibido: 2 de octubre de 2013.
Aprobado: 5 de diciembre de 2013.
Marlene Duran Lengua. Facultad de Ingeniería. Universidad de Cartagena. Campus Universitario Piedra de Bolivar. Cartagena de Indias, Colombia. Correo electrónico: marlene_duran@hotmail.es, mduranl@unicartagena.edu.co