Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.48 no.2 Ciudad de la Habana abr.-jun. 2014
PRODUCTO NATURAL
Validación de un método por CLAR para la cuantificación de L-prolina en la tintura al 20 % de Murraya paniculata L. Jack
Validation of a high performance liquid chromatography method for quantitation of L-proline in 20 % tincture from Murraya paniculata L. Jack
MSc. Noel Varona Torres,I DraC. Yamilet Irene Gutiérrez Gaitén,II MSc. Celia Magaly Casado Martín,II MSc. Adalberto Izquierdo Castro,I MSc. Rodny Montes de Oca PortoIII
I Laboratorio de Producción Farmacéutico NOVATEC. La Habana, Cuba.
II Instituto de Farmacia y Alimentos. Universidad de La Habana. . La Habana, Cuba.
III Instituto de Medicina Deportiva. La Habana, Cuba.
RESUMEN
Introducción: la búsqueda de técnicas analíticas para el control de la calidad de los medicamentos constituye un aspecto de gran interés en el campo farmacéutico, más si van dirigidas al estudio del o los marcadores químicos de las plantas medicinales, sus extractos y fitomedicamentos.
Objetivo: validar un método de cromatografía líquida de alta resolución (CLAR) para la determinación cuantitativa del aminoácido L-prolina como sustancia marcador en la tintura de Murraya paniculata L. Jack.
Métodos: en el método por CLAR, la separación se realizó en una columna C-18 (UP5ODB-150/046), se utilizó como fase móvil una mezcla de solución buffer fosfato, pH ajustado a 2,4 y acetonitrilo (70:30 v/v), con una velocidad de flujo de 0,6 mL/min, modo isocrático, con detección ultravioleta a 440 nm. El volumen de inyección de la muestra fue de 20 µL. El método fue validado según la categoría I, siguiendo las exigencias internacionales.
Resultados: la curva de calibración fue lineal en el rango de concentraciones ensayadas (30 a 375 µg/mL), se observó una buena precisión con coeficientes de variación menores del 2 %. Los valores de recobrado estuvieron dentro de los límites establecidos para los métodos cromatográficos (98-102 %). Se demostró la especificidad del método, al no presentarse interferencias de picos adicionales en la zona de elusión del compuesto de interés (L-prolina).
Conclusiones: el método analítico por CLAR, validado para la cuantificación del aminoácido L-prolina en la tintura de M. paniculata, demostró ser lineal, preciso, exacto y específico bajo las condiciones de estudio.
Palabras clave: Murraya paniculata L., L-prolina, marcador químico, cromatografía líquida de alta resolución (CLAR), control de la calidad.
ABSTRACT
Introduction: the search for analytical methods that may monitor the quality of drugs is an issue of great interest in the pharmaceutical field, even more if they are directed to studying chemical markers of medicinal plants, their extracts and phytomedicines.
Objective: to validate a high-resolution liquid chromatography (HPLC) method for the quantitative determination of the L-proline amino acid as a marker substance in Murraya paniculata L. Jack tincture.
Methods: in the HPLC, the separation was performed on a C-18 (UP5ODB-150/046) column, with a mixture of phosphate buffer solution, pH adjusted to 2.4 and acetonitrile (70:30 v/v) used as mobile phase, the flow rate was 0.6 mL/min, isocratic mode with UV detection set at 440 nm. The injection volume of the sample was 20 µL. The method was validated according to category I, following international requirements.
Results: the calibration curve was linear over the concentration range tested (30-375 mg/mL), good precision was observed with a variation coefficient less than 2 %. Recovery values were within the limits for chromatographic methods (98-102 %). The method was specific since there was no-interference by additional peaks in the elution zone of the compound in question (L-proline).
Conclusions: the HPLC analytical method, validated for the quantification of L-proline amino acid in M. paniculata tincture, proved to be linear, precise, accurate and specific under the study conditions.
Key words: Murraya paniculata L., L-proline, chemical marker, high performance liquid chromatography (HPLC), quality control.
INTRODUCCIÓN
La búsqueda de técnicas analíticas para el control de la calidad de los medicamentos constituye un aspecto de gran interés en el campo farmacéutico, más si van dirigidas al estudio del o los marcadores químicos de las plantas medicinales, sus extractos y fitomedicamentos, con vistas a establecer criterios cualitativos y cuantitativos de calidad para garantizar su seguridad y eficacia. En este sentido, deben seguirse diferentes vertientes en dependencia del conocimiento disponible en cuanto a los principios activos; si son conocidos y aceptados, deberán ser cuantificados empleando un método analítico apropiado. Si los componentes activos son desconocidos o están en discusión, el extracto total se reconoce como el "principio activo", y en ese caso deberán analizarse compuestos marcadores en el control de la calidad.1,2
Teniendo en cuenta, que el resurgir del uso de los productos naturales en los países del tercer mundo, es también, debido a una necesidad primaria en los sistemas de salud y en la estructura económica, es que se considera de suma importancia el estudio de la tintura de Murraya paniculata L. Jack, muy utilizada en el tratamiento de los síntomas y signos de inflamación y dolor asociados a enfermedades osteomioarticulares.
La tintura está incluida en el Formulario Nacional de Fitofármacos y Apifármacos del Ministerio de Salud Pública de Cuba,3 con una norma provisional que contempla algunos parámetros físico-químicos, pero adolece de estudios que permitan su control químico.
Estudios fitoquímicos realizados a la tintura por nuestro grupo de investigación demostraron que uno de los constituyentes químicos que pudieran estar relacionados con las propiedades farmacológicas informadas3 es la L-prolina, un aminoácido no esencial que presenta efecto antiinflamatorio y es importante para restaurar la fluidez en las junturas, tendones y huesos. Sus beneficios como suplemento dietético están dirigidos principalmente a la estructura y mantenimiento del cuerpo, y es fundamental en el tratamiento de la osteoartritis.4,5
Con el propósito de contar con un método rutinario que permita el control químico de calidad de la tintura de M. paniculata, el trabajo persiguió como objetivo validar un método de cromatografía líquida de alta resolución para la determinación cuantitativa del aminoácido L-prolina como sustancia marcador del fitopreparado.
MÉTODOS
Se utilizaron muestras de tintura de M. paniculata y como estándar de referencia L-prolina (99 % de pureza, procedente de la Merck).
En el desarrollo del método analítico por cromatografía líquida de alta resolución se empleó un cromatógrafo líquido Smartline (Knauer, Alemania) compuesto por una interfase Manager 5000, una bomba cuaternaria S-1000, horno para columnas (Knauer), autoinyector Marathon 3800 (Knauer), detector UV-2500 todo integrado al programa ClarityChrom v 2.4 para la adquisición, procesamiento y reporte de datos (Knauer, Alemania). Las condiciones cromatográficas más adecuadas de trabajo fueron las siguientes:
- Fase móvil: solución buffer fosfato pH= 2,4: acetonitrilo (70:30 v/v)
- Detector UV: 440 nm
- Flujo: 0,6 mL/min, modo isocrático
- Volumen de inyección: 20 µL
- Columna: C-18 (UP5ODB-150/046), No de serie 1105333, lote A-5-7130, fabricante (Interchim, Francia).
- Temperatura de la columna: 25 ºC
El método fue validado según la categoría I, siguiendo las exigencias internacionales.6-9 Se determinaron los parámetros siguientes:
Linealidad: en la comprobación de la linealidad se procedió a realizar una curva de calibración de área vs. concentración del estándar (L-prolina) en el orden de 30, 50, 200, 300 y 375 µg/mL. Se efectuó un análisis de regresión lineal para determinar los coeficientes de correlación r (≥ 0,99) y coeficiente de determinación r2 (≥ 0,98), una prueba de linealidad para definir el coeficiente de variación de los factores de respuesta (CVf) el cual debe ser ≤ 5 %, la significación estadística de la varianza de la pendiente donde la desviación estándar relativa (Sbrel) debe ser ≤ 2 % y la prueba de proporcionalidad para el intercepto donde t experimental< ttabulada, demostrándose que este no debe ser significativamente diferente de cero.
Precisión: la precisión se evaluó en términos de repetibilidad y precisión intermedia.
- Repetibilidad: se realizó a través del análisis de los valores de áreas obtenidos tras la inyección en el equipo de múltiples alícuotas de la tintura. Se efectuaron 10 inyecciones, cada una de 20 µL. El criterio de aceptación es un coeficiente de variación (CV) ≤ 2 %.
- Precisión intermedia: se efectuó con la misma tintura, pero inyectada seis veces, por cada analista, días diferentes (dos analistas, dos días). Como criterio se exige que el coeficiente de variación (CV) sea ≤ 2 %.
Se realizó una prueba de significación de Fischer donde Fexperimental < Ftabulada para demostrar que las precisiones son similares y una prueba de significación de t Student mediante la cual se determina que no existen diferencias significativas entre las medias alcanzadas por los analistas al ser texperimental < ttabulada.
Exactitud: se realizó el estudio por el método de adición de patrón. Para ello, se prepararon tres muestras por adición de cantidades exactas de analito patrón (L-prolina) a las concentraciones de 30, 200 y 375 µg/mL del contenido teórico y cada muestra se analizó por triplicado. Se determinó estadísticamente la relación entre las concentraciones calculadas y añadidas, a través de una curva de recuperación, y para verificar que no existían diferencias significativas entre el porcentaje de recobrado promedio y el 100 % de recobrado, se realizó la prueba t de Student. Se aplicó además el ensayo de Cochran (G) con vistas a comprobar si la variación de la concentración producía diferencias significativas en los resultados.
El porcentaje de recobro se calculó por la expresión siguiente:
![]()
El método es exacto si se obtienen porcentajes de recobrado entre un 98 y 102 %, si el coeficiente de variación total es ≤ 2 % y si los resultados del análisis de regresión lineal cumplen con los criterios de aceptación para la linealidad (coeficiente de correlación (r) ≥ 0,99, coeficiente de determinación (r2) ≥ 0,98; en la significación estadística de la varianza de la pendiente la desviación estándar relativa (Sbrel) debe ser ≤ 2 % y en la prueba t de proporcionalidad para el intercepto t experimental debe ser menor que ttabulada.
Especificidad: para demostrar este parámetro se sometieron las muestras (sustancia de referencia y tintura de M. paniculata) a hidrólisis ácida con ácido clorhídrico al 1 N (reflujo una hora) e hidrólisis alcalina con hidróxido de sodio al 1 N (reflujo 1 h). Posteriormente todas fueron inyectadas en el equipo y se desarrolló el método, se obtuvieron los cromatogramas correspondientes para analizar si existía solapamiento o no entre el compuesto de interés (L-prolina) y sus productos de degradación.
Las muestras sometidas a hidrólisis también fueron analizadas por cromatografía en capa delgada con vistas a detectar posibles degradaciones por las vías evaluadas.
El método se considera específico si:
- No aparecen nuevas señales en el cromatograma y (o) de aparecer, no deben interferir con el tiempo de retención correspondiente al analito de interés.
- El método debe ser capaz de detectar únicamente el analito o en su defecto, separarlo de sus impurezas y (o) productos de degradación, si aparecen durante la degradación artificial.
Los parámetros de validación se procesaron matemáticamente utilizando el paquete estadístico Statgraphic Plus 5.0.
RESULTADOS
En el estudio de linealidad se obtuvo una curva de calibración con la ecuación de la recta Y= 1,1711X + 0,013, un coeficiente de correlación lineal (r) de 0,9992 (≥ 0,99) y un coeficiente de determinación (r2) de 0,9984 (≥ 0,98).
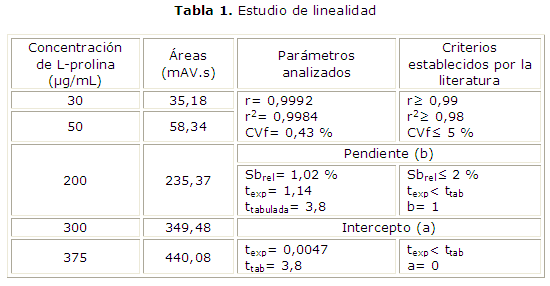
En la prueba de proporcionalidad para el intercepto, el valor de texperimental fue de 0,0047, menor que la ttabulada (3,18) y una probabilidad (p) de 0,9963, mayor de 0,05, lo que demuestra que el intercepto no es significativamente diferente de cero para un 95 % de confianza. Los resultados de la significación estadística de la varianza de la pendiente mostraron una desviación estándar relativa (Sbrel) de 1,02 %, la texperimental= 1,14 menor que el valor tabulado (3,18), cumpliéndose la hipótesis nula de b= 1 para un nivel de confianza del 95 %. La prueba de linealidad mostró un coeficiente de variación de los factores de respuesta (CVf) de 0,43 %, inferior al normado (≤ 5 %), lo que evidencia que los factores de respuesta fueron semejantes entre sí. La tabla 1 muestra los resultados del estudio de linealidad.
En la tabla 2 y 3 se recogen los resultados del estudio de repetibilidad y precisión intermedia respectivamente. Como queda demostrado se observa una buena precisión con CV menores al 2 %. Se define que la precisión en condiciones intermedias su CV debe ser igual o mayor que la repetibilidad, aspecto que se cumple en el estudio y que fue confirmado por la prueba de Fischer.
Los resultados del ensayo de exactitud se muestran en la tabla 4. Como se puede apreciar, el porcentaje de recuperación de analito (L-prolina) estuvo dentro del intervalo exigido (98-102 %), no existieron diferencias significativas entre el recobrado promedio (100,21 %) y el 100 %, al ser t experimental< ttabulada (0,34< 4,30). El coeficiente de variación resultó ser (1,81 %) menor del 2 %.
Al evaluarse estadísticamente el gráfico del porcentaje de L-prolina calculado contra el añadido, se cumplió con los criterios de aceptación para la linealidad. La curva de regresión lineal obtenida tuvo una ecuación de la recta Y= 1,0099X - 0,09 con un coeficiente de correlación (r) de 0,999 y un coeficiente de determinación de 0,998.
El intercepto de la recta no fue significativamente diferente de cero al ser texperimental (-0,39) menor que la ttabulada (3,18). Por su parte, la significación estadística de la varianza de la pendiente mostró una desviación estándar relativa de 0,92 %, menor del 2 %.
Como resultado del estudio de especificidad, los productos de degradación generados durante el proceso de hidrólisis ácida y alcalina no interfieren con la determinación de L-prolina, al no encontrarse solapamiento entre los picos, bajo las condiciones ensayadas. En las figuras 1 y 2 se representan los cromatogramas del análisis por CLAR y cromatografía en capa delgada respectivamente, de la sustancia de referencia y las muestras de tintura de M. paniculata, posterior a los procesos degradativos.
DISCUSIÓN
Los resultados (tabla 1) manifestaron la linealidad del método propuesto. La curva de calibración obtenida se comportó de forma lineal en el rango de concentraciones evaluadas, cumpliendo con la ley de Lambert-Beer; se obtuvieron coeficientes de correlación lineal (r) y de determinación (r2) superiores a los exigidos, existiendo una correlación con un grado de probabilidad elevada, así como, un grado de relación entre las variables concentración y respuesta detectada por el equipo empleado, al ser r cercano a la unidad.6-9
La prueba de linealidad evidenció un coeficiente de variación de los factores de respuesta inferior al normado (≤ 5 %), lo que evidencia que los factores de respuesta fueron semejantes entre sí. Se demostró que el intercepto no difiere significativamente de cero para un 95 % de confianza. Los resultados de la significación estadística de la varianza de la pendiente mostraron una desviación estándar relativa (Sb rel) menor del 2 % que es el valor establecido por la literatura y la pendiente fue cercana a la unidad.7
Los resultados del estudio de repetibilidad (tabla 2) mostraron que el ensayo cumple con el requisito establecido de ser el coeficiente de variación (CV) menor del 2 %. El ensayo de precisión intermedia (tabla 3) evidenció que no existían diferencias significativas entre las precisiones alcanzadas por los dos analistas en días diferentes, al efectuarse la prueba de significación de Fischer, siendo Fexperimental (0,37) < Ftabulada (4,54). Una vez demostrada que las precisiones eran similares, se aplicó una prueba t de Student mediante la cual se determinó que no existían diferencias significativas entre las medias alcanzadas por los analistas al ser texperimental (0,47)< ttabulada (2,23).
Los valores de porcentaje de recobrado estuvieron dentro de los límites establecidos para los métodos cromatográficos (98-102 %), y los valores del coeficiente de variación para cada concentración estudiada y el total, resultaron ser menores del 2 %. Al aplicar la prueba de Cochran (G) se obtuvo que Gcalculada fue menor que Gtabulada (probabilidad de 0,05; k= 3; n= 3); por lo tanto, las varianzas de las tres concentraciones empleadas son equivalentes, lo que indica que la concentración no influye en la variabilidad de los resultados.7-9
De acuerdo con los resultados que se exponen en la figura 1, relacionados con la especificidad del método, las muestras sometidas a hidrólisis ácida generaron un producto(s) de degradación (PD1) con un valor de tiempo de retención mayor que el compuesto de interés (P), o sea, un pico de pequeña intensidad con un tiempo de retención de 2,76 min (Fig. 1) (A) para el patrón degradado y 2,73 min para la tintura sometida a las mismas condiciones (Fig. 1) (C), el cual pudiera estar relacionado con la mancha 2 de Rf= 0,29 que se evidencia en la figura 2.
Como resultado de la hidrólisis alcalina también se generaron productos de degradación que se reflejaron en el cromatograma con un pico de mayor intensidad (PD2) que el producto obtenido de la hidrólisis ácida (PD1), y menor tiempo de retención que la sustancia de interés, es decir, 1,85 min (Fig. 1) (B) y 1,88 min (Fig. 1) (D) para el patrón y la tintura respectivamente, el cual pudiera estar en correspondencia con la mancha 1´ de color amarillo de Rf= 0,08 que aparece en la cromatoplaca de la figura 2. Bajo estas mismas condiciones, en la tintura aparece otra nueva señal a un tiempo de 14,42 min (PD3), que no interfiere con la del marcador químico.
En ambos estudios de degradación artificial, se encontró una disminución en los valores de áreas del marcador químico (L-prolina) respecto a las muestras sin degradar, por tanto, el método también es capaz de detectar los posibles cambios por degradación del compuesto de interés bajo las condiciones de estudio.
Con los resultados obtenidos se demuestra la especificidad del método,7-9 al no presentarse interferencias de picos adicionales en la zona de elusión del producto de interés (L-prolina), ya que los productos de degradación presentan tiempos de retención diferentes al marcador químico.
En conclusión, el método analítico por CLAR, validado para la cuantificación del aminoácido L-prolina en la tintura de M. paniculata, demostró ser lineal, preciso, exacto y específico bajo las condiciones de estudio, ya que cumple con los criterios de aceptación establecidos en la literatura para estos parámetros, lo cual demuestra su utilidad en el control de dicho marcador químico en la preparación.
REFERENCIAS BIBLIOGRÁFICAS
1. Regulación No. 28. Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED). Ministerio de Salud Pública. Ministerio de Salud Pública. La Habana, Cuba. 2000. p. 4-5.
2. Regulación No. 28. Requisitos para las solicitudes de inscripción, renovación y modificación en el registro de medicamentos de origen natural de uso humano. Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED). Ministerio de Salud Pública. Ministerio de Salud Pública. La Habana, Cuba. 2002.
3. Ministerio de Salud Pública. Dirección Nacional de Farmacias. Formulario Nacional Fitofármacos y Apifármacos. La Habana: Editorial Ciencias Médicas; 2010. p. 75-7.
4. Doulgkeris CM, Galanakis D, Kourounakis AP, Tsiakitzis KC, Gavalas AM, Eleftheriou PT, et al. Synthesis and pharmacochemical study of novel polyfunctional molecules combining anti-inflammatory, antioxidant, and hypocholesterolemic properties. Bioorg Med Chem Lett. 2006;6(4):825-9
5. Méndez A. The Function and Uses of L-Proline. 2010. ID 4589629.
6. Quattrochi OA, de Andrizzi SA, Laba RF. Introducción a la HPLC. Aplicación y práctica. Buenos Aires: Artes Gráficas Farro SA; 1992. p. 301-28.
7. Fernández A, Rosales I. Segundo Taller Nacional de Validación. Validación de métodos analíticos. 1996. p. 5-47.
8. ICH. International Conference on Harmonisation. Validation of Analytical Procedures: Text and Methodology. Commission of the European Communities. 2005. p. 1-10.
9.The United Stated Pharmacopoeia 33 and National Formulary 28 (USP33-NF28). Washington: The United States Pharmacopeial Convention, Inc; 2010. p. 773.
Recibido: 4 de noviembre de 2013.
Aprobado: 20 de diciembre de 2013.
Noel Varona Torres . Laboratorio de Producción Farmacéutico NOVATEC. Ave 15 No. 216A03 e/ 216A y 222. Atabey, Playa. La Habana, Cuba. Correo electrónico: ygutierrez@infomed.sld.cu