Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.48 no.2 Ciudad de la Habana abr.-jun. 2014
PRODUCTO NATURAL
Determinación de biflavonoides en diferentes partes de la especie Garcinia bakeriana (Urb) Borhidi
Determination of biflavonoids in different parts of Garcinia bakeriana (Urb) Borhidi
Lic. Ahmed Al-Shaghdari, DrC. Adonis Bello Alarcón, DrC. Osmany Cuesta-Rubio
Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
RESUMEN
Introducción: el género Garcinia produce una gran variedad de metabolitos secundarios representados por xantonas, acilfloroglucinoles y biflavonoides fundamentalmente. Sin embargo, existe muy poca información sobre la composición química de las especies cubanas pertenecientes a este género.
Objetivo: determinar la presencia de 11 biflavonoides en las hojas, la corteza del tallo y el látex de Garcinia bakeriana (Urb) Borhidi.
Métodos : los extractos de las hojas, látex y la corteza del tallo de G. bakeriana fueron comparados empleando un método de cromatografía líquida de ultra alta eficacia (CLUAE) y 11 biflavonoides como sustancias de referencia.
Resultados: los biflavonoides GB-1A, GB-2A, glicósido de GB-2A, glicósido de morelloflavona, 4´´´metoxi- I3,II8-biapigenina, I3,II8-biapigenina, amentoflavona y 4´´´-metoxiamentoflavona fueron detectados como constituyentes de las hojas y la corteza del tallo de G. bakeriana.
Conclusiones: la especie G. bakeriana presenta biflavonoides como constituyentes de las hojas y la corteza del tallo. Además, la metodología de trabajo desarrollada contribuye al conocimiento de la composición química de la flora cubana y podría constituir una alternativa, rápida y de bajo consumo de disolventes, para el estudio comparativo de especies endémicas cubanas de escasa distribución y abundancia.
Palabras clave: Garcinia bakeriana , biflavonoides, CLUAE.
ABSTRACT
Introduction: previous studies have revealed genus Garcinia to be a rich source of secondary metabolites, namely xanthones, acylphloroglucinols and bioflavonoids. However, the chemical composition of Cuban species in this genus is almost unknown.
Objective: to determine the presence of 11 biflavonoids in Garcinia bakeriana leaves, latex and stem bark.
Methods: leaves, latex and stem bark extracts of G. bakeriana were compared by using an ultra high performance liquid chromatography method (UPLC) and 11 biflavonoid standards.
Results: biflavonoids GB-1A, GB-2A, GB-2A glycoside, morelloflavone glycoside, 4´´´methoxy- I3,II8-biapigenin, I3,II8-biapigenin, amentoflavone y 4´´´-methoxyamentoflavone were detected as components in G. bakeriana leaves and stem bark.
Conclusions: G. Bakeriana species has biflavonoids as components of its leaves and stem bark. The work methodology described in this paper helps to expand the knowledge about the chemical composition of the Cuban flora and may represent a rapid method with low dissolver consumption for the comparative study of poorly distributed and non abundant Cuban endemic species
Key words: Garcinia bakeriana, biflavonoids, UPLC.
INTRODUCCIÓN
Las investigaciones fitoquímicas realizadas con especies de Clusiaceae (Guttiferae) se han comportado de un modo creciente en los últimos años, debido a la gran diversidad de metabolitos secundarios con propiedades biológicas que presenta esta familia. Clusiaceae está formada por alrededor de 1 200 especies agrupadas en 45 géneros, dentro de los cuales los géneros Garcinia, Clusia y Calophyllum son los principales.1 En el género Garcinia, además de las benzofenonas que son los metabolitos fundamentales de este género, se describe la presencia de flavonoides, biflavonoides, xantonas, y en menor medida terpenoides y esteroides.2-4 En estas especies se han encontrado metabolitos secundarios con acciones farmacológicas, como: potente actividad antimicrobiana (en el tratamiento de caries, en la prevención de placas dentales, gingivitis, úlceras y estomatitis), actividad anticancerígena (en el cáncer de ovario) y algunos efectos vasculares.5-9
Los estudios fitoquímicos realizados con especies cubanas son escasos. De la especie G. aristata se aislaron y caracterizaron las aristofenonas A y B, un par de benzofenonas preniladas.10 En un estudio realizado recientemente con las hojas de G. bakeriana se identificaron 11 biflavonoides como los constituyentes principales del extracto de acetato de etilo de las hojas.11 Teniendo en cuenta estos resultados y la escasa información fitoquímica sobre la especie G. bakeriana se realiza un estudio, basado en cromatografía liquida de ultra alta eficacia (CLUAE), para determinar la presencia de 11 biflavonoides en los extractos de diferentes órganos del vegetal.
MÉTODOS
MATERIAL VEGETAL
Las hojas, el látex y la corteza del tallo de Garcinia bakeriana (Urb) Borhidi. fueron colectados en el Jardín Botánico de Santa Clara, provincia Villa Clara, en el mes de noviembre de 2008. La especie fue identificada por el doctor Víctor Fuentes Fiallo y una muestra del ejemplar se conserva en el herbario del Instituto de Investigaciones Fundamentales de la Agricultura Tropical (# 482).
El material vegetal (hojas y corteza del tallo) se secó en una estufa MLW MK-100 a 40 °C hasta obtener un valor de masa constante y se trituró en un molino MANESTI de cuchilla empleando un tamiz de 3 mm.
EXTRACCIÓN DEL MATERIAL VEGETAL
Se extrajeron 10 g del material vegetal (hojas y corteza del tallo), de forma independiente, por maceración (7 días) empleando tres disolventes en orden creciente de polaridad: hexano (extracto A), acetato de etilo (extracto B) y metanol (extracto C). Cada disolvente se removió a los 3, 5 y 7 días. En cada ocasión se utilizó 0,1 L de disolvente. Los extractos obtenidos con cada disolvente se reunieron, filtraron, concentraron a sequedad en un rotoevaporador Buchi (40 °C) y se conservaron protegidos de la luz (5 °C) hasta su utilización. El proceso de extracción se realizó por triplicado con cada órgano vegetal. El látex (1 mL) se disovió en 3 mL de acetonitrilo (grado CLAE) y después de filtrado se concentró a sequedad en el rotoevaporador (40 °C).
CROMATOGRAFÍA LÍQUIDA DE ULTRA ALTA EFICACIA
Preparación de las muestras de los extractos de G. bakeriana: aproximadamente 1 mg (de los extractos secos B, C y del látex) se pesó y se disolvió en 0,5 mL de acetonitrilo calidad CLAE. La disolución obtenida se filtró a través de un filtro (filtro CLAE, marca PANREAC) para disolventes polares. De estas disoluciones se tomaron 0,4 mL que fueron enrasados a 1 mL en un volumétrico con acetonitrilo, para obtener una concentración final de 0,8 mg/mL. Todos los volúmenes fueron medidos con micropipetas de 1 mL. Cada muestra se preparó por triplicado.
Preparación de las sustancias de referencia: se utilizaron 11 biflavonoides (BF) aislados y caracterizados anteriormente del extracto de acetato de etilo de las hojas de G. bakeriana: BF1 (GB-1A), BF2 (GB-2A), BF3 (volkensiflavona), BF4 (glicósido de GB-2A ),BF5 (glicósido de volkensiflavone), BF6 (6''-(2-hidroxi-3-metil-3-butenil)-amentoflavona), BF7(4'''-O-metil-I3,II8-biapigenina), BF8 (amentoflavona), BF9 (4'''-O-metilamentoflavona), BF10 (dihidroamentoflavona) y BF11 (I3,II8-biapigenina) (Fig. 1).
Las sustancias de referencia (BF) se disolvieron en acetonitrilo y se prepararon disoluciones a una concentración de 0,1 mg/mL en un volumétrico de 2 mL. Todas las sustancias mostraron una pureza superior al 95 % según sus espectros de RMN 1H y el análisis previo por CLUAE.
La mezcla de sustancias de referencia se preparó al mezclar 0,1 mL de cada disolución de biflavonoide.
Sistema de cromatografía líquida: se utilizó un equipo Knauer, de fabricación alemana (Platin Blue UHPLC system) GmbH, con dos bombas de ultra alta presión y un autoanalizador con un detector con arreglo de diodos programado a dos longitudes de onda: 220 y 280 nm. Las separaciones se desarrollaron con una columna analítica Kinetex XB C18 (100 × 2,1 mm DI, 2,6 μm, Phenomenex). El volumen de inyección fue de 2 µL. Como fase móvil se utilizó 0,1 % de ácido trifluoracético en agua (A) y acetonitrilo (B) a un flujo de 0,6 mL/min. Para la separación de las sustancias de referencia y los extractos se ejecutó el siguiente método en gradiente: 0-1 min (22 % B), 1-3 min (30 % B), 3-8 min (45 % B). El tiempo total máximo de corrida fue de 8 min. El análisis se realizó a 30 °C.
RESULTADOS
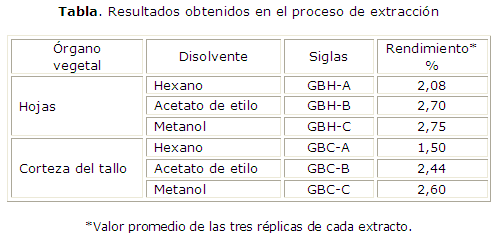
Los rendimientos de los extractos de G. bakeriana obtenidos por maceración se muestran en la tabla.
Los cromatogramas obtenidos para la mezcla de sustancias de referencia y los extractos de hojas y corteza del tallo se aprecian en la figura 2.
En el cromatograma del extracto GBC-B se detectaron siete biflavonoides: GB-1A (BF1), GB-2A (BF2), glicósido de GB-2A (BF4), glicósido de volkensiflavona (BF5), 4´´´metoxi I3-II8 biapigenina (BF7), amentoflavona (BF8) y 4´´´-metoxiamentoflavona (BF9). A los 0,79 min y 2,69 min se detectaron dos señales que no mostraron coincidencia con los patrones empleados. Los cromatogramas de GBH-C (Fig. 2) (C) y GBC-C (Fig. 2) (D) mostraron los mismos biflavonoides detectados en GBC-B y la presencia de I3,II8-biapigenina (BF11). Los biflavonoides volkensiflavona (BF3), 6''-(2-hidroxi-3-metil-3-butenil)-amentoflavona (BF6) y dihidroamentoflavona (BF10) no fueron detectados en ningún extracto. En casi todos los cromatogramas se apreciaron picos que no fueron identificados.
DISCUSIÓN
La maceración con tres disolventes en orden creciente de polaridad favoreció la obtención de tres extractos con comportamientos en cromatografía de capa delgada diferentes (resultados no mostrados). Los extractos de mediana y alta polaridad fueron los de mayor rendimiento en ambos órganos vegetales (tabla), resultado que concuerda con las publicaciones previamente realizadas con otras especies de Garcinia.12-14 Los extractos A se obtuvieron con el objetivo de realizar un desengrase inicial y favorecer la eliminación de pigmentos como las clorofilas y carotenos que entorpecen los procedimientos ulteriores. Estos mostraron una alta pigmentación y bajo rendimiento, por lo que no fueron considerados para el análisis por CLUAE.
Los extractos B y C mostraron los mejores rendimientos, lo que sugiere que la mayoría de los metabolitos secundarios presentes en los órganos vegetales estudiados son solubles en disolventes de mediana y alta polaridad. Sin embargo, los valores de rendimientos obtenidos poseen un valor limitado, pues tanto las hojas como las cortezas fueron colectadas desde un solo ejemplar. Resulta importante destacar que la especie G. bakeriana es una especie endémica de escasa distribución y que en el sitio de colección solo existía un ejemplar.
El cromatograma obtenido para la mezcla de sustancias de referencias mostró, de forma general, una buena resolución entre los picos cromatográficos. La combinación de los tiempos de retención (Tr) y el espectro UV de cada sustancia de referencia fueron la base de la identificación de los biflavonoides en cada extracto. Aunque en la mezcla de sustancias de referencias las concentraciones empleadas para cada compuesto fueron las mismas (0,1 mg/mL), el cromatograma correspondiente mostró 11 picos con intensidades diferentes. Este comportamiento se asoció al hecho que los biflavonoides empleados no poseen idénticos cromóforos e inclusive en algunos casos la diferencia de conjugación entre ellos es apreciable, sobre todo cuando se comparan dímeros de flavona y flavanona.
Los diferentes extractos fueron analizados directamente, sin previa purificación, y a una concentración (0,8 mg/mL) que se corresponde con el rango habitual (0,5-1 mg/mL) empleado en estudios de extractos totales de plantas.15,16
Algunos biflavonoides (BF1, BF2, BF4, BF5, BF7, BF8 y BF9) fueron detectados en todos los extractos de acetato de etilo y metanol evaluados, tanto en las hojas (GBH-C) como en la corteza del tallo (GBC-B y GBC-C). Aunque cada muestra se extrajo tres veces con acetato de etilo fresco, este procedimiento no parece ser suficiente para agotar totalmente el material vegetal, ya que el extracto obtenido con metanol logró extraer los mismos biflavonoides. Todos estos biflavonoides son dímeros de apigenina o de derivados estructuralmente relacionados con esta. En ambos órganos vegetales se detectaron compuestos con uniones interflavonoide I3-II8 y I3'-II8, lo que sugiere que el tipo de unión no parece estar vinculada con un órgano vegetal en particular. La presencia de dímeros de flavona o flavanona tampoco parece estar condicionada por el órgano vegetal, ya que ambos tipos estuvieron presentes tanto en hojas como en corteza del tallo. Para confirmar estas sugerencias se podrían realizar comparaciones entre órganos vegetales de diferentes especies de Garcinia que crecen en Cuba. En los extractos más polares (GBH-C y GBC-C) también se detectó la presencia de I3, II8 biapigenina (BF11), un biflavonoide ampliamente distribuido en Clusiaceae.17,18
Los biflavonoides BF3, BF6 y BF10, aislados previamente del extracto de acetato de etilo de las hojas de la especie en estudio, no fueron detectados en ningún extracto con las condiciones experimentales empleadas. Para el extracto GBC-B se realizó un análisis a una concentración más alta (1,2 mg/mL) pero se apreció una disminución de la resolución de las señales cromatográficas cercanas y las señales correspondientes a dichos flavonoides no fueron detectadas tampoco. Es importante tener en cuenta que los extractos totales de plantas son mezclas muy complejas, en que algunos metabolitos se presentan en bajas concentraciones. Por otra parte, los biflavonoides BF1-BF11 fueron aislados de las hojas de la misma planta, pero a través de procesos de fraccionamiento y separación permiten enriquecer las fracciones que contienen los metabolitos secundarios que se encuentran en bajas concentraciones.
BF5, un glicósido de biflavonoide, fue el pico más intenso en los cromatogramas de los extractos evaluados. Resulta interesante destacar que este comportamiento no fue apreciado en el cromatograma de la mezcla de las sustancias de referencia y podría sugerir la alta concentración de este compuesto tanto en las hojas como en la corteza del tallo.
Aunque los biflavonoides BF3, BF6 y BF10 no fueron detectados, no se puede concluir de forma categórica sobre su presencia o no en las muestras estudiadas.
El látex de la planta, disuelto directamente en acetonitrilo, fue también analizado por CLUAE pero mostró picos cromatográficos con Tr más altos que no coincidieron con las sustancias de referencia empleadas. Los metabolitos secundarios contenidos en el látex parecen ser más apolares y serán objeto de estudio en trabajos posteriores. No se detectó la presencia de alguno de los biflavonoides evaluados en el látex.
A manera de conclusión podemos decir que el estudio comparativo realizado por CLUAE permitió sugerir que tanto las hojas como la corteza del tallo de G. bakeriana muestran una composición química similar, caracterizada por la presencia de dímeros de apigenina con un enlace interflavonoide C-C del tipo I3-II8 o I3'-II8. Los biflavonoides GB-1A, GB-2A, glicósido de GB-2A, glicósido de volkensiflavone, 4'''-O-metil-I3,II8-biapigenina, amentoflavona y 4'''-O-metilamentoflavona fueron extraídos, tanto con metanol como con acetato de etilo, de ambos órganos vegetales, evidenciando que en la corteza del tallo y las hojas de G. bakeriana coexisten tanto aglicones como glicósidos de biflavonoides. El método de CLUAE aplicado permitió la separación e identificación de una mezcla de biflavonoides, estructuralmente relacionados, presentes en extractos totales que no fueron purificados previamente. La metodología de trabajo desarrollada contribuye al conocimiento de la composición química de la flora cubana y podría constituir una alternativa, rápida y de bajo consumo de disolventes, para el estudio comparativo de especies endémicas cubanas de escasa distribución y abundancia.
REFERENCIAS BIBLIOGRÁFICAS
1. Waterman PG, Hussain RA. Systematic Significance of Xanthones, Benzophenones and Biflavonoids in Garcinia. Biochemical Systematics and Ecology. 1983;11(1):21-8.
2. Baliga MS, Bhat HP, Pai RJ, Boloor R, Palatty PL. The chemistry and medicinal uses of the underutilized Indian fruit tree Garcinia indica Choisy (kokum): A review. Food Res Intern. 2011;44(7):1790-9.
3. Dos Santos MH, Nagem TJ, Lula IS. Complete assignment of the ¹H and ¹³C NMR spectra of the tetraisoprenylated benzophenone 15-epiclusianone. Magnetic Resonance in Chemistry. 2001;39(1):155-9.
4. Chomnawang M, Surassmo S, Nukoolkarn VS, Gritsanapan W. Effect of Garcinia mangostana on inflammation caused by Propionibacterium acnes. Fitoterapia. 2007;78(1):401-8.
5. Chen J, Yong L, Yan-Ping S. Determination of flavonoids in the flowers of Paulownia tomentosa by high-performance liquid chromatography. J Analyt Chem. 2009;64(3):282-8.
6. Carvalho-Silva LB, Oliveira MV, Gontijo VS, Oliveira WF, Derogis P, Stringheta PC, et al. Antioxidant, cytotoxic and antimutagenic activities of 7-epi-clusianone obtained from pericarp of Garcinia brasiliensis. Food Res Intern. 2012;48(1):180-6.
7. Verdi LG, Pizzolatti MG, Montanher AB. Antibacterial and brine shrimp lethality tests of biflavonoids and derivative of Rheedia gardneriana. Fitoterapia. 2004;75(1):360-3.
8. Rui-Min H, Yu-Xi T, Yin L, Chang-Hui C, Xi-Cheng A, Jian-Ping Z, et al. Comparison of flavonoids and isoflavonoids as antioxidants. J Agricult Food Chem. 2009;57(9):3780-5.
9. Jawed AS, Swarnkar G, Sharan K, Chakravarti B, Sharma G, Rawat P, et al. 8,8″-Biapigeninyl stimulates osteoblast functions and inhibits osteoclast and adipocyte functions: Osteoprotective action of 8,8″-biapigeninyl in ovariectomized mice. Art Mol Cel Endocrinol. 2010;323(2):256-66.
10. Cuesta-Rubio O, Padrón A, Vélez-Castro H, Pizza C, Rastrelli L. Aristophenones A and B A new tautomeric pair of polyisoprenylated benzophenones from Garcinia aristata. J Nat Product. 2001;64:973-5.
11. Al-Shaghdari A, Bello-Alarcón A, Cuesta-Rubio O, Piccinelli AL, Rastrelli L. Biflavonoids, Main Constituents from Garcinia bakeriana Leaves. Natural Product Communications. 2013;8(9):1237-40.
12. Douglas AK, Hee-byung C, Chung KS, William JK. The classical drug discovery approach to defining bioactive constituents of botanicals. Fitoterapia. 2011;82(1):71-9.
13. Gontijo VS, Judice WAS, Codonho B, Pereira IO, Assis DM, Januário JP, et al. Leishmanicidal, antiproteolytic and antioxidant evaluation of natural biflavonoids isolated from Garcinia brasiliensis and their semisynthetic derivatives. Eur J Med Chem. 2012;58:613-23.
14. Hong-Xi X, Sumaya M, Oluronke T, Song FL. Isolation and characterization of an antibacterial biflavonoid from an African chewing stick Garcinia kola Heckel (Clusiaceae). J Ethnopharmacol. 2013;147(2):497-502.
15. Bharathi A, Yan-Hong W, Rahul SP, Yatin JS, Troy JS, Ikhlas AK. A rapid method for chemical fingerprint analysis of Hoodia species, related genera, and dietary supplements using UPLC-UV-MS. J Pharmaceut Biomed Anal. 2011;48(3):722-31.
16. Yan Z, Sheng-Xiong H, Jian-Xin P, Jin-Rong L, Li-Sheng D, Dao-Feng C, et al. Ultra performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometric procedure for qualitative and quantitative analyses of nortriterpenoids and lignans in the genus Schisandra. J Pharmaceut Biomed Anal. 2011;56(5):916-27.
17. Yuh-Meei L, Flavin MT, Cassidy CS, Aye M, Fa-Chin C. Biflavonoids as a novel antituberculosis agent. Bioorg Med Chem Let. 2001;11(1):2101-4.
18. Castardo JC, Prudente AS, Ferreira J. Anti-inflamatory effects of hydroalcoholic extract and two biflavonoids from Garcinia garneriana leaves in mouse paw o edema. J Ethnopharmacol. 2008;118(3):405-11.
Recibido: 4 de noviembre de 2013.
Aprobado: 20 de diciembre de 2013.
Ahmed Al-Shaghdari. Instituto de Farmacia y Alimentos, Universidad de La Habana. Departamento de Farmacia. Ave 222 No. 2317 entre 23 y 29, La Coronela, La Lisa. La Habana, Cuba. Correo electrónico: osmanycr@infomed.sld.cu