Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.48 no.2 Ciudad de la Habana abr.-jun. 2014
PRODUCTO NATURAL
Actividad antiviral in vitro de un extracto acuoso del alga roja Tricleocarpa fragilis frente a virus influenza A
In vitro antiviral activity of aqueous extract from red seaweed Tricleocarpa fragilis to Influenza A virus
MSc. Amilcar Pérez-Riverol,I MSc. Alexander Piñon Ramos,II MSc. Luis Francisco Morier Díaz,II DraC. Belsy Acosta Herrera,I Lic. Olga Valdés Iglesias,III DraC. Gloria del Barrio AlonsoI
I Facultad de Biología. Universidad de La Habana. La Habana, Cuba.
II Laboratorio Nacional de Referencia de Virus Influenza. Instituto de Medicina Tropical "Pedro Kourí". La Lisa. La Habana. Cuba.
III Centro de Bioproductos Marinos (CEBIMAR). La Habana, Cuba.
RESUMEN
Introducción: los virus influenza constituyen importantes patógenos de humanos que anualmente causan alrededor de 500 000 muertes a nivel mundial. La emergencia de variantes virales resistentes a los fármacos antiinfluenza disponibles, motiva la búsqueda de nuevos antivirales. Los extractos obtenidos a partir de algas pueden ser empleados con esta finalidad, teniendo en cuenta la diversidad de metabolitos secundarios descritos en estos organismos.
Objetivo: evaluar la actividad antiviral in vitro de un extracto acuoso del alga roja Tricleocarpa fragilis frente a virus influenza A(H1N1) y A(H3N2).
Métodos: se determinó el valor de concentración citotóxica media (CC50) empleando el ensayo de reducción de MTT en células MDCK . El cálculo de la concentración inhibitoria media (CI50) se realizó mediante un ensayo de hemaglutinación y de inhibición del efecto citopático (ECP) en células MDCK. El índice selectivo (IS) se calculó a partir de la relación IS= CC 50/CI50.
Resultados: el extracto acuoso de T. fragilis no resultó tóxico en las células MDCK, en el rango de concentraciones evaluadas. El alga inhibió la replicación in vitro de virus influenza A(H1N1), A(H3N2) con valores de IS> 11,4 y 106, respectivamente.
Conclusiones: el extracto acuoso de T. fragilis posee actividad antiviral frente a virus influenza A y puede ser empleado en el desarrollo de fármacos antiinfluenza novedosos. Este trabajo constituye el primer informe sobre la actividad antiviral de esta especie de alga.
Palabras clave: virus influenza, antiviral, Tricleocarpa fragilis, algas.
ABSTRACT
Introduction: influenza viruses are major human pathogens that cause over 500 000 deaths every year. The emergence of viral variants resistant to approved antiviral drugs has prompted the search for new anti-influenza compounds. Alga could be used as a source for the development of new anti-influenza drugs, taking into account the diversity of secondary metabolites previously described in these organisms.
Objective: to evaluate the in vitro antiviral activity of aqueous extract of the red seaweed Tricleocarpa fragilis against influenza A virus.
Methods: the mean citotoxicity (CC50) concentration of the extract was determined by using the MTT reduction assay in MDCK cells. The mean inhibitory concentration (CI50) was estimated by means of viral protein (hemagglutinin) test and a cytopathic effect inhibition test in MDCK cells. The Selective index was calculated from (SI)= CC50/IC50.
Results: T. fragilis was not toxic at the concentrations evaluated in MDCK cells. The aqueous extract inhibited in vitro influenza A(H1N1) and A(H3N2) virus replication with SI values > 11.4 and 106; respectively.
Conclusions: aqueous extract of T. fragilis showed in vitro anti-influenza activity and can be employed as a source for new antiviral drugs. This paper was the first report for the antiviral activity of T. fragilis.
Key words: influenza virus, antiviral, Tricleocarpa fragilis, seaweeds.
INTRODUCCIÓN
Los virus influenza A (Orthomyxoviridae) constituyen importantes patógenos humanos que causan epidemias estacionales y pandemias. La terapia antiviral resulta una importante estrategia de tratamiento de las infecciones provocadas por estos virus. Hasta el momento han sido aprobados para su uso dos grupos de fármacos, los inhibidores de la proteína M2 (adamantanos) y de la neuraminidasa (NA). Sin embargo, el empleo de estos fármacos está amenazado por el aumento en la circulación de virus influenza A resistentes a ambos grupos de fármacos.1,2 Esta situación resalta la necesidad de desarrollar nuevos compuestos, que adicionalmente, actúen sobre otras dianas virales.
Las algas son una alternativa para la obtención de nuevos fármacos antiinfluenza, teniendo en cuenta la diversidad de metabolitos secundarios con estructuras novedosas descritos en estos organismos. Las condiciones ambientales en las que se desarrollan, las convierten en una fuente muy atractiva para la búsqueda de moléculas de interés farmacológico.3 Entre los miembros del Phyllum Rhodophyta (macroalgas rojas) han sido descritos una gran variedad de compuestos con actividad antiinflamatoria, neuroprotectora, antihelmíntica, antioxidante, antitumoral y antibacteriana.4 Adicionalmente los miembros de este Phyllum exhiben actividad antiviral frente a varios virus patógenos de humanos. Metabolitos aislados de varias especies de algas rojas mostraron actividad frente a HHV1 y HHV2,5,6 VIH7 y DENV-2, DENV-3 y DENV-4.8 Varios autores describieron la actividad antiinfluenza de miembros de Rhodophyta. Un extracto acuoso del alga roja Ceramium rubrum (Huds) inhibe la replicación de los virus influenza A in vitro e in ovo.9 La fracción polisacarídica del alga roja Gracilaria lemaneiformis posee actividad frente a una cepa de virus influenza A(H1N1) estacional.10 Recientemente, varios trabajos informaron que κ-carragenanos e iotas carragenanos identificados a partir de miembros de Rhodophyta poseen una elevada actividad inhibitoria frente a virus influenza A.11,12
Este trabajo tiene el objetivo de evaluar la actividad antiviral in vitro de un extracto acuoso del alga roja Tricleocarpa fragilis frente a virus influenza A(H1N1) y A(H3N2). T. fragilis (Linnaeus) Huisman & Townsend, 1993 (Rhodophyta) es una especie ampliamente distribuida en la plataforma insular. Hasta el momento, los estudios de caracterización química de T. fragilis son escasos. Por otra parte, no existen informes previos relacionados con actividad biológica y farmacológica de la especie en Cuba. La evaluación in vitro de actividad antiviral de T. fragilis podría conducir a la obtención de nuevos candidatos para el desarrollo de fármacos activos frente a virus influenza.
MÉTODOS
CEPAS VIRALES
Para la evaluación de la actividad antiviral se emplearon las cepas A/HABANA/190/2006 de virus influenza A(H1N1); obtenida a partir del banco de muestras clínicas del Laboratorio Nacional de Referencia de Virus Influenza del Instituto de Medicina Tropical ¨Pedro Kourí¨, La Habana, Cuba y la cepa patrón A/PANAMÁ/2007/1999 de virus influenza A (H3N2), donada por el Centro Colaborador para la Influenza de la OMS en Londres.
EXTRACTO DE ALGAS
El muestreo de T. fragilis se realizó en la Playa de Baracoa, Artemisa (23º02'84"N- 82º34'34"W), de la costa norte Occidental de Cuba, en mayo de 2009. Se procedió a la identificación taxonómica de la especie por el doctor Arsenio Areces Mallea, investigador del Instituto de Oceanología según Littler y Littler13 y a su homologación con la especie depositada en la colección Vaucher del Acuario Nacional de Cuba, con el número IdO 345. El extracto acuoso se preparó a partir de la maceración en buffer fosfato 0,1 M, pH 7,2 siguiendo el procedimiento descrito por Shiomi, Kamiya y Shimizu.14 Previo a la extracción, las muestras fueron molidas y homogeneizadas, y los extractos se prepararon, en proporción 1:10 (alga:buffer). Los extractos fueron mantenidos a 10 °C, con agitación periódica, filtrados, centrifugados a 10 000 x g, concentrados al vacío por evaporación rotatoria a 50 °C y secados por liofilización con N líquido.
Para la realización de los ensayos el extracto se disolvió en Medio MEMgane a una concentración final de 5 000 µg.mL-1.
MEDIOS DE CULTIVO Y LÍNEA CELULAR
- Medio de crecimiento: medio MEMgane (medio esencial mínimo suplementado con glutamina y aminoácidos no esenciales) (GibcoTM, EUA) y suero fetal bovino inactivado (SFBI) al 10 % (SIGMA®, EUA).
- Medio de inoculación: medio MEMgane (GibcoTM, EUA) suplementado con Tripsina (Himedia®, España) a 2 µg.mL-1 y penicilina-estreptomicina (Invitrogen®, EUA) a 5 unid/mL. Los ensayos de citotoxicidad y de evaluación de actividad se realizaron en la línea celular MDCK (ATCC-CCL34). Se emplearon los subcultivos del 18-30.
ENSAYO DE CITOTOXICIDAD
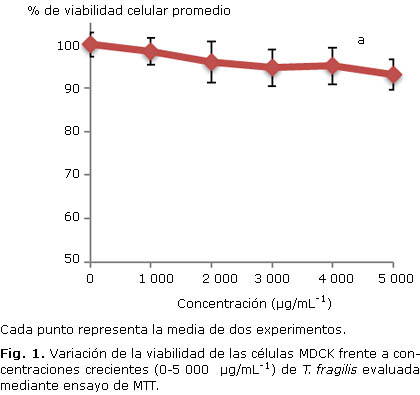
Para la determinación de la citotoxicidad del extracto en las células MDCK, se empleó el ensayo de reducción del bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difenil-2H-tetrazolio (MTT) (SIGMA, EUA), a una concentración final de 500 µg.mL-1.15 El rango de concentraciones del extracto de T. fragilis evaluado fue de 1 000-5 000 µg.mL-1. Los cristales de formazan se resuspendieron empleando 100 µL de dimetil-sulfóxido anhidro (Panreac®, India) por pocillo. La lectura de los resultados se realizó a una absorbancia de 560 nm, con filtro de referencia de 620 nm, empleando un espectrofotómetro lector de placas multipozos (MRX Revelation, Dynex Technologies, EUA) con el programa integrado Dynex Revelation 4.02. El porcentaje de viabilidad celular asociado a cada concentración del extracto se calculó dividiendo el valor medio de la absorbancia de los cultivos tratados con dicha concentración entre el valor medio de absorbancia de los controles de células (sin tratar), los cuales se consideraron el 100 % de viabilidad celular. Se determinó el valor de la CC50 empleando dos réplicas del ensayo y mediante regresión lineal a partir de la ecuación de la línea de tendencia de la curva dosis-respuesta, obtenida al graficar (concentración del extracto-porcentaje de viabilidad celular).
EVALUACIÓN DE LA ACTIVIDAD ANTIVIRAL IN VITRO
- Ensayo de inhibición del ECP: para la evaluación primaria de la actividad antiviral se empleó inicialmente el método de lectura de ECP,16,17 con modificaciones. Se adicionaron 100 µL del extracto disuelto en medio de inoculación a placas de 96 pocillos sembradas con monocapa confluente, cubriendo un rango de concentraciones 3 000 µg.mL-1-25 µg.mL-1 y exceptuando la columna correspondiente al control de virus. Posteriormente, se incubó la placa durante 1 h, a 37 °C, en atmósfera con 5 % de CO2 (Binder®, EUA). Pasado este tiempo, se adicionaron 20 µL de virus con 100TCID50/mL a cada pocillo, exceptuando la columna correspondiente al control de células. Las placas se incubaron a 37 °C, en atmósfera con 5 % de CO2 (Binder®, EUA) y se observaron diariamente durante 72 h. Para cada concentración del extracto se determinó el porcentaje de pocillos con ECP. Se cálculo el valor de CI50 mediante regresión lineal a partir de la ecuación de la línea de tendencia de la curva dosis-respuesta. Cada ensayo se realizó por duplicado.
- Ensayo de hemaglutinación: este ensayo se realizó siguiendo el procedimiento propuesto en el Manual para el diagnóstico de laboratorio y la vigilancia virológica de influenza.18 Se utilizaron eritrocitos de gallo (0,5 %) provenientes del vivario del Instituto de Medicina Tropical ¨Pedro Kourí¨ diluidos en solución salina tamponada con fosfato (0,01 M; pH= 7).
ÍNDICE SELECTIVO
El índice selectivo se determinó a partir de la relación IS= CC50/CI50. Se empleó el valor de CI50 del ensayo de inhibición de ECP, teniendo en cuenta el resultado del análisis comparativo realizado con respecto al valor obtenido en el ensayo de hemaglutinación.
PROCESAMIENTO ESTADÍSTICO
Se empleó la prueba de Shapiro Wilk para comprobar la normalidad de los datos de absorbancia a 560 nm obtenidos en el ensayo de citotoxicidad. La dependencia lineal entre el porcentaje de viabilidad celular, del ECP y de positividad a hemaglutinación frente a las dosis del extracto, se comprobó mediante un análisis de varianza (ANOVA). Se realizó análisis de regresión lineal para determinación de los valores de CC50 y CI50. Los valores de CI50 determinados por ECP y por hemaglutinación para cada cepa, fueron comparados mediante análisis de significación estadística de pendientes, a partir de las curvas de regresión, empleando el paquete del Programa StatGraphics Plus 2.1. Los gráficos se construyeron utilizando el paquete Microsoft Office Excel® 2007.
RESULTADOS
CITOTOXICIDAD DEL EXTRACTO ACUOSO DE Tricleocarpa fragilis
La visualización al microscopio óptico no evidenció cambios morfofisiológicos considerables en las células MDCK para las concentraciones del extracto empleadas en el ensayo. La figura 1 muestra el comportamiento de la relación dosis del extracto-porcentaje de viabilidad celular. El extracto acuoso de T. fragilis no resultó tóxico en el rango de concentraciones evaluado.
ACTIVIDAD ANTIVIRAL DEL EXTRACTO DE T. fragilis FRENTE A VIRUS INFLUENZA A(H1N1) Y A(H3N2)
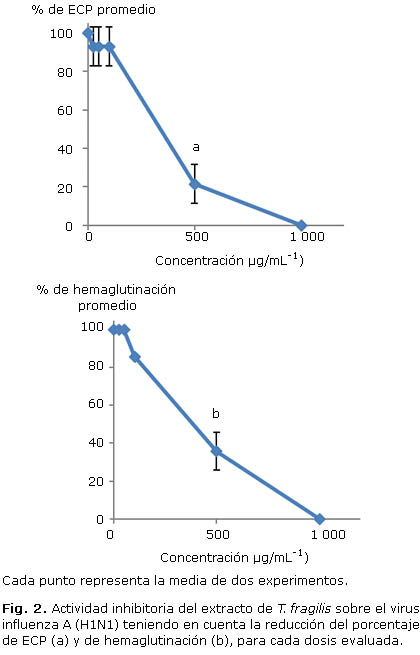
El análisis de los resultados obtenidos en los ensayos primarios de actividad antiviral mostró que el extracto acuoso de T. fragilis inhibe la multiplicación de los dos subtipos de virus influenza A evaluados en este estudio. En la figura 2 se presentan los resultados del ensayo frente a la cepa A/HABANA/190/2006 A(H1N1), empleando el método de lectura por ECP (a) y hemaglutinación (b). La evaluación de actividad mediante ensayo de inhibición de ECP evidenció una relación lineal entre las variables dosis-% de ECP promedio, según el ANOVA, con un coeficiente de correlación (R2) de 0,933. La determinación del valor de CI50 empleando la ecuación de la recta mostró un valor de 437,6 ± 13,4 µg.mL-1. La curva construida a partir de la relación dosis-% de hemaglutinación, muestra un comportamiento semejante al de la lectura a partir del ECP. El análisis comparativo de ambas curvas de regresión, demostró que el valor de CI50 calculado en este caso (472,4 ± 4,4 µg.mL-1), no posee diferencias estadísticamente significativas con respecto al valor calculado por disminución de ECP (p< 0,005). En este trabajo, todos los cálculos de IS se realizaron empleando el valor obtenido para el caso de la lectura por % de ECP. El cálculo del IS para la evaluación de actividad antiviral del extracto acuoso T. fragilis frente a influenza A (H1N1) mostró un valor de IS>11,4.
La evaluación frente al aislamiento A/PANAMÁ/2007/1999 (H3N2) mostró, para ambos tipos de marcadores, elevados niveles de actividad antiviral. Como se observa en la figura 3, las curvas construidas a partir de los valores de dosis-% ECP promedio (a), y dosis-% de hemaglutinación (b), muestran un comportamiento lineal para el intervalo de concentraciones evaluadas, obteniéndose valores de coeficiente de correlación (R2) de 0,969 y 0,986, respectivamente.
La determinación de CI50 empleando la ecuación de las rectas resultantes en ambos casos mostró valores de CI50= 47,1 ± 1,7 µg.mL-1 para la determinación por ECP y de CI50= 54,2 ± 1,2 µg.mL-1 para la lectura por hemaglutinación. En este subtipo, igualmente, no se encontraron diferencias estadísticamente significativas entre ambos valores (p> 0,005). El cálculo del índice selectivo teniendo en cuenta los resultados obtenidos en el ensayo de citotoxicidad mostró un valor de IS> 106. En la tabla se resumen los resultados de la evaluación primaria de actividad antiviral para cada uno de los extractos de algas frente a las tres cepas de virus influenza.
DISCUSIÓN
T. fragilis es una Rhodophyta ampliamente distribuida en la plataforma insular de Cuba. Teniendo en cuenta los antecedentes de obtención de compuestos de interés farmacológicos en miembros de este Phyllum, en este trabajo se evaluó la actividad inhibitoria de esta especie sobre la replicación in vitro de virus influenza A (H1N1) y A H3N2). El extracto acuoso exhibió valores de CC50 superiores a 5 000 µg.mL-1 en las células MDCK, resultado que concuerda con lo informado previamente para varios extractos de algas en esta línea celular. Un extracto del alga roja Ceramium rubrum (Huds) evidenció una CC50= 6 800 µg.mL-1.9 La determinación de CC50 del extracto acuoso de Aphanotece sacrum en células MDCK evidenció valores de 7 000 µg.mL -1.19 La ausencia de citotoxicidad del extracto acuoso de T. fragilis en el rango de concentraciones evaluado constituye un resultado muy interesante con vistas al desarrollo de nuevos fármacos antiinfluenza empleando esta alga como fuente de obtención.
Los valores de IS del extracto obtenidos frente a cada subtipo viral son indicativos de actividad inhibitoria para un extracto natural, según el criterio establecido por Vanden Berghe20 (IS> 10). En la actualidad la terapia antiviral frente a virus influenza se basa en el empleo de los inhibidores de la proteína viral M2 (amantadina y rimantadina) y de la neuraminidasa (zanamivir y oseltamivir). Los inhibidores de la proteína M2 (canal iónico) impiden el flujo de protones al interior de la partícula viral y bloquean su desemsamblaje.
El cultivo de células la CI50 de este grupo de fármacos (adamantanos) se encuentra entre 0,1-0,4 µg.mL-1.21 Debido a los elevados niveles de circulación de cepas estacionales de virus influenza A(H1N1) y A(H3N2)1 que poseen los marcadores de resistencia a los adamantanos, el uso de este grupo de fármacos ha sido prácticamente suprimido en los esquemas de terapia antiviral. Los inhibidores de la neuraminidasa exhiben valores de CI50 en el rango de 0,92 a 4,19 nM,22 en dependencia del subtipo viral empleado. Los valores de CI50 obtenidos en este trabajo son superiores a los de ambos grupos de fármacos. Este comportamiento se fundamenta al hecho de que en nuestro trabajo la evaluación se realizó empleando el extracto acuoso de T. fragilis y no metabolitos purificados a partir del alga. El fraccionamiento del extracto, la evaluación de las fracciones y la posterior purificación de los compuestos activos, podría conducir a la reducción en varios órdenes de los valores de CI50 determinados y al aumento de su efectividad.
Los niveles de actividad inhibitoria del extracto de T. fragilis son superiores a los informados para un extracto del alga roja Ceramium rubrum frente a virus influenza, el cual evidenció valores de IS= 9,5-68,3.9 Nuestros valores son semejantes a los informados para un extracto de Geranium sanguineum L. (IS= 7,3-160).23 Por otra parte, varios trabajos informan sobre la actividad antiinfluenza de compuestos aislados a partir de macroalgas.11,12 En todos los casos los valores de CI50 son inferiores a los determinados en el presente trabajo. Estas diferencias se deben igualmente a que, en estos trabajos, la evaluación se realizó empleando metabolitos purificados.
El valor de IS> 106 determinado para la cepa de virus A(H3N2) constituye un importante hallazgo teniendo en cuenta los elevados niveles de circulación de cepas de este subtipo que poseen las mutaciones que confieren de resistencia a los adamantanos. Estudios recientes muestran niveles de circulación de virus resistentes superiores al 94 % en varias regiones del planeta, incluyendo a Cuba.24 El extracto de T. fragilis podría ser empleado como candidato para la identificación y obtención de compuestos activos frente al subtipo A (H3N2), como alternativa al empleo de los adamantanos.
La ausencia de estudios de caracterización química de especies pertenecientes al género Tricleocarpa dificulta el entendimiento sobre el tipo de metabolitos que podrían estar involucrados en la actividad anti-influenza descrita en este trabajo. Sin embargo, se conoce que las especies pertenecientes al Phyllum Rhodophyta poseen elevados niveles de polisacáridos sulfatados y que este grupo de compuestos están asociados a la actividad antiviral de estas macroalgas frente a virus envueltos. El mecanismo de acción parece incluir la interacción directa entre las cargas negativas de estos metabolitos y los dominios cargados positivamente de las glicoproteínas virales.25 Varios autores informaron sobre la actividad anti-influenza de polisacáridos sulfatados como iotas-carragenanos11 y κ-carragenanos,12 identificados en especies de algas rojas.
En este trabajo se evidenciaron diferencias entre los valores de IS obtenidos para cada subtipo viral, A(H1N1)- IS> 11,4 y A(H3N2)> 106. Estas diferencias pueden ser resultado de variaciones en la afinidad de interacción de los polisacáridos sulfatados del alga con las glicoproteínas de superficie (H1, H3 y N1, N2) de los subtipos virales. La actividad inhibitoria del extracto podría involucrar mecanismos e interacciones específicas, que definen diferencias en los niveles de actividad, incluso entre subtipos. Carragenanos y galactanos aislados de las algas rojas Gymnogongrus griffithsiae y Cryptonemia crenulata, poseen actividad frente a DENV-2, pero baja o ninguna actividad frente a los restantes serotipos de virus dengue.26 Polisacáridos aislados a partir del alga Cladosiphon okamuranus poseen actividad frente a DENV-2 pero no frente a los restantes serotipos de virus dengue.27 En este caso la existencia del residuo R232 en la proteína de envoltura de DENV-2 constituye un determinante en el mecanismo de acción de los compuestos. Los sulfatos de galactanos aislados del alga roja Gymnogongrus torulosus poseen actividad inhibitoria frente a HHV-2, sin embargo, no inhiben la replicación de HHV-1.28
Teniendo en cuenta estos resultados podría sugerirse que la actividad anti-influenza observada en los ensayos primarios con T. fragilis, involucra interacciones de elevada afinidad con segmentos de las glicoproteínas H3 y N2, y de baja afinidad con H1 y N1. Un elemento adicional que sostiene esta hipótesis es la ausencia de actividad sobre virus influenza tipo B (no se muestra), en los que las proteínas de superficie poseen mayores diferencias en su secuencia primaria, sus características antigénicas y conformacionales con respecto a los virus del tipo A.
Este trabajo constituye el primer informe de actividad antiviral del alga roja T. fragilis frente a virus influenza A(H1N1) y A(H3N2). Teniendo en cuenta los elevados niveles de circulación a nivel global de cepas de influenza A resistentes a los antivirales aprobados para su uso, el hallazgo de actividad inhibitoria de este extracto constituye un resultado de interés en la estrategia de obtención de nuevos fármacos anti-influenza.
Agradecimientos
A los miembros del Laboratorio Nacional de Referencia de Virus Respiratorios de Instituto de Medicina Tropical "Pedro Kourí" (IPK), DrC. Odalys Valdés Ramírez, Tec. Bárbara Hernández, por su apoyo en los ensayos de evaluación de actividad antiviral, y especialmente a la Tec. Dianeya Mendoza Llanes del Laboratorio de Cultivo de Células del Departamento de Asistencia Científico-Técnica de la referida institución por su valiosa colaboración en el trabajo con los cultivos de células MDCK.
REFERENCIAS BIBLIOGRÁFICAS
1. Deyde VM, Xu X, Bright RA, Shaw M, Smith CB, Zhang Y, et al. Surveillance of Resistance to Adamantanes Among Influenza A(H3N2) and A(H1N1) Viruses Isolated Worldwide. J Infect Dis. 2007;196:249-55.
2. Gubareva LV, Sheu TG, Deyde VM, Okomo-Adhiambo M, Garten R, Xu X, et al. Surveillance for Neuraminidase Inhibitor Resistance among Human Influenza A and B Viruses Circulating Worldwide from 2004 to 2008. Antimicrob Agents Chemother. 2008;52(9):3284-92.
3. El Gamal AA. Biological importance of marine algae. Saudi Pharmaceut J. 2010;18:1-25.
4. Mayer AMS, Rodríguez AD, Berlinck RGS, Fusetani N. Marine pharmacology in 2007-8: Marine compounds with antibacterial, anticoagulant, antifungal, anti-inflammatory, antimalarial, antiprotozoal, antituberculosis, and antiviral activities; affecting the immune and nervous system, and other miscellaneous mechanisms of action. Comparative Biochem Physiol. 2011;5:19-22.
5. Mandal P, Pujol CA, Carlucci MJ, Chattopadhyay K, Damonte EB, Ray B. Anti-herpetic activity of a sulfated xylomannan from Scinaia hatei. Phytochemistry. 2008;69:2193-9.
6. Chattopadhyay K, Mateu CG, Mandal P, Pujol CA, Damonte EB, Ray B. Galactan sulfate of Grateloupia indica: Isolation, structural features and antiviral activity. Phytochemistry. 2007;68:1428-35.
7. Mori T, O'Keefe BR, Sowder RC, Bringans S, Gardella R, Berg S. Isolation and characterization of griffiths, a novel HIV-inactivating protein, from the red alga Griffithsia sp. J Biol Chem. 2005;280:9345-53.
8. Talarico LB, Pujol CA, Zibetti RGM, Faría PC, Noseda MD, Duarte ME, et al. The antiviral activity of sulphate polysaccharides against dengue virus is dependent on virus serotype and host cell. Antiviral Res. 2005;66:103-10.
9. Serkedjieva J. Antiviral Activity of the Red Marine Alga Ceramium rubrum. Phytother Res. 2004;18:480-3.
10. Chen M, Xie H, Yang L, Liao Z, Yu J. In vitro anti-influenza virus activities of sulfated polysaccharide fractions from Gracilaria lemaneiformis. Virologica Sinica. 2010;25(5):341-51.
11. Leibbrandt A, Meier C, Konig-Schuster M, Weinmullner R, Kalthoff D, Pflugfelder B, et al. Iota-Carrageenan is a Potent Inhibitor of Influenza A Virus Infection. Plos One. 2010;5(12):e14320.
12. Wang W, Zhang P, Hao C, Zhang XE, Cui CQ, Guan HS. In vitro inhibitory effect of carrageenan oligosaccharide on influenza A H1N1 virus. Antiviral Res. 2011;92:237-46.
13. Littler DS, Littler MM. Rhodophyta. In: Littler DS, Littler MM, editor. Caribbean Reef Plants. Washington: Off Shore Graphics; 2000. p. 66.
14. Shiomi K, Kamiya H, Shimizu Y. Purification and characterization of an agglutinin in the red alga Agardhiella tenera. Biochim Biophyc Acta. 1979;576:118-27.
15. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65:55-63.
16. del Barrio G, Parra F. Evaluation of the antiviral activity of an aqueous extract for Phyllantus orbicularis. J Etnopharmacol. 2000;72:317-22.
17. Al Jabri A, Wigg AMD, Odford JS. Initial in vitro screening of drugs candidates for their potential antiviral activities. In: Mahy BWJ, Kangro HO, editors. Virology Methods Manual. New York: Academic Press; 1996: 60-74.
18. WHO. Manual for the laboratory and virological surveillance of influenza. Suiza: WHO Press; 2010. p.4.
19. Ogura F. Hashayi K, Lee JB, Kanekiyo K, Hashayi T. Evaluation of a Edible Blue-Green Algae, Aphanotece sacrum, for Its Inhibitory effects on replication on Herpes Simple Virus Type 2 and Influenza Virus Type A. Bioscien Biotchen Biochem. 2010;74;(8):1687-90.
20. Vanden Berghe A, Vlietinck AJ, Van Hoof L. Plant products as potential antiviral agents. Bull Pasteur Institute. 1986;84:101-47.
21. Hayden F, Palese P. Influenza virus. En: Richman DD, Whiley RJ, Hayden FG editors. Clinical Virology. Washington, DC: ASM Press; 2002. p. 891-920.
22. Ferraris O, Kessler N, Lina B. Sensitivity of influenza viruses to zanamivir and oseltamivir: a study performed on viruses circulating in France prior to the introduction of neuraminidase inhibitors in clinical practice. Antiviral Res. 2005;68(1):43-8.
23. Serkedjieva J, Hay AJ. In vitro anti-influenza virus activity of a plant preparation from Geranium sanguineum L. Antiviral Res. 1998;37:121-30.
24. Piñón A, Herrera A, Valdés O, Pérez A, Arencibia A, Savón C, et. al. Adamantane and neuraminidase inhibitor resistance among circulating human influenza A viruses in Cuba during 2006-2010. Int J Antimicrob Agents. 2013;24(1):94-8.
25. Damonte EB, Matulewicz MC, Cerezo AS. Sulfated seaweed polysaccharides as antiviral agents. Curr Med Chem. 2004(11):2399-419.
26. Talarico LB, Zibetti RG, Faria PC, Scolaro LA, Duarte ME, Noseda MD, et al. Anti-herpes simplex virus activity of sulfated galactans from the red seaweeds Gymnogongrus griffithsiae and Cryptonemia crenulata. Int J Biol Macromol. 2004;34:63-71.
27. Hidari KIPJ, Takahashi N, Arihara M, Nagaoka M, Morita K, Suzuki T. Structure and anti-dengue virus activity of sulfated polysaccharide from a marine alga. Biochem Biophys Res Commun. 2008;376:91-5.
28. Pujol CA, Estevez JM, Carlucci MJ, Ciancia M, Cerezo AS, Damonte EB. Novel galactan hybrids from the red seaweed Gymnogongrus torulosus are potent inhibitors of herpes simplex virus and dengue virus. Antivir Chem Chemother. 2002;13:83-9.
Recibido: 4 de noviembre de 2013.
Aprobado: 20 de diciembre de 2013.
Gloria del Barrio Alonso . Facultad de Biología. Universidad de La Habana. Facultad de Biología. Departamento. de Microbiología y Virología. Calle 25, No.455, entre J e I, Vedado, Plaza de la Revolución, CP 10400. La Habana, Cuba. Correo electrónico: gbarrio@infomed.sld.cu