Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.48 no.3 Ciudad de la Habana jul.-set. 2014
ARTÍCULO DE REVISIÓN
El sistema citocromo P450 y el metabolismo de xenobióticos
Cytochrome P450 system and xenobiotic metabolism
MSc. Julio César Rodríguez GonzálezI, DraC. Idania Rodeiro GuerraII
I Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
II Centro de Bioactivos Marinos (CEBIMAR). La Habana, Cuba.
RESUMEN
Los organismos están constantemente expuestos a una gran variedad de xenobióticos. Las enzimas citocromo P450 participan en la fase I del metabolismo de xenobióticos, incluyendo los fármacos, y en funciones biosintéticas endógenas por reacciones de oxidación, reducción e hidrólisis. En el hombre se estima que pueden metabolizar hasta dos tercios de las drogas y la mayor parte de estas reacciones ocurre en el hígado. Estas enzimas se encuentran en todos los reinos biológicos. Actualmente se conocen más de 18 000 genes citocromo P450 organizados en familias y subfamilias según el porcentaje de identidad de secuencia de sus aminoácidos, y este número aumenta cada año con el hallazgo de nuevas secuencias del genoma. Ellas son una superfamilia de hemoproteínas monooxidasas del sistema oxidasa de función mixta localizadas en las membranas del retículo endoplasmático liso y mitocondrial interna. La diversidad de reacciones que cataliza y su amplia especificidad de sustrato lo destacan como uno de los catalizadores más diversos y versátiles conocidos y juega un papel crítico en la bioquímica, farmacología y toxicología. Se realizó una búsqueda por palabras clave en las bases de datos Pubmed y Medscape en los últimos diez años. También se consultaron sitios de Internet relacionados con investigaciones del citocromo P450 como bases de datos. Esta revisión es una actualización sobre aspectos generales del citocromo P450 y comprende una breve historia de la investigación del citocromo P450, su sistema de nomenclatura estándar; y describe su multiplicidad, la distribución a nivel de órgano y localización subcelular, estructura y función.
Palabras clave: citocromo P450, xenobióticos, metabolismo de los fármacos.
ABSTRACT
The organisms are constantly exposed to a wide array of xenobiotics. Cytochrome P450 enzymes are involved in the phase I of xenobiotic metabolism, including pharmaceuticals, and in endogenous biosynthetic functions through oxidation, reduction reactions and hydrolysis. It is estimated that cytochrome P450 can metabolize up to two-thirds of drugs present in humans and that the bulk of these reactions occur in the liver. These enzymes are found in all biological domains. More than 18 000 cytochrome P450 genes are currently known and arranged into families and subfamilies on the basis of amino acid sequence identity percentage, and this number increases each year as new genome sequences are reported. They are a superfamily of monooxidase hemoproteins in the oxidase system with mixed functions and found on the membranes of the smooth endoplasmic reticulum and in the inner mitochondrial membrane. The diversity of reactions that catalyzes and its extensive substrate specificity turn it into one of the most diverse and versatile catalysts ever known and plays a critical role in biochemistry, pharmacology and toxicology. A keyword search was performed in Pubmed and Medscape databases in the last ten years. Websites related to cytochrome P450 research as databases were also consulted. This updated review covered general aspects of cytochrome P450, a brief history of the research on this enzyme and its standard nomenclature system, and also described its multiplicity, its distribution in body organs and its sub-cellular location, structure and function.
Keywords: cytochrome P450, xenobiotics, drug metabolism.
INTRODUCCIÓN
En su evolución, los organismos vivos están sometidos a distintas presiones, que pueden ser de tipo ambientales, biológicas o químicas. Ante estas, los organismos, de alguna manera, deben reaccionar, adaptarse o perecer. Uno de los ataques más permanente proviene de los productos químicos de nuestro entorno. Dentro de ellos, hay compuestos sintéticos (cosméticos, aditivos alimentarios, pesticidas, plaguicidas organofosforados, residuales industriales, productos de uso domésticos, derivados de la combustión de carburantes, etc.), productos tóxicos naturales (micotoxinas y alcaloides), los contaminantes ambientales y fármacos. Para salvaguardarse del libre acceso de estos compuestos, los organismos interponen una serie de barreras físicas y/o biológicas. Sin embargo, una gran cantidad de sustancias extrañas a nuestro organismo burlan estos sistemas de protección y penetran a través de la piel, sangre y pulmones, y ocasionan trastornos inmediatos o a largo plazo, como los disruptores hormonales con efectos adversos en la reproducción; lo que se evita gracias a que contamos con sistemas biológicos que llevan a cabo su biotransformación y eliminación del organismo.1
Los compuestos que no son parte de la composición habitual del cuerpo, pero que son capaces de acceder a su interior, se conocen genéricamente como xenobióticos (Xbs). Al no ser utilizados como nutrientes, los Xbs no se incorporan a las rutas bioquímicas del metabolismo intermediario, y no son metabolizados por estas. Muchos son compuestos de naturaleza lipofílica (liposolubles), que pueden atravesar las membranas biológicas, acceder al interior celular, unirse a estructuras celulares de naturaleza lipofílica y pueden, en suficiente cantidad, interferir con los procesos metabólicos normales a nivel celular. Por otra parte, su excreción es dificultosa, dado que la eliminación de sustancias no volátiles se realiza a través de los fluidos acuosos, fundamentalmente la orina.2
¿Qué hace el organismo ante químicos que posiblemente encontrará una sola vez en su vida? No sería razonable para el cuerpo generar mecanismos bioquímicos, enzimas, vías de degradación y excreción para cada molécula. El sistema más eficiente involucraría un mecanismo general que se encargue de eliminar del organismo la máxima cantidad de moléculas al mismo tiempo. Para esto, los organismos cuentan con dos sistemas: el sistema del citocromo P450 (CYP450) y el sistema inmune, los cuales muestran interrelaciones.1
El CYP450 es un gran complejo enzimático no integrado en las vías del metabolismo del organismo y cuyos sustratos son fundamentalmente los Xbs. Su función es transformar sus sustratos en moléculas más polares e hidrosolubles y, por tanto, más fácilmente excretables.2
En esta revisión nos proponemos ofrecer una actualización de algunos aspectos generales del sistema multienzimático citocromo P450, su nomenclatura, multiplicidad, distribución a nivel de órgano y localización subcelular, estructura, mecanismo de acción y función en la biotransformación de Xbs. Para esto, se realizó una búsqueda por palabras clave en las bases de datos Pubmed y Medscape en los últimos diez años. También se consultaron sitios de Internet relacionados con investigaciones del citocromo P450 como bases de datos.
CARACTERÍSTICAS GENERALES DEL CITOCROMO P450
Los primeros estudios que llevaron al descubrimiento del CYP450 se enmarcan en los años 50 del siglo pasado, empleándose células hepáticas. Se identificó en 1958 como un pigmento celular reducido y unido a membrana, con un pico de absorción inusual a 450 nm.3,4 En 1964, se identificó la naturaleza hemoprotéica de un pigmento presente en los microsomas hepáticos de diferentes especies de mamíferos, que era capaz de unirse al monóxido de carbono al ser reducido por fosfato dinucleótido nicotinamida-adenina (NADPH) o por ditionita y se le sugiere el nombre de citocromo P450 por Omura y Sato,5 nombre por el que actualmente se conoce. Su función catalítica pronto se relacionó con el metabolismo de gran número de Xbs, así como de algunas sustancias endógenas como algunos mediadores hormonales, colesterol, ácidos biliares, feromonas, esteroides, aminas biogénicas, leucotrienos, vitaminas liposolubles y ácidos grasos. Al inicio los resultados obtenidos eran contradictorios en relación con sus características y funciones. Esto fue esclarecido cuando se comprobó que existían varios tipos de moléculas CYP450, incluso en individuos de una misma especie.5-8
El conjunto de enzimas que conforman el CYP450 hacen que esté presente una enorme versatilidad funcional tanto en la variedad de procesos que cataliza como en la gran diversidad de sustratos que puede transformar.2 La enorme versatilidad funcional del complejo enzimático de CYP450 juega un papel muy importante en la farmacogenética y en la toxicología ambiental, pues durante la fase oxidativa del metabolismo de ciertos fármacos, algunos tienen la capacidad de aumentar o disminuir la actividad de las enzimas del CYP450, por lo cual resulta ser un biomarcador de gran transcendencia, de exposición, efecto y de susceptibilidad, porque no solo valora las interacciones de los fármacos entre sí, sino con otros Xbs ambientales al igual que con otras interacciones del metabolismo endógeno.2,9,10 Para esto, no solo realiza reacciones de oxidación, también de reducción e hidrólisis. Salvo excepciones, el CYP450 requiere de dioxígeno (O2) y NADPH para oxidar sus sustratos por reacciones de monooxidación. Las enzimas que catalizan este tipo de oxidaciones se les denomina monooxigenasas u oxidasas de función mixta.
Dichas reacciones difieren de las catalizadas por las oxidasas del metabolismo intermediario, con formación de peróxido de oxígeno, y de las reacciones de peroxidación en las cuales el átomo de O2 introducido en el substrato procede de peróxidos y no del O2. Entre las oxidaciones catalizadas por este sistema enzimático tenemos: hidroxilaciones aromáticas y alifáticas, N- y S-oxidaciones, epoxidaciones, O-, N- y S-desalquilaciones, desaminaciones, desulfuraciones, deshalogenaciones y deshidrogenaciones.11 Presenta una gran diversidad y especificidad de substratos, en los que se incluyen tanto moléculas pequeñas como de tamaños mayores, de los tipos aromáticos y alifáticos, de estructura planar como globular, que contengan o no heteroátomos (cuadro 1).2,5-7 Por otra parte, una misma enzima puede formar dos productos diferentes a partir del mismo sustrato.12
Otra de las características del CYP450 es su susceptibilidad a ser inducido o inhibido, inclusive por los propios Xbs al ser biotransformados. Este hecho fue constatado en estudios con animales de experimentación y se comprobó la existencia de grupos de inductores que actuaban de forma selectiva sobre diferentes enzimas P45013,14 (cuadro 1). Esto tiene una trascendencia fundamental en la valoración de las interacciones de fármacos entre sí. Por ejemplo, si un fármaco inhibe la enzima que degrada a un segundo fármaco, en presencia de ambos el segundo fármaco aumentará sus niveles en sangre y, subsiguientemente, las posibilidades de causar daños por sobredosis. De forma inversa, si lo que hace es inducir el metabolismo, las concentraciones del segundo fármaco disminuirán, estando por debajo de los niveles terapéuticos, factor de vital importancia por ejemplo en los antibióticos. Ello justifica que sea necesario un conocimiento exhaustivo de las enzimas implicadas en el metabolismo de los fármacos para evitar errores deventana terapéutica o de efectos secundarios.
Además, la expresión y actividad de los P450 son influenciadas por diversos factores como la edad, sexo, raza, dieta, especie, tejido, estados fisiológicos y alteraciones fisiopatológicas, la genética, entre otros.15
CITOCROMO P450: ESTRUCTURA, ETIMOLOGÍA, DISTRIBUCIÓN, CLASIFICACIÓN, LOCALIZACIÓN CELULAR Y FUNCIÓN METABÓLICA
Los P450 es una superfamilia de hemoproteínas de función catalítica en la que el grupo tiol (-SH) de una cisteína funciona como quinto ligando al átomo de hierro del grupo hemo, y el sexto ligando es una molécula de agua.2,16 Esa cisteína y sus residuos vecinos son altamente conservados entre los citocromos,17 por lo que existe poca variedad entre citocromos en su sitio de unión con el hierro. En eucariontes, el peso molecular de los CYP450 oscila entre 50 y 60 KD y la similitud a nivel de estructura primaria es relativamente baja, siendo el extremo C-terminal más conservada que el N-terminal.18,19
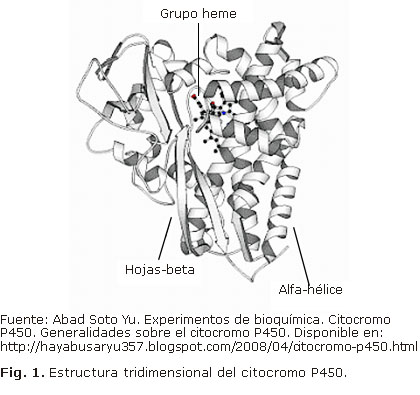
Los estudios de cristalografía de proteínas han permitido comprobar que existe un alto grado de conservación en la topografía y la estructura tridimensional del citocromo P450.19 La molécula está constituida por una combinación de regiones en a-hélice y en hojas plegadas (láminas b) fundamentalmente en la región de la proteína que rodea al grupo hemo, mientras que las regiones más variables son las que constituyen los lugares de anclaje a la membrana o de unión y reconocimiento de substratos; estas últimas son justamente seis regiones denominadas SRSs (sustrate recognition sites)15,18,19 (Fig. 1). La alta conservación de la región del grupo hemo, que se corresponde con el centro catalítico de la enzima, refleja un mecanismo común de transferencia de electrones y de protones, y de activación de O2;11 sin embargo, hay una divergencia considerable en muchos aspectos, especialmente en los sitios activos.16,18 Los espacios que ocupan los sitios activos de los CYP450 humanos varia al menos siete veces, y varios presentan dos sustratos.19
La enzima permanece anclada a la membrana a través de una hélice hidrofóbica cercana al extremo N-terminal, por lo que la mayor parte de la proteína se sitúa hacia la cara citosólica de la membrana.19 Esta hélice transmembrana está seguida, por regla general, por una serie de aminoácidos básicos cuyos residuos interaccionan con las cargas negativas de los lípidos de la membrana.19
El monóxido de carbono puede unirse al hierro ferroso (forma reducida de la hemoproteína) del P450 para formar un complejo Fe2+-CO, produciendo un cambio en el máximo de absorbancia del grupo hemo (pico de Soret) a 450 nm, propiedad que dio origen a su nombre. Son proteínas celulares (cito) coloreadas (cromo), con un pigmento (P es por pigmento) que absorbe luz a una longitud de onda de 450 nm como se explicó.15
Las enzimas P450 se encuentran ampliamente distribuidas en animales —desde bacterias hasta mamíferos—, plantas y protistas, para los que se supone un origen común.20 Se conocen más de 18 000 secuencias de CYP450 organizadas en familias,21 y con la secuenciación del genoma de los diferentes organismos, cada año esta cantidad seguirá en ascenso. Dentro de un mismo organismo, este sistema se encuentra en diferentes tejidos como riñón, pulmón, piel, cerebro, corteza adrenal, placenta, testículos y otros,22 pero el hígado e intestino delgado resultan ser los más importantes.22,23 En organismos eucariotas se ha detectado prácticamente en todas las membranas subcelulares, siendo la mitocondria, y esencialmente condriosomas y retículo endoplasmático liso, los orgánulos más importantes.2,5
Los P450s requieren electrones para reducir el O2, salvo excepciones que utilizan peróxidos. Se clasifican en cuatro clases en función de cómo acceden los electrones desde el NADPH hasta el centro catalítico de la enzima.2,13,15 Las proteínas de clase I utilizan una reductasa que contiene FAD (ferridoxina reductasa) para reducir a una ferrosulfoproteína (ferridoxina), la cual transfiere los electrones al CYP450. Las de clase II necesitan una reductasa del CYP450 (CYP450 reductasa-NADPH dependiente) que contiene FAD/FMN para la transferencia de electrones (Fig. 2). Las de clase III no requieren un donador de electrones, son autosuficientes dado que los genes del CYP450 y CYP450- reductasa NADPH dependiente están integrados en una sola proteína. Las de clase IV reciben los electrones directamente del NADPH.
En las bacterias y eucariotas, los P450s de clase I se encuentran asociados a la membrana interna de la mitocondria, sin embargo, los de clase II son los más abundantes en eucariotas.2,15,19 En los mamíferos los P450s y las NADPH-citocromo P450 reductasas no están asociados y ambos están anclados de forma independiente en la cara externa de la membrana del retículo endoplásmico liso mediante la región hidrofóbica del extremo N-terminal2,15,19 (Fig. 2). La actividad de algunos P450 se ve favorecida por la interrelación estrecha con el citocromo b 5 microsomal como donador del segundo electrón.24
Además de sus funciones biosintéticas, los P450s de las clases I y II de todos los organismos participan en la biotransformación de Xbs.2,10,15 Son enzimas responsables del metabolismo de fármacos y de los procesos de destoxificación. No obstante, en ocasiones participan en procesos de activación contribuyendo a la aparición de fenómenos tóxicos o de carcinogénesis.2,12 Los P450s de clase III participan en la síntesis de prostaglandinas en mamíferos, mientras que el P450 de clase IV solo se ha identificado en hongos.2,5,8
CITOCROMO P450: NOMENCLATURA
En un inicio las enzimas se nombraron en relación con la reacción que catalizaban o de su inducibilidad, lo que favoreció que una misma enzima recibiera nombres diferentes. El número creciente de CYP450 identificado indujo a la comunidad científica a la necesidad de establecer un sistema de nomenclatura25. Así, en 1987 se establecieron los principios que rigen el sistema actual de nomenclatura y clasificación de los P450s.10,17,25 Los P450s se identifican con las siglas CYP (referido al nombre inglés: cytochrome P) seguido de un número arábico que designa la familia, una letra que identifica la subfamilia y otro número arábico que se corresponde con el gen (por ejemplo, CYP1A1, CYP2C9). En una misma familia se agrupan aquellas enzimas cuya secuencia de aminoácidos tiene una similitud del 40 % o más, independientemente de la especie de procedencia. Dentro de una familia, los P450s se agrupan en diferentes subfamilias que, siempre que haya más de una, se denominan correlativamente empezando siempre por la letra A (por ejemplo: CYP2A, CYP2B, CYP2C, etc). El requisito para que dos P450s estén en la misma subfamilia es que tengan como mínimo un 55 % de homología. Por último, dentro de la misma subfamilia, las enzimas individuales se designan por números arábicos empezando siempre por el 1 (por ejemplo: CYP1A1, CYP1A2), teniendo en cuenta que dos P450s se consideran diferentes siempre y cuando sus respectivas secuencias difieran en más de un 3 %; este último número corresponde al gen de cada isoenzima. Por convención se escribe el nombre en cursiva cuando la abreviación se refiere al gen. Por ejemplo, el CYP3A4 es el gen que codifica a la enzima CYP3A4. Estas enzimas se han utilizado como instrumentos para estudios filogenéticos y han permitido la generación de mapas evolutivos de dichas especies y las relaciones existentes entre estas.26
CITOCROMO P450: MECANISMOS DE BIOTRANSFORMACIÓN DE XENOBIÓTICOS
- Fase I: catalizada principalmente por el sistema de monooxigenasas dependientes del CYP450, donde los Xbs son transformados mediante reacciones de oxidación, reducción o hidrólisis, y convertidos en productos más hidrosolubles a causa de la formación de nuevos grupos funcionales polares (carboxilo, hidroxilo, amino).
- Fase II: participan una serie de transferasas que actúan sobre los Xbs, o los metabolitos generados en las reacciones de fase I, para combinarlos mediante reacciones de conjugación (glucuronoconjugación, sulfonación y acetilación) con moléculas endógenas de carácter polar (ácido glucurónico, sulfatos, acetatos, glutatión o algunos aminoácidos) para facilitar su transporte por el organismo y su rápida excreción. El objetivo final es aumentar la solubilidad en agua de los compuestos y facilitar su excreción a través de la orina o la bilis.2,15
Aunque la función principal de los P450s es participar en las reacciones de destoxificación, también interviene en procesos de activación metabólica, así compuestos inertes y poco reactivos son transformados en otros que resultan tóxicos para el organismo por su reactividad química que causan daño celular por mecanismos de mutagénesis, carcinogénesis, entre otros.2,12,15
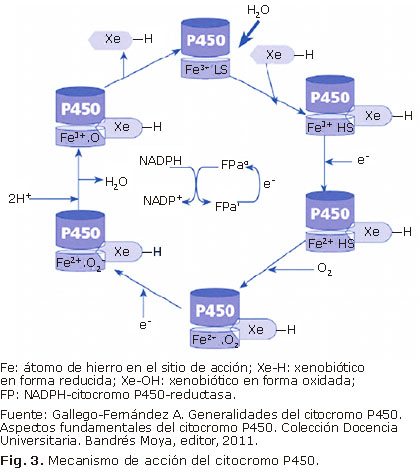
El mecanismo de acción de estas reacciones es complejo y aún no está bien esclarecido.27 Sigue un ciclo catalítico de reacciones generalmente aceptado, que lleva asociado un sistema de transporte de electrones y de O2 (Fig. 3). Existen evidencias de que se generan especies reactivas de oxígeno como el anión superóxido (O2•-) y peróxido de hidrógeno (H2O2), además del radical libre sustrato (R•) el que al unirse a un radical hidroxilo, generaría finalmente el producto hidroxilado (ROH).2,28 El aspecto mejor conocido es la activación del O2, similar en todos los CYP450s. 2,15,29 La reacción general de monooxidación catalizada por este sistema enzimático es la siguiente:
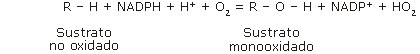
Como se observa, los P450s tienen requerimiento absoluto del cofactor NADPH como fuente principal de electrones —aunque también pueden provenir del citocromo b5— y O2 para la catálisis de la monooxigenación. Según sea la clase de CYP450 de que se trate, los electrones que intervienen en el proceso acceden al grupo hemo del CYP450 por diversas vías.29 El resultado de la actividad enzimática del P450 no siempre es la inserción de oxígeno en el substrato, pudiendo catalizar reacciones de deshidratación, deshidrogenación, isomerización, dimerización, incluso reducción y otras reacciones no usuales.2,11,15
LAS ENZIMAS CYP450 EN EL HOMBRE
Hasta el momento el genoma humano consta de 57 genes CYP450 activos, divididos en 18 familias y 44 subfamilias; y 58 seudogenes para un total de 115 genes.17 Los CYP450 no son enzimas exclusivas del tejido hepático como inicialmente se pensaba, sino que muestran una amplia distribución en todo el organismo, algunos se localizan solo en tejidos extrahepáticos (por ejemplo: CYP1A1, CYP2F1).2,22 Se estima que alrededor del 70 % de los CYP450 hepáticos pertenecen a las familias 1, 2 y 3; las cuales son las que catalizan la mayor parte de las reacciones de biotransformación de Xbs.23 De estas, las isoenzimas más abundantes en el tejido hepático humano son CYP2C y CYP3A4 que representan alrededor del 20 % y 30 % del contenido hepático total del CYP450, respectivamente (cuadro 2).2,10,13,15
Existen otras enzimas CYP450 que metabolizan sustratos endógenos como ácidos biliares, ácidos grasos, esteroides, prostaglandinas, leucotrienos, etc., y que cumplen funciones fisiológicas muy importantes en el organismo, por ejemplo, las enzimas de la subfamilia 4A (en el humano, CYP4A9 y CYP4A11) muy abundantes en el hígado humano y participan en el metabolismo de ácidos grasos como el del ácido araquidónico.2,30,31 Algunas enzimas de las familias 1, 2 y 3 también metabolizan substratos endógenos, y para enzimas de la familia 2 (por ejemplo: CYP2S1, CYP2T, CYP2U1, CYP2V, CYP2W1) y 4 (por ejemplo: CYP4V2, CYP4X1, CYP4Z1) no se han podido demostrar con certeza sus papeles en el metabolismo de Xbs.31 Otros CYP presentes en hígado humano son los pertenecientes a las subfamilias 4B y 4F, 11A y 11B y a las familias 17, 19, 21 y 27.15
CONCLUSIONES
Las isoenzimas de este versátil complejo multienzimático funcional, denominado citocromo P450, están presentes desde bacterias a los mamíferos, y de las que ya se han identificado más de 18 000 isoformas diferentes. Son hemoproteínas que presentan una gran variedad de localizaciones tisulares, siendo el hígado el tejido más importante donde el citocromo P450 es extremadamente activo; amplia especificidad por sustratos, tanto endógenos como exógenos; susceptibilidad a ser inhibidas e inducidas por múltiples compuestos, inclusive por los propios Xbs. Catalizan una gran variedad de procesos bioquímicos no solo mediante reacciones de monooxidación, sino también reacciones de reducción e hidrólisis, entre otras. Se localiza en la membrana del retículo endoplasmático liso y en la membrana interna mitocondrial, donde desempeñan sus funciones biosintéticas de compuestos endógenos y de biotransformación de Xbs para su neutralización y eliminación, de ahí su gran importancia, al ser las responsables, por ejemplo, del metabolismo de fármacos y de los procesos de destoxificación. No obstante, en ocasiones participan en procesos de activación que contribuyen a la aparición de fenómenos tóxicos o de carcinogénesis y teratogénesis.
REFERENCIAS BIBLIOGRÁFICAS
1. Cutiño Rodríguez EMR. Defensa química y citocromo P450: relación con la defensa inmune. Rev Med UV. 2011 Jul-Dic:53-63.
2. Guengerich FR. Cytochromes P450. In: Azenbacher P, Zanger UM editors. Metabolism of Drugs and Other Xenobiotics. Germany: Wiley-VCH Verlag GmbH and Co. KGaA Weinheim; 2012. p. 27-66.
3. Klingerberg M. Pigments of rat liver microsomes. Arch Biochem Biophys. 1958;75:376-86.
4. Garfinkel D. Studies on pig liver microsomes. I. Enzymic and pigment composition of different microsomal fractions. Arch Biochem Biophys. 1958;77:493-509.
5. Omura T. Recollection of the early years of the research on cytochrome P450. Proc Jpn Acad Scr B Phys Biol Sci. 2011;87:617-40.
6. Singh D, Kashyap A, Pandey RV, Saini KS. Novel advances in cytochrome P450 research. Drug Discov Today. 2011;16:793-9.
7. Zhang T, Zhao M, Xie Z, He J, Liu LA, Wei DQ. Recent progress on bioinformatics, functional genomics, and metabolomics research of cytochrome P450 and its impact on drug discovery. Curr Top Med Chem. 2012;12:1346-55.
8. Mansuy D. Brief historical overview and recent progress on cytochromes P450: adaptation of aerobic organisms to their chemical environment and new mechanisms of prodrug bioactivation. An Pharm Fr. 2011;69:62-9.
9. Guengerich FP, Rendic S. Update information on drug metabolism systems 2009, part I. Curr Drug Metab. 2010;11:1-3.
10. McKinnon RA, Sorich MJ, Ward MB. Cytochrome P450, part 1: multiplicity and function. J Pharm Pract Re. 2008;38:55-7.
11. Guengerich FP, Munro AW. Unusual cytochrome P450 enzymes and reactions. J Biol Chem. 2013;288:17065-73.
12. Rendic S, Guengerich FP. Contributions of human enzymes in carcinogen metabolism. Chem Res Toxicol. 2012;25:1316-83.
13. Ortiz de Montellano P. Cytochrome P450: Structure, Mechanism, and Biochemistry. New York: Kluwer Academic/Plenum Publishers; 2005.
14. Hollenberg PF, Kent UM, Bumpus NN. Mechanism-based inactivation of human cytochromes p450s: experimental characterization, reactive intermediates, and clinical implications. Chem Res Toxicol. 2008;21:189-205.
15. Gallego-Fernández A. Generalidades del Citocromo P450. Aspectos fundamentales del citocromo P450. Madrid: Colección Docencia Universitaria; 2011. p. 7-32.
16. Poulos TL, Johnson EF. Structures of cytochrome P450 enzymes. In Cytochrome P450: Structure, Mechanism, and Biochemistry. Ortiz de Montellano PR. 3rd ed. New York: Kluwer Academic/Plenum Publishers; 2005. p. 87-114.
17. Nelson DR. Cytochrome P450s in humans. Human Genomics. 2009 [cited 2013 Sep 14];4:59-65. Available from: http://drnelson.utmem.edu/CytochromeP450.html
18. Sirim D, Widmann M, Wagner F, Pleiss J. Prediction and analysis of the modular structure of cytochrome P450 monooxygenases. BMC Struct. Biol. 2010;10:34.
19. Johnson EF, Stout CD. Structural diversity of eukaryotic membrane cytochrome P450s. J Biol Chem. 2013;288:17082-90.
20. Nelson DR. Progress in tracing the evolutionary paths of cytochrome P450. Biochim Biophys Acta Prot Proteom. 2011;1814:14-8.
21. Guengerich FP. New trends in cytochrome P450 research at the half-century mark. J Biol Chem. 2013;288:17063-4.
22. Ding X, Kaminsky LS. Human extrahepatic cytochromes P450: Function in xenobiotic metabolism and tissue-selective chemical toxicity in the respiratory and gastrointestinal tracts. Annu Rev Pharmacol Toxicol. 2003;43:149-73.
23. Sevior DK, Pelkonen O, Ahokas JT. Hepatocytes: the powerhouse of biotransformation. Int J Biochem Cell Biol. 2012;44:257-61.
24. Im SC, Waskell L. The interaction of microsomal cytochrome P450 2B4 with its redox partners, cytochrome P450 reductase and cytochrome b5. Arch Biochem Biophys. 2011;507:144-53.
25. Sim SC, Ingelman-Sundberg M. The Human Cytochrome P450 (CYP) Allele Nomenclature website: A peerreviewed database of CYP variants and their associated effects. Human Genomic. 2010;4:278-81.
26. Nelson DR. Comparison of P-450s from human and fugu: 420 million years of vertebrade P-450 evolution. Arch Biochem Biophys. 2003;409:18-24.
27. de Visser SP, Porro CS, Quesne MG, Sainna MA, Munro AW. Overview on theoretical studies discriminating the two-oxidant versus two-state-reactivity models for substrate monoxygenation by cytochrome P450 enzymes. Curr Top Med Chem. 2013;13:2218-32.
28. Krest CM, Onderko EL, Yosca TH, Calixto JC, Karp RF, Livada J, et al. Reactive intermediates in cytochrome P450 catalysis. J Biol Chem. 2013;288:17074-8.
29. Hannemann F, Bichet A, Ewen KM, Bernhardt R. Cytochrome P450 systems-biological variations of electron transport chains. Biochim Biophys Acta. 2007;1770:330-344.
30. Capdevila JH, Faick JR, Harris RC. Cytochrome P-450 and arachidonic acid bioactivation. Molecular and functional properties of the arachidonate monooxygenase. J Lipid Res. 2000,41:613-81.
31. Guengerich FP, Cheng Q. Orphans in the human cytochrome P450 family: approaches to discovering function and relevance to pharmacology. Pharmacol Rev. 2011;63:684-99.
Recibido: 2 de junio de 2014.
Aprobado: 23 de julio de 2014.
Julio César Rodríguez González . Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26, No. 1605, e/ Ave. Boyeros y Calzada de Puentes Grande, Nuevo Vedado, CP 10600, La Habana, Cuba. Correo electrónico: jcesar.rodriguez@cidem.sld.cu