Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.48 no.4 Ciudad de la Habana oct.-dic. 2014
Cuantificación simultánea de andrógenos, estrógenos, corticoides y pregnanos mediante cromatografía de gases acoplada a espectrometría de masas
Simultaneous quantification of androgens, estrogens, corticoids and pregnanes thorugh the gas chromatography-mass spectrometry method
Lic. Dayamín Martínez Brito,I Lic. Margarita Teresa Correa Vidal,I Téc. Roberto Oropesa Rodríguez,I Téc. Odalys González Pérez,I Dr. Oscar Ernesto Ledea LozanoII
I Instituto de Medicina Deportiva, Laboratorio Antidoping. La Habana, Cuba.
II Centro Nacional de Investigaciones Científicas (CNIC). La Habana, Cuba.
RESUMEN
Introducción: la evaluación de hormonas en pacientes de endocrinología y bioquímica clínica, entre otros, se realiza actualmente por métodos de inmunoensayo con las desventajas inherentes a este tipo de análisis (ejemplo: reacciones cruzadas). Con la aplicación de la espectrometría de masas acoplada a cromatografía de gases es posible aumentar la sensibilidad y especificidad de los análisis.
Objetivo: validar un ensayo que permita la cuantificación de 21 hormonas mediante la técnica de cromatografía de gases-espectrometría de masas con propósitos de pesquizaje.
Métodos: el ensayo se basó en una extracción en fase sólida con columnas DetectabuseTM y posterior extracción líquido-líquido a pH básico. Los derivados trimetilsilil se analizaron con un cromatógrafo de gases Hewlett-Packard 6890 acoplado a un espectrómetro de masas cuadrupolar serie 5973. La columna capilar fue HP Ultra-1 (17 m x 0,20 mm x 0,11 µm). La adquisición fue realizada en modo SIM (monitoreo selectivo de iones).
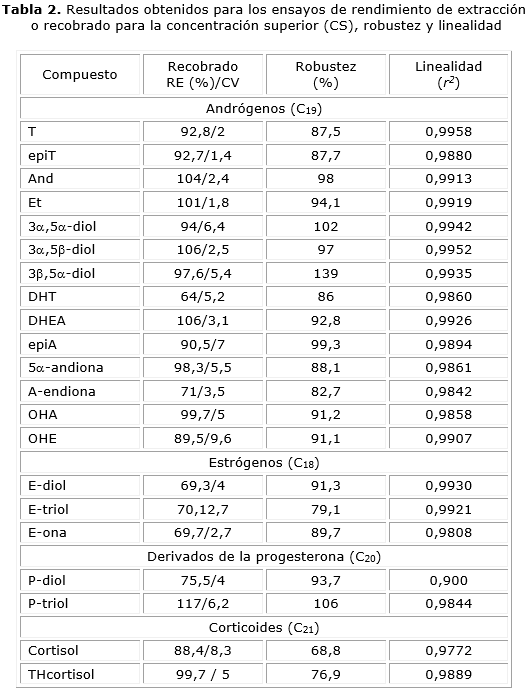
Resultados: los resultados del proceso de validación cumplieron con los criterios de aceptación de una manera adecuada correspondiente a un método con propósitos de pesquizaje. El método resultó ser específico para los 21 compuestos estudiados, lineal (r2= 0,900-0,996) y preciso (CV entre 1,4-9,6 %). El rendimiento de extracción se mantuvo entre 69-117 %. La robustez con variación de disolvente mostró recobrados entre 69-139 %.
Conclusiones: los resultados demuestran que la técnica analítica desarrollada para la cuantificación de los 21 compuestos esteroidales en orina, es exacta, específica, lineal, precisa y robusta para su aplicación con propósitos de pesquizaje en estudios endocrinológicos clínicos.
Palabras clave: hormonas, validación, cromatografía de gases, espectrometría de masas.
ABSTRACT
Introduction: the evaluation of hormones on endocrinology and clinical biochemistry patients, among others, is presently performed, using inmunoassays with its intrinsic disadvantages such as cross reactions. The application of gas chromatography coupled to mass spectrometry allows increasing the sensitivity and specificity of this analysis.
Objective: to validate an assay for quantitation of 21 hormones by the analytical technique of gas chromatography - mass spectrometry for screening purposes.
Methods: the assay followed a solid-phase extraction using DetectabuseTM columns and subsequently liquid-liquid extraction at basic pH. Trimethylsilyl derivatives were evaluated on Hewlett-Packard 6890 gas chromatograph coupled to serial 5973 quadrupolar mass spectrometer. The capillary column was HP Ultra-1 (17 m x 0.20 mm x 0.11 µm). Data was gathered following SIM mode (selective ion monitoring).
Results: the results of the validation process adequately fulfilled the acceptance criteria for screening purposes. The assay proved to be specific for all studied compounds, linear (r2= 0.900-0.996) and precise (VC 1.4-9.6 %). The extraction yield was kept at 69-117 %. The robustness assay with varying dissolvent showed extraction yields ranging 69-139 %.
Conclusions: results of the validation process show that the developed assay to simultaneously quantify 21 steroidal compounds in urine is exact, linear, precise, robust and specific for its application in clinical endocrine studies for screening purposes
Keywords: hormones, validation, gas chromatography, mass spectrometry.
INTRODUCCIÓN
El perfil de esteroides en orina ha sido una parte fundamental del diagnóstico de desórdenes de la síntesis de hormonas y su metabolismo desde la década de 1960. El inmunoensayo y las técnicas relacionadas han sido ampliamente usadas en la cuantificación de hormonas plasmáticas en procesos de rutina de diagnóstico. Aún cuando estas técnicas han sido y son fundamentales en la capacidad de diagnóstico de la clínica, los resultados se encuentran comprometidos teniendo en cuenta los problemas de reactividad cruzada y de especificidad que no han podido ser resueltos para algunos analitos, lo que influye en la especificidad del ensayo.1,2
Otro problema que enfrentan estas técnicas es cuando se encuentran niveles de hormonas en bajas concentraciones como es el caso de muestras pediátricas o de mujeres posmenopáusicas. En este sentido, las técnicas de cromatografía líquida o de gases acoplada a espectrometría de masas no solo han demostrado ser superiores en cuanto a límites de detección y especificidad, sino también en la linealidad incluso en bajas concentraciones.1
La cromatografía de gases acoplada a espectrometría de masas (CG-EM) es, actualmente, la técnica más prometedora para procedimientos de pesquisaje (ej.: hormonas) no solo en el campo de la analítica del dopaje sino en otros campos de aplicación (ej. Ciencias Forenses). Al emplear el modo de adquisición de Monitoreo Selectivo de Iones (SIM, siglas en inglés) pueden alcanzarse límites de detección hasta 100 veces mayores que los logrados habitualmente en modo de adquisición SCAN. Entre los requisitos para lograr una identificación y cuantificación adecuadas de los analitos mediante esta técnica, se encuentra una eficiente reacción de formación de derivados y una elevada relación señal: ruido para los picos cromatográficos.3-6
Uno de los problemas de las técnicas de cuantificación (y su validación) de analitos en fluidos biológicos es la matriz a emplear en los controles negativos o positivos. El uso de matrices artificiales es una de las soluciones propuestas. En su forma más simple, una matriz artificial es agua pura o un tampón (ej.: tampón fosfato-salino, PBS).7,8
El objetivo del presente trabajo fue validar una técnica que permite la cuantificación simultánea, con propósitos de pesquizaje, de 14 andrógenos, tres estrógenos, dos derivados del pregnano y dos corticoides. Se empleó la cromatografía de gases acoplada a espectrometría de masas y el modo de adquisición SIM con este fin.
MÉTODOS
Reactivos: Se emplearon materiales de referencia provenientes de SIGMA (Alemania) y NMI (Australia). Todos los reactivos y los disolventes empleados para el desarrollo experimental fueron de grado analítico. Las columnas de extracción en fase sólida utilizadas fueron DetectabuseTM (Biochemical Diagnostics, EE.UU.).Los analitos validados fueron:
Andrógenos: 11b-hidroxi-androsterona (OHA), 11b-hidroxi-etiocolanolona (OHE), 3a,5a-androstandiol (5a-androstane-3a,17b-diol), 3a,5b-androstandiol (5b-androstane-3a,17b-diol), 3b,5a-androstandiol (5a-androstane-3b,17b-diol), 5a-androstandiona (5a-androstane-3,17-dione), dihidrotestosterona (DHT), androstenediona (4-androstene-3,17-dione), androsterone (A), epiandrosterone (epiA), epitestosterone (E), etiocolanolona (Et), testosterone (T), dehidroepiandrosterona (DHEA).
Estrógenos: estradiol (E-diol), estriol (E-triol), estrone (E-one).
Pregnanos: pregnandiol (P-diol) y pregnantriol (P-triol).
Corticoides: cortisol y tetrahidrocortisol (THcortisol). Se empleó como patrón interno 17a-metiltestosterona (P.I.).
Descripción del ensayo: Se realizó una extracción en fase sólida con columnas Detectabuseä. La extracción líquido-líquido se realizó a pH 9-10 con tert-butilmetiléter, luego de la hidrólisis enzimática con la enzima b-glucuronidasa (E. coli) a pH= 7,0; 55 °C/1 h. El extracto se sometió a la formación de derivados trimetilsilil con MSTFA:NH4I:2-mercaptoetanol (1000:2:6 v/w/v), a 60 °C por 30 min.
Equipamiento: Cromatógrafo de gases Hewlett-Packard 6890, espectrómetro de masas cuadrupolar serie 5973 (Palo Alto, CA, EE.UU.). Columna capilar Ultra-1 (17m x 0,20mm x 0,11 µm). Gas portador: helio, (0,9 mL/min). El programa de temperatura fue desde 182 °C hasta 310 °C.
Volumen de inyección: 2 µL, temperatura del inyector 280 °C. La adquisición se realizó en modo SIM en el intervalo de 40-700 uma. La energía de ionización fue de 70 eV. La temperatura de la interfase se mantuvo en 280 °C y la de la fuente se fijó en 230 °C. El tiempo de monitoreo de los iones fue de 20 ms.
Ensayos del proceso de validación: Los parámetros de validación ensayados se proponen en el Estándar Internacional de Laboratorios de la Agencia Mundial Antidopaje y la Norma Cubana NC ISO/IEC 17025: 2006 (tabla 1). Los criterios de aceptación en los ensayos fueron obtenidos de la literatura especializada.4,9,10
Especificidad. Se verificaron las interferencias en blancos de reactivos (n= 10) al tiempo de retención (TR) de los analitos de interés. Además, se evaluaron muestras de orina (n= 5) de orígenes diferentes para determinar la pureza del pico cromatográfico de cada analito.
Límite de detección (LD) y de cuantificación (LC). Se calculó la relación señal/ruido (S/R, n= 5) de los picos cromatográficos en el primer nivel de concentración del ensayo de linealidad. Ambos límites se fijaron en las concentraciones donde la relación S/R fue igual a 3 y 10, respectivamente. Criterio de aceptación: coeficientes de variación (CV) < a 10 %.
Precisión intraensayo (repetibilidad) y precisión intermedia. Se calculó el CV, de las respuestas a dos concentraciones distintas (control inferior, CI y control superior, CS, n= 5). Criterios de aceptación: CV< 25 % para el CI y al 15 % para el CS. Los controles se prepararon por un técnico diferente para el ensayo de precisión intermedia, y los resultados obtenidos se compararon con el ensayo de repetibilidad mediante una prueba de student (a= 0,05).
Rendimiento de extracción (RE). Se analizaron en paralelo cinco réplicas de los CI y CS extraídas según el procedimiento descrito y cinco réplicas donde la matriz fue extraída previamente a la adición de los patrones para alcanzar las mismas concentraciones. Criterios de aceptación: RE> 50 %. Criterio de aceptación adicional: CV< 10 % para CS y < 15 % para la CI.
Exactitud. La exactitud intraensayo se expresó como la media de los errores obtenidos. Criterio de aceptación: CV< 15 % y, además, que el valor calculado muestre hasta un 15 % de variación con respecto al valor nominal, (CI y CS, n= 5).
Resistencia o robustez. Se extrajeron muestras en la CS (n= 10) sustituyendo el disolvente empleado en la extracción líquido-líquido (TBME) por éter dietílico. Se calculó el RE a partir de los controles considerados como el 100 % de extracción en el acápite 4. Los resultados obtenidos se compararon con los obtenidos en el ensayo de RE mediante una prueba de Student (a= 0,05).
Linealidad. Se verificó el ajuste de los valores obtenidos a un modelo lineal del tipo y= a + bx con siete niveles de concentración. Se calculó el coeficiente de determinación (r2) para cada analito. Criterio de aceptación: r2 > 0,98. Se tomaron tres replicas en cada nivel de concentración estudiado.
Contaminación entre muestras. Se verificó en muestras blanco inyectadas inmediatamente después de una muestra concentrada. Criterio de aceptación: área de los analitos en las muestras blanco < 20 % del área obtenida para el mismo analito en la concentración mínima del ensayo de linealidad. La tabla 1 describe las concentraciones estudiadas para los ensayos de precisión intra-ensayo (repetibilidad), RE y exactitud intraensayo.
RESULTADOS
La figura 1 muestra la corriente total iónica de una muestra control obtenida luego del análisis cromatográfico.
Especificidad. No se observaron interferencias a los TR de los analitos de interés siempre que sea empleado el método SIM. El análisis de los diez blancos de reactivos mostró una ausencia de interferencias en los TR de interés proveniente de los reactivos empleados en el ensayo (Fig. 2).
Límite de detección (LD) y de cuantificación (LC). La evaluación de ambos límites se realizó mediante los CV % obtenidos en 5 réplicas en la concentración mínima ensayada (tabla 1). Todos los analitos mostraron un CV menor al 10 % en los límites estimados. La relación S/R para los andrógenos se mantuvo entre 10 y 140 y específicamente para A y Et se mostró superior a 1 000. Los estrógenos mostraron relación S/R entre 10,3 y 11,2, mientras que el resto de los analitos mostró una relación superior a 100, con excepción del cortisol. Los LC de los analitos estudiados se mantuvieron entre 0,3 y 3,4 ng/mL, mientras que los LD se estimaron entre 0,1 y 1,0 ng/mL.
Precisión. En el ensayo de repetibilidad, los CV fueron inferiores al 10 % con excepción del THcortisol en el CI. En el ensayo de precisión intermedia se aplicó una prueba de Student (a= 0,05) para comparar un caso (ensayo de repetibilidad) y otro (técnico y días diferentes). No se observaron diferencias significativas.
Exactitud. Se observaron desviaciones menores al 1 %, excepto para el THcortisol y cortisol que fueron 4,3 % y 3,4 % en las CI y CS, respectivamente. La CS mostró mayores diferencias para la A, Et, P-diol, P-triol y THcortisol.
Rendimiento de extracción (RE) y robustez. La tabla 2 muestra los RE obtenidos para las concentraciones ensayadas. Los estrógenos (E-diol, E-triol y E-ona) mantuvieron una gran similitud (69,3; 70,1 y 69,7 % para la CS). El P-triol mostró el RE mayor del estudio (117 % para la CS). El recobrado obtenido en las muestras extraídas con éter dietílico se comparó a través de una prueba de Student (a= 0,05) con el obtenido en el ensayo de RE. Se observó un aumento en el RE en nueve de los analitos (OHE, 3a,5a-diol, DHT, A-endiona, EpiA, E-diol, E-triol, E-ona y P-diol), pero solo la A-endiona, OHE y E-triol mostraron diferencias significativas. Además, los compuestos cuyo RE se vio afectado fueron 12 (ej.: OHA, 3a,5b-diol, 5a-andiona, A, cortisol, Et, DHEA, P-triol y THcortisol) y solamente presentaron diferencias significativas el cortisol y el THcortisol.
Linealidad. Los coeficientes de determinación obtenidos se describen en la tabla 2.
Contaminación entre muestras. Todos los analitos cumplieron con el criterio de aceptación. Solo sobrepasaron el 10 %, el 3a,5a-diol, P-triol, THcortisol, OHA y P-diol.
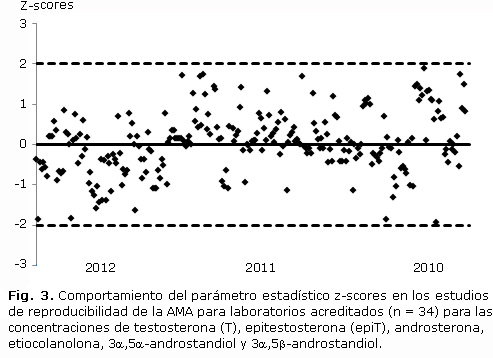
Resultados de ensayos de reproducibilidad. Este ensayo ha sido aplicado por el laboratorio Antidoping de La Habana y se ha evaluado por la Agencia Mundial Antidopaje de conjunto con otros 34 laboratorios en más de 10 rondas de estudios de ínter comparación. La evaluación se realiza mediante el cálculo de z-scores (valores entre -2 y 2 se consideran adecuados). Los resultados obtenidos con la aplicación del ensayo descrito se muestran en la figura 3.
DISCUSIÓN
La adecuación o no de un ensayo a un objetivo específico queda demostrada en el proceso de validación.9,10
Especificidad: El espectrómetro de masas opera monitoreando iones diagnósticos del analito de interés. Con este método se logra una drástica disminución del ruido químico, es decir, todos los componentes que interfieren al TR con el (los) analito (s) de interés, si no presentan el ion monitoreado en su espectro de masas no son detectados. Esto aumenta la especificidad y disminuye los niveles de detección aumentando la sensibilidad. Este método es empleado en la cuantificación y detección de compuestos conocidos, por lo tanto su uso es factible en procedimientos de pesquisaje. Las condiciones cromatográficas empleadas permitieron la separación satisfactoria de los 21 analitos con excepción de dos de ellos. La DHT y la E-ona coeluyen al mismo TR, lo cual no constituye un inconveniente si se tiene en cuenta que con el método empleado de adquisición de datos (SIM), se puede controlar la contribución entre los iones fragmentos monitoreados para cada compuesto, mediante su adecuada selección. La cuantificación de la DHT se realiza a través de su ion molecular (pico base) m/z 434, mientras que para la E-ona se emplea el ion m/z 414. Las estructuras y espectros de masas de ambos compuestos descartan la posibilidad de que uno aporte a la señal del otro definiendo así, la especificidad del método.9 (Fig. 2).
Las ventajas de la espectrometría de masas, específicamente el uso de este modo de adquisición permite, entre otros, discriminar muchas de las interferencias de la matriz y obtener señales amplificadas mediante la optimización del instrumento, pues se logra una mayor eficiencia de la ionización. Todos estos factores contribuyen positivamente a la especificidad del método.
Exactitud: Es muy probable que el comportamiento del THcortisol y cortisol se deba a la propia estructura química de los corticoides. Ellos presentan un número de grupos funcionales, susceptibles a formar derivados, superior que el resto de los compuestos. Además, la labilidad del grupo en C17 de estos compuestos en el inyector puede influir en este comportamiento. No obstante, los valores obtenidos son satisfactorios y cumplen con el criterio de aceptación establecido.
Rendimiento de extracción (RE) y robustez: Los procedimientos de pesquisaje están diseñados para la detección de un gran número de sustancias, por lo que se establecen condiciones de compromiso en la extracción y las condiciones cromatográficas. Como consecuencia, no todos los analitos se extraen bajo las condiciones óptimas y es por ello que no se han establecido rangos rígidos en la evaluación de este parámetro. El E-diol y el E-triol (dos y tres grupos -OH respectivamente) permiten la obtención de derivados Bis y Tris - O - TMS. Por su parte, la E-ona presenta un grupo ceto cuya formación de derivados resulta más compleja que los grupos hidroxilo en dependencia del equilibrio ceto-enólico.
En el caso del ensayo de robustez, el cortisol y THcortisol fueron desfavorecidos por el uso del disolvente propiamente. En la literatura especializada, el ensayo de precisión intermedia se considera como una evaluación de la robustez del método. Luego de observar los resultados obtenidos puede considerarse este, un método robusto.
Linealidad. El cortisol y el P-diol fueron los únicos analitos que se mantuvieron por debajo del criterio de r2, aun así fueron aceptados teniendo en cuenta que este es un ensayo de pesquizaje. De manera general, los isómeros A y Et mostraron comportamientos similares pero se observó, aunque ligera, una menor sensibilidad para el primer analito. En el caso de los estrógenos se observó que el orden de sensibilidad es menor mientras mayor es la complejidad de las estructuras, referido en el punto de Evaluación de RE (sensibilidad E-diol> E-ona> E-triol).10
Contaminación entre muestras. El arrastre es un término aplicado específicamente en la cromatografía-espectrometría de masas y se refiere a la recuperación del detector luego de una muestra inyectada. Los resultados demuestran la capacidad del equipo de recuperarse ante el análisis de muestras a altas concentraciones, por lo que no es necesaria la inyección de blancos entre muestras, lo cual evita pérdida de tiempo en la evaluación de lotes analíticos.
Resultados de ensayos de reproducibilidad. El comportamiento es aleatorio con valores distribuidos alrededor del valor óptimo (z-score= 0) (Fig. 3), lo que es acertado si se tiene en cuenta algunos factores como son: la calibración del equipamiento, las columnas cromatográficas, preparación de los controles para la cuantificación, errores del personal y del material y/o cristalería empleado y las incertidumbres asociadas en cada paso del ensayo en los 34 laboratorios acreditados.
Los resultados obtenidos demuestran que la técnica analítica desarrollada para la cuantificación de los 21 compuestos esteroidales en orina, es exacta, específica, lineal y robusta para su aplicación con propósitos de pesquizaje en estudios endocrinológicos clínicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Krone NP, Hughes BA, Lavery GG, Stewart PM, Arlt W, Shackleton CHL. Gas chromatography/mass spectrometry (GC/MS) remains a pre-eminent discovery tool in clinical steroid investigations. J Steroid Biochem Mol Biol. 2010;121:496-504.
2. Aman CS, Pastor A, Cighetti G, de la Guardia M. Development of a multianalyte method for the determination of anabolic hormones in bovine urine by isotope-dilution GC-MS/MS. Anal Bioana Chem. 2006;386:1869-79.
3. De Brabanter N, Van Gansbeke W, Geldof L, Van Eenoo P. An improved gas chromatography screening method for doping substances using triple quadrupole mass spectrometry, with an emphasis on quality assurance. Biomed Chromatography. 2012. DOI 10.1002/bmc.2714.
4. Boyd RK, Basic C, Bethem RA. Trace Quantitative Analysis by Mass Spectrometry. Hoboken, New Jersey: John Wiley & Sons, Ltd.; 2008.
5. Opfermann G, Schänzer W. Trimethylsilylation-Aspects for derivatisation. Recent Advances in Doping Analysis (4). Proceeding of the 14th Cologne Workshop in Dope Analysis, Sport und BuchStrauβ, Köln; 1997. p. 247-52.
6. Marques MAS, Pereira HMG, Aquino Neto FR. Improvements in steroids screening in doping control with special emphasis to GC-MS analytical conditions and method validation. J Bra Chem Soc. 2006;17(2):382-92.
7. Ahmadkhaniha R, Shaffie A, Rastkari N, Khoshayand MR, Kobarfad F. Quantification of endogenous steroids in human urine by gas chromatography mass spectrometry using a surrogate analyte approach. J Chromatogr B. 2010;878:845-52.
8. Van de Merbel NC. Quantitative determination of endogenous compounds in biological samples using chromatographic techniques. Trends Analytical Chemistry. 2008;27(10):924-33.
9. Bliesner DM. Validating Chromatographic Methods. A Practical Guide. Hoboken, New Jersey: John Wiley & Sons, Ltd.; 2006.
10. Jiménez C, Ventura R, Segura J. Validation of qualitative chromatographic methods: strategy in antidoping control laboratories. J Chromatogr B Anal Technol Biomed Life Sci. 2002;767:341.
Recibido: 23 de julio de 2014.
Aprobado: 30 de agosto de 2014.
Dayamín Martínez Brito . Instituto de Medicina Deportiva, Laboratorio Antidoping. Calle 100 esq. Aldabó, Municipio Boyeros, La Habana, Cuba. Teléfono: 643 7649