My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515On-line version ISSN 1561-2988
Rev Cubana Farm vol.48 no.4 Ciudad de la Habana Oct.-Dec. 2014
ARTÍCULO ORIGINAL
Estabilidad de la crema reformulada de nitrato de miconazol al 2 %
Stability of reformulated 2 % miconazol nitrate cream
Lic. Wendy Calzadilla Aguiar,I Lic. Saidel Moreno Martínez,I Lic. Oscar García Pulpeiro,II Lic. Eduardo Besada Maribona,II Lic. Yania Suárez PérezI
I Instituto de Farmacia y Alimentos. Universidad de la Habana. La Habana, Cuba.
II Empresa Laboratorio "Roberto Escudero Díaz". La Habana, Cuba.
RESUMEN
Introducción: la Empresa Productora "Roberto Escudero Díaz", llevó a cabo la reformulación de la crema de nitrato de miconazol al 2 %, por incumplimiento de algunas especificaciones de calidad y contaminaciones microbiológicas de varios lotes industriales, por lo que hubo que realizar cambios mayores a la composición de la formulación registrada.
Objetivo: determinar la estabilidad de la nueva formulación de nitrato de miconazol crema al 2 %, para determinar su período de validez.
Métodos: se realizaron los estudios según las regulaciones vigentes. Se emplearon tres lotes elaborados a escala piloto, envasados en tubos comprimibles de aluminio por 25 g. Se emplearon como métodos analíticos una técnica por cromatografía líquida de alta resolución y una por cromatografía en capa delgada previamente validadas para estos propósitos. Se consideraron dos temperaturas de almacenamiento: 30 ± 2 ºC (vida de estante) y 40 ± 2 ºC (estabilidad acelerada). Se determinaron los parámetros: propiedades organolépticas, pH, área de extensibilidad, valoración, contenido de sustancias relacionadas y/o productos de degradación, y además se evaluó la calidad de la formulación desde el punto de vista microbiológico.
Resultados: desde el punto de vista químico, los lotes evaluados mostraron contenidos superiores al 98 % de analito y niveles muy bajos de sustancias relacionadas, independientemente del lote y la temperatura de almacenamiento. No se detectaron manchas adicionales por cromatografía en capa delgada atribuibles a posibles productos de degradación. La extensibilidad mostró un decrecimiento normal debido a la estructuración progresiva del sistema, y el pH también disminuyó discretamente pero dentro de los límites propuestos. Además se comprobó la elevada estabilidad microbiológica del medicamento a los 12 meses.
Conclusiones: la crema es estable química, física y microbiológicamente a temperatura ambiente durante 12 meses, por lo que se propone este tiempo como período de validez provisional.
Palabras clave: nitrato de miconazol, crema, estabilidad acelerada, estabilidad por vida de estante, cromatografía en capa delgada, cromatografía líquida de alta resolución.
ABSTRACT
Introduction: "Roberto Escudero Diaz" drug producing company is carrying out the reformulation of 2 % miconazole nitrate cream due to non-compliance with some quality specifications and the microbiological contamination of several industrial batches, so it was required to make major changes in the registered formulation composition.
Objective: to determine the stability of the new 2 % miconazol nitrate cream formulation to verify its validity period.
Methods: the studies followed the regulations in force. Three pilot-scaled batches, packed in 25 g aluminum tubes, were used. The analytical methods were high resolution liquid chromatography technique and thin layer chromatography, being both methods previously validated for these purposes. The selected storage temperatures were 30 ± 2 °C (shelf life) and 40 ± 2 ºC (accelerated stability). The estimated parameters included organoleptic properties, pH, extensibility area, titration, content of related substances and/or degradation products in addition to evaluating the quality of formulation from the microbiological viewpoint.
Results: from the chemical viewpoint, the evaluated batches showed contents over 98 % of analyte and very low levels of related substances, regardless of batch and the storage temperature. The thin layer chromatography did not detect any additional stain attributed to possible degradation products. The extensibility showed normal decrease resulting from progressive structuring of the system and the pH also lowered within the set limits. The microbiological stability of the drug was proved to be high after 12 months.
Conclusions: the cream was chemically, physically and microbiologically stable at room temperature for 12 months, so this is the term suggested as the temporary validity period.
Keywords: miconazol nitrate, cream, accelerated stability, shelf life stability, thin layer chromatography, high resolution liquid chromatography.
INTRODUCCIÓN
El nitrato de miconazol pertenece al grupo farmacológico de los antifúngicos de tipo azólico derivados del imidazo,l el cual le confiere características básicas y es muy utilizado en medicina por sus propiedades antimicóticas. En dependencia de la forma farmacéutica se puede utilizar tanto como fármaco base o como sal: nitrato de miconazol.1,2
Se conoce como un polvo cristalino, blanco e inodoro, escasamente soluble en metanol, ligeramente soluble en etanol y muy poco soluble en agua. Este comportamiento se debe a que la molécula se encuentra poco ionizada, presenta una elevada masa molar de 479,14 g/mol y la influencia de grupos funcionales voluminosos le proporcionan liposolubilidad.2,3
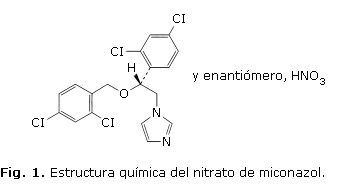
Su nombre químico es 1-[(2RS)-2-[(2,4-Dichlorobenzyl)oxy]-2-(2,4-dichlorophenyl)ethyl]-1H- imidazol nitrato.2 En la figura 1 se muestra su estructura química.
En Cuba se comercializa en forma de crema al 2 %.4 Recientemente se llevó a cabo su reformulación teniendo en cuenta incumplimientos en algunas especificaciones de calidad y contaminaciones microbiológicas de varios lotes industriales.
Como parte del conjunto de investigaciones que se requiere para el registro de un nuevo producto, se destacan por su importancia los estudios de estabilidad, cuyo propósito es proveer evidencia de cómo la calidad de un principio activo o producto terminado varía en el tiempo bajo la influencia de una serie de factores ambientales (temperatura, humedad, luz, exposición al oxígeno, entre otros); con esta finalidad se emplean métodos que permitan comprobar la estabilidad física, química y microbiológica, para poder establecer el período de validez y las condiciones de almacenamiento durante la etapa de comercialización.5,6
Dados estos antecedentes, este trabajo tuvo como objetivo determinar la estabilidad de la nueva formulación de nitrato de miconazol crema al 2 %, para determinar su período de validez.
MÉTODOS
Para la realización de este estudio se emplearon muestras representativas de tres lotes elaborados a escala piloto de la nueva formulación de nitrato de miconazol en la Empresa Roberto Escudero Díaz (fecha de fabricación octubre de 2011), rotuladas como lotes EP11001, EP11002 y EP11003.
Para el almacenamiento de los lotes se empleó como envase primario tubos comprimibles de aluminio litografiados, con laca epoxifenólica interior y boca ciega, tapa plástica con perforador de polietileno de alta densidad de color blanco y como envase secundario, estuches plegables de cartulina blanca litografiados también exteriormente.
Para la determinación del área de extensibilidad se utilizaron dos láminas de vidrio de 12 x 15 cm, colocando una de ellas sobre papel milimetrado. Se añadieron 2 g del semisólido pesados en balanza técnica digital Sartorius BS2202S (China), en el centro de la placa y se colocó cuidadosamente la otra lámina de vidrio. Esta última pesaba 200 g. Transcurridos 5 min, se determinó la distancia desde el punto de aplicación hasta donde se extendió el semisólido. Se midió la extensibilidad en cuatro direcciones perpendiculares entre sí. Se calculó el área de la elipse formada mediante la siguiente fórmula:
A= p (d1 x d2) / 4
donde:
A: área de la elipse formada (mm2).
d1 y d2: semidiámetros perpendiculares a la elipse formada (mm).
Se aplicó por triplicado y se determinó, la desviación estándar (DE) y el coeficiente de variación (CV).
La determinación del pH durante el estudio se realizó mediante un pHmetro PHSJ-3F (China).
En el estudio se utilizó un método por cromatografía en capa delgada (CCD) para seguir el comportamiento de la estabilidad química de las cremas con fines cualitativos validado previamente con este propósito,7 empleando como fase estacionaria placas sin activar de sílica gel GF254, como fase móvil éter de petróleo: cloroformo: metanol: solución amoniacal al 25 % en una proporción (60:30:10:1 v/v/v/v) y como revelador luz UV suministrada por una lámpara UV HANAU (China) a 254 nm.
Para realizar la valoración se empleó el método analítico propuesto por la Farmacopea Británica del 20102 para la cuantificación del ingrediente farmacéuticamente activo (IFA) en la crema, el cual fue previamente evaluado con la finalidad de realizar los estudios de estabilidad de la nueva crema de nitrato de miconazol al 2 %.7 A su vez las condiciones cromatográficas en este método coinciden con las reportadas para la determinación de sustancias relacionadas en esta misma Farmacopea, las cuales se muestran a continuación: cromatógrafo KNauer (Alemania) con detector UV-VIS (KNauer) ajustado a 235 nm. La separación se realizó por reparto en fase reversa, empleando una columna MEDITERRANEA SEA RP C18 5 µm (10 x 0,21). La fase móvil consistió en una solución de acetato de amonio 0,6 % m/v en una mezcla de 300 mL de acetonitrilo, 320 mL de metanol y 380 mL de agua, con una velocidad de flujo de 2 mL/min.
Se empleó como sustancia de referencia (SR) el nitrato de miconazol USP (United States Pharmacopoeia, lote JOD011, procedente de Estados Unidos de América)
ESTABILIDAD ACELERADA Y POR VIDA DE ESTANTE
Se realizaron dos tipos de estudios de estabilidad (acelerado y vida útil o estante). Se almacenaron muestras suficientes de cada lote piloto de crema de nitrato de miconazol al 2 % en dos condiciones de almacenamiento diferentes. Para el estudio de estabilidad acelerada las muestras se colocaron en la estufa P Selecta (España) a 40 ± 2 °C y para el estudio de estabilidad de vida útil, las muestras se almacenaron a temperatura ambiente (30 ± 2 ºC).
Se siguió la metodología establecida por el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) en lo referido a tipo de estudio de estabilidad, condiciones de almacenamiento, tipo de lotes a analizar, frecuencia de muestreo y duración del ensayo.5 La duración del estudio de estabilidad acelerada fue de 6 meses, mientras que el estudio de vida útil fue de 12 meses. Como el producto se consideró "conocido", el muestreo se realizó individualmente por lote almacenado en cada condición de almacenamiento antes descrita, con la siguiente frecuencia: acelerado (0, 3, 6 meses) y vida de estante (0, 3, 6, 12 meses).
En ambas condiciones de almacenamiento se evaluaron propiedades organolépticas, área de extensibilidad, pH, valoración, sustancias relacionadas y/o productos de degradación, así como conteo microbiológico que solamente se realizó a las cremas almacenadas durante 12 meses a temperatura ambiente.
RESULTADOS
Los tres lotes pilotos en las diferentes condiciones de almacenamiento propuestas presentaron un adecuado cumplimiento de los criterios de aceptación establecidos para los parámetros evaluados.
En la tabla 1 se muestran los resultados de los parámetros evaluados durante el estudio de estabilidad acelerada y en la tabla 2 los valores obtenidos en el estudio de vida de estante.
Desde el punto de vista químico los lotes evaluados, mostraron contenidos superiores al 98 % de analito y niveles muy bajos de sustancias relacionadas, independientemente del lote y la temperatura de almacenamiento como se muestra en las tablas 1 y 2.
Las áreas de extensibilidad mostraron un decrecimiento ligero y el pH también disminuyó discretamente pero dentro de los límites propuestos. En cuanto a las propiedades organolépticas se cumplieron con los criterios establecidos, lo cual se puede apreciar de igual forma en las tablas 1 y 2.
En la figura 2 se muestran los resultados obtenidos por CCD, en la que se observa la no aparición de manchas adicionales atribuibles a posibles productos de degradación.
Adicionalmente se corroboró la estabilidad química de las cremas analizadas al comparar cromatogramas resultantes para los tres lotes en condiciones de vida de estante con cremas a tiempo cero, SR nitrato de miconazol utilizada en la cuantificación y cremas placebos del producto en estudio (Fig. 3).
Además se comprobó la elevada estabilidad microbiológica del medicamento a los 12 meses al ser evaluado según las exigencias establecidas para productos no estériles.
DISCUSIÓN
La selección del envase utilizado para el almacenamiento de las cremas de nitrato de miconazol al 2 % (tubos comprimibles de aluminio, con laca epoxifenólica interior y boca ciega, tapa plástica con perforador de polietileno de alta densidad, color blanco y litografiados), se realizó teniendo en cuenta que su disponibilidad y calidad se encuentran garantizadas, ya que estos tubos comprimibles se suministran por un proveedor evaluado de trayectoria satisfactoria; además teniendo en cuenta su superioridad con respecto a otros envases alternativos disponibles en el país en cuanto a calidad y hermeticidad.
Los tres lotes pilotos de crema de nitrato de miconazol al 2 % cumplieron satisfactoriamente con las especificaciones de calidad descritas para este producto.8
Las propiedades organolépticas estuvieron acorde con la descripción registrada, tanto en condiciones aceleradas como de vida de estante. Se describe como un semisólido de aspecto uniforme, libre de grumos y arenosidad, de color blanco y olor característico. No se detectó la presencia de grumos, ni otros síntomas relacionados con problemas de inestabilidad física durante el proceso de elaboración.
El área de extensibilidad mostró un ligero decrecimiento en el período de estudio pero siempre se mantuvo dentro de los límites establecidos para el producto. Estos resultados fueron lógicos, ya que en las etapas iniciales ocurre la estructuración del sistema que tiene lugar de forma progresiva, lo cual se refleja en un aumento de la consistencia, expresado por la disminución del área de extensibilidad en el tiempo. En general, se pudo observar una marcada influencia del lote, la cual fue mayor para el caso del lote EP11002, en la que ocurrió la menor variación en las áreas de extensibilidad entre el inicio y el final del estudio en condiciones aceleradas y para las condiciones de vida de estante fue el lote EP11003 el cual mostró un mejor comportamiento.
Es importante destacar que este ensayo se realiza totalmente de forma manual, por lo que pequeñas variaciones en su ejecución repercuten de forma marcada en los resultados. Estas variaciones pueden estar dadas por la fuerza con que se coloca la lámina de cristal superior, que no siempre se logra sea la misma, en la destreza del analista para determinar los semidiámetros de la elipse, y en la exactitud de la cantidad de semisólido que se pesa para el ensayo.
El pH sufrió un decrecimiento discreto en todos los lotes, pero dentro de los límites propuestos, con muy bajos valores de DE, lo cual avala la precisión de la determinación. Las reducciones al cabo de los 12 meses fueron ligeramente inferiores a las detectadas al cabo de 6 meses de estudio acelerado, excepto para el lote EP11001.
El pH resultante en la crema de nitrato de miconazol, viene dado fundamentalmente por el sistema buffer formado entre el miconazol nitrato (forma disociada= FD) y el miconazol en forma de base (forma no disociada= FND), especies en equilibrio en la formulación. Ambos son insolubles en la fase acuosa, pero la forma base lo es aun más, por lo que se encuentra en estado sólido o en mayor proporción disuelta en la fase oleosa, con la cual tiene mayor afinidad. Por esta razón, durante el almacenamiento, la tendencia es a que la concentración disminuya en fase acuosa.
Según la ecuación de Henderson-Hasselbalch:9 pH= pKa + log [FD] / [FND], al reducirse la concentración de la forma base (FND), el pH resultante tiende a disminuir, lo que se presentó en el estudio realizado.
La CCD permitió evaluar cualitativamente, la presencia del analito libre de interferencias de sus posibles productos de degradación y demás componentes de la formulación (excipientes), en condiciones de vida de estante. Solo se detectaron manchas de igual Rf (Rf= 0,6) e intensidad que el IFA presente en la SR y la correspondiente a los parabenos presentes en la formulación en el punto de aplicación (Rf= 0), lo cual se corresponde con lo reportado en la literatura.7 Las respuestas obtenidas por este método en las muestras de crema procedentes de los tres lotes analizados, tuvieron el mismo comportamiento durante todo el período de estudio, es decir, no se detectó ninguna mancha adicional atribuible a la aparición de productos de degradación.
Los resultados promedio del contenido de nitrato de miconazol en la crema, así como el contenido de sustancias relacionadas individuales y totales mostraron el mismo comportamiento durante todo el estudio.
Los valores del contenido de nitrato de miconazol en los lotes estudiados tuvieron pequeñas disminuciones en ambas condiciones de almacenamiento, lo que demuestra que el producto fue estable químicamente.
En cuanto a las sustancias relacionadas (como criterio indirecto del comportamiento de los productos de degradación a través del tiempo), dieron en todos los casos áreas de los picos individuales secundarios ≤ 0,25 % y la suma de las áreas de todos los picos secundarios fueron ≤ 0,5 %; lo cual se corresponde con los criterios propuestos por la Farmacopea Británica de 20102 para este ensayo.
En la figura 3 se muestra, a modo de ejemplo, un cromatograma del lote EP11002 (Fig. 3, D) almacenado a temperatura ambiente durante 12 meses, donde solo se detectó la presencia del IFA al ser comparado con cromatogramas de cremas recién elaboradas (tiempo cero) (Fig. 3, C), de SR de nitrato de miconazol utilizada en la cuantificación (Fig. 3, A) y con placebos del producto en estudio (Fig. 3, B).
Se puede observar la obtención de un pico con un tiempo de retención mayor correspondiente al IFA en la SR (tr= 8,450) y la señal atribuible al frente de disolvente al inicio (tr= 0,383), señal que apareció en todos los casos al inicio de los cromatogramas y que se debió a la respuesta de la mezcla de disolventes empleadas en la preparación de muestras y patrones.
La variabilidad observada en los tr del nitrato de miconazol y en las áreas de los picos se atribuyó a variaciones en las condiciones experimentales durante la ejecución de los ensayos, por ejemplo, días y columnas diferentes. En su mayoría se trabajó con columnas con un tiempo de uso bastante prolongado, por lo que pudo haber ocurrido pérdida de la fase estacionaria,10 de igual forma no se pudo asegurar que se mantuviera el mismo número de platos teóricos en estas columnas durante las diferentes corridas, ni la misma temperatura en el sistema.10 Todos estos factores pudieron estar influyendo en las diferencias en los tiempos de retención resultantes para la señal analítica atribuible al nitrato de miconazol a los 12 meses.
Por otra parte el fenómeno de ensanchamiento del pico para esta misma muestra, pudiera explicarse a través del proceso cinético denominado efecto multipaso,10 dado que existe una gran cantidad de trayectorias que puede encontrar una molécula en su camino a través del empaque de una columna, lo que conduce a que unas se adelanten y otras se atrasen, lo cual está muy relacionado con el tamaño y la geometría de las partículas del empaque, así como con el grado de compactación del empaquetamiento. Por lo tanto, cuando en un punto de la columna hay obstrucción de la fase móvil debido a partículas muy pequeñas o cuando esta tiene que rodear partículas muy grandes de relleno y por estos motivos parte de las moléculas de un soluto se retrasan, los movimientos axiales de la fase móvil que tienen lugar en ambos casos conducen a un ensanchamiento del pico.10
Teniendo en cuenta entonces las deficiencias de las columnas cromatográficas empleadas en este estudio, se puede atribuir los resultados obtenidos a lo anteriormente explicado.
No obstante se puede afirmar que este pico a los 12 meses, si se corresponde con el nitrato de miconazol pues no existe ninguna otra señal analítica que pueda ser atribuida al nitrato de miconazol o algún producto de degradación.
En cuanto al conteo microbiológico y diferencial de las cremas almacenadas a temperatura ambiente, se obtuvo que todos los lotes presentaron valores acordes con los límites establecidos. No se aislaron Pseudomonas aeruginosas, Staphylococus aureus, ni otros microorganismos patógenos que atenten contra la calidad de estos productos.
Los resultados de los estudios de vida de estante permiten afirmar que las cremas nitrato de miconazol al 2 % fueron estables desde el punto de vista físico, químico y microbiológico durante 12 meses almacenadas a temperatura ambiente en el envase propuesto por el fabricante, por lo que se propone este plazo como período de validez.
REFERENCIAS BIBLIOGRÁFICAS
1. Brunton L. Goodman & Gilman's The Pharmacological Basis of Therapeutics. Section VII Chemotherapy of Microbial Diseases. Antifungal Agents. 12th ed. Connecticut, New Heaven: University Yale; 2011.
2. British Pharmacopoeia. Volume I & II. Monographs: Medicinal and Pharmaceutical Substances-Miconazole Nitrate. London: The Stationery Office; 2010. Versión electrónica 14.0.
3. Gómez M, López M. García G. Diseño de una formulación antimicótica. Rev Cubana Farm. 1998 [citado 13 feb 2012];32(1). Disponible en: http://www.bvs.sld.cu/revistas/far/vol32_1_98/far02198.htm
4. Empresa Laboratorio "Roberto Escudero Díaz". No. Reg.: 1168. Información administrativa Miconazol Crema. Parte I. Solicitud de Inscripción Registro de Medicamentos. La Habana, Cuba: Empresa Laboratorio "Roberto Escudero Díaz"; 1988.
5. Regulación 23-2000. Anexo 2. Centro para el Control Estatal de la Calidad de los Medicamentos, Equipos y Dispositivos Médicos. Requerimientos para los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. La Habana, Cuba: CECMED; 2000.
6. ICH Q1A (R2). Harmonised Tripartite Guideline. Stability Testing of new drug substances and products (Stress Testing). 2003. [cited 2012 Feb 13]. Available from: http://www.ich.org/products/guidelines/quality/quality-single/article/stability-testing-of-new-drug-substances-and-products.html
7. García O, Calzadilla W, Rodríguez W, Besada ER, Suárez Y. Evaluación de métodos cromatográficos para la estabilidad química del Nitrato de Miconazol en una nueva crema. Rev Cubana Farm. 2013 [citado 13 feb 2012];47(3). Disponible en: http://scielo.sld.cu/scielo.php?pid=S0034-75152013000300003&script=sci_arttext
8. ESP-ACC 11-1-064. Especificaciones de calidad del Miconazol crema. Producto Terminado. La Habana, Cuba: Empresa Laboratorio "Roberto Escudero Díaz"; 2011.
9. The United Stated Pharmacopoeia 35 and National Formulary 30 (USP 35-NF 30). Validation of compendial procedures. 35 ed. Rockville: Mack Printing; 2011. p. 840.
10. Zumbado H. Análisis Instrumental de Alimentos. Apuntes para un libro de texto. La Habana: Instituto de Farmacia y Alimentos, Universidad de La Habana; 2011. p. 188-90.
Recibido: 23 de julio de 2014.
Aprobado: 30 de agosto de 2014.
Wendy Calzadilla Aguiar. Instituto de Farmacia y Alimentos. Ave 23 # 21425 e/ 214 y 222. La Coronela, La Lisa. La Habana, Cuba. Correo electrónico: wendy@ifal.uh.cu