Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.2 Ciudad de la Habana abr.-jun. 2015
ARTÍCULO ORIGINAL
Estabilidad de una formulación de ciclopentolato 1 % colirio
Stability of a formulation of 1% cyclopentolate eye drops
MSc. Caridad Margarita García Peña, Ing. Yanet Montes de Oca Porto, Téc. Vivian Martínez Espinosa
Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
RESUMEN
Introducción: el colirio de ciclopentolato al 1 %, se indica para medir los errores de la refracción, producir cicloplejía en procedimientos diagnósticos y también midriasis preoperatoria y postoperatoria, en el tratamiento de la uveítis y en los estados inflamatorios del iris.
Objetivo: evaluar el desempeño del método de cromatografía líquida de alta resolución, aplicable al control de la calidad y estudio de estabilidad del colirio.
Métodos: para cuantificar el ingrediente farmacéutico activo en el producto terminado, se empleó el método descrito en la Farmacopea de los Estados Unidos (USP 32, 2009). El estudio de vida de estante se desarrolló por un periodo de 24 meses a temperatura controlada entre 15-25 °C; mientras que el de estabilidad acelerada a 40 ± 2 °C y 75 ± 5 % de humedad relativa, durante 6 meses.
Resultados: los resultados obtenidos en la evaluación del desempeño del método analítico se encontraron dentro de los límites establecidos. Los resultados del estudio de estabilidad por vida de estante después de transcurridos los 24 meses indicaron que el producto mantiene los parámetros que determinan su calidad durante ese tiempo, y en los acelerados no se observó degradación significativa del producto.
Conclusiones: la evaluación del desempeño del método analítico evaluado por cromatografía líquida de alta resolución demostró la confiabilidad del mismo. Se estableció 2 años como fecha de vencimiento en las condiciones señaladas.
Palabras clave: ciclopentolato, cromatografía líquida de alta eficiencia, colirio, control de calidad, estudio de estabilidad.
ABSTRACT
Introduction: the 1% cyclopentolate eye drops is indicated to measure the refractive errors, to cause cycloplexy in diagnostic procedures and also preoperative and postoperative midriasis in treating uveitis and in inflammatory conditions of the iris.
Objective: to evaluate the performance of a high performance liquid chromatography applicable to the quality control and the study of the eye drops stability.
Methods: with the purpose of quantifying the active ingredient in the finished product, the method described in the US Pharmacopea (USP 32,2009) was used. The shelf life study was conducted for 24 months at controlled 15-25 ºC temperature whereas the study of accelerated stability at40±2 ºC and 75± 5 % relative humidity lasted 6 months.
Results: the achieved results in the evaluation of the performance of the analytical method were within the set limits. The results for the shelf life stability after 24 months yielded that the product keeps the quality parameters during this time and in the accelerated stability study, there was no sign of significant degradation.
Conclusions: the evaluation of the performance of the analytical method based on high performance liquid chromatography showed its reliability. The expiry date was set at 2 years under the stated conditions.
Keywords: cyclopentolate, high performance liquid chromatography, eye drops, quality control, stability study.
INTRODUCCIÓN
El clorhidrato de ciclopentolato se emplea en oftalmología para provocar midriasis y ciclopejía (parálisis de la acomodación) en distintas circunstancias o en procedimientos oftálmicos de diagnóstico, como son el tratamiento de la queratitis o el exámen del fondo de ojo. Se indica para medir los errores de la refracción, el tratamiento de la uveítis y los estados inflamatorios del iris, la midriasis preoperatoria y postoperatoria.1,2
En la Farmacopea de los Estados Unidos (USP 32, 2009)3 aparece el método analítico por Cromatografía Líquida de Alta Resolución (CLAR) para el producto terminado. La evaluación del método se realiza para obtener pruebas documentales de que el método a emplear en el control de la calidad y el estudio de estabilidad del producto terminado es confiable y seguro. Los parámetros analíticos que pueden ser considerados en la evaluación de un método analítico son exactitud, precisión, especificidad y linealidad.4,5
La CLAR le brinda al analista la posibilidad de emplear esta herramienta para solucionar los inconvenientes de los métodos espectrofotométricos en los estudios de estabilidad, pues además de presentar una alta sensibilidad y exactitud, es en esencia un método separativo; lo que permite medir con gran selectividad el compuesto deseado, siempre y cuando se encuentre un sistema cromatográfico que asegure una adecuada separación.4
La estabilidad de los productos farmacéuticos representa un importante eslabón en el desarrollo y formulación de toda forma terminada. De esta manera se puede definir las condiciones de almacenamiento en el envase propuesto y establecer la vida útil del producto farmacéutico. Estos estudios contemplan la conservación de la potencia, pureza, características organolépticas y su efectividad. El Centro para el Control Estatal de los Medicamentos (CECMED) exige para el registro de un nuevo medicamento la realización de los estudios de estabilidad.6
El presente trabajo se realiza con el objetivo de evaluar el método de análisis para el producto terminado y realizar el estudio de estabilidad de una formulación de ciclopentolato 1 % colirio.
MÉTODOS
La sustancia de referencia química de ciclopentolato hidrocloruro, patrón primario, fue suministrado por el grupo de sustancias de referencia del Centro de Investigación y Desarrollo de Medicamentos (CIDEM), el cual fue analizado por el método cromatográfico establecido para realizar el control de la calidad de la materia prima, con una pureza de 99,6 %. El producto terminado en forma de colirio, fue elaborado en el Laboratorio de Formas Terminadas del CIDEM, identificado con los lotes 9001, 9002 y 9003, fabricado en mayo de 2009, el cual cumplió con las especificaciones establecidas para el control de la calidad.
EVALUACIÓN DEL MÉTODO ANALÍTICO
La evaluación se realizó según el método reportado en la Farmacopea de los Estados Unidos (USP, 32) para el colirio de ciclopentolato 1 %; se evaluaron los parámetros que se describen.
Para el estudio de la linealidad de la respuesta del detector se prepararon soluciones de concentraciones en un rango de 60 a 140 μg/mL, que representan del 60 al 140 % de la concentración teórica del ingrediente farmacéutico activa (IFA) en la solución. Se determinaron valores de área a la longitud de onda (220 nm) obteniéndose una curva de calibración que respondió a la ecuación de la recta el coeficiente de correlación, la prueba de significación de la pendiente Sb rel (%) y el coeficiente de variación de los factores de respuesta.
En el estudio de la exactitud se empleó el método de recuperación, preparando muestras con diferentes niveles de ciclopentolato (80, 100 y 120 %); según la formulación propuesta, se determinó el porciento de recuperación y el coeficiente de variación. Se realizó además la prueba de Cochram con vistas a comprobar si la variación de la concentración producía diferencias significativas en los resultados, para una k= 3, n= 3, 95 % de confianza, y la prueba de la t de Student para determinar diferencias significativas entre la recuperación media y el 100 %.
Se evaluó la precisión del método. La repetibilidad se estudió sobre la base de seis determinaciones; con ellas se determinaron los valores medios, la desviación estándar y el coeficiente de variación. De igual manera para el ensayo de la Precisión intermedia para dos analistas y tres días diferentes. Se aplicó la prueba de Fisher y de t de Student para determinar si existen diferencias significativas entre los resultados al variar las condiciones de análisis.
En la especificidad del método se analizó la sustancia de referencia química, el placebo y una muestra sometida a condiciones drásticas como: hidrólisis (ácida HCl 1 N), (básica NaOH 1 N), oxidación con peróxido de hidrogeno 3 % y luz. No debe existir la presencia de otros compuestos que puedan presentar tiempos de retención similares.
ESTUDIO DE ESTABILIDAD
Para el desarrollo de la formulación se empleó como materia prima ciclopentolato hidrocloruro, procedente de la China, fecha de fabricación julio de 2007, la cual fue analizada siguiendo las especificaciones de calidad descritas en la monografía de la USP 32.
Este estudio se realizó por los métodos de vida de estante y estabilidad acelerada. Se emplearon muestras de los lotes 9001, 9002 y 9003, producidos en el Laboratorio de Formas Terminadas del CIDEM y envasados en frasco de polietileno de baja densidad, producido in situ por la llenadora Bottel Pack, por 5 mL, transparente con tapa de polipropileno de alta densidad.
Estabilidad acelerada: se almacenaron las muestras de los lotes estudiados en un horno a temperatura controlada de 40 ± 2 °C y 75 ± 5 % humedad relativa (HR); se valoraron al inicio, a 1, 2, 3 y 6 meses.
Estabilidad por vida de estante: los lotes estudiados se almacenaron a temperatura controlada (15-25 °C) y protegidos de la luz; se valoraron al inicio, a 3, 6, 9, 12, 18 y 24 meses de fabricados.
Estabilidad en frasco en uso: el lote estudiado (9001) se almacenó a temperatura controlada (15-25 °C) y protegidos de la luz; se valoraron al inicio, a 7, 15, 21 y 28 días de iniciado el estudio.
RESULTADOS
EVALUACIÓN DEL DESEMPEÑO DEL MÉTODO
La figura muestra los resultados obtenidos en el estudio de especificidad del método. En los cromatogramas se observa que no se obtiene ninguna señal, en el placebo (A), en la zona de interés, al ser comparado con la señal obtenida para la solución de referencia química (B) y la muestra (C), lo que indica que los excipientes o sustancias auxiliares no interfieren en la determinación del IFA. En cuanto a las muestras sometidas a condiciones drásticas se observa una disminución significativa del área del pico del ciclopentolato, de más de un 15 %, en las muestras sometidas a hidrolisis (D y E), no ocurriendo lo mismo en las muestras sometidas a oxidación y fotólisis donde no se observa disminución alguna; y un ligero aumento del área en el pico de aproximadamente 1,6-1,7 minutos, el cual no interfiere en la determinación del IFA, debido a que la elución del ciclopentolato ocurre a los 7,5 minutos aproximadamente.
En la tabla 1 se reportan los resultados del estudio de la linealidad del sistema; el coeficiente de regresión lineal fue de 0,996 y el coeficiente de variación de los factores de respuesta resultaron igual a 1,00.
En el estudio de repetibilidad, la media obtenida fue de 99,8 % y el coeficiente de variación fue de 0,36 %. El resultado del estudio de precisión del método desarrollado aparece reportado en la tabla 2, los valores de F y t calculadas resultaron menores que los valores tabulados por analistas y por días para un 95 % de confianza.
La recuperación media en el estudio de exactitud fue de 99,9 % y el valor de t calculada (1,578) y de G calculada (0,611) resultaron menores que los valores tabulados, t tabulada 2,306 para un 95 % de confianza y G tabulada 0,797 para un 95 % de confianza, k= 3 y n= 3.
ESTUDIO DE ESTABILIDAD
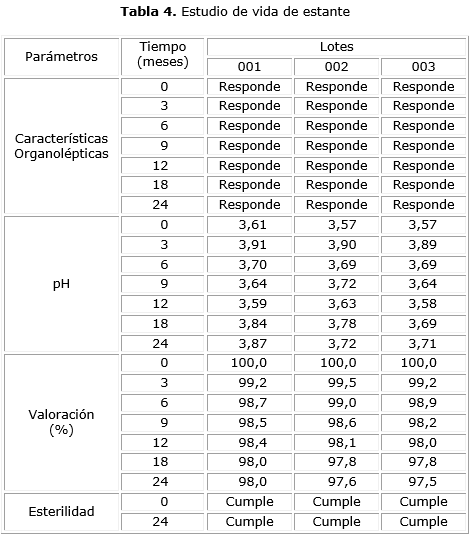
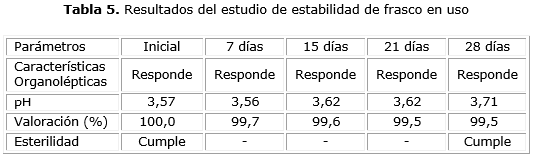
Los resultados de los estudios de estabilidad acelerada, vida de estante y de frasco en uso, se reportan en las tablas 3, 4 y 5, respectivamente, demostrándose en todos los casos, que el producto terminado es estable.
DISCUSIÓN
EVALUACIÓN DEL MÉTODO
Los resultados obtenidos en el estudio de especificidad del método (Fig.), demuestran la especificidad del método al no presentarse interferencias de picos adicionales en la determinación del IFA, no se evidencian interferencias de los excipientes, ni de los productos de degradación,4-5 por lo que puede aplicarse en el control de la calidad y estudio de estabilidad del producto terminado.
En el estudio de linealidad se obtuvieron valores superiores a los exigidos para los coeficiente de regresión y de determinación de 0,99 y 0,98 respectivamente; se demostró con el valor del coeficiente de correlación obtenido, cercano a la unidad, la existencia de correlación con una probabilidad elevada, así como el grado de relación entre las variables concentración y respuesta detectada por el equipo empleado. También el coeficiente de variación de los factores de respuesta (CVf) y la desviación estándar relativa de la pendiente fueron inferiores al normado como máximo para estos indicadores, 5 % y 2 % respectivamente, considerados estimadores puntuales que permiten caracterizar la variabilidad. El valor obtenido del CVf demostró que existe variabilidad en la relación respuesta y concentración para cada nivel evaluado.4,5
El coeficiente de variación resulto adecuado para la repetibilidad, lo que demuestra la buena precisión del método; se observa una variabilidad de los resultados dentro de los límites establecidos para los métodos cromatográficos CV ≤ 2,0 %.4,5
Los valores que se obtienen en los estudios de precisión intermedia, de las pruebas de Fischer y t de Student, demuestran que no existen diferencias significativas entre las precisiones alcanzadas por los analistas en diferentes días para un 95 % de confianza, ya que el valor de F calculado fue menor que la F tabulada, estos resultados permiten establecer que las precisiones son similares (tabla 2). Al realizar las pruebas de la t de Student, el valor calculado resultó menor que el tabulado, para un 95 % de confianza, lo cual demuestra que no existen diferencias significativas entre las medias alcanzadas, con un nivel de significación de un 5 %.
El valor de porcentaje de recobro, en la exactitud, estuvo dentro de los límites establecidos para los métodos cromatográficos (98‒102 %) y el valor del coeficiente de variación para cada uno de los niveles de concentración estudiados resultó ser menor que el 2 %. En la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud al aplicar la prueba de Cochran se obtuvo que la G calculada fue menor que la G tabulada para un 95 % de confianza, k= 3 y n= 3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes, lo que indica que la concentración no influye en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, el coeficiente de variación fue adecuado, el valor de t calculada resultó menor que la t tabulada. En el rango seleccionado en el estudio de exactitud, los valores de porcentaje de recobro están dentro de los límites establecidos para los métodos cromatográficos (98-102 %) y los valores del coeficiente de variación, para cada uno de los niveles de concentración estudiados, fueron menores que el 2 %.4,5
ESTUDIO DE ESTABILIDAD
El conjunto de los resultados obtenidos en la tabla 3, demostraron la estabilidad térmica del producto ya que después de transcurridos seis meses se mantuvo la concentración conforme con los límites establecidos en las especificaciones de calidad del producto terminado.6
No se observaron cambios significativos, en el estudio por vida de estante (tabla 4), en los aspectos organolépticos, ni en el pH y tampoco en la concentración del IFA determinado en la valoración durante el tiempo de almacenamiento estudiado, por lo que se evidenció la estabilidad del producto terminado por un periodo de dos años, ya que el producto se mantuvo estable en el tiempo de duración del estudio.
Los resultados obtenidos en el estudio de frasco (tabla 5), se encontraron dentro de los límites establecidos para el producto terminado y se demostró la estabilidad del producto en las condiciones de uso de este.6
El método analítico reportado en la USP 32, evaluado para su aplicación en el colirio ciclopentolato 1 % de producción nacional, resultó específico, lineal, exacto y preciso en el rango de concentraciones estudiadas y demostró la estabilidad física, química y microbiológica del producto por espacio de 24 meses a temperatura controlada, ya que en todos los casos los resultados obtenidos se encontraron dentro de los límites establecidos en las especificaciones de calidad del mismo.
REFERENCIAS BIBLIOGRÁFICAS
1. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. Tomo II. 3ra ed. La Habana: Editorial Científico Técnica; 1994.
2. PDR. Physician´s Desk Reference. 57 ed. New York: Inc at Montuale; 2003.
3. The United States Pharmacopeial Convention. USP 32. [CD-ROM]. Rockville: Mack Printing; 2009.
4. Dierksneier G. Métodos cromatograficos. La Habana: Ed. Científico-Técnica; 2005:1-4, 256-412.
5. International Conference on Harmonization. Validation of Analytical Procedures. Technical Requirements for the Registration of Pharmaceuticals for Human Use. Geneva: ICH-Q2A; 1995.
6. Centro Estatal para el Control de Medicamentos. Regulación No. 16-2000: Buenas Prácticas de Fabricación de Productos Farmacéuticos. La Habana: CECMED; 2000.
Recibido: 25 de agosto de 2014.
Aprobado: 7 de noviembre 2014.
Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1605 e/ Boyeros y Puentes Grandes. CP 10600. Plaza de la Revolución, La Habana, Cuba.
Correo electrónico: caridadgp@infomed.sld.cu