Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.3 Ciudad de la Habana jul.-set. 2015
ARTÍCULO ORIGINAL
Avaliações comparativas da associação entre antibióticos frente à Pseudomonas aeruginosa
Evaluation of the association antibiotics against Pseudomonas aeruginosa
Evaluación comparativa del uso asociado de antibióticos frente a Pseudomonas aeruginosa
PhD. Henrique Douglas Melo Coutinho,I MSc. Dara Isabel Vieira de Brito,I MSc. Celestina Elba Sobral de Souza,I MSc. Gioconda Morais de Andrade Bezerra Martins,I MSc. Poliana Moreira de Medeiros Carvalho,II BSc. Fábia Ferreira Campina, I Lic. Rosimeire Sabino AlbuquerqueI
I Laboratório de Microbiologia e Biologia Molecular, Universidade Regional do Cariri, Crato (CE), Brasil.
II Laboratório de Farmacologia e Química Molecular, Universidade Regional do Cariri, Crato (CE), Brasil.
RESUMO
Introdução: Pseudomonas aeruginosa caracteriza-se como bastonete gram-negativo reto ou ligeiramente curvo, aeróbio estrito, podendo ser encontrado na água, solo, vegetais, esgoto e animais. É um patógeno nosocomial com envolvimento em infecções hospitalares provocando infecções oportunistas em pacientes, principalmente naqueles imunocomprometidos. Uma das características de P. aeruginosa é seu alto nível de resistência intrínseca a agentes antimicrobianos estruturalmente diferentes.
Objetivo: avaliar as atividades microbiológicas e comparar as atividades decorrentes da associação entre antibióticos que atuam no mesmo alvo e também em alvos diferentes frente às cepas bacterianas de Pseudomonas aeruginosa.
Métodos: a Concentração Inibitória Mínima (CIM) foi realizada pelo método de microdiluição em caldo. Foi realizada modulação com bactérias associando os antibióticos.
Resultados: as associações claritromicina‒imipenem e claritromicina ‒ciprofloxacina apresentaram sinergismo frente à P. aeruginosa, porém a associação claritromicina‒gentamicina demonstrou indiferença. Por outro lado as associações imipenem‒claritromicina, ciprofloxacino‒claritromicina e gentamicina ‒claritromicina apresentaram antagonismo.
Conclusão: o resultado deste ensaio sugere que a associação de dois antibióticos testados aumenta o seu potencial antimicrobiano, podendo ser usado em combinação mediante investigações posteriores que comprovem a segurança de tal uso.
Palavras-chave: antibióticos, Pseudomonas aeruginosa, modulação, resistência.
ABSTRACT
Introduction: Pseudomonas aeruginosa is an anaerobic and gramnegative rod, they can be isolated from water, soil, vegetables, waste and animals. This microorganism is a nosocomial opportunistic infectious agent, mainly for immunocompromised patients. One of the main traits of P. aeruginosa is its intrinsic drug resistance to structurally different antibiotics.
Objective: to evaluate the microbiological effect and to compare the activities derived from the antibiotic association s acting on the same target and on different targets against P. aeruginosa strains.
Methods: the Minimun Inhibitory Concentration (MIC) was determined by broth microdilution method. The modulation of the activity on the bacteria was based on the antibiotic association.
Results: the association of clarithromycin-imipenem and of clarothromycin-ciprofloxacin demonstrate synergism against P. aeruginosa. However, the association of clarithromycin?gentamycin did not show differences. On the other hand, the association of imipenem-clarihtromycin, of ciprofloxacine-clarithromycin and of gentamycin-clarithromycin showed antagonistic effect.
Conclusions: the results of this study indicated that the association of two antibiotics enhances the antimicrobial potential of these drugs, and that they can be used in combination whenever other research studies confirm the safety of such use.
Keywords: antibiotics, Pseudomonas aeruginosa, modulation, resistance.
RESUMEN
Introducción: la Pseudomonas aeruginosa se caracteriza por ser gramnegativos con imagen de bastones rectos o ligeramente curvos, aeróbios, se pueden encuentrar en el agua, el suelo, en plantas, animales y aguas residuales. Es un patógeno nosocomial implicado en infecciones hospitalarias, causando infecciones oportunistas en pacientes, especialmente en aquellos inmunocomprometidos. Una de las características de la P. aeruginosa es su alto nivel de resistencia intrínseca a agentes antimicrobianos estructuralmente diferentes.
Objetivo: evaluar las actividades microbiológicas y comparar las actividades derivadas de la asociación de antibióticos que actúan sobre la misma diana y también sobre diferentes dianas frente a cepas bacterianas de Pseudomonas aeruginosa.
Métodos: el cálculo de la Concentración Mínima Inhibitoria (CMI) se realizó por el método de microdilución en caldo. La modulación de la actividad sobre bacterias se realizó por asociación de antibióticos.
Resultados: las asociaciones claritromicina‒imipenem y claritromicina ‒ciprofloxacina mostraron sinergismo frente a P. aeruginosa; sin embargo la asociación claritromicina‒gentamicina no mostro diferencias. Por otro lado las asociaciones imipenem‒claritromicina, ciprofloxacino‒claritromicina y gentamicina ‒claritromicina demostraron antagonismo.
Conclusión: los resultados de este estudio indican que la combinación de dos antibióticos aumenta su potencial antimicrobiano, y que pueden ser utilizadas en combinación, una vez que otras investigaciones confirmen la seguridad de dicho uso.
Palabras clave: antibióticos, Pseudomonas aeruginosa, modulación, resistencia.
INTRODUÇÃO
Pseudomonas aeruginosa, microrganismo pertencente à família Pseudomonadaceae, caracteriza-se como bastonete gram-negativo reto ou ligeiramente curvo, aeróbio estrito, apresentando-se como células isoladas, aos pares, ou em cadeias curtas, revelando mobilidade através de flagelo polar monotríqueo, podendo ser encontrado na água, solo, vegetais, esgoto e animais.1
P. aeruginosa é considerado um patógeno nosocomial com envolvimento em diversas infecções hospitalares provocando infecções oportunistas em pacientes, principalmente naqueles imunocomprometidos.2 As infecções causadas por este patógeno compreendem desde aquelas consideradas superficiais até sepses fulminantes.3
Uma das características da P. aeruginosa é seu alto nível de resistência intrínseca a agentes antimicrobianos estruturalmente diferentes.4
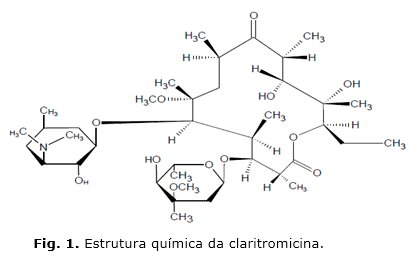
A Claritromicina, antibiótico pertencente à classe dos macrolídeos, penetra na parede celular e inibe a síntese de proteínas ao ligar-se às subunidades ribossomais 50S, bloqueando a translocação de aminoácidos pelo RNA transportador e interrompendo a síntese de polipeptídeos (fig.1).5
O Imipenem, assim como outros antibióticos β‒lactâmicos, liga-se às proteínas de ligação da penicilina (PBP), interrompe a síntese da parede celular bacteriana e provoca morte dos microrganismos sensíveis. Sua atividade in vitro é excelente para uma ampla variedade de microrganismos aeróbicos e anaeróbicos (fig. 2).6
O mecanismo de ação dos aminoglicosídeos depende, essencialmente, da veiculação dos princípios ativos para o interior dos microrganismos, proporcionando a atuação destas drogas no ribossomo bacteriano.7
Dentro da célula, o antibiótico Gentamicina, do grupo dos aminoglicosídeos, liga-se a proteínas específicas da subunidade 30S dos ribossomos. A síntese proteica é então inibida por pelo menos 03 (três) maneiras: interferência sobre o complexo de iniciação da formação do peptídio; leitura incorreta do mRNA, que causa a incorporação de aminoácidos incorretos ao peptídeo, resultando em uma proteína não-funcionante; quebra dos polissomos em monossomos não-funcionantes (fig. 3).8
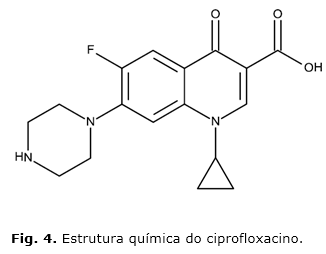
As fluoroquinolonas, classe a qual pertence à ciprofloxacina, têm como alvo duas enzimas homólogas, nomeadamente a DNA topoisomerase II (também conhecida por DNA girase) e DNA topoisomerase IV, as quais são essenciais no superenrolamento do DNA da bactéria. Ambas as enzimas são compostas por subunidades codificadas pelos genes gyrA e gyrB (para DNA girase) e parC e parE (para a topoisomerase IV).9 As fluoroquinolonas inibem a síntese de DNA por interação do antibiótico com o complexo formado pela união do DNA com os alvos da quinolona, a DNA girase e a topoisomerase IV (fig. 4).10
As opções terapêuticas para tratamento das infecções causadas por Pseudomonas aeruginosa incluem aminoglicosídeos, fluoroquinolonas, penicilinas de amplo espectro, monobactâmicos, cefalosporinas de terceira e quarta gerações e carbapenêmicos.1 Entretanto, um dos grandes problemas no tratamento das infecções causadas por esta bactéria está relacionado ao alto nível de resistência da mesma aos antimicrobianos. O objetivo desse trabalho foi avaliar as atividades microbiológicas da ciprofloxacina, claritromicina, gentamicina e do imipenem, considerando o potencial antimicrobiano, e avaliar comparativamente as atividades da associação entre os antibióticos frente à Pseudomonas aeruginosa.
MÉTODOS
LINHAGENS CELULARES UTILIZADAS
Os microrganismos utilizados neste trabalho foram as seguintes bactérias: linhagem padrão Pseudomonas aeruginosa 15442 e a multirresistente P. aeruginosa 03. Todas as linhagens foram cedidas pelo Laboratório de Micologia da Universidade Federal da Paraíba‒UFPB.
Foram utilizados os seguintes meios de cultura: Agar Heart Infusion‒HIA ( Difco Laboratories Ltda) e Brain Heart Infusion broth‒BHI (Difco Laboratories Ltda) na concentração indicada pelo fabricante e a 10 %. Todos os meios de cultura foram preparados de acordo com as especificações do fabricante e esterilizados em autoclave de vapor quente. As bactérias foram inoculadas em caldo Brain Heart Infusion e incubadas a ±35 °C, durante 24 horas.
ANTIBIÓTICOS
As drogas utilizadas neste trabalho foram a claritromicina, ciprofloxacina, gentamicina e o imipenem obtidas da Sigma Chemical Co. Todas as drogas foram dissolvidas em água estéril.
CONCENTRAÇÃO INIBITÓRIA MÍNIMA (CIM)
A Concentração Inibitória Mínima (CIM) foi realizada pelo método de microdiluição em caldo. Os microrganismos, mantidos em HIA, foram inoculados em 3 mL de caldo BHI por 24h à 37 ºC, afim de formar uma suspensão de 105 UFC/mL. Uma solução contendo 1350 µL de BHI (10%) e 150 µL do inóculo foi colocada em cada um dos eppendorfs. Em seguida foram distribuídos 100 µL desta solução em cada cavidade da placa de microdiluição e logo em seguida adicionados 100 µL do antibiótico na primeira cavidade, seguido de sucessivas diluições na proporção de 1:1, até a penúltima cavidade. A última cavidade foi reservada para controle. As concentrações dos antibióticos variaram de 1024‒1 µg/mL. A placa foi colocada na estufa por um período de 24 horas a 37 °C.11 A CIM de cada antibiótico foi determinada. A revelação da CIM bacteriana foi feita utilizando-se a resazurina.
MODULAÇÃO DA ATIVIDADE ANTIBIÓTICA POR MICRODILUIÇÃO
A solução do antibiótico imipenem foi testada em concentração subinibitória (MIC/8).12 Em seguida o mesmo procedimento foi realizado com a claritromicina, a gentamicina e a ciprofloxacina. Foram distribuídos 100 µL de uma solução contendo BHI, inóculo e o antibiótico modulado em cada poço da placa. Em seguida, 100 µL da droga moduladora foram misturados ao primeiro poço, procedendo-se a microdiluição em série, numa proporção de 1:1 até a penúltima cavidade. As concentrações de claritromicina e imipenem variaram gradualmente de 256 a ˃1 µg/mL. As concentrações da gentamicina, ciprofloxacina e claritromicina variaram de 512 a 1 µg/mL.
ANÁLISE ESTATÍSTICA
Os resultados dos testes foram feitos em triplicata e expressos como média geométrica. Para análise estatística foi aplicada a two-way ANOVA seguida do teste de Bonferroni posttests.
RESULTADOS
Quando utilizada a gentamicina como agente modulador sobre a claritromicina (GEN/CLA), observou-se um efeito de caráter antagônico, ou seja, apresentaram um pior efeito quando administrados em conjunto, uma vez que o efeito antagônico antibacteriano pode ocorrer com a administração concomitante de bacteriostáticos e bactericidas.13 Mesmo esse antagonismo não sendo bem definido, trata-se de uma observação frequente in vitro. Quando testado inversamente, não foi observado um resultado significante contradizendo Gomes 14, já que o referido autor menciona que a terapia com macrolídeo pode ser efetiva contra patógenos gram-negativos produtores de biofilme, além de aumentar a efetividade de outros antibióticos associados (fig. 5).
Quando foi utilizado o imipenem modulando a claritromicina (IMI/CLA)frente a P. aeruginosa, o efeito antimicrobiano isolado da claritromicina é maior quando comparado à associação com o imipenem, demonstrando antagonismo, concordando assim com Diniz e colaboradores15 os quais afirmam que a claritromicina apresenta ação antagônica com as cefalosporinas e a penicilina por exercer ação bacteriostática, inibindo o efeito bactericida dos betalactâmicos (fig. 5).
Quando a claritromicina foi utilizada como droga moduladora sobre os demais antibióticos, obteve-se efeito sinérgico nas associações claritromicina/imipenem (CLA/IMI) e claritromicina/ciprofloxacina (CLA/CIP), possivelmente por atuarem em alvos diferentes, observando-se que a associação dos efeitos melhorou a atividade antimicrobiana (fig. 5).
DISCUSSÃO
P. aeruginosa possui susceptibilidade muito baixa aos antibióticos hidrofóbicos, como por exemplo, os macrolídeos. Por isso, estes antibióticos têm dificuldade em atravessar a membrana externa bacteriana.16 Embora os macrolídeos não possuam atividade intrínseca antimicrobiana contra P. aeruginosa em concentrações terapêuticas, existe um enorme interesse nas possibilidades de uso destes antibióticos associados a outras classes de uso terapêutico.17,18,19
Os efeitos potenciais dos macrolídeos sobre o biofilme bacteriano, com redução de fatores de virulência bacteriana quando utilizado em concentração sub-inibitória, também têm sido avaliados.20 Esses dados concordam com os resultados obtidos neste estudo quando a claritrocimina foi utilizada como droga moduladora em concentrações sub-inibitórias.
Os antibióticos utilizados no tratamento das infecções causadas por P. aeruginosa incluem os aminoglicosídeos, fluoroquinolonas, penicilinas de amplo espectro, monobactâmicos, cefalosporinas de terceira e quarta gerações e carbapenêmicos. É recomendado a utilização de uma associação incluindo um β‒lactâmico e outro antibiótico, comumente um aminoglicosídeo ou quinolona, sendo os β‒lactâmicos a base da associação escolhida.21 Isso concorda com a associação sinérgica que ocorreu quando o imipenem foi modulado pela claritromicina.
A resistência às quinolonas acontece por meio de mutações na DNA girase e topoisomerase IV, mas também por mutações em genes que regulam os diferentes sistemas de efluxo. A DNA girase é o principal alvo das quinolonas em bactérias gramnegativas.22
P. aeruginosa resistentes às quinolonas podem estar dentro de duas classes: (1) resultantes de mutação nas enzimas-alvo (DNA girase) ou (2) resultantes de mutações que ocorrem nos sistemas de efluxo.23 O primeiro mecanismo de resistência de P. aeruginosa, que ocorre em resposta a uma única exposição às quinolonas em concentrações perto da CIM, é o efluxo do antibiótico e não a alteração da DNA girase. Embora mutações da DNA girase possam atribuir maiores níveis de resistência, ao que parecem, estas mutações ocorrem com menor frequência do que a ativação do sistema de efluxo.24
Apesar de Yassien e colaboradores25 terem apresentado que concentrações sub-inibitórias das fluoroquinolonas reduziram a adesão do microrganismo P. aeruginosa a superfícies de plástico e cateteres vasculares, quando utilizada a ciprofloxacina modulando a claritromicina (CIP/CLA) frente a P. aeruginosa, o efeito antimicrobiano isolado da claritromicina é maior quando comparado à associação com o claritromicina, demonstrando antagonismo.
Os resultados obtidos foram significantes quanto ao sinergismo entre os antibióticos claritromicina e ciprofloxacino, claritromicina e imipenem, sendo de grande valia para terapêutica em bactérias multirresistentes, onde a associação de antibióticos de diferentes classes e mecanismos de ação pode surtir sucesso no tratamento.
Para reduzir a multirresistência torna-se necessário uma monitorização epidemiológica e racionalização do uso de antibióticos, com ou sem associações.
REFERÊNCIAS
1. Martins MA. Manual de infecção hospitalar – epidemiologia, prevenção e controle. 2ª ed. Minas Gerais: MEDSI, 2001.
2. Freitas ALP, Barth AL. Antibiotic resistance and molecular typing of Pseudomonas aeruginosa: focus on imipenem. Br J Inf Dis. 2002;6(1):1-7.
3. Kiska DL, Gillian PH. Pseudomonas. Manual of Clinical Microbiology. In: Murray PR, Baron EJ, Pfaller MA, Jorgensen JH, Yolken RH (eds). 8ª ed. Manual of Clinical microbiology. Washington DC: American Society for Clinical Microbiology; 2003.
4. Torres JCN, Menezes EA, Ângelo MRF, Oliveira IRN, Salviano MNC, Xavier DE, et al. Cepas de Pseudomonas spp. produtoras de metalo-betalactamase isoladas no Hospital Geral de Fortaleza. J Bras Patol Med Lab. 2006;42(5):313-19.
5. Piscitelli SC, Danzinger LH, Rodvold KA. Clarithromycin and azithromycin: new macrolide antibiotics. Clin Pharm., Bethesda 1992;11:137-52.
6. Petre Jr WA. Antimicrobianos: penicilinas, cefalosporinas e outros antibióticos beta-lactâmicos. In: Goodman A. As bases farmacológicas da terapêutica. 10ª ed. Rio de Janeiro: McGraw-Hill; 2003. p. 891-912.
7. Tavares W. Manual de antibióticos e quimioterápicos antiinfecciosos. 2ª ed. São Paulo: Atheneu; 1996. p. 792.
8. Chambers HF. Aminoglicosídeos e espectinomicina. En: Katzung BG. Farmacologia Básica e Clínica. 10ª ed.Sau Paulo: McGraw-Hill Interamericana do Brasil Ltda; 2010.
9. Woodford N, Ellington MJ. The emergence of antibiotic resistance by mutation. Clinical Microbiology Infection. 2007;13:5–18.
10. Rodriguez-Martinez JM. Mechanisms of plasmid-mediated resistance to quinolones. Enferm Infecc Microbiol Clin. 2005;23(1):25–31.
11. Javadpour MM, Juban MM, Lo WC, Bishop SM, Alberty JB, Cowell SM, et al. De novo antimicrobial peptides with low mammalian cell toxicity. Journal of medicinal chemistry. 1996;39:3107–13.
12. Coutinho HDM, Costa JGM, Lima EO, Falcão-Silva VS, Siqueira-Jr. Enhancement of the antibiotic activity against a multiresistant Escherichia coli by Mentha arvensis L. and chlorpromazine. Chemotherapy. 2008;54:328–30.
13. Goodman & Gilman. As bases farmacológicas da terapêutica. 10ª ed. Sal Paulo: McGraw-Hill Interamericana do Brasil Ltda.; 2005. p. 757-69.
14. Gomes M. Papel dos macrolídeos como agentes imunomoduladores. Pneumologia Paulista. 2008;21(4):57-59.
15. Diniz MFFM, Pereira GAS, Barreto RC, Vasconcelos LCS, Veloso DJ, Cunha PASMA, et al. Principais drogas com as possíveis interações medicamentosas prescritas na clínica odontológica. Revista Brasileira de Ciências da Saúde. 2009;13(1):66-70.
16. Nordmann P. Mechanism of resistance to belactam antibiotics in P. aeruginosa. Annales Françaises d’Anesthésie et de Réanimation. 2003;22:527–30.
17. Lopez-Boado YS, Rubin BK. Macrolides as immunomodulatory medications for the therapy of chronic lung diseases. Curr Opin Pharmacol. 2008;8(3):286-91.
18. Schoni MH. Macrolide antibiotic therapy in patients with cystic fibrosis. Swiss Med Wkly. 2003;133(21-22):297-301.
19. Nguyen T, Louie SG, Beringer PM, Gill MA. Potential role of macrolide antibiotics in the management of cystic fibrosis lung disease. Curr Opin Pulm Med. 2002;8(6):521-28.
20. Fujimura S, Sato T, Kikuchi T, Gomi K, Watanabe A, Mchami T. Combined efficacy of clarithromycin plus cefazolin or vancomycin against Staphyloccoccus aureus biofilms formed on titanium medical devices. Int J Antimicrob Agents. 2008;32(6):481-84.
21. Normark BH, Normark S. Evolution and spread of antibiotic resistance. Journal of Internal Medicine. 2002;252:91–106.
22. Kugelberg E, Lofmark S, Wretlind B, Andersson DI. Reduction of the fitness burden of quinolone resistance in Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 2005;55:22–30.
23. Hancock REW. Resistance mechanisms in Pseudomonas aeruginosa and other nonfermentative gram-negative bacteria. Clinical Infectious Diseases. 1998;27(1):93–99.
24. Köller W, Wilcox WF, Barnard J, Jones AL, Brown PG. Detection and quantification of resistance of Venturia inaequalis populations to sterol demethylation inhibitors. Phytopathology 1997;87:184-190.
25. Yassien M, Khardori N, Ahmedy A, Toama M. Modulation of Biofilms of Pseudomonas aeruginosa by Quinolones. Antimicrobial Agents And Chemotherapy 1995;39(10):2262–68.
Recibido: 5 de noviembre de 2014
Aprobado: 4 de febrero de 2015
Henrique Douglas Melo Coutinho. Departamento de Química Biológica, Universidade Regional do Cariri, URCA. Crato-CE Brasil. Rua Cel. Antonio Luis 1161, Pimenta, CEP: 63105-000. Telefono: +55(88)31021212 - Fax +55(88) 31021291. Correo electrónico: hdmcoutinho@gmail.com.