Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.3 Ciudad de la Habana jul.-set. 2015
PRODUCTOS NATURALES
Fitoquímica preliminar, actividad antioxidante e hipoglucemiante de extractos de hojas de Cnidoscolus aconitifolius (Mill.) I. M. Johnst (chaya)
Phytochemical, antioxidant and hypoglucemic activity of extracts from leaves of Cnidoscolus aconitifolius (Mill.) I. M. Johnst (chaya)
MSc. Carmita Gladys Jaramillo Jaramillo,I Dr.C. Viviana García Mir,I Dr.C. Osmany Cuesta Rubio,I Dr.C. Mercedes Campo Fernández,I MSc. Gastón García SimónII
I Universidad Técnica de Machala. Machala, Provincia El Oro, Ecuador.
II Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana. Cuba.
RESUMEN
Objetivo: evaluar, preliminarmente, la composición química de diferentes extractos obtenidos a partir de las hojas de Cnidoscolus aconitifolius (Mill.) I. M. Johnst que crece en Ecuador, así como la actividad antioxidante e hipoglucemiante del extracto acuoso.
Métodos: el estudio fitoquímico de la droga cruda fue realizado mediante Cromatografía gaseosa acoplada a Espectrometría de Masa y Resonancia Magnética Nuclear Protónica a diferentes extractos obtenidos por maceración en hexano, acetona y metanol. La evaluación antioxidante del extracto acuoso incluyó determinaciones del potencial de reducción total, de glutatión reducido y organoperóxidos totales. La actividad hipoglucemiante del extracto acuoso liofilizado se estudió, en ratas, utilizando alloxano como agente inductor de la hiperglucemia.
Resultados: se identificaron los principales metabolitos presentes en el material vegetal, resaltando los ácidos grasos (ácido palmítico, ácido linoleico, ácido ?-linoleico), triterpenos (3 ceto-?-amirina, ?-amirina, acetato de ?-amirina y acetato de lupeol) y azúcares (glicerol, xilitol, arabitol, glucitol). En cuanto a las potencialidades de empleo de la planta: la actividad antioxidante para los grupos -SH no proteicos del extracto acuoso de droga cruda a concentraciones de 0,12 mg/mL mostró valores significativos en relación con los intervalos de referencia en plasma humano. Sin embargo, el extracto acuoso liofilizado obtenido a partir de la droga cruda, a la dosis de 500 mg/kg de peso corporal de la rata, no demostró poseer efecto hipoglucemiante.
Conclusiones: de manera preliminar se identificaron los principales metabolitos presentes en la especie que crece en Ecuador y las posibilidades de empleo del extracto acuoso como agente antioxidante, no así como hipoglucemiante.
Palabras clave: chaya, Cnidoscolus aconitifolius. fitoquímica, antioxidante, hipoglucemiante.
ABSTRACT
Objective: to evaluate, preliminary, chemical composition of different extracts obtained from leaves of Cnidoscolus aconitifolius (Mill.) I. M. Johns, and antioxidant and hypoglycemic activity of water extract.
Methods: phytochemical study to different extracts obtained by maceration in hexane, acetone and methanol was conducted by Gas chromatography-mass spectrometry and Proton Nuclear Magnetic Resonance. Antioxidant evaluation of water extract included total reduction potential, reduced glutathione and organoperoxides determinations. The hypoglycemic activity of lyophilized water extract was studied in rats using alloxano as hyperglycemia-inducing agent.
Results: the main metabolites present in the plant were identified, fatty acids (palmitic acid, linoleic acid, ?-linolenic acid), triterpenes (3 keto ?-amyrin, ?-amyrin, ?-amyrin acetate and ?-lupeol acetate) and sugars (glycerol, xylitol, arabitol, glucitol). For potential use of the plant: antioxidant activity for non-protein -SH groups of the water extract of raw drug at concentrations of 0,12 mg/mL showed significant values compared to the reference ranges in human plasma. However, the lyophilized water extract obtaines from de raw drug (dose of 500 mg/kg body weight of rat) was shown to possess hypoglycemic effect.
Conclusions: were identified, preliminary, the mayor metabolites present in the species growing in Ecuador and possible use of water extract as antioxidant agent and not like hipoglucemian.
Keywords: chaya, Cnidoscolus aconitifolius, phytochemistry, antioxidant activity, hypoglucemic activity.
INTRODUCCIÓN
En Ecuador se estima que existen unas 500 especies de plantas medicinales conocidas, de ellas 228 son registradas como las más utilizadas y unas 125 identificadas como las más comercializadas. Entre ellas se encuentra la especie Cnidoscolus aconitifolius (Mill.) I. M. Johnst,1 conocida comúnmente como chaya o como el árbol espinaca. Es un arbusto robusto de hojas perennes, perteneciente a la familia de las Euphorbiaceae, nativo de la Península de Yucatán en México. Es muy popular en México y en Centroamérica pues sus hojas se utilizan como una berza, que son cocinadas y preparadas como las espinacas. Esta planta se viene utilizando desde hace muchos años por la población, en infusión, por su efecto medicinal en el tratamiento de diversas enfermedades del cerebro, artritis, diabetes, entre otras.2.
Algunas de estas actividades terapéuticas se han demostrado científicamente, aunque aún existen controversias en la comunidad científica en cuanto a algunos de estos efectos y su relación con los principales metabolitos presentes en el material vegetal.3 ˗5 Además, es importante considerar las posibles variaciones de composición química que pueden existir en dependencia del lugar donde crece la especie.
Por esta razón, el propósito del presente trabajo fue evaluar, preliminarmente, la composición química de diferentes extractos obtenidos a partir de las hojas de Cnidoscolus aconitifolius (Mill.) I. M. Johnst que crece en Ecuador, así como la actividad antioxidante e hipoglucemiante del extracto acuoso.
MÉTODOS
MATERIAL VEGETAL
Se trabajó con hojas de plantas adultas florecidas de Cnidoscolus aconitifolius (Mill.) I. M. Johnst. (Euphorbiaceae), recolectadas manualmente en las primeras horas de la mañana en una granja experimental del Colegio “9 de Octubre”, de la ciudad de Machala, provincia de El Oro, Ecuador. Una muestra se tomó para la identificación botánica de la especie y fue herborizada en el Herbario de la Facultad de Ciencias Naturales de la Universidad de Guayaquil (GUAY), por la Dra. Carmita Bonifaz. El material vegetal se secó en una estufa Memmert a 40 ºC durante 48 h.
CROMATOGRAFÍA GASEOSA ACOPLADA A ESPECTROMETRÍA DE MASAS (CG-EM).
Preparación de las muestras
Se pesaron tres porciones de 200±5 mg de la droga seca en balanza analítica SHIMADZU Aux220 y se colocó cada una en erlenmeyers diferentes. La extracción se realizó por maceración con 2 mL del disolvente: hexano, acetona y metanol de forma independiente (cada erlenmeyer con un disolvente), durante 15 minutos, empleando agitación continua en una zaranda (Retomed, mizard 2001) a 168 rpm. Los extractos fueron filtrados a través de algodón desengrasado y llevados a sequedad en un rotoevaporador Büchi (40 ºC).
Una alícuota del extracto metanólico (1 mL) rico en clorofila se pasó por una columna de Silica gel RP-18 (100 mg) contenida en un cartucho plástico. Como fase móvil se empleó metanol.
Para la derivatización de las muestras se pesó 1 mg de cada uno de los tres extractos secos obtenidos anteriormente y se mezcló con 100 µL de N˗metil˗N˗trimetilsililtrifluoroacetamida (MSTFA). Las mezclas resultantes se sometieron a 60 ºC durante 15 min y 1 µL de cada una se analizó por CG˗EM.
CONDICIONES CROMATOGRÁFICAS
Se empleó un cromatógrafo de gases Agilent serie 6890N, equipado con un detector selectivo de masas, serie 5 973N. La inyección de la muestra se realizó por el modo de fraccionamiento con una relación de 1:10, siendo la temperatura del inyector 280 ºC.
La separación fue llevada a cabo en una columna HP˗5 (17 m x 0,2 mm x 0,33 µm). Se trabajó con una temperatura inicial de 80 ºC, subiendo 5 ºC/min hasta 310 ºC donde se mantuvo durante 20 min. Como gas portador se utilizó helio a un flujo de 0,8 mL/min. El espectrómetro de masas fue operado en un rango de 40 hasta 800 uma.
RESONANCIA MAGNÉTICA NUCLEAR PROTÓNICA (RMN1H)
El espectro de RMN1H se realizó en un equipo Bruker 250. Se empleó tetrametilsilano (TMS) como referencia interna y como disolvente dimetilsulfóxido deuterado (DMSO˗d6). Los datos de corrimiento químico se expresaron en la escala delta (δ). La técnica se desarrolló según la metodología descrita en la literatura.6
ESTUDIO DE LA ACTIVIDAD ANTIOXIDANTE DE LOS EXTRACTOS DE HOJAS DE CHAYA
Los ensayos se realizaron con el extracto acuoso al 10%, elaborado por decocción durante 10 min de la droga seca, para garantizar la eliminación de los glucósidos cianogénicos y realizar un procedimiento similar al que emplea la población tradicionalmente. Las técnicas seleccionadas para la caracterización antioxidante fueron: potencial de reducción total (FRAP), determinación de grupos˗SH no proteicos y el aporte de los extractos en términos de peróxidos orgánicos (determinación de organoperóxidos totales). Las determinaciones (n=5) fueron de carácter espectrofotométrico, empleándose un espectrofotómetro UV˗Visible (Ultrospec-Plus) y un lector de placas de 96 pocillos marca SUMA (Sistema Ultramicroanalítico).
DETERMINACIÓN DEL POTENCIAL DE REDUCCIÓN TOTAL
El complejo Fe3+-2, 4, 6˗tripiridil˗s˗triazina (TPTZ) en presencia de agentes reductores se reduce a Fe2+˗TPTZ, que desarrolla un color azul intenso con un máximo de absorbancia a 593 nm.7 En la evaluación se compararon los valores obtenidos contra un patrón de Vitamina C (1,7 mg en cada determinación).
DETERMINACIÓN DE GLUTATIÓN REDUCIDO O GRUPOS ˗SH NO PROTEICOS
La muestra se precipitó con ácido tricloroacético al 10 % m/v más EDTA 10-3 M y el sobrenadante se hizo reaccionar con el reactivo de Ellman (ácido 5,5¨ditio˗bis (2˗nitrobenzoico) 10-2 M. Se utilizaron patrones de glutatión (GSH) de concentraciones conocidas (100˗150 mg.L-1).8
DETERMINACIÓN DE ORGANOPERÓXIDOS TOTALES
Se empleó el juego de reactivos Bioxytech H2O2-560 (Cat 21024) (Portland, USA) leyendo en el espectrofotómetro a 560 nm.
En la comparación estadística de los resultados se empleó el test paramétrico ANOVA y la prueba de Duncan para el contraste múltiple considerando un nivel de significación α=0,05. El software utilizado fue el IBM˗SPSS versión 21 (2012). Previó se chequeó el cumplimiento de los requisitos de Normalidad y homocedasticidad de los datos mediante las pruebas de Shapiro Wills y Levene, respectivamente.
ESTUDIO DEL EFECTO HIPOGLUCEMIANTE DEL LIOFILIZADO DE LAS HOJAS DE CHAYA
El extracto acuoso fue liofilizado (alícuotas de 5 mL en frascos de vidrio de 20 mL de capacidad) en un liofilizador EYELA FDU830, a temperatura de ˗50 ºC y a vacío absoluto. El liofilizado se selló y guardó a temperatura ambiente, protegido de la luz.
Se siguieron los procedimientos descritos por el CYTED9 y Vogel y Vogel.10 Las variables medidas fueron: inducción de hiperglucemia y determinación del efecto hipoglucemiante.
Se emplearon ratas Wistar (machos) procedente del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), con un peso entre 250 y 300 g. Los animales se mantuvieron en cuarentena y aclimatados (ciclo de luz/oscuridad 12 x 12 horas, temperatura 22±1 °C y humedad 50±5 %) según lo establecido en el Centro de Estudios para las Investigaciones y Evaluaciones Biológicas (CEIEB), radicado en el Instituto de Farmacia y Alimentos (IFAL). El acceso al agua y la comida fue ad libitum. Los animales fueron distribuidos aleatoriamente en grupos de 5, de la siguiente forma:
˗ Grupo 1. Animales sin tratamiento.
˗ Grupo 2. Animales tratados con alloxano 150 mg/kg.
˗ Grupo 3. Animales tratados con extracto acuosos liofilizado de chaya (500 mg/kg) + alloxano 150 mg/kg.
Se confeccionó la curva de calibración de la glucosa con las concentraciones siguientes: 50, 125, 150 y 200 mg/dL empleando el reactivo gluco test, y leyendo en un sistema ultramicroanalítico a 560 nm.
Inicialmente, se extrajo la sangre del plexo ocular de las ratas previamente anestesiadas con tiopental sódico (40 mg/kg). La sangre se centrifugó a 3 500 rpm durante 20 minutos, recogiendo el sobrenadante para proceder a la lectura de glucosa. Luego se les inyectó por vía intraperitonial 1 mL de una solución de alloxano 150 mg/kg disuelto en buffer citrato pH 4,2, de manera que cada rata de 200 g recibió 9 mg de una sola vez. A las 48 horas se realizó una segunda extracción de sangre para verificar que las ratas eran hiperglucémicas (más de 200 mg/dL). El liofilizado de chaya (500 mg/kg) se administró por vía oral, empleando una cánula intragástrica,
A las 4 horas se realizaron extracciones de sangre del plexo ocular para determinar el regreso o no a la normalidad de la glucosa en la sangre de los animales tratados con alloxano y alloxano + chaya. Se hicieron tres lecturas del contenido de glucosa.
El ensayo tuvo una duración de 8 días (3 de prueba y 5 de aclimatación). Los animales fueron sacrificados en una cámara saturada de éter, cumpliendo con los procedimientos de refinamiento. Los principios éticos de Buenas Prácticas de Laboratorio fueron cumplidos para evitar el sufrimiento de los animales durante la experimentación.
Los grupos fueron contrastados estadísticamente empleando un ANOVA de clasificación simple y la prueba Student Newman Keuls (α=0,05) empleando el software estadístico IBM SPSS Statistics versión 21 (2012).
RESULTADOS
En la tabla 1 se muestra los compuestos identificados por CG˗EM en los extractos de hexano, acetona, metanol y metanol despigmentado.
Tabla 1 . Compuestos identificados por CG-EM en los diferentes extractos evaluados
| TR*(min) | Compuesto | Hexano | Acetona | Metanol | Metanol despigmentado |
| 3,18 | L-alanina | X | |||
| 5,67 | L-valina | X | |||
| 6,81 | Urea | X | |||
| 7,55 | L-prolina | X | |||
| 7,66 | Glicerol | X | X | X | |
| 8,29 | Ácido butanodioco | X | |||
| 9,08 | Ácido-2,3 dihidroxi propanóico | X | |||
| 9,58 | 1,2-butanodiol | X | |||
| 9,91 | L-serina | X | |||
| 10,95 | Ácido 4˗metoxi fenilacético, | X | |||
| 13,38 | Ácido butanodioco | X | |||
| 13,45 | 5˗oxoprolina | X | |||
| 13,97 | Butanal | X | X | ||
| 15,13 | L˗fenilalanina | X | |||
| 16,57 | Galactitol | X | |||
| 16,89 | Xilitol | X | X | X | |
| 16,98 | Arabitol | X | |||
| 17,33 | Ácido azelaico (9:0) | X | |||
| 17,64 | 2-pentadecanona | X | |||
| 17,79 | Ácido mirístico (14:0) | X | |||
| 17,81 | Sorbopiranosa | X | X | ||
| 17,86 | D˗fructosa | X | X | ||
| 18,59 | α˗D˗glucopiranosa | X | X | ||
| 19,03 | D˗manitol | X | |||
| 19,09 | Glucitol | X | X | ||
| 19,23 | Inositol | X | X | ||
| 19,29 | β˗D˗ galactofuranósido | X | |||
| 19,50 | Scyllo˗inositol | X | |||
| 19,61 | β˗D˗glucopiranosa | X | X | ||
| 19,66 | Galactopiranosa | X | |||
| 19,71 | Ácido palmítico | X | X | X | X |
| 20,40 | Myo˗inositol | X | X | ||
| 21,06 | Ácido linoleico | X | X | ||
| 21,12 | Ácido α˗linoleico | X | X | X | |
| 21,39 | Ácido esteárico | X | X | X | |
| 22,97 | Ácido araquídico (20:0) | X | |||
| 24,17 | 1˗palmitato de glicerina | X | |||
| 24,20 | Ácido ˗2,3˗ dihidroxi palmítico | X | |||
| 24,42 | Ácido behénico (22:0) | X | |||
| 24,94 | β˗D˗fructofuranosa | X | |||
| 25,78 | Ácido lignocérico (24:0) | X | |||
| 27,40 | Hentriacontano | X | |||
| 28,28 | 3˗ceto˗β˗amirina | X | X | ||
| 28,59 | β˗amirina | X | X | ||
| 28,66 | β˗sitosterol | X | |||
| 29,08 | Acetato de β˗ amirina | X | X | ||
| 29,36 | Acetato de lupeol | X | X |
*TR tiempo de retención
La figura muestra el espectro RMN1H del extracto metanólico despigmentado, que se caracterizó por presentar señales intensas en la zona alifática entre 3 y 3,5 ppm
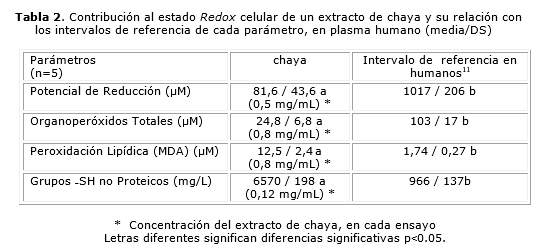
La tabla 2 resume los resultados de la determinación del efecto antioxidante.
Los resultados de la evaluación del efecto hipoglucemiante se muestra en la tabla 3.
DISCUSIÓN
ESTUDIO FITOQUÍMICO DE LOS DIFERENTES EXTRACTOS OBTENIDOS A PARTIR DE LA HOJA DE LAS HOJAS DE C. ACONITIFOLIUS
El análisis se realizó con cuatro extractos: extractos obtenidos con hexano, acetona, metanol y un extracto despigmentado obtenido a partir del extracto metanólico.
Las cuatro muestras se trataron con MSTFA, formando los trimetilsilil derivados (TMS), para favorecer la volatilidad de las moléculas. En este sentido los compuestos con grupos OH, presentarán un ión molecular (M+) con 72 unidades de masas por encima de su masa molecular. Igual sucederá con los fragmentos hidroxisustituidos, generados tras el impacto electrónico.
En el extracto de hexano la mayor complejidad cromatográfica se apreció entre 27 y 30 min. Los compuestos detectados por debajo de los 26 min fueron identificados por comparación con la base de datos NIST 98 y por el análisis de sus espectros de masas. La composición química se relaciona en la tabla 1, donde se observa la variada composición de ácidos grasos que posee la planta. La literatura científica refiere que la especie C. aconitifilius presenta en su composición lipídica ácidos grasos tales como: ácido palmítico, esteárico, oleico, linoleico, entre otros, en valores que oscilan entre 0,2 y 2,0 %.5 Entre 26 y 30 min se identificaron algunos triterpenos. Dentro de los triterpenos, los de mayor abundancia en la naturaleza suelen ser los derivados del núcleo del oleanano (β‒amirina). Este metabolito pudo ser identificado a partir del extracto de hexano. En el espectro de masas se apreció el ion molecular derivatizado del compuesto en m/z 498 ([M + 72]+) El pico base del espectro de masas se apreció en m/z 218, el cual se forma tras una reacción de tipo retro Diels‒Alder. También se observan otros fragmentos característicos del compuesto tales como: m/z 279, 205, 203, 189 y 133.
Para el acetato de β‒amirina, el ion molecular del espectro de masas se apreció en m/z 468 ([M]+) y el pico base del espectro también se apreció en m/z 218. La presencia del grupo acetilo en posición 3 justificó la diferencia de 30 uma entre el derivado TMS de la β‒amirina y este derivado acetilado. Adicionalmente, se apreció el fragmento en m/z 43 correspondiente al ion CH3CO+, el cual confirma la presencia del acetilo. El resto de los fragmentos antes referidos para la β‒amirina se mantienen invariables, a excepción del ion m/z 279 el cual indica la sustitución sobre el anillo A.
El compuesto de mayor abundancia relativa del cromatograma fue el acetato de lupeol. Este metabolito, al igual que el acetato de β‒amirina, mostró su ion molecular en m/z 468 y el ion fragmento en m/z 43. Otros fragmentos característicos del acetato de lupeol fueron: m/z 453 (M +‒15) de baja intensidad, lo cual es propio de la serie de lupanos insaturados y m/z 189. También se observó el ion fragmento en m/z 249, indicativo de la presencia del grupo acetato en la posición 3 y el ion fragmento en m/z 206, originado por la pérdida del grupo acetato a partir de m/z 249.
Otros compuestos identificados fueron el β‒sitosterol (pico 19) y un alcano (hentriacontano) de fórmula química C31H 64 (pico 13)
El extracto obtenido con acetona mostró mayor complejidad cromatográfica que el extracto de hexano. Los picos 13 y 32, correspondientes al ácido palmítico y al acetato de lupeol, resultaron ser los de mayor abundancia relativa. Además de estos metabolitos, la base de datos permitió la identificación de los compuestos que se relacionan en la tabla 1.
Como se puede apreciar, varios de los compuestos ya se habían detectado en el extracto de hexano. Particularmente, los triterpenos 3‒ceto ‒β‒amirina, β‒amirina, acetato de β‒amirina y acetato de lupeol son metabolitos que pueden ser extraídos en ambos disolventes. Debe señalarse que en este estudio se prepararon extractos con cada uno de los disolventes de manera individual. Sin embargo, si se hubiera sometido la droga a un gradiente de extracción, de menor a mayor polaridad, comenzando con hexano y continuando con acetona, tal vez la mayor proporción de dichos triterpenos se hubiese concentrado en el extracto de hexano.
El análisis por CG‒EM correspondiente al extracto de metanol permitió identificar la presencia de polioles como compuestos mayoritarios, ácidos orgánicos y aminoácidos.
La literatura refiere para la especie C. aconitifolius altos niveles de aminoácidos esenciales, algunos de los cuales, como la valina, fenilalanina y alanina, fueron identificados en esta muestra.5
También se identificaron tres de los triterpenos (β‒amirina, acetato de β‒amirina, acetato de lupeol) presentes en los extractos de hexano y acetona. Estos productos eluyeron muy cerca de los 30 minutos y las abundancias relativas fueron, apreciablemente pequeñas. Este comportamiento es lógico teniendo en cuenta que los triterpenos son compuestos de características básicamente apolares, por lo que presentan una mayor afinidad en los disolventes antes utilizados.
Posteriormente, se decidió pasar el extracto metanólico por una columna de sílica RP‒18, con el objetivo de eliminar las clorofilas presentes y favorecer el análisis por CG‒EM, así como para centrar la atención en los compuestos más polares de dicho extracto. Este procedimiento es rápido, sencillo y se ha informado previamente en la literatura.6 La columna se eluyó con metanol y se hizo pasar disolvente hasta que la primera mancha verde de clorofilas se acercó a la base de la columna. De esta forma, todos los compuestos polares fueron extraídos de la columna y separados de las clorofilas.
En este cromatograma disminuye el número de pico eluidos, con relación a igual extracto sin despigmentar, lo que sugiere la absorción de gran cantidad de compuestos en la columna RP‒18, sobre todo los que eluyen por encima de los 17 minutos en el extracto metanólico original y que se corresponden con los compuestos más apolares del extracto que tienen afinidad por el soporte apolar de la columna empleada. Ej: ácidos grasos, triterpenos, clorofilas, carotenos, entre otros.
En todos los extractos analizados por CG‒EM quedaron picos cromatográficos sin identificar al realizar la comparación con la base de datos empleada. El análisis de los espectros de masas correspondientes tampoco permitió la identificación de dichos compuestos. La información estructural que brinda esta técnica es de gran utilidad, pues con la ayuda de bases de datos se puede determinar cualitativamente la composición química de un extracto total. Para identificar los compuestos pendientes se deben realizar procedimientos de aislamiento y caracterización espectroscópica que no se incluyeron en el objetivo de este trabajo.
Atendiendo a lo que informa la literatura, debió esperarse la presencia de flavonoides, fundamentalmente quercetina y kaemferol en forma glicosilada. 5 Estos metabolitosse han detectado y reportado tanto en hojas frescas como sometidas al proceso de cocción. Los resultados obtenidos en este trabajo sugieren que estos flavonoides parecen no estar presentes en la droga cruda. Es necesario destacar que el análisis por CG‒EM no es la técnica de elección para detectar la presencia de los supuestos glicósidos de flavonoides, ya que las altas temperaturas empleadas favorecen la degradación de estos compuestos.
Con el objetivo de sugerir la ausencia de esta clase de metabolitos, se realizó el experimento de RMN1H al extracto de metanol despigmentado. Como se puede apreciar en la figura, las señales fundamentales del espectro RMN1H se corresponden con protones alifáticos desblindados, característicos de grupos CH y CH2 unidos a elementos desblindantes como el átomo de oxígeno. Este resultado complementa el análisis realizado por CG‒EM, ya que los azúcares y polioles identificados por este procedimiento justifican las señales más intensas apreciadas en el espectro RMN1H. En la zona donde deben resonar los protones aromáticos (entre 6‒9 ppm), las señales mostraron muy baja intensidad. Con este último experimento se puede concluir que el extracto metanólico despigmentado presenta una composición mayoritaria en compuestos alifáticos como azúcares y polioles. La presencia de flavonoides no puede ser descartada, ya que la técnica de RMN es muy poco sensible, pero si se puede concluir que los supuestos flavonoides no son compuestos mayoritarios en la fracción más polar del extracto metanólico. La adsorción irreversible de dichos flavonoides a la columna de RP‒18 fue descartada, ya que la misma fue lavada con abundante metanol. Es importante señalar que tanto las clorofilas como otros compuestos apolares, que podían empañar la calidad del espectro RMN1H, fueron eliminados. De esta forma se favoreció la posible detección de los compuestos más polares, ya que los compuestos más apolares no limitan la solubilidad del extracto en DMSO, garantizando que se disuelva la mayor cantidad de compuestos polares en el volumen limitado de disolvente que se emplea para realizar el espectro de RMN1H. Tampoco quedó residuo de la muestra cuando el extracto fue disuelto en 0,5 mL de DMSO. Por otra parte, el DMSO es un disolvente de elección para el análisis de flavonoides por la alta solubilidad de estos metabolitos en el mismo y en especial para los flavonoides informados con anterioridad para esta especie.
Ante esta situación se precisa un estudio farmacoergástico que investigue la dinámica de acumulación de tales compuestos, pues, evidentemente, la droga vegetal actualmente analizada no parece contener cantidades apreciables de dichos glicósidos fenólicos. Factores como el clima, la naturaleza del suelo, la edad de la planta, podrían incidir en las variaciones de la composición química de la planta y como consecuencia afectar la capacidad antioxidante e hipoglucimante que para la planta se refiere.4,6
CAPACIDAD ANTIOXIDANTE TOTAL, DE CARÁCTER REDUCTOR (FE3+- FE2+) Y APORTE DE GRUPOS SULFIDRILOS NO PROTEICOS
El análisis estadístico del potencial de reducción de hierro férrico se realizó entre el extracto acuoso de chaya y el valor de referencia para la vitamina C (404±22,1) encontrándose diferencias altamente significativas entre ambos tratamientos in vitro, siendo la vitamina C, la que manifestó un mayor potencial de reducción. Los valores obtenidos para el extracto de chaya (81,6 µM), no se consideraron significativos en cuanto al poder reductor por lo que se puede plantear que en este modelo, la chaya no evidenció potencialidades como antioxidante.
De los resultados en cuanto al aporte de grupos ‒SH no proteicos del extracto, se pudo apreciar el significativo aporte que realiza el mismo en cuanto a estos grupos se refiere. El valor obtenido de 6 570 mg/L es sustancialmente superior con respecto a lo que se reporta como rango establecido para este parámetro en plasma de individuos aparentemente sanos (966 mg/L). Estos datos concuerdan con lo reportado por Kuty y Konuru.5
El resultado obtenido para este parámetro evidencia la presencia en el extracto de compuestos con grupos ‒SH no proteicos como por ejemplo el GSH, que garantizan efectos antioxidantes importantes contra la oxidación de proteínas y lípidos que constituyen en muchas ocasiones causas de desbalance redox y de daños orgánicos irreversibles.11
Los altos niveles de organoperóxidos en los extractos vegetales, puede ser un elemento a tener en cuenta a la hora de limitar sus usos clínicos, teniendo en cuenta los efectos lesivos que pueden provocar los mismos sobre la integridad celular, sobre todo el H2O2, el cual constituye una especie reactiva de oxigeno (ERO) muy agresiva.
Como puede observarse el aporte del extracto en cuanto a organoperóxidos totales es muy bajo (24,8 µM), resultado satisfactorio si se tiene en cuenta lo referido anteriormente. Al realizar una comparación con el intervalo de referencia en plasma de sujetos aparentemente sanos, se observa que hay diferencias altamente significativas, y el aporte de la chaya mucho menor. El análisis estadístico se realizó, para cada parámetro, entre el extracto de chaya y el rango de referencia en plasma humano.
Como se pudo apreciar (tabla 2), con excepción de la peroxidación lipídica y los grupos tioles, el aporte de la chaya a cada marcador estudiado estuvo por debajo de los intervalos de referencia. Los lípidos peroxidados se encontraron en niveles superiores a los referidos en el plasma de humanos; sin embargo, llama la atención el aporte sobresaliente de los grupos ‒SH no proteicos antioxidantes, los cuales fueron significativamente superiores a los establecidos como rango de normalidad en humanos, realizando una contribución importante en este parámetro.
ESTUDIO DEL EFECTO HIPOGLUCEMIANTE DEL LIOFILIZADO DE HOJAS DE CHAYA
Las medias de los tratamientos se contrastaron estadísticamente obteniendo que los animales que no recibieron el tratamiento se mantuvieron con una glucemia baja, (valores normales entre 75 y 135 mg/dL) (tabla 3). Los animales a los que se les administró el alloxano para tornarlos hiperglucémicos a las 48 horas mostraron una elevación de más de 200 mg/dL de glucosa en sangre.
Por otra parte, a las 52 horas de comenzado el experimento aquellos que recibieron alloxano y alloxano más el extracto liofilizado mantienen elevada su glucemia por encima de los valores normales no observando diferencia estadística entre estos dos últimos a diferencia del grupo control que no recibe tratamiento alguno.
Por consiguiente, el liofilizado de chaya a la dosis de 500 mg/kg de peso corporal de la rata, no demostró poseer efecto hipoglucemiante cuando se emplea el alloxano como agente inductor de la hiperglucemia, lo que está en concordancia con los resultados de un estudio publicado en el 2004, 12 en condiciones similares, con la diferencia que para inducir la hiperglucemia en las ratas Wistar se utilizó estreptozotocina (STZ) y se les administró a las ratas diabéticas infusión de chaya (C. chamayansa) al 2 %. Estos resultados no se corresponden con lo reportado por otros autores4,13 donde los extractos acuosos y metanólicos de C. chamayansa disminuyeron considerablemente los niveles de glucosa en conejos en condiciones de hiperglucemia. Obsérvese que en estos estudios se refiere como chaya a otra especie del mismo género.
El efecto hipoglucemiante se atribuye a la presencia de metabolitos secundarios, en especial a los compuestos fenólicos que no se detectaron en la planta objeto de investigación.13
La formación de los metabolitos secundarios está determinada por diferentes factores, condiciones de cultivo (tipo de suelo, condiciones ambientales), época de recolección, edad de la planta entre otros, lo que puede explicar la variación de los resultados de los estudios referidos. Resulta importante señalar que con el mismo nombre común se conocen especies diferentes en El Ecuador.
La cromatografía gaseosa acoplada a espectrometría de masas (CG‒EM) y la resonancia magnética nuclear (RMN1H) contribuyeron a la identificación, de manera preliminar, de los principales metabolitos presentes en las hojas de C. aconitifolius que crece en Ecuador y las potencialidades de empleo de la planta debido a la actividad antioxidante para los grupos ‒SH no proteicos del extracto acuoso de la droga seca. Sin embargo, el liofilizado de este extracto a la dosis de 500 mg/kg de peso corporal no mostró poseer efecto hipoglucemiante cuando se emplea el alloxano como agente inductor de la hiperglucemia.
REFERENCIAS BIBLIOGRÁFICAS
1. CORPEI. Estudio de Oferta y Demanda del Sector de Productos Naturales. Programa de Promoción del Comercio Sur-Sur (CCI). UNAD: Bogotá; Mayo 2003.
2. Ross-Ibarra J, Molina-Cruz A. The ethnobotany of chaya (\emph{Cnidoscolus aconitifolius} ssp (\emph{aconitifolius Breckon): A nutritious Maya vegetable. Economic Botany. 2002; 56: 350–365.
3. Kuti JO, Torres ES. Potential nutritional and health benefits of tree spinach, In: Janick J. Progress in New Crops. Arlington: ASHS Press; 1996. p. 516–520.
4. Kuti JO, Kuti HO. Proximate composition and mineral content of two edible species of Cnidosolus (tree spinach). Texas, Plant Foods for Human Nutrition. 1999; 53: 275–283.
5. Kuti JO, Konuru HB. Antioxidant Capacity and Phenolic Content in Leaf Extracts of Tree Spinach (Cnidoscolus spp,) J. Agric. Food Chem. 2004; 52 (1): 117-121.
6. Braun S, Kalinowski HO, Berger A. 100 and more basic NMR experiments. A practical course. Weinhein: Ed. VCH; 1996.
7. Benzie I, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of “Antioxidante Power”. The FRAP assay. Anal. Biochem. 1996; 239 (1): 70-76.
8. Sedlak J, Lindsay R.H. Estimation of total protein-bound and nonprotein sulfhydryl groups in tissue with Elmma´s reagent. Anal Biochem. 1968; 25: 192-205.
9. CYTED. Curso para Investigadores en el descubrimiento de nuevos medicamentos. Lima: CYTED; 1996: 173p.
10. Vogel H, Vogel WH (eds). Drug Discovery and Evaluation. Pharmacological Assays. Berlin Heidelberg GmbH: Springer-Verlag; 1997.
11. Elejal de Guerra IJ. Estrés oxidativo, enfermedades y tratamientos Antioxidantes. Anales de Medicina Interna. 2001; 18: 326-335.
12. Palos-Suárez GMR, Ramos-Gómez M, Reynoso-Camacho R, González-Jasso E. Estudio de la administración subcrónica del té de chaya (Cnidoscolus chayamansa) en la diabetes inducida químicamente en ratas. 2º Congreso Nacional de Química Médica. Ciudad de México; 2004.
13. Mendoza Díaz SO. Caracterización química y biológica de los agentes hipoglucemiantes de la hoja de chaya ( Cnidoscolus chayamansa Mc. Vaugh). Revista de investigación y ciencia Sapĕre Junio 2005;2005:23.
Recibido: 25 de septiembre de 2014.
Aprobado: 6 de abril de 2015.
Viviana García Mir . Universidad Técnica de Machala. Ave. Panamericana Km 5 ½. Machala, Provincia El Oro, Ecuador. Teléfono: 963040 Telefax: 930 344. Correo electrónico: vgarciamir@yahoo.es