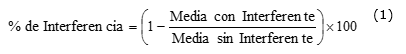Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.4 Ciudad de la Habana oct.-dic. 2015
ARTÍCULO ORIGINAL
Validación del método enzimático para la determinación de creatinina en suero y orina
Validation of the enzymatic method for the estimation of serum and urine creatinine
Lic. Idalmis R. Carrión Domínguez,I MSc. Lisandra García Borges,II Dra.C. Yania Suárez Pérez,III Tec. Belkis Rodríguez Fernández,I MSc. Gissel Aja MasaI
I Empresa de Productos Biológicos “Carlos J. Finlay”. La Habana, Cuba.
II Centro de Investigación Desarrollo y de Medicamentos (CIDEM). La Habana, Cuba.
III Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
RESUMEN
Introducción: la creatinina es un importante marcador de control y monitoreo en diferentes patologías renales.
Objetivo: validar un método enzimático colorimétrico de análisis cinético para la determinación de creatinina en suero y orina desarrollado con reactivos de producción nacional para su aplicación en los laboratorios clínicos.
Métodos: el método enzimático se aplica para determinaciones cinéticas a partir de la medición espectrofotométrica a una longitud de onda de 550 nm de la quinoneimina formada. Se realizó la validación evaluando los parámetros especificidad, linealidad, precisión, exactitud, límite de detección y de cuantificación, cumpliendo con las regulaciones vigentes en Cuba.
Resultados: el método fue suficientemente específico para el objetivo propuesto, brindó una respuesta lineal desde 26,52 a 2 652 µmol/L en suero y de 884 a 26 520 µmol/L en orina, presentó una elevada precisión, exactitud y adecuados límites de detección y cuantificación.
Conclusión: al cumplir el método evaluado con las exigencias regulatorias vigentes se puede emplear en los laboratorios clínicos del país, para la determinación de creatinina en suero y orina.
Palabras clave: creatinina, espectrofotometría, laboratorio clínico, validación.
ABSTRACT
Introduction: creatinine is an important control and monitoring marker in various kidney pathologies.
Objectives: to validate a colorimetric enzymatic method of kinetic analysis developed with Cuban-made reagents, in order to determine the serum and urine creatinine for future application in the clinical laboratories.
Methods: the enzymatic method is used for kinetic determinations based on the spectrophotometric measurement at 550nm wavelength of the formed quinoneimine. The validation evaluated the parameters specificity, linearity, precision, accuracy, detection and quantitation limits in compliance with the present Cuban regulations.
Results: the method was specific for the suggested objective; provided linear response from 26,52 to 2 652 µmol/L in serum and from 884 to 26 520 µmol/L in urine; had great precision and accuracy and its detection and quantitation limits were adequate.
Conclusions: since the evaluated method fulfilled the present regulatory demands, it may be used in the domestic clinic laboratories to determine serum and urine creatinine.
Keywords: creatinine, spectrophotometry, clinical laboratory, validation.
INTRODUCCIÓN
La creatinina es el producto final del metabolismo muscular y se origina a partir de la creatina por pérdida de una molécula de agua. Es un compuesto sumamente difusible y distribuido de manera uniforme en el agua corporal. Una vez formada, la creatinina se difunde pasivamente en el torrente circulatorio, de donde sale por la acción de la filtración glomerular del riñón, siendo un índice excepcionalmente útil del funcionamiento renal.1
La determinación de la creatinina se utiliza en el diagnóstico de las enfermedades renales agudas o crónicas y también para el monitoreo de la diálisis renal.2 Como un marcador adicional, es importante en el control y monitoreo de otras condiciones patológicas como obstrucciones urinarias por afectaciones de próstata, vejiga, uréter; anurias reflejas secundarias a cálculos uretrales y nefropatías.3
Actualmente en los laboratorios clínicos de nuestro país se emplean los métodos Jaffé cinético y punto final para la determinación de creatinina en suero, los cuales requieren de la preparación de muestras y de reactivos de trabajo. Estos métodos tienen como desventaja la poca sensibilidad ante pequeños cambios de concentración y un insuficiente intervalo de análisis, lo cual limita su uso en pacientes pediátricos y geriátricos. Es por ello que los laboratorios clínicos en el mundo prefieren los métodos enzimáticos.4
Los métodos enzimáticos para este analito garantizan mayor especificidad, exactitud y precisión dentro de la práctica diaria; con resultados comparables a un método de referencia como la cromatografía líquida de alta eficacia (HPLC) con este mismo objetivo. Aunque existe diversidad de métodos enzimáticos, en este estudio el fundamento de la técnica se basa en un método colorimétrico cinético en el cual se forma la sarcosina luego de la hidrólisis de la Creatinina, debido a la acción de las enzimas creatininasa y creatinasa. La reacción es catalizada por peroxidasa para obtener quinoneimina, complejo de color púrpura, que se determina espectrofotométricamente a 550 nm.4
Este método se considera como de gran necesidad diagnóstica para el Sistema Nacional de Salud. Por esta razón, como parte de la asimilación de un método enzimático colorimétrico de análisis cinético propuesto para la determinación de creatinina en suero y orina; a partir de la transferencia tecnológica de una firma de reconocido prestigio comercial en el campo de la química clínica; la investigación resulta de interés para la Empresa de Producción de Biológicos "Carlos J. Finlay” de La Habana, Cuba, por lo que es su objetivo validar el método enzimático colorimétrico de análisis cinético para la determinación de creatinina en suero y orina desarrollado con reactivos de producción nacional para su aplicación en los laboratorios clínicos.
MÉTODOS
Todos los reactivos y materias primas utilizadas fueron de calidad analitica (p.a) y liberados “Conforme” por la Dirección de Calidad de la Empresa de Producción de Biológicos "Carlos J. Finlay”. Se utilizaron muestras de suero control (Elitrol I; Lote: 111336, Elitrol II; Lote: 111394) suministrados por la firma comercial SEPPIM, Francia y muestras de orina control (Orina control L; Lote: 1203212, Orina control H; Lote: 1203213.), procedentes de la firma comercial HORIBA ABX (Francia), con valores conocidos de Creatinina, en un intervalo de concentraciones normales y patológicas del analito.
La validación del método analítico se realizó en la Unidad Empresarial de Base (UEB) Desarrollo e Innovación Tecnológica de la Empresa de Producción de Biológicos "Carlos J. Finlay", se preparó un lote 3001 a escala piloto del juego de reactivos creatinina PAP. Se empleó solución de referencia de creatinina 177 µmol/L Lote: 3003 de producción nacional (UEB Finlay) utilizada en la comercialización de los juegos de reactivos para la determinación de Creatinina. Se asignó el valor de la solución de referencia utilizando el calibrador ELICAL 2 de una firma comercial reconocida SEPPIM No. Cat. CALI-1550 y se verificó la trazabilidad utilizando el calibrador Spintrol H Cal suero humano (Firma SPINREACT, España No. Cat. 1002011).
Los ensayos se realizaron en un autoanalizador semiautomático; ELIMAT a una longitud de onda de 550 nm.
Se evaluaron los parámetros de especificidad, linealidad, precisión, exactitud, límite de detección y de cuantificación
Para demostrar la especificidad se adicionaron cantidades crecientes de diferentes sustancias que constituyen interferentes endógenos de las matrices biológicas a muestras de suero en concentraciones normales y a muestras de orina en concentraciones normales y patológicas, además se consideró la contaminación de estas matrices con interferentes exógenos para ambos casos. La preparación del material interferente para enriquecer las muestras de suero y orina se prepararon a partir de materias primas procedentes de diferentes firmas Merck (Alemania), Panreac (España) y Sigma (Estados Unidos).
Se determinó el porciento (%) de interferencia según la ecuación 1:
La linealidad se evaluó en el intervalo de concentraciones de interés clínico de 26,52 a 2652 µmol/L para el suero y desde 884 a 26520 µmol/L en orina distribuidos en 6 puntos en la curva de calibración para cada matriz. Se hicieron tres réplicas para cada nivel de concentración y los resultados se procesaron con el programa estadístico STAGRAPHIC PLUS 5.5. Se determinó por regresión lineal el coeficiente de correlación (r) y determinación (r2), la proporcionalidad (significación del intercepto) y el coeficiente de variación de los factores respuesta (CVf).
Para la evaluación de la repetibilidad se procesaron 18 réplicas de muestras homogéneas de suero y de orina control, de concentración conocida y utilizando dos niveles de concentraciones: normal y patológico; en cada caso. Los análisis fueron realizados por el mismo analista, equipo y en el mismo día.
En el caso de la precisión intermedia se evaluaron las contribuciones de las siguientes fuentes de variación:
Efecto del día: se procesaron 9 réplicas de muestras de suero y orina control por el mismo analista, durante 3 días consecutivos; a dos niveles de concentraciones: normal y patológico.
Efecto del analista: se procesaron 9 réplicas de muestras de suero y orina controles normales y patológicos, realizados por dos analistas diferentes, en el mismo día y empleando el mismo equipo.
Efecto del equipo: se procesaron 9 réplicas de muestras de suero y orina controles normales y patológicos por el mismo analista, el mismo día, en diferentes equipos autoanalizadores semiautomáticos, de marcas ECHO y ELIMAT, ambos procedentes de la firma comercial SEPPIM, Francia.
Se calculó la media, la desviación estándar y los coeficientes de variación en los resultados obtenidos tanto para la precisión intermedia como la repetibilidad. Además se compararon los resultados experimentales obtenidos en las diferentes condiciones ensayadas aplicando análisis de varianza de clasificación simple, para un nivel de significación del 95 %.
La exactitud se evaluó mediante un estudio de comparación de métodos, determinando la concentración de creatinina en 105 muestras de pacientes cuyas concentraciones se encontraban de 43,20 a 1059,4 mol/L en muestras de suero y de 2400 a 25290 mol/L en muestras de orina, mediante el juego de reactivos propuesto (Laboratorios Finlay, La Habana, Cuba) y un método comercial reconocido para la determinación de creatinina PAP No. Cat. C0104 de la Firma CPM (Tecnologías científicas biomédicas, Italia). Se determinó el coeficiente de correlación lineal entre ambos métodos aplicando regresión lineal por el programa estadístico STAGRAPHIC PLUS 5.5 y análisis de varianza de clasificación simple.
Para la determinación de los límites de detección y cuantificación se hicieron 30 determinaciones en concentraciones muy bajas de analito (comparables con el blanco muestra). Se realizó la dilución de suero control y orina control para obtener un valor teórico de 2 mg/L (17,68 mol/L) para el suero y 100 mg/L (884 mol/L) para la orina. Se calculó el límite de detección (LD) y el límite de cuantificación (LQ) según las expresiones siguientes (2 y 3):
Para comprobar los resultados obtenidos, para el límite de cuantificación se realizó un estudio de exactitud por ensayo de recuperación y un estudio de repetibilidad. Se diluyeron muestras control a la concentración de creatinina próximas al LQ obtenido.
Se realizó la determinación de creatinina en un número de 9 réplicas consecutivas (repetibilidad) calculando la media, la desviación estándar y el coeficientes de variación. Además se determinó el porciento de recobrado (exactitud) teniendo en cuenta las concentraciones reales obtenidas en el ensayo.
RESULTADOS
En el estudio de especificidad se obtuvo que no interfieren significativamente en el método de análisis de Creatininapara muestras de suero, las sustancias que a continuación se relacionan:
- Los triglicéridos hasta 6,14 g/L
- La hemoglobina hasta 5 g/L
- La bilirrubina conjugada hasta 260 µmol/L
- La bilirrubina no conjugada hasta 615,8 µmol/L
- La glucosa hasta 5 g/L
- El ácido úrico hasta 180 mg/L
- El ácido ascórbico hasta 200 mg/L
El dobesilato de calcio y la metildopa conducen a la obtención de resultados falsamente bajos en concentraciones terapéuticas cuando se realiza el análisis en muestras de suero.(figura 1)
En las muestras de orina no se detectaron interferencias significativas para el método de análisis en los siguientes casos:
- La hemoglobina hasta 5 g/L
- La bilirrubina conjugada hasta 427,6 µmol/L
- La glucosa hasta 18 g/L
- El ácido ascórbico hasta 2000 mg/L
Para el dobesilato de calcio no hubo interferencia significativa hasta 1000 mg/L en la orina normal y existió tendencia negativa desde 300 mg/L en orina patológica. En el caso de la metildopa existió tendencia negativa desde 400 mg/L en orina normal y desde 50 mg/L en orina patológica. Estos resultados se muestran gráficamente en la (figura 2).
La contaminación de las matrices biológicas a muestras de suero en concentraciones normales y a muestras de orina en concentraciones normales y patológicas con interferentes exógenos se puede observar en la tabla 1.
Los resultados del procesamiento estadístico obtenidos en el estudio de la linealidad se muestran en la tabla 2. Se obtuvo un comportamiento lineal desde 3 a 300 mg/L (26,52 a 2 652 µmol/L), y en la orina abarcó un rango desde 100 a 3 000 mg/L (884 a 26 520 µmol/L). Los coeficientes de variación de los factores respuesta obtenidos en la prueba de linealidad se encontraron por debajo del valor permitido. Los valores obtenidos de la desviación estándar relativa cumplieron igualmente con el criterio de aceptación establecido.
En la tabla 3 y 4 se presentan los resultados del estudio de repetibilidad y precisión intermedia en muestras de suero y orina. Los valores del coeficiente de variación obtenidos se encuentran por debajo del límite permisible para métodos enzimáticos cinéticos (inferiores al 7 %).5 Todos los resultados experimentales de concentración de creatinina promedio en suero u orina estuvieron dentro de los límites reportados para los controles utilizados.
En la exactitud se aplicó el análisis de regresión simple para un intervalo de 43,2 a 1059,4 µmol/L en suero para el cual se obtuvo una pendiente 1,075, r=0,9950, una desviación estándar relativa 0,99 % y un nivel de significación del intercepto 0,4679 y en orina para un intervalo de 2 400 a 25 290 µmol/L se obtuvo una pendiente 1,124, r=0,9996, una desviación estándar relativa 1,20 % y un nivel de significación del intercepto 0,072 lo cual responde al criterio aceptado, en un número de muestras significativo de pacientes con valores normales y patológicos. La comparación aplicando la prueba de Fisher permitió obtener valores inferiores al valor tabulado para un nivel de significación del 95 %, siendo para el suero de 0,42773 y para la orina de 0,70445.
Los valores obtenidos para el límite de detección fueron 5,30 µmol/L para el suero y 336 µmol/L para orina, mientras que el límite de cuantificación fue de 14,14 µmol/L para el suero y 911 µmol/L para la orina. Los resultados para ambos parámetros fueron satisfactorios para el uso previsto.
DISCUSIÓN
Los métodos enzimáticos para la determinación espectrofotométrica, se caracterizan por ser más fiables, precisos, exactos y selectivos que los métodos químicos tradicionales, los análisis de creatinina en suero y orina no son la excepción. Estos métodos enzimáticos mejoran la selectividad para la Creatinina, por ser una técnica cinética con la cual se logra una mayor especificidad dada por la velocidad de reacción de la creatinina con respecto a los cromógenos no creatinínicos. Además se logra eliminar el paso previo de desproteinización de la muestra de suero, lo cual posibilita una mayor rapidez en el análisis.
El método enzimático para la determinación de creatinina debe brindar estimados de filtración glomerular clínicamente importantes, especialmente en neonatos y niños donde existen cantidades significativas de sustancias interferentes reportadas para esta determinación por otros métodos en las muestras de orina, de ahí la preferencia de este método en pacientes pediátricos.9
Una de las herramientas con las que cuentan las empresas para asegurar la calidad de sus productos son los procedimientos de validación, por lo cual, la adopción de un nuevo método analítico debe estar soportado por suficientes datos de laboratorio y una validación bien documentada, que cumpla con los requisitos establecidos por las entidades regulatorias del país e internacionalmente. Por esta razón, cada uno de los ensayos realizados es fundamental para evaluar el buen funcionamiento del diagnosticador.
En el estudio de especificidad la presencia de algunos interferentes en las muestras de suero no provocaron interferencias analíticas a las concentraciones estudiadas. El valor de interferencia se encuentra dentro de los límites de tolerancia permisibles; descritos para este método por la literatura.5,10,11
Sin embargo, se detectaron interferencias negativas causadas por la bilirrubina conjugada, el ácido úrico, el dobesilato de calcio y la metildopa en las muestras de suero, por lo que se genera un riesgo potencial de realizar un diagnóstico inadecuado y poco confiable en presencia de estos compuestos a las concentraciones a partir de la cual disminuyen los valores de creatinina en la determinación.10,11
La Hemoglobina a valores superiores de 5 g/L se considera una hemólisis significativa, para lo cual el método empleado, hasta este valor estudiado, no mostró interferencia analítica. En cambio a esta concentración sí interfiere en el método cinético Jaffé, donde para la determinación cinética se reportan interferencias negativas a partir de 1,0 g/L de Hemoglobina, valores de hemólisis ligera debido a que la Hemoglobina es fácilmente oxidable en medio básico fuerte presente en el reactivo, formando compuestos incoloros de creatinina6.
El método enzimático presentó interferencias frente a sustancias reductoras como son la bilirrubina, el ácido úrico, el dobesilato de calcio y la metildopa. En el caso de la bilirrubina se plantea, que puede ser oxidada con una base fuerte a un cromógeno no identificado, llevando a un decremento en la absorción en la región de 450 a 550 nm. Como consecuencia se obtienen valores de concentración de creatinina por debajo de los reales. Diferentes autores reportan interferencias negativas, pero existen discrepancias en el valor a partir del cual comienzan a ser significativas. En el caso de los otros compuestos no hay resultados claramente descritos, pero si se concuerda en una disminución de los valores de creatinina.6,10,11
Otras sustancias presentes en la muestra y reportadas como interferentes en esta determinación, fueron la glucosa y el ácido ascórbico,6 que no causaron ninguna modificación en las concentraciones de creatinina, lo cual reafirma, la mayor especificidad que presenta este método con respecto a los tradicionales.12
No obstante, al realizar la determinación de creatinina, se debe como norma de calidad, conocer las especificaciones del método utilizado en el laboratorio de bioquímica, antes de tomar decisiones clínicas para garantizar que la fase pre analítica esté correctamente asegurada, y así evitar la presencia de factores como la hemólisis y la turbidez. Además se debe contar con datos que permitan conocer si el paciente ha sido dosificado con medicamentos, días previos a la toma de muestra que conlleven a un diagnóstico errado.
Los resultados obtenidos en las muestras de orina difieren significativamente en determinados analitos, cuando la orina es normal y cuando es patológica, por lo que para un estudio profundo de las interferencias en el método de análisis utilizado en estos fluidos, se recomienda analizar ambas condiciones.
Cuando se enriqueció la matriz biológica de orina normal y patológica con los diferentes analitos, no se observaron interferencias significativas, excepto para el dobesilato de calcio en orina patológica y para la metildopa en orina normal y patológica, que resultaron ser interferentes para la determinación de creatinina en muestras de orina.
A pesar de las interferencias detectadas el método enzimático sigue siendo el método de elección en el análisis clínico de la Creatinina, además se ratifica que presenta mayor especificidad que el método tradicional cinético Jaffé.7,10,11,12
En el ensayo de linealidad, los intervalos obtenidos en ambas matrices biológicas (suero y orina) cubrieron el rango de interés analítico para muestras de los pacientes que acuden al laboratorio clínico, esto se debe a que la media de valores normales de creatinina en suero oscila entre 5 y 12 mg/L (de 45 a 104 µmol/L) y en orina entre 288,5 y 2262,4 mg/L (de 2550 a 20000 µmol/L).
Con los resultados obtenidos en el estudio de repetibilidad y precisión intermedia se puede apreciar que el método analítico fue suficientemente repetible al emplear las mismas condiciones de operación (analista, día, equipo), de igual forma se observa una mínima dispersión en los valores a las diferentes concentraciones analizadas, con la presencia de pequeños cambios deliberados como son los analistas, el equipo de medición y los días en que se realizó el estudio; lo que avala la limitada influencia que ejercen los errores aleatorios en el método propuesto, lo cual brinda mayor seguridad y confiabilidad para el producto utilizado en el diagnóstico clínico.
Estos resultados fueron lógicos teniendo en cuenta que el personal involucrado posee una amplia experiencia en la ejecución de procedimientos similares, lo cual minimiza los errores experimentales. Con el empleo de este método se podrán obtener resultados precisos en los laboratorios clínicos independientemente de la infraestructura tecnológica y el personal entrenado para realizar los análisis clínicos de rutina en la determinación de creatininaen suero y orina, sin que se evidencie el impacto significativo de errores aleatorios.
En la comparación del método en estudio con el juego de reactivos para la determinación de creatinina PAP (Firma CPM), validado y reconocido, para un número de muestras significativo de pacientes con valores normales y patológicos, se obtuvieron coeficientes de correlación mayor de 0,98 y valor de pendiente significativo. No existieron diferencias significativas según los resultados del procesamiento estadístico aplicado, lo cual permite definir a este método con una exactitud similar a su homólogo para poder ser aplicado en los laboratorios clínicos.
Los valores de creatinina inferiores al nivel normal no son muy frecuentes. Estos pueden ser indicio de distrofia muscular (etapa avanzada), miastenia grave y algunas enfermedades hepáticas severas; aunque la creatinina no constituye un marcador específico para estas patologías. Los valores superiores son los de mayor interés clínico y están relacionados con las enfermedades renales, patologías para las cuales la creatinina es uno de los marcadores principales.8 Por ello los límites de detección y los límites de cuantificación obtenidos son aplicables al análisis de la creatinina. Estos valores fueron inferiores a los valores reportados para el método cinético Jaffé donde se demostró un límite de cuantificación de 22 µmol/L en suero3 y se encuentra en correspondencia con lo planteado por otros autores para el método en orina5,6,7 lo cual demuestra la mayor sensibilidad del método enzimático en estudio.10,12,13
La comprobación del límite de cuantificación en suero y orina obtenidos garantizan confiabilidad del análisis realizado. En el estudio de precisión los coeficientes de variación estuvieron por debajo del 7 % y en el estudio de exactitud por recuperación, los valores de porcentaje de recobrado promedio, estuvieron por encima del 90 % para las concentraciones evaluadas en ambas muestras biológicas. Con los resultados obtenidos en este estudio se ratificó que el diagnosticador puede detectar y cuantificar creatinina en los niveles para los cuales está destinado el mismo.
El método cinético enzimático colorimétrico creatinina PAP resultó ser específico frente a la mayoría de interferentes estudiados, lineal, preciso, exacto y presentó adecuados límites de detección y cuantificación para llevar a cabo la toma de decisiones médicas en el laboratorio clínico respecto a la presencia de valores normales o patológicos de creatinina en suero y orina.
REFERENCIAS BIBLIOGRÁFICAS
1. Burtis CA, Ashwood ER. Tiezt Texbook of Clinical Chemistry. Third Edition. Philadelphia: WB Saunders Co ed; 2001. p. 1241-45.
2. Gurdián M, Kontorovsky I, Alvarado E, González A. Manual de procedimientos de labotarorio en bioquímica clínica y control de calidad. Managua: Ministerio de Salud de Nicatagua; 2004. p85-88.
3. Aja G. Desarrollo de un diagnosticador para determinar Creatinina en suero. Tesis de Maestría de Tecnología y Control de Medicamentos. La Habana: IFAL. UH; 2007.
4. Perazzi B, Angerosa M. Creatinina en sangre: calidad analítica e influencia en la estimación del Índice de Filtrado Glomerular. Acta Bioquím. Clín. Latinoam. 2011;45(2):5-7.
5. Myers G. Recommendations for improving serum measurement: A report from the laboratory working group of the National Kidney Disease Education Program. Clin. Chem. 2006;52(5):101-5.
6. Roberts WL. Reference information for the Clinical Laboratory/ In: Burtis CA, Ashwood ER, Bruns DE (Eds). Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. Fourth Edition. St. Louis, Missouri: Elsevier Inc; 2006. pp. 2251-2318.
7. Murray RL. Creatinine. In: Pesce-Kaplan Publisher. Laboratory Medicine: A Scientific and Managerial Infobase. [CD-ROM] V. 4.2. Cincinati: Pesce-Kaplan Publisher; 2000.
8. American Association for Clinical Chemistry (AACC). Kidney and urinary tract function, disorders and diseases. March 7, 2002. [citado: 15 Sep 2014] Disponible en: http://labtestsonline.org/understanding/conditions/
9. Greenberg N, Roberts WL, Bachmann LM, Wright EC, Neil DR, Jack J, et al. Specificity Characteristics of 7 Commercial Creatinine Measurement Procedures by Enzymatic and Jaffe Method Principles. Clinical Chemistry. 2012;58(2):391-401.
10. Marakala V, Avinash SS, Shivashankara AR, Malathi M, Arun K. Serum creatinine assay: enzymatic vs kinetic jaffe's method. Journal of Evolution of Medical and Dental Sciences. 2012 Oct-Dec;1(4):258-264.
11. Çuhadar S. Preanalytical variables and factors that interfere with the biochemical parameters: a review. OA Biotechnology. 2013 Jun 01;2(2):19.
12. Sugita O, Uchiyama K, Yamada T, Sato T, Okada M, Takeuchi K. Reference values of serum and urine creatinine, and of creatinine clearance by a new enzymatic method. Ann Clin Biochem. 1992;29 (Pt. 5):523-528.
13. Barreto Penie J, Santana Porben S, Consuegra SD. Intervalos de referencia locales para la excreción urinaria de creatinina en una población adulta. Nutr. Hosp. 2003;XVIII(2):65-75.
Recibido: 15 de septiembre de 2014.
Aprobado: 23 de enero de 2015.