Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Farmacia
versão On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.4 Ciudad de la Habana out.-dez. 2015
ARTÍCULO ORIGINAL
Estudio biofarmacéutico comparativo de tabletas de acetaminofén 500 mg disponibles en el mercado colombiano
A comparative biopharmaceutical study of brands of acetaminophen tablets 500 mg available on the colombian market
QF. Glicerio León Méndez,I MSc. María del Rosario Osorio Fortich,I Dr.C. Germán Eduardo Matiz MeloII
I Facultad de Ciencias Farmacéuticas, Universidad de Cartagena. Grupo de Investigación en Tecnología Farmacéutica, Cosmética y de Alimentos (GITFCA). Cartagena, Colombia.
II Facultad de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia, Sede Bogotá. Grupo de Investigación en Tecnología de Productos Naturales (TECPRONA). Bogotá, Colombia.
RESUMEN
Objetivo: determinar la equivalencia biofarmacéutica de once marcas comerciales de tabletas de acetaminofén 500 mg disponibles en el mercado colombiano.
Métodos: se tomaron once productos comerciales de acetaminofén tabletas de 500 mg, adquiridos en droguerías y farmacias de las ciudades de Bogotá, Cali, Medellín, Barranquilla y Cartagena; se les evaluaron las características físicas, químicas y biofarmacéuticas, tales como variación de peso, dureza, desintegración, test de disolución, perfil de disolución, eficiencia de la disolución y valoración de principio activo, los ensayos farmacopéicos se efecturaron según lo establecido en la USP 37. Los resultados se analizaron a fin de establecer diferencias estadísticamente significativas y posible intercambiabilidad entre los productos evaluados.
Resultados: el análisis comparativo de los productos, permitió evidenciar marcadas diferencias en cuanto a la liberación in vitro del principio activo, sin embargo ninguno de los productos evaluados, incumple este importante parámetro de calidad. Cabe resaltar que todos los productos cumplen con las especificaciones oficiales de identificación y valoración del principio activo, uniformidad de dosificación y tiempo de desintegración.
Conclusiones: los resultados de este trabajo constituyen una valiosa información para las autoridades sanitarias y para los pacientes que consumen este tipo de productos ya que genera confianza en términos de efectividad del medicamento.
Palabras Clave: acetaminofén, biofarmacéutica, disolución, control de calidad.
ABSTRACT
Objective: to determine the biopharmaceutical equivalency of eleven brands of 500 mg acetaminophen tablets available on the Colombian market.
Methods: eleven brands of 500 mg acetaminophen tablets obtained from drugstores and pharmacies in Bogota, Cali, Medellin, Barranquilla and Cartagena were evaluated in terms of physical, chemical and biopharmaceutical characteristics were evaluated, such as weight variation hardness, disintegration, dissolution test, dissolution profile and efficiency and quantitation of active principle; the pharmacopeial assays were evaluated according to the USP 37. The result analysis was used to establish statistically significant differences and possible interchangeability among the evaluated products.
Results: the comparative analysis of products allowed showing marked differences in terms of the in vitro release of the active principle; however none of the evaluated products fail to comply with this important quality parameter. It is worth noting that all tested products comply with the official specifications of identification and measurement of the active ingredient, dosage uniformity and disintegration time.
Conclusions: the results of this study provide valuable information for health authorities and patients who take these products because they show reliability in terms of drug effectiveness.
Keywords: acetaminophen, biopharmaceutical, dissolution, quality control.
INTRODUCCIÓN
Los medicamentos son compuestos esenciales para proteger y preservar la salud del ser humano. Sin embargo, el empleo de estos no está exento de riesgos; aparte de los relacionados con la dosificación, almacenamiento, distribución, prescripción y uso por los pacientes, un medicamento puede ofrecer otros riesgos atribuidos al incumplimiento de factores asociados al control de calidad, encontrándose medicamentos falsificados, fraudulentos, de contrabando, etc. De esta forma, los medicamentos de calidad deficiente son un problema de salud pública de dimensiones mundiales.1,2
Por lo anterior se considera que el control de calidad de los medicamentos es fundamental para garantizar el cumplimiento de las medidas sanitarias de seguridad y que es igual de importante llevar a cabo vigilancia a los medicamentos presentes en el mercado.3-6
Por otra parte, la existencia en el mercado de una amplia variedad de medicamentos genéricos y comerciales del mismo principio activo trae consigo una competencia por la permanencia y prevalencia en el mercado, y como consecuencia una gran variedad en los precios de los medicamentos, así como el uso de diferentes excipientes en sus formulaciones y procesos de manufactura distintos al empleado para el medicamento innovador. Esto último podría ser un factor que comprometería su calidad, por lo que es conveniente demostrar que no existen diferencias en la calidad de estos productos. Para ello, las pruebas de control de calidad permiten evaluar si éstos cumplen con los estándares requeridos para su comercialización.7
Uno de los medicamentos de mayor empleo es el acetaminofén, pues este, es un fármaco de fácil acceso al paciente, debido a que es un producto de venta libre y sus altos grados de seguridad y tolerabilidad, permiten que sea ampliamente utilizado como analgésico y antipirético, puesto que, usado bajo un apropiado régimen de dosificación, es capaz de ocasionar muy pocos, o ningún efecto adverso, además de poseer una escasa interacción con otros medicamentos.9
En Colombia, el acetaminofén es comercializado por diferentes laboratorios como monodroga bajo la forma de comprimidos, gotas y jarabes, pudiendo también encontrarse formando parte de asociaciones. En el caso de comprimidos la forma más habitual es la de 500 mg por unidad, de la cual se comercializan aproximadamente veinte marcas diferentes.9
Esta coexistencia de múltiples marcas trae aparejados algunos efectos beneficiosos en la comunidad, entre los que se incluyen la reducción de costos del producto por competencia y una mayor conciencia por parte de los consumidores acerca de la existencia de productos alternativos. Sin embargo, no siempre se dispone de suficiente información comparativa sobre características funcionales de las distintas marcas, este no es un aspecto menor, ya que el beneficio que los medicamentos aportan a la calidad de vida de los pacientes que los consumen se encuentra en relación directa con su aptitud para el uso.10
Por lo anterior y dada la inminente apertura de nuestro país al mercado internacional, cobra especial relevancia el tema del control integral de calidad a los medicamentos, tanto los producidos en Colombia como aquellos que están por entrar al país, más aún cuando se tiene en cuenta que en Colombia los índices de adulteración y falsificación en los medicamentos son muy altos y según el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA), ente regulador en Colombia, los medicamentos de consumo masivo como analgésicos, antiinflamatorios y multivitamínicos son los más falsificados, y a esto se suma el uso indebido que se da a medicamentos que aun siendo legítimos, como los de uso institucional, se expenden irregularmente, dejando de ejercer la actividad esperada y poniendo en riesgo la salud de los usuarios.11
Según el Sistema de Clasificación Biofarmacéutico (SCB) el acetaminofén es una molécula que exhibe características similares a los fármacos de clase III, presentando una alta solubilidad y baja permeabilidad, pudiendo ser exento de estudios de bioequivalencia in vivo,12 cobrando mayor relevancia la realización de estudios comparativos de equivalencia biofarmacéutica en estos productos.13,14
Los resultados obtenidos con el presente trabajo serán un aporte significativo, para poder establecer bioequivalencias entre estos productos y constituye un apoyo a los entes reguladores del país.
MÉTODOS
Fueron adquiridas en farmacias y droguerías de las ciudades de Bogotá, Cali, Medellín, Barranquilla y Cartagena, tabletas de acetaminofén 500 mg, correspondientes a once productos disponibles en el mercado farmacéutico colombiano. Se incluyeron productos con denominación genérica, comercial y el producto innovador, se prestó atención en que todos estuviesen dentro de su período de vida útil y con registro sanitario vigente del INVIMA.
Con el fin de evitar el sesgo analítico, el promedio de cada lote se identificó de modo aleatorio con letras de la A hasta la K, siendo G el medicamento tomado como referencia. Durante los estudios, los productos se almacenaron en estanterías cerradas protegidas de la luz, a una temperatura de 25 °C y humedad relativa del 60 %.
Todos los ensayos fueron realizados siguiendo los métodos descritos en la USP‒37 previa validación de algunos parámetros.15 Las comparaciones se realizaron frente a un estándar de referencia secundario valorado con el estándar primario de acetaminofén USP (100 %), el cual fue una amable donación de un laboratorio nacional de especialidades farmacéuticas.
ENSAYOS FÍSICOS
Se desarrollaron según se describe en los correspondientes capítulos de la USP-37, con algunas adaptaciones.15
Peso: se pesaron de manera individual diez comprimidos de cada lote y marca, a los que previamente se les retiró el polvo de la superficie sin quebrarlos, y se registró su peso exacto. Este procedimiento se repitió seis veces por tableta y se calculó el valor medio y su desviación (RSD).5,6,15
Dureza: una tableta de cada producto se colocó en el durómetro y se registró la fuerza necesaria para provocar su ruptura. Este procedimiento se realizó en seis tabletas de cada lote y marca y se determinó el valor promedio y RSD.5,6,15
Friabilidad: en una balanza analítica marca (OHAUS Pioneer™, Estados Unidos); se pesaron 10 tabletas de cada marca analizada, se colocaron en el friabilizador a 100 rpm durante cuatro minutos, transcurrido ese tiempo, se sacaron las tabletas y cuidadosamente se pesaron nuevamente y se determinó la diferencia de peso y el porcentaje de pérdida de peso. Teniendo en cuenta los criterios estipulados por la USP se tomaron como aceptable un porcentaje de pérdida de peso menor del 1 %.2
Desintegración: una tableta de cada lote y marca se colocó en cada uno de los seis tubos de la canastilla del equipo de desintegración, empleando agua desionizada (37,0±1,0 °C) como líquido de inmersión. Se determinó el tiempo necesario para la completa desintegración de cada tableta y se calculó su valor medio y RSD.5,6,15
Test de disolución: se evaluaron seis tabletas de acetaminofén por lote y marca empleando el aparato II (paleta) del equipo, 500 mL de buffer fosfato pH 5,8±0,05 (37,0±0,5 °C) como medio para la disolución y velocidad de agitación de 50 rpm, previamente desgasificado en un sonicador Cole Parmer 88‒53 y a una humedad de 39 %. Transcurridos 30 minutos del ensayo, una alícuota de 5 mL de disolución se extrajo de cada vaso, se filtró y se cuantificó por espectrofotometría (de 243 nm). No menos del 80+5 % de la cantidad declarada en el marbete debe disolverse en 30 minutos (Q30, S1).15
Perfil de disolución : las condiciones experimentales y de cuantificación correspondieron a las descritas en el ensayo anterior (velocidad de disolución). Esta prueba, que no es oficial en la farmacopea americana, la recomienda la FDA como un ensayo muy indicativo del desempeño de los comprimidos.15 Se realizó muestreándose de manera seriada cada vaso a los 1, 2, 5, 10, 15, 30 y 45 minutos para el acetaminofén y calculándose el porcentaje de fármaco liberado (%) en cada punto, a lo largo del ensayo.6
Eficiencia de la disolución (ED): la eficiencia de la disolución (ED), se calculó a partir de los perfiles de disolución como la razón entre el área bajo la curva de disolución hasta 60 minutos utilizando la regla trapezoidal y el área total de un rectángulo que describe el 100 % de disolución a ese tiempo y expresada como porcentaje. Los perfiles de disolución de los productos de acetaminofén en estudio fueron generados graficando la cantidad de fármaco disuelta contra el tiempo. A partir de esta información, se evaluaron las áreas bajo la curva (ABC), y la eficiencia de la disolución (ED) para cada una de las curvas con el fin de realizar las respectivas comparaciones.5,6,15 Para su evaluación, se optimizó y validó un método apoyado en HPLC-DAD para la molécula. Las condiciones cromatográficas establecidas para el análisis de comprimidos de acetaminofén incluyeron el uso de una columna Chromolith® performance Merck C18 (100 x 4,6 mm), empleando un programa de elución isocrática basado de una mezcla de agua/metanol (3:1), con flujo de 1,5 mL/min. La longitud de onda de detección fue 254 nm.
Para la valoración del principio activo se determinó el peso promedio de diez tabletas de cada lote y marca, pulverizándolas a fin de preparar disoluciones de concentración 10 µg mL–1. Cada muestra se preparó por triplicado y cada disolución se inyectó tres veces en el equipo.15
Para calcular el factor de diferencia f1 y el de similitud f2, se utilizaron los valores promedio de disolución de las curvas en el mismo intervalo de tiempo.
ANÁLISIS ESTADÍSTICO
Para todos los ensayos se calcularon las medias de los resultados entre los dos lotes de una misma marca mediante prueba t de student p<0,05 se consideraron significativas. Las diferencias entre las áreas bajo la curva (ABC) entre marcas se determinaron mediante análisis de varianza (Anova) y prueba de Tukey post hoc p<0,05 se consideraron significativas.
RESULTADOS
En la tabla se presentan los resultados obtenidos en los ensayos de variación de peso, dureza, desintegración, test de disolución, eficiencia de la disolución y valoración de principio activo, todas las muestras satisfacen las especificaciones farmacopéicas; con valores entre 97,7‒109,9 % para el contenido de ingrediente activo, lo cual indica que se ajusta correctamente a los límites de 90,0‒110,0 %. También se describe los resultados el factor de diferencia f1 y el de similitud f2 .
Tabla. Resultados de ensayos físicos y químicos sobre tabletas de ácido acetilsalicílico
| Marca | Medidas | Peso (mg) | Dureza (Kgcm-2) | Desintegración (min) | Disolución (% Q30min) Mín:80% | ABC | Eficiencia disolución | Contenido % (90-110) | f2 (%) | |
| Diámetro (mm) | Altura (mm) | |||||||||
| A1 | 7.05 ± 0.02 | 3.02 ± 0.02 | 119.24 ± 1.68 | 3.5 ± 0.52* | 0.24± | 100.38 ± 6.4* | 5223.86 ± 6.98* | 87.06 ± 8.23* | 101.79 ± 0.99 | 46.68 |
| A2 | 7.02 ± 0.12 | 2.82 ± 0.13 | 120.62 ± 1.14 | 3.1 ± 0.52* | 0.17± | 81.99 ± 5.32* | 4378.53 ± 3.50* | 72.98 ± 4.13* | 100.38 ± 0.98 | |
| B1 | 8.02 ± 0.01 | 4.43 ± 0.08 | 233.06 ± 6.71 | 8.7 ± 1.13* | 1.87± | 89.11 ± 5.11 | 4962.47 ± 2.95 | 82.71 ± 3.48 | 103.34 ± 1.23 | 55.74 |
| B2 | 8.02 ± 0.007 | 4.38 ± 0.06 | 225.92 ± 6.23 | 9.1 ± 1.64* | 1.78± | 85.40 ± 2.73 | 4785.24 ± 1.38 | 79.75 ± 1.63 | 101.6 ± 1.20 | |
| C1 | 7.02 ± 0.005 | 3.11 ± 0.04 | 126.71 ± 2.17 | 3.7 ± 0.53* | 0.78± | 86.30 ± 3.91* | 4451.23 ± 1.04 | 74.19 ± 1.23 | 91.99 ± 1.01 | 38.31 |
| C2 | 7.02 ± 0.008 | 3.10 ± 0.04 | 125.59 ± 2.00 | 5.5 ± 0.55* | 1.00± | 80.08 ± 4.23* | 4209.84 ± 0.06 | 70.16 ± 0.07 | 90.56 ± 1.11 | |
| D1 | 8.10 ± 0.05 | 4.40 ± 0.06 | 228.89 ± 5.06 | 8.8 ± 1.00* | 2.15± | 89.96 ± 0.82* | 4781.83 ± 1.75 | 79.70 ± 2.07 | 104.70 ± 0.49 | Ref. |
| D2 | 8.04 ± 0.01 | 4.44 ± 0.03 | 231.44 ± 8.00 | 7.3 ± 0.67* | 1.60± | 95.43 ± 2.63* | 4997.97 ± 1.48 | 83.30 ± 1.75 | 105.4 ± 0.47 | |
| E1 | 7.69 ± 0.05 | 4.04 ± 0.04 | 168.81 ± 3.72 | 4.2 ± 0.92 | 0.70±0.22 | 60,00 ± 2.13 | 2987.44 ± 0.68 | 49.79 ± 0.81 | 85.41 ± 0.35 | 23.93 |
| E2 | NA | NA | NA | NA | NA | NA | NA | NA | NA | |
Los valores representan la media ± RSD.*Lotes 1 y 2 son estadísticamente diferentes (p< 0,05).
Estadísticamente diferentes (p<0,05) de la marca de referencia (D). N. A. No aplica, pues se trata de tabletas de la
marca E solo se analizó un solo lote debido a la poca disponibilidad de este producto en el mercado.
El ensayo de peso promedio mostró que los productos distribuyen los 500 mg de acetaminofén en tabletas que oscilan entre 553,260‒770,570 mg. Igualmente, en el ensayo de uniformidad de dosificación por el método de variación de peso, permitió identificar grandes diferencias entre los pesos de las diversas marcas, siendo la marca I la que presentó un peso mayor, el cual fue de 770,570 mg y la marca A la que mostró el peso más bajo con 553,260 mg; cabe destacar que todas las muestras arrojaron una desviación estándar menor del 5 %, lo que indica que existe reproducibilidad dentro y entre lotes de producción de cada marca. Para la identificación del principio activo se compararon los cromatogramas obtenidos en el ensayo de valoración, evidenciándose total correspondencia en los tiempos de retención de las muestras y el estándar de referencia.
Se encontró que los valores de dureza oscilaron en un intervalo desde 9,35±0,97 hasta 15,35±0,28 Kg, presentándose los menores valores para las marcas F y C.
Todos los medicamentos analizados en la prueba de disolución se encontraron dentro de un intervalo de 93,37 % para la marca K, hasta 112,75 % para la marca B.
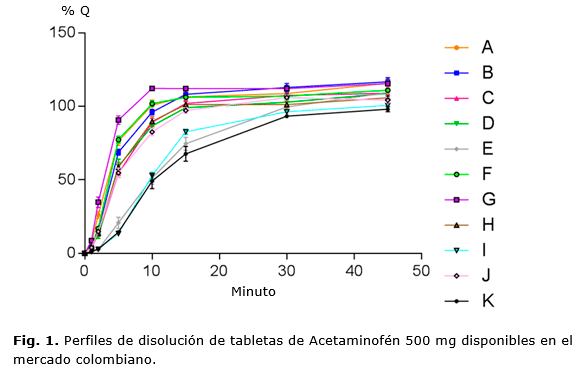
En la figura 1 se presentan los porcentajes promedio de disolución de marcas de acetaminofén 500 mg por tiempos de muestreo en el ensayo de perfil de disolución. De manera consecuente al minuto 30 se alcanza casi la totalidad de la disolución del medicamento, obteniéndose una concentración constante en los minutos posteriores, lo que produce una línea casi recta en la gráfica del perfil de disolución de todas las muestras analizadas.
En cuanto a los perfiles de disolución, estos fueron evaluados mediante comparaciones estadísticas y de su proceder cinético, a fin de determinar si existen diferencias significativas entre los lotes de una misma marca y entre las marcas en estudio.
A partir del perfil de disolución de cada muestra se calculó el área bajo la curva (ABC) de disolución hasta un tiempo de ensayo de 45 minutos y se expresó como el porcentaje del área total de un rectángulo cuya altura representa el 100 % disuelto y es su base el tiempo de disolución (min 0 hasta min 45);17 la mayoría de las marcas estudiadas presentaron una ED mayor del 80 % exceptuando las marcas E, I y K, las cuales presentaron valores de 75,6 %, 74,5 % y 69,4 % respectivamente. Por otro lado se evidencia que los valores de las marcas A, B, F y G se acercan a los valores de una disolución ideal del 100 %. Sin embargo se evidencian diferencias en el comportamiento de disolución de cada medicamento, notándose un mayor desempeño en las marcas A, B, C, D, F, G, H, y J, dentro de las cuales la que presentó el mejor perfil, correspondiente a una completa disolución y la más alta velocidad con la marca G, por el contrario los que presentaron los más bajos desempeños fueron las marcas I, E y K. Este comportamiento puede deberse a diferencias en su formulación o a los procesos de manufactura principalmente.
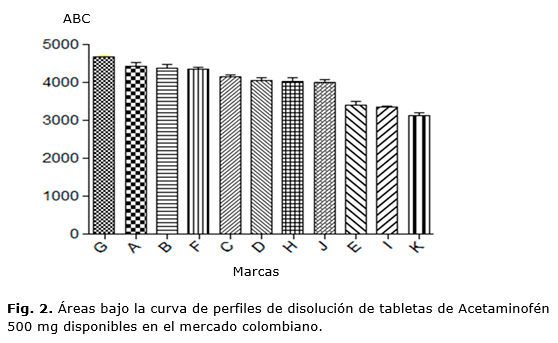
Los perfiles de disolución de acetaminofén 500 mg de este estudio fueron además sometidos a análisis estadísticos comparando, entre sí, el ABC, correspondiente a la medida de 12 réplicas diferentes. En la figura 2, se encuentran representadas las ABC de los perfiles de disolución. Los análisis estadísticos arrojaron que no existen diferencias significativas (p<0.05) del ABC entre la marca G (marca de referencia) y las marcas A, B y F; mostrando un mejor perfil la marca G; por el contrario se encontró que sí existe una diferencia significativa (p<0.05) entre las marcas C, D, H, J, E, I y K, y la marca tomada como referencia; de esta forma las marcas que presento los valores más alto de ABC fue la G con un ABC de 4 668, seguido de la marca A, B, F (4 429,79, 4 368,42 y 4 353,08), mientras que las que presentaron ABC más bajo y por lo tanto menos cantidad de fármaco disuelto son las marcas I y K con valores de 335,962 y 3 124,08 respectivamente.
DISCUSIÓN
En los resultados de la valoración de principio activo desde este punto de vista todas las marcas analizadas de acetaminofén 500 mg cumplen con el ensayo de valoración y con la uniformidad de dosis, lo que es un buen indicio para la calidad de los mismos y del mercado farmacéutico nacional.
Por otro lado es de importancia resaltar que no existe una regla que regule el peso que deben poseer las tabletas, ya que queda a disposición de cada laboratorio estipular el peso del comprimido, el cual puede variar debido a factores como: tipo, cantidad y voluminosidad de los excipientes utilizados en la formulación. El estricto cumplimiento de las buenas prácticas de fabricación durante la granulación y etapas de compresión aseguran la uniformidad de peso en la tableta.16
Uno de los análisis más discutidos en estos estudios, se refiere a los resultados de las pruebas de desintegración, en este estudio se evidenciaron diferencias significativas entre algunas marcas, el tiempo de desintegración de todas fue satisfactorio, puesto que, aun las tabletas que más tardaron en desintegrarse (E y I con un tiempo en minutos de 9,04 y 19,69) superaron la prueba, teniendo en cuenta que la USP NF‒37 estipula un tiempo máximo de desintegración de 30 minutos para las tabletas de acetaminofén de liberación convencional.16
Los resultados de la oscilación de los valores de dureza sugiere la presencia de poco aglutinante o a una débil compresión; caso contrario se evidenció en las marcas I y E cuya dureza fue mayor al ser comparadas con el resto de las marcas, pudiendo ser un indicativo de mayor presencia de aglutinante o resultado de una mayor compresión por parte de la maquina tableteadora, lo cual pudo retrasar la desintegración de la tableta, y como consecuencia la tardía liberación del principio activo. Igualmente se puede evidenciar la poca variabilidad dentro de los resultados obtenidos para una misma marca, hecho que demuestra homogeneidad inter e intralote en cada laboratorio fabricante.
Los resultados del ensayo de friabilidad, muestran que todas las marcas cumplen con la prueba; ya que ninguna presentó un porcentaje de pérdida de peso superior al 1 %, estipulado por la USP, de igual forma no se evidenciaron tabletas agrietadas, segmentadas o rotas después de realizar la prueba, hecho que indica una adecuada resistencia al degaste durante las etapas de manufactura, empaque, transporte y manipulación.7
Es importante destacar que todas las muestras cumplieron satisfactoriamente con las parámetros de calidad físicos, pero al comparar los resultados de dureza, friabilidad y desintegración; se nota que existe una relación directa entre estas pruebas biofarmacéuticas ya que, aquellas marcas que presentaron una dureza elevada, debido posiblemente a la fuerza de compresión de la maquina tableteadora, presentaron un porcentaje de pérdida de peso bajos; puesto que mientras más compactos se encuentren los gránulos que conforman las tabletas más difícil será que esta pierda peso; por lo tanto estas tabletas son más resistentes al desgaste y a la abrasión durante los procesos de fabricación, distribución y uso; sin embargo esos resultados en ocasiones influyen negativamente sobre la velocidad de desintegración, obteniéndose tiempos de disgregación elevados lo que puede influir en una tardía liberación del principio activo en el Tracto Gastrointestinal.5,6
De esta forma, las marcas I, E, y K que presentaron un tiempo de desintegración más elevado con respecto a las demás, también se destacaron con altas durezas y menores perdidas de peso por abrasión o degaste.
En la prueba de disolución, las marcas analizadas cumplen con las especificaciones establecidas por la USP, ya que se evidencia un porcentaje del principio activo disuelto de más del 80 % de la cantidad mencionada en el marbete al cabo de 30 minutos de iniciada la prueba. Cabe destacar que el perfil de disolución es una herramienta que permite encontrar diferencias en la formulación, calidad de excipientes, así como en el proceso de manufactura de los sólidos orales, con el fin de controlar la homogeneidad lote a lote.7
Al observar la cuantificación de principio activo y el porcentaje de acetaminofén disuelto al minuto 30 se mantiene una relación directa entre los perfiles de disolución, con la valoración de principio activo y los porcentajes de disolución, hecho que se hace más notorio en las marcas G y K, dado a que la marca G fue la que presentó el mayor contenido de principio activo, el más alto porcentaje de acetaminofén disuelto en el tiempo estipulado y el mejor perfil de disolución, caso totalmente opuesto para la marca K que mostró los valores más bajos en las pruebas antes mencionadas.
Con respecto a los perfiles de disolución, se observaron notables diferencias entre las marcas. Si bien las mismas no implican un no cumplimiento del ensayo farmacopéico de disolución, éstas evidencian diferencias en la composición de excipientes y la tecnología farmacéutica empleada en las distintas formulaciones estudiadas. Las marcas A, B, F y G son las que presentaron un mejor desempeño en la prueba de disolución con perfiles de disolución similares, por tanto pueden ser consideradas equivalentes farmacéuticos.
La comparación de los perfiles de disolución de las marcas analizadas respecto al producto de referencia, aplicando un método modelo independiente, indica que para las marcas C, D, E, G, H, I, J y K existen diferencias en dichos perfiles respecto a la marca de referencia (G), deducido en virtud de que los valores del factor f1 son mayores a 15. Al evaluar el factor f2 se confirma la falta de similaridad entre las curvas ya que los valores obtenidos son menores a 50.
Una vez en el mercado, el monitoreo de los productos farmacéuticos es clave para lograr resultados clínicos efectivos y estos resultados constituyen un valioso aporte para en un futuro cercano y en función de las políticas nacionales, poder establecer bioequivalencia entre estos productos.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Cartagena (Colombia) por el apoyo financiero e institucional recibido.
REFERENCIAS BIBLIGRÁFICAS
1. Bate R, Zhen G, Mathur A. Does price reveal poor-quality drugs? Evidence from 17 countries. Journal of Health Economics. 2011; 30:1150-1163.
2. Belay S, Tesfaye A, Tajure N. Comparative quality evaluation of Paracetamol tablet marketed in Somali region of Ethiopia. International Journal of Pharmaceutical Sciences and Research. 2012;3(2):545-550.
3. Quevedo F. El control de la calidad integral de los medicamentos. Revista diagnóstico. 2004;43(2). [citado: 12 de dic. 2014]. Disponible en: http://fihu-diagnostico.org.pe/revista/numeros/2004/mar-abr04/94-96.html
4. Ngwuluka NC, Lawal K, Olorunfemi PO, Ochekpe NA. Post-market in vitro bioequivalence study of six brands of ciprofloxacin tablets/caplets in Jos, Nigeria. Scientific Research and Essay. 2009;4(4):298-305.
5. Franco LA, Matiz GE, Pájaro IB. Estudio biofarmacéutico comparativo de marcas comerciales de tabletas de ciprofloxacino disponibles en el mercado colombiano. Rev Salud Publ. 2012;14(4):695-709.
6. Matiz GE, Erika Rodríguez E. Comparative study of the biopharmaceutical quality of commercial and generic brands of captopril and losartan tablets in the Colombian market. Rev Colomb Cienc Quím Farm. 2014;43(2):213-229.
7. Martínez M, Camacho M. Evaluación in-vitro de doce marcas de comprimidos de Ciprofloxacino que se comercializan en el mercado mexicano. Revista Mexicana de Ciencias Farmacéuticas. 2010;41(4):43-49.
8. Obu H, Chinawa J, Ubesie A, Eke C, Ndu K. Paracetamol use (and/or misuse) in children in Enugu, South-East, Nigeria. BMC Pediatrics. 2012;12:103.
9. INVIMA, Manual de normas técnicas de calidad. Guía técnica de análisis. 3ra Revisión; 2002. p. 1-37.
10. Operto M, Castellano P, Kaufman T. Evaluación y análisis de parámetros de calidad de comprimidos de paracetamol. Latin American Journal of Pharmacy. 2008;27(4):603-607.
11. Valbuena Z. Los mecanismos de control frente al contrabando y adulteración de medicamentos. Tesis Esp. en Gerencia Pública, Esc. Sup. de Adm. Pública-ESAP; 2006.
12. Kalantzi L, Reppas C, Dressman JB, Amidon GL, Junginger HE, Midha KK, et al. Biowaiver monographs for immediate release solid oral dosage forms: acetaminophen (paracetamol). J Pharm Sci. 2006;95(1):4-14.
13. Nehal AK, Marc W, Chandrasekharan R, Marival B, Hans L, Ajaz SH. Molecular Properties of WHO Essential Drugs and Provisional Biopharmaceutical Classification. Molecular Pharmaceutics. 2004;1(1):85-96.
14. World Health Organization. Proposal to waive in vivo bioequivalence requirements for WHO Model List of essential medicines inmediate-release, solid oral dosage forms. Ginebra: WHO Technical Report Series, No. 937.2006.
15. The United States Pharmacopeial Convention. US Pharmacopeia, 37th. Rockville, MD: USPC, Inc, 2014.
16. Awofisayo S, Willie E, Umoh E. Quality Control Evaluation of Multi-Source Artemether-Lumefantrine Tablets Prescribed for Uncomplicated Multi-drug Resistant Malaria. Indian Journal of Novel Drug Delivery. 2010;2(4):153-157.
17. Muralidhar S, Devala G, Manohar B, Narayana V, Ramesh R. Studies to enhance dissolution properties of Celecoxib. Pharmacie globale international journal of comprehensive pharmacy. 2011;1(5):1-5.
Recibido: 23 de marzo de 2015.
Aprobado: 22 de abril de 2015.