Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.4 Ciudad de la Habana oct.-dic. 2015
ARTÍCULO ORIGINAL
Evaluación de la efectividad de abiraterona en el tratamiento del cáncer de próstata metastásico
Evaluation of the effectiveness of abiraterone in treatment of metastatic prostate cáncer
Pablo Selvi Sabater,I José Carlos Titos Arcos,I Noemí Manresa Ramón,I José Enrique de la Rubia Orti II
I Servicio de Farmacia. Hospital Morales Meseguer. Murcia. España.
I I Universidad Católica de Valencia. Valencia. España.
RESUMEN
Objetivo: estudiar el perfil de efectividad y seguridad de abiraterona en la práctica clínica, en pacientes con cáncer de próstata metastásico hormonoresistente.
Métodos: se diseñó un estudio descriptivo retrospectivo de los pacientes diagnosticados con cáncer de próstata metastásico que recibieron tratamiento con abiraterona durante los mese de febrero 2012 a abril 2013. Las variables estudiadas fueron sexo, edad, escala del Eastern Cooperative Oncology Group (ECOG), tratamiento previo con docetaxel, antígeno prostático especifico (PSA) y supervivencia libre de progresión. La información se obtuvo de las historias clínicas, el programa de prescripción Savac® y el programa de validación farmacéutica Farmis‒Oncofarm®.
Resultados: los 24 pacientes incluidos contaban una mediana de edad de 70 años. El estado funcional fue ECOG<2 en el 58,3 % y ECOG≥2 en el 41,7 % de los pacientes. El PSA disminuyó un 50 % o más de su valor basal en el 52 % de los pacientes.
En cuanto a la supervivencia libre de progresión la mediana fue de 166 días (5,5 meses). En los pacientes con un ECOG≤2 la mediana fue de 231 días (7,7 meses) mientras que para los pacientes con ECOG˃2 fue de 106 días (3,5 meses). Abiraterona presentó pocas reacciones adversas por lo que resulta un fármaco seguro, a pesar de presentar algunas reacciones de suma importancia.
Conclusiones: los resultados obtenidos en nuestra práctica clínica difieren con los obtenidos en los estudios pivotales. Se observan mayor supervivencia libre de progresión en los pacientes con un ECOG≤1 y en los que nunca habían recibido quimioterapia previa.
Palabras clave: efectividad, Abiraterona, cáncer de próstata metastásico.
ABSTRACT
Objectives: to study the efficacy and safety profile of abiraterone in clinical practice to treat patients with hormone-resistant metastatic prostate cancer.
Methods: retrospective and descriptive study of patients who were diagnosed with metastatic prostate cancer and were treated with abiraterone since February 2012 to April 2013. The studied variables were gender, age, level of Eastern Cooperative Oncology Group (ECOG) scale, prior treatment with docetaxel, prostate specific antigen (PSA), progression-free survival (PFS). Data sources included medical records, the Savac® prescription and the Farmis-Oncofarm® pharmaceutical validation programs.
Results: twenty-four patients were included, with average age of 70 years. The ECOG performance status was less than 2 in 58,3 % of patients whereas 41,7 % of the patients showed ECOG equal to 2 or higher. The PSA decreased by 50 % or more its basal value in 52 % of the patients. As regards to PFS, the median was 166 days (5,5 months) in progression-free survival. In patients with ECOG≤2, the median PFS was 231 days (7,7 months), whereas for patients with ECOG˃2,it was 106 days (3,5 months). Abiraterone has fewer side effects, so it may be considered a safe drug, although some are significant.
Conclusions: the results obtained in our clinical practice differ from the ones obtained in the pivotal trials . Increased progression-free survival was observed in patients with an ECOG≤1 or less, and in those who had never received prior chemotherapy
Keywords: effectiveness, Abiraterone, metastatic prostate cancer.
INTRODUCCIÓN
El cáncer de próstata (CP) es el cáncer más frecuente en varones, en países desarrollados. Según GLOBOCAN 2012, la incidencia en Europa es de 96/100 000 habitantes, con una mortalidad de 19,3/100 000 habitantes. Su incidencia se encuentra muy por encima de otros tipos de cáncer, como el de pulmón (con una incidencia de 41,9/100 000 habitantes) o el cáncer colorrectal en mujeres (con una incidencia de 25/100 000 aproximadamente), según la SEOM (Sociedad Española de Oncología Medica, la incidencia en España en 2012 fue de 12,9/100 000 habitantes.1
Distintos factores influyen en la incidencia del cáncer, entre los que se destaca la edad. La incidencia del cáncer de próstata (CP) se incrementa a partir de los 50 años aproximadamente, raramente es diagnosticado en pacientes de menor edad.2,3 Por ello, es fundamental un programa de cribado, capaz de detectar precozmente este tipo de tumores. Habitualmente se utiliza el antígeno prostático específico (PSA), que se considera normal hasta 4 ng/mL y patológico a partir de 10 ng/mL (en caso de encontrarse entre 4 y 10 ng/mL se debe realizar el porcentaje PSA libre/PSA total).4-7
Para el tratamiento farmacológico del cáncer de próstata metastático (CPM), se utiliza el bloqueo androgénico completo, que se define como la asociación de un análogo de LHRH (como leuprolida, goserelina) y un antiandrogénico (como finasterida o dutasterida), lo que mantiene los niveles de testosterona por debajo de 50 ng/dL.8,9 Los tratamientos de deprivación de andrógenos, disminuyen la producción de estos en los testículos, pero no afectan su producción en las glándulas suprarrenales o en el tumor. En los pacientes resistentes a la castración química, suele recurrirse a la quimioterapia principalmente con docetaxel, terapia de elección en estos pacientes.10
La abiraterona es un inhibidor selectivo de la enzima 17 α‒hidroxilasa/C17, 20‒liasa (CYP17). La expresión de esta enzima es necesaria para la biosíntesis de andrógenos en los tejidos testiculares, suprarrenales y tejidos prostáticos tumorales. El CYP17 cataliza la conversión de pregnenolona y progesterona a los precursores de la testosterona, DHEA y androstenediona, respectivamente, por 17α‒hidroxilación y rotura del enlace C17, 20.11 Fue autorizada para su comercialización por la EMA en Septiembre de 2011 en asociación con prednisona o prednisolona para el tratamiento del CPM resistente a la castración en hombres adultos que sean asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de deprivación de andrógenos en los cuales la quimioterapia no está aún clínicamente indicada y el tratamiento del CPM resistente a la castración en hombres adultos cuya enfermedad ha progresado durante o tras un régimen de quimioterapia basado en docetaxel.1
Este estudio se diseña con el fin estudiar el perfil de efectividad y seguridad de abiraterona en la práctica clínica, en pacientes con cáncer de próstata metastásico hormonoresistente.
MÉTODOS
Se diseñó un estudio descriptivo retrospectivo de los pacientes diagnosticados con CPM que recibieron tratamiento con abiraterona desde febrero 2012 hasta abril 2013.
Los datos recogidos se obtuvieron mediante revisión de historias clínicas, consulta del programa informático de prescripción y validación de citostáticos (Farmis_Oncofarm® versión 2011.0.4.18), consulta del programa informático de la historia clínica (Selene® versión 5.3.1 [1]) y consulta del programa de prescripción de fármacos ( SAVAC® versión 3.20.19). Se analizaron los siguientes parámetros: sexo, edad, escala del estado funcional del Eastern Cooperative Oncology Group (ECOG), localización de las metástasis, tratamiento previo con docetaxel 75 mg/m2 (con una media de 1,7 m2 de superficie corporal) cada 3 semanas, antígeno prostático especifico (PSA) al inicio, a los tres y a los seis meses de iniciado el tratamiento, la supervivencia libre de progresión (SLP), las reacciones adversas (RA) de grado 3 y 4 (según los criterios de toxicidad de National Cancer Institute Common Terminology Criteria of Adverse Events v4.0)12 relacionadas con abiraterona según criterio del clínico.
Para evaluar la respuesta se estratificaron los pacientes en dos grupos: uno consideró el estado funcional en ECOG≤1 o ECOG˃1 y otro si habían recibido quimioterapia previa o no con Docetaxel.
La dosis recibida de abiraterona fue de 1 000 mg en todos los pacientes, según especifica la ficha técnica del mismo.
La supervivencia libre de progresión se valoró según progresión del PSA (aumento confirmado del 25 % con respecto al valor basal/mínimo del paciente) conjuntamente con criterios de progresión radiológica RECIST versión 1.113 y los criterios de progresión radiológica de lesiones óseas, definido por la aparición de dos o más lesiones nuevas según los criterios de Prostate Cancer Working Group-2.14 También se evaluó la disminución de PSA≥50 %.
RESULTADOS
Se incluyeron 24 pacientes diagnosticados con CPM que fueron tratados con abiraterona con una mediana de edad de 70 años (rango 64‒92). Se evaluaron los pacientes al inicio del tratamiento, clasificándolos según la escala ECOG (tabla 1). El 58 % de los pacientes habían recibido tratamiento previo con docetaxel.
En cuanto a la distribución de las metástasis, el 54,2 % de los pacientes solo presentaban metástasis óseas, el 20,8 % presentaban metástasis óseas y de tejidos blandos o ganglios linfáticos y el 25 % presentaba además metástasis viscerales.
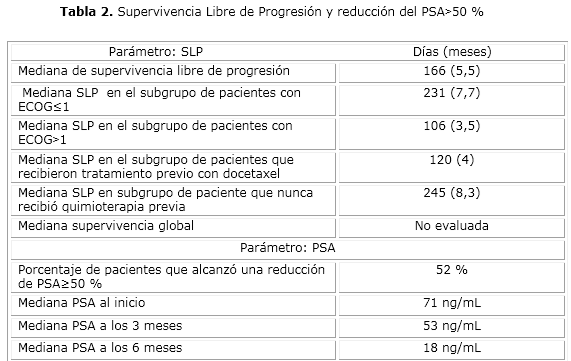
La tabla 2 muestra los principales parámetros de efectividad estudiados y según subgrupos. Hubo un disminución del PSA≥50 % de su valor basal en el 52 % de los pacientes. La mediana de PSA al inicio del tratamiento fue de 71 ng/mL, a los 3 meses de 53 ng/mL (en 16 pacientes que aún continuaban en tratamiento) y a los 6 meses fue de 18 ng/mL (en 11 pacientes que aún continuaban en tratamiento).
La mediana de SLP fue de 166 días (5,5 meses) (rango 24‒365 días). En cuanto al subgrupo de pacientes con un ECOG≤1 la mediana SLP fue de 231 días (7,7 meses) mientras que para los pacientes con ECOG˃1 fue de 106 días (3,5 meses). En los pacientes tratados previamente con docetaxel la mediana de SLP a abiraterona fue de 120 días (4 meses) mientras que los pacientes que nunca habían recibido tratamiento con docetaxel la SLP fue de 270 días (9 meses).
En cuanto a las RA, únicamente se registraron en las historias clínicas tres RA de grado 3‒4 en 3 pacientes (12,5 %) diferentes y son astenia de grado 4 en dos pacientes y flutter auricular en un paciente, que obligaron a suspender el tratamiento. En cuanto a las astenias no se encuentran muy documentadas. El flutter auricular se diagnosticó tras acudir el paciente a consulta con disnea y ligero edema en miembros inferiores e hipotensión, con taquicardia. En el electrocardiograma no se observan ondas p, con QRS rítmicos a 150 latidos por minuto, con lo que se llega al diagnóstico de insuficiencia cardiaca por flutter auricular.
DISCUSIÓN
La actividad de abiraterona en el CPM fue confirmada en los ensayos clínicos pivotales de fase III 301 y 302.15,16 En el ensayo clínico 302 se incluyeron 1 088 pacientes (546 tratados con abiraterona) que tenían CPM y que no habían recibido tratamiento previo con QT (pacientes asintomáticos o levemente sintomáticos y en los cuales la quimioterapia no estaba aún clínicamente indicada). Presentaban un ECOG≤1 (el 76 % ECOG=0) y fueron excluidos los pacientes con metástasis viscerales. Los resultados de este estudio muestran una mediana SLP de 16,5 meses (495 días) muy superior a los datos obtenidos en nuestro estudio (7,7 meses). Esta diferencia puede deberse a la diferencia del estado funcional de los pacientes entre el estudio 302 y el presente estudio, así como a la exclusión de los pacientes con metástasis viscerales. En el ensayo clínico 301 se incluyeron 1 195 pacientes (797 tratados con abiraterona) que habían recibido docetaxel previamente. El 11 % presentaba un ECOG=2 y un 11 % presentaban metástasis hepáticas. Los resultados de este estudio muestran una reducción de la PSA≥50 % en el 38 % de los pacientes, un dato algo menor que en el presente estudio (reducción PSA≥50 % del 52 %). Sin embargo, muestra una SLP del PSA de 10,2 meses (306 días), y una SLP radiológica de 5,6 meses (168 días), resultado algo superiores a los obtenidos en nuestro estudio. Estas diferencias pueden deberse a las comentadas anteriormente, el estado funcional de los pacientes y la baja proporción de pacientes con metástasis viscerales.
Daniel C et al,17 realizaron un estudio en el que se trataron 58 pacientes con CPM con abiraterona que habían recibido docetaxel previo, con una mediana de edad de 69,5 años, un PSA inicial de 189,6 ng/mL y en el que más del 90 % de los pacientes presentaban un ECOG≤1. En cuanto a las metástasis, el 19 % presentaba únicamente metástasis óseas y el 22 % de los pacientes presentaban metástasis viscerales. El 43 % de los pacientes una disminución de la PSA≥43 % y una SLP de 169 días (5,6 meses). Los resultados de este estudio, son comparables a los del presente trabajo.
Un reciente estudio de Arun A et al,18 presentaron una serie de 519 pacientes, en el que el 61 % presentaba un ECOG≤1. La SLP fue menor en el grupo con ECOG˃1 frente al grupo con ECOG≤1 (4,1 meses frente a 5,2 meses respectivamente) y una reducción de la PSA≥50 % en el 32 % frente al 45 %. La SG fue de 9,1 meses frente a 20 meses.
En un trabajo presentado en el I Congreso de Oncología Médica y Farmacia Oncológica,19 se mostraron los resultados de 93 pacientes tratados con abiraterona con un PSA inicial de 96,7 ng/mL en el que el 68 % presentaba un ECOG≤1 y solo el 6 % un ECOG˃2. El 49 % presentó respuesta con una disminución de la PSA y la SLP fue de 4,9 meses (147 días), datos ligeramente inferiores a los del presente estudio.
En otro trabajo presentado en el mismo Congreso20 se evaluaron 32 pacientes con una PSA inicial de 104,8 ng/mL con ECOG entre 0 y 3 (sin especificar más datos) en el que el 50 % de los pacientes presentó una disminución de la PSA≥50 % y una SLP de 158 días (5,3 meses), datos similares a los presentados en este trabajo.
En el XLIX Congreso de la Sociedad Americana de Oncología Médica (ASCO) en 2013,21 se comparó la eficacia de abiraterona frente a ketoconazol. Veinte y seis pacientes fueron tratados con abiraterona, con una mediana de edad de 71 años. La SLP fue de 6 meses, ligeramente superior a la de este estudio.
Caro Teller J.M publicó recientemente un trabajo en el que se incluyó a 45 pacientes españoles con una mediana de PSA de 457 ng/mL y obtuvieron una reducción del PSA≥50 % en un 40 % de los pacientes y una con una mediana de duración del tratamiento de 5 meses (que fue suspendido por progresión en todos los casos). Entre las reacciones adversas que encontramos en este estudio podemos observar de grado 1‒2 astenia (35,6 %), elevación de las enzimas hepáticas (28,9 %), hipopotasemia (13,3 %), retención de fluidos (11,1 %) y trastornos cardiacos (2,2 %). Destacables fueron los cinco eventos de grado 3 que se observaron dos casos de hipopotasemia, un caso de astenia, otro de retención de fluidos y un caso de insuficiencia cardiaca.22
En cuanto a la seguridad, es difícil poder evaluarla, dado la escasa recogida de RA que aparecen reflejadas en la historia clínica, por lo que, por el momento, no se puede llegar a ninguna conclusión con esta serie de pacientes. Destacan tres RA de grado 3‒4 (astenia de grado 4 en dos pacientes y flutter auricular en un paciente).
En este trabajo se presenta la experiencia en el Hospital Morales Meseguer con el tratamiento del CPM con abiraterona. Se puede observar una mayor supervivencia libre de progresión (aproximadamente, el doble) en aquellos pacientes con un ECOG≤1 y en aquellos pacientes que nunca recibieron tratamiento previo con docetaxel. La tasa reducción de la PSA≥50 % observada es comparable a lo publicado en los estudios disponibles y es algo superior en todos a la obtenida en el ensayos pivotales 301 y 302. En cuanto a la SLP de esta serie, fue similar a la obtenida en el resto de los estudios publicados, siendo en todos ellos mucho menor a la publicada en los ensayos pivotales 301 y 302. Se deberán realizar futuros estudios, con mayor número de pacientes, para determinar con más exactitud la SLP y la SG de este fármaco en la práctica clínica diaria. En cuanto a seguridad, abiraterona es bien tolerada con un perfil de RA comparable con lo publicado.
REFERENCIAS BIBLIOGRÁFICAS
1. Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012. J.European Journal of Cancer. 2013;49:1374–1403.
2. Hankey BF, Feuer EJ, Clegg LX, Hayes RB, Legler JM, Prorok PC, et al. Cancer Surveillance Series: Interpreting Trends in Prostate Cancer-Part I: Evidence of the Effects of Screening in Recent Prostate Cancer Incidence, Mortality, and Survival Rates. J Natl Cancer Inst. 1999 Jun 16;91(12):1017-24.
3. Delongchamps NB, Singh A, Haas GP. The Role of Prevalence in the Diagnosis of Prostate Cancer. Cancer Control. 2006 Jul;13(3):158-68.
4. Partin AW, Carter HB, Chan DW, Epstein JI, Oesterling JE, Rock RC, et al. Prostate specific antigen in the staging of localized prostate cancer: influence of tumor differentiation, tumor volume and benign hyperplasia. J Urol. 1990 Apr;143(4):747-52.
5. Lange PH, Ercole CJ, Lightner DJ, Fraley EE, Vessella R. The value of serum prostate specific antigen determinations before and after radical prostatectomy. J Urol. 1989 Apr;141(4):873-9.
6. Hudson MA, Bahnson RR, Catalona WJ. Clinical use of prostate specific antigen in patients with prostate cancer. J Urol. 1989 Oct;142(4):1011-7.
7. Catalona WJ, Smith DS, Ornstein DK. Prostate cancer detection in men with serum PSA concentrations of 2.6 to 4.0 ng/mL and benign prostate examination. Enhancement of specificity with free PSA measurements. JAMA. 1997 May 14;277(18):1452-5.
8. Loblaw DA, Virgo KS, Nam R, Somerfield MR, Ben-Josef E, Mendelson DS. Initial hormonal management of androgen-sensitive metastatic, recurrent, or progressive prostate cancer: 2006 update of an American Society of Clinical Oncology practice guideline. J Clin Oncol. 2007 Apr 20;25(12):1596-605.
9. Prostate Cancer Trialists' Collaborative Group. Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Lancet. 2000 Apr 29;355(9214):1491-8.
10. Basch EM, Somerfield MR, Beer TM, Carducci MA, Higano CS, Hussain MH, et al. American Society of Clinical Oncology endorsement of the Cancer Care Ontario Practice Guideline on nonhormonal therapy for men with metastatic hormone-refractory (castration-resistant) prostate cancer. J Clin Oncol. 2007 Nov 20;25(33):5313-8.
11. EMA. Product information Zytiga. [access june 2014]. Available at: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR-Product_Information/human/002321/WC500112858.pdf
12. National Cancer Institute. United States. Cancer therapy evaluating program. Reporting guidelines. Common Terminology Criteria of Adverse Events v4.0. [access march 2014]. Available at: http://www.eortc.be/services/doc/ctc/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf
13. Hamid Chalian, Hüseyin Gürkan Töre, Jeanne M. Horowitz, Riad Salem, Frank H. Miller, Vahid Yaghmai. Radiologic Assessment of Response to Therapy: Comparison of RECIST Versions 1.1 and 1.01. RadioGraphics. 2011; 31:2093-210.
14. Scher H1, Halabi S, Tannock I, Morris M, Sternberg CN, Carducci MA. Design and end points of clinical trials for patients with progressive prostate cancer and castrate levels of testosterone: recommendations of the Prostate Cancer Clinical Trials Working Group. J Clin Oncol. 2008 Mar 1;26(7):1148-59.
15. Fizazi K, Scher HI, Molina A, Logothetis CJ, Chi KN, Jones RJ. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2012 Oct;13(10):983-92.
16. Basch E, Autio K, Ryan CJ, Mulders P, Shore N, Kheoh T. Abiraterone acetate plus prednisone versus prednisone alone in chemotherapy-naive men with metastatic castration-resistant prostate cancer: patient-reported outcome results of a randomised phase 3 trial. Lancet Oncol. 2013 Nov;14(12):1193-9.
17. Danila DC, Morris MJ, de Bono JS, Ryan CJ, Denmeade SR, Smith MR. Phase II multicenter study of abiraterone acetate plus prednisone therapy in patients with docetaxel-treated castration-resistant prostate cancer. J Clin Oncol. 2010 Mar 20;28(9):1496-501.
18. Azad AA, Eigl BJ, Leibowitz-Amit R, Lester R, Kollmannsberger C, Murray N. Outcomes with Abiraterone Acetate in Metastatic Castration-resistant Prostate Cancer Patients Who Have Poor Performance Status. Eur Urol. 2014 Jan 31. PMID:24508071.
19. Bujaldón-Querejeta N, Talens-Bolós A, Camacho-Romera D, López-Jiménez A, Sánchez-Sánchez JL. Efectividad y seguridad del tratamiento con abiraterona en pacientes con adenocarcinoma de próstata metastásico resistente a castración en la práctica clínica. I Congreso Nacional de Oncología Médica y Farmacia Oncológica. Toledo, España. Noviembre 2013.
20. Mejía-Recuero M, Martínez-Valdivieso L, Flor-García A, Mulet-Alberola A, Santiago-Crespo J, Barreda-Hernández E. Estudio de utilización de abiraterona en el tratamiento de cáncer de próstata. I Congreso Nacional de Oncología Médica y Farmacia Oncológica. Toledo, España. Noviembre 2013.
21. Michael A. Morgan, Martin Fenner, Viktor Grünwald, Axel S. Merseburger, Arnold Ganser, Christoph W. Reuter . Effectiveness of abiraterone as salvage therapy in patients with docetaxel- and castration-resistant prostate cancer (mDCPC) that progressed during second-line chemotherapy with carboplatin plus weekly docetaxel. J Clin Oncol 31, 2013;31(suppl):e16064.
22. Caro Teller JM, Cortijo Cascajares S, Escribano Valenciano I, Serrano Garrote O, Ferrari Piquero JM. Uso, efectividad y seguridad de abiraterona en cáncer de próstata. Farm Hosp. 2014;38(2):118-122.
Recibido: 7 de noviembre de 2014.
Aprobado: 27 de febrero de 2015.
Pablo Selvi Sabater. Hospital Morales Meseguer. C/ Márquez de los Vélez s/n CP:30 007. Murcia. España. Teléfono: +34 968 36 09 02. Correo electrónico: pbselvi@gmail.com