Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.50 no.1 Ciudad de la Habana ene.-mar. 2016
ARTÍCULO ORIGINAL
Evaluación del desempeño de los métodos analíticos aplicados en el diclofenaco sódico 100 mg retard de producción nacional
Evaluation of the performance of the analytical methods applied to Cuban-made 100mg retard sodium diclofenac
Caridad Margarita García Peña,I Lisandra García Borges,I Malvis Robaina Mesa,II Ofelia de la Caridad Fariñas Suárez,III Iverlis Díaz Polanco I,I Jorge Luís Cataño FernándezIII
I Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
II Oficina del Historiador de la Ciudad. La Habana, Cuba.
III Laboratorios SOLMED. La Habana, Cuba.
RESUMEN
Introducción: el diclofenaco sódico es un derivado del ácido fenilácetico y pertenece al grupo de los antinflamatorios no esteroideos con propiedades antinflamatorios, analgésicas y antipiréticas pronunciadas. En la Farmacopea de los Estados Unidos (USP 36, 2013) aparece reportado los métodos analíticos para el control de calidad del diclofenaco sódico en el ingrediente farmacéutico activo y en las tabletas.
Objetivos: evaluar el desempeño de los métodos analíticos que se emplean en el control de la calidad de cuantificación y los estudios de estabilidad del ingrediente farmacéutico activo; así como los ensayos de disolución de las tabletas de diclofenaco sódico 100 mg retard de producción nacional.
Métodos: en la evaluación del desempeño del método analítico potenciométrico para la cuantificación del ingrediente farmacéutico activo se analizaron los parámetros de linealidad y de precisión (repetibilidad y precisión intermedia). Para el método cromatográfico aplicable a la cuantificación del ingrediente farmacéutico activo en el producto terminado se analizaron los parámetros de especificidad, precisión y exactitud. En el método espectrofotométrico empleado en el ensayo de disolución se tuvo en cuenta la especificidad, la precisión, la linealidad, la influencia del filtrado y la estabilidad de las soluciones analíticas.
Resultados: la evaluación del desempeño realizada a los diferentes métodos analíticos, fueron satisfactorias, demostrando que son lineales, precisos y específicos en el rango de concentraciones estudiadas.
Conclusiones: se demostró la confiabilidad de los métodos empleados en el control de la calidad y los estudios de estabilidad del ingrediente farmacéutico activo y de las tabletas de diclofenaco sódico 100 mg retard de producción nacional.
Palabras claves: diclofenaco sódico; tabletas; espectrofotometría; cromatografía líquida de alta resolución; validación; ingrediente farmacéutico activo.
ABSTRACT
Introduction: sodium dicloflenac is a phenylacetic acid derivate included in the non-steroidal anti-inflammatory group, with marked analgesic and antipyretic properties. The US Pharmacopeia (USP 36, 2013) reports the analytical methods for the quality control of sodium diclofenac in the active ingredient and in tablets.
Objectives: to evaluate the performance of the analytical methods used in the quality control of quantitation and the stability studies of the active ingredient as well as the dissolution tests of the Cuban-made 100 mg retard sodium diclofenac.
Methods: the evaluation of the performance of the potentiometric analytical method for quantitation of the active ingredient analyzed the parameters called linearity and precision (repeatability and intermediate precision). For the chromatographic method applicable to quantitation of the active ingredient in the finished product, parameters such as specificity, precision and accuracy were analyzed. The spectrophotometric method used in the dissolution test took into account specificity, precision, linearity, filtering effect and stability of the analytical solutions.
Results: the evaluation of the performance of the different analytical methods was satisfactory and they proved to be linear, precise and specific in the range of studied concentrations.
Conclusions: the reliability of the methods for the quality control and of the stability studies of the active ingredient and of Cuban-made 100 mg retard sodium diclofenac was demonstrated.
Keywords: sodium diclofenac; tablets; spectrophotometry; high performance liquid chromatography; validation; active ingredient.
INTRODUCCIÓN
El diclofenaco sódico es un medicamento inhibidor relativamente no selectivo de la ciclooxígenasa, miembro de la familia de los antinflamatorio no esteroideo (AINE), indicado para reducir inflamaciones y como analgésico, pues reduce dolores causados por heridas menores y dolores tan intensos como los de la artritis.1,2
Como analgésico puede bloquear la generación del impulso del dolor y como antinflamatorio actúa en los tejidos inflamados, ambos mecanismos involucra la reducción de la actividad de las prostanglandinas. La inhibición de la biosíntesis de las prostaglandinas y otros prostanoides es fundamental en su mecanismo de acción, mediante la inhibición competitiva y reversible de la enzima ciclooxígenasa, produce una disminución de la formación de los precursores de las prostaglandinas y los tromboxanos del ácido araquidónico.1,2
Se metaboliza en el hígado, en parte por la glucuronidación de la molécula intacta, pero principalmente por hidroxilación y metoxilación única y múltiple, lo cual tiene como resultados varios metabolitos fenólicos, que en su mayoría se convierten en conjugados glucurónidos.1,2
Se comercializa en formulaciones resistentes a los ácidos gástricos, en colirios, inyectables, gotas suspensión oral, supositorios, cremas y tabletas de liberación lenta y controlada. También se encuentran combinados con otros medicamentos. El empleo de las tabletas retard ha permitido una mejor posología del tratamiento y minimizar los efectos gastrointestinales.2
En la literatura aparecen reportados diferentes métodos analíticos para la cuantificación del diclofenaco sódico dependiendo del objetivo propuesto, de esta forma para la valoración del ingrediente farmacéutico activo IFA se propone un método pontenciométrico, para la cuantificación del IFA en el producto terminado se emplea la Cromatografía Líquida de Alta Resolución (CLAR) y en el ensayo de disolución se plantea el uso de la espectrofotometría ultravioleta.3
Los métodos analíticos que se emplean en el control de la calidad y los estudios de estabilidad de medicamentos, deben de ser previamente validados para obtener pruebas documentales de la confiabilidad de los mismos para su posterior empleo.4-9 Constituye además, una exigencia por parte del órgano regulador cubano (CECMED) desde el año 2013 la evaluación del desempeño del método aplicado en la valoración del IFA,10 así como la evaluación del método aplicado en el ensayo de disolución de las tabletas.
El ensayo de disolución constituye uno de los estudios más importantes en el desarrollo de una forma farmacéutica sólida oral. Permite evaluar los procesos de fabricación, la calidad intra e inter-lotes, además de predecir en algunos casos la bioequivalencia y biodisponibilidad de productos sólidos orales y la estabilidad del preparado farmacéutico.11
La evaluación del desempeño de los métodos analíticos aplicables en la valoración del principio activo en el IFA, así como en la cuantificación del IFA y el ensayo de disolución de las tabletas de diclofenaco sódico 100 mg retard de producción nacional, que se emplean en el control de la calidad y los estudios de estabilidad constituyó el objetivo de este trabajo.
MÉTODOS
La sustancia de referencia química de diclofenaco sódico fue suministrada por el grupo de sustancias de referencia del Centro de Investigación y Desarrollo de Medicamentos (CIDEM), se analizó por el método potenciométrico establecido para realizar el control de la calidad de la materia prima, con una pureza de 99,7 %. El producto terminado en forma de tabletas y fue elaborado en los Laboratorios SOLMED perteneciente al Complejo MEDSOL, identificado como lote 14001, el cual cumplió con las especificaciones de calidad establecidas para el control de la calidad de las tabletas.Todos los reactivos utilizados fueron de grado HPLC, procedentes de la Riedel -de Haen (España).
MÉTODO ANALÍTICO PARA LA VALORACIÓN EN EL IFA
Se pesaron con exactitud 450 mg de diclofenaco sódico y se disolvió en 25 mL de ácido acético glacial. Se valoró hasta determinar el punto final potenciométricamente con ácido perclórico 0,1 N.
En el estudio de validación del método se evaluaron los siguientes parámetros:
Linealidad: para el estudio de la linealidad de la respuesta del detector se preparó una curva de calibración con solución de la sustancia de referencia química de diclofenaco sódico en un rango de concentraciones que representan entre el 50-150 % de la concentración teórica del principio activo en la solución.
Criterios: la ecuación de la recta debe cumplir que y=mx+b; coeficiente de correlación r≥0,999; coeficiente de variación de los factores respuesta C.Vf≤5 %; en la prueba de significación del intercepto, la t Student calculada (t cal) debe ser menor que la t tabulada (t tab) para un nivel de significación del 95 %.10
Precisión: se evaluó la precisión del método a través del estudio de repetibilidad y la precisión intermedia. La repetibilidad se realizó sobre la base de diez determinaciones. La precisión intermedia se efectuó por dos analistas, réplica de diez determinaciones en una muestra de concentración.
Criterios: repetibilidad (C.V≤3,0 %); Precisión intermedia (t student calculada para la variable analista debe ser menor t tabulada; F de análisis de varianza calculada debe ser menor F tabulada) para un nivel de significación del 95 %.10
MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DEL IFA EN EL PRODUCTO TERMINADO
En el ensayo se empleó un cromatógrafo (KNAUER) con detector UV/VIS (KNAUER) ajustado a 254 nm, un dosificador (Loop) de 10 µL e integrador (SHIMADZU CR 8 A). La separación se realizó isocráticamente sobre una columna Lichrospher 100, RP-8 (10 µm) (4,6 mm x 25 cm). La fase móvil consistió en una mezcla desgasificada de metanol, buffer (fosfato monobásico de sodio 0,01 M y ácido fosfórico 0,01 M ajustado a pH 2,5) (7:3); con una velocidad de flujo de 1,0 mL/min.3
La sustancia de referencia química y las muestras fueron preparadas según la metodología establecida en la Farmacopea de los Estados Unidos (USP 36, 2013).
Los parámetros evaluados durante la validación de este método analítico fueron:
Especificidad: con el objetivo de identificar la señal correspondiente al diclofenaco sódico se adicionaron 20 mg de sustancia de referencia química de diclofenaco sódico a una muestra de producto terminado preparada con el objetivo de demostrar que la señal que se obtiene corresponde con la del IFA. Simultáneamente se adicionaron 10 mg de sustancia relacionada A de diclofenaco sódico a una muestra de producto terminado, con el objetivo de identificar el tiempo de retención donde eluye y poder identificar los picos en el producto terminado.
La especificidad del método cromatográfico fue evaluada, analizándose la sustancia de referencia química de diclofenaco sódico, el placebo, la muestra correspondiente a la tableta retard y las muestras sometidas a condiciones tales como: hidrólisis ácida (HCL 1N), hidrólisis básica (NaOH 0,1 N) y luz durante 3 días.
Criterio: no se debe obtener señales del placebo ni de los productos de degradación en la zona de elusión del ingrediente activo.4-10
Precisión: se evaluó la precisión del método a través del estudio de repetibilidad y la precisión intermedia. La repetibilidad se efectuó sobre la base de seis determinaciones a una muestra de concentración. Se determinaron los valores medios, la desviación estándar y el coeficiente de variación. El estudio de precisión intermedia se realizó a tres niveles de concentración (80, 100, 120 %) por dos analistas, tres días diferentes.
Criterios: repetibilidad (C.V≤2,0 %); Precisión intermedia (t student calculada para la variable analista y días debe ser menor t tabulada; F de análisis de varianza calculada debe ser menor F tabulada para un nivel de significación del 95 %).4-10
Exactitud: en el estudio de la exactitud se empleó el método de recuperación, con muestras de diferentes niveles de la concentración teórica del principio activo en la solución: bajo, medio y alto correspondiente con el 80, 100 y 120 %, respectivamente.
Criterios: el porciento de recuperación del principio activo debe ser entre el 98,0 y 102,0 %, G de Cochran calculada debe ser menor que G tabulada así como la t student calculada para las muestras debe ser menor t tabulada para un nivel de significación del 95 %.4-10
MÉTODO ANALÍTICO PARA EL ENSAYO DE DISOLUCIÓN
El método analítico empleado para el ensayo de disolución de las tabletas de diclofenaco sódico 100 mg retard se realizó según lo descrito en la Farmacopea de los Estados Unidos USP 36; 2013, el cual establece cuatro pruebas y aplica para la cuantificación la Espectrofotometría ultravioleta. La sustancia de referencia química de diclofenaco sódico y las muestras de tabletas 100 mg retard fueron preparadas según lo establecido en la USP 36.3
Los parámetros evaluados fueron los siguientes: especificidad, precisión, influencia del filtrado, estabilidad de las soluciones analíticas y linealidad, según lo establecido en la Regulación 41-2013 (CECMED)(La Habana, Cuba) para la validación de métodos analíticos empleados en los ensayos de disolución.
Especificidad: este estudio se realizó empleando seis unidades del placebo y según el procedimiento descrito para el ensayo de disolución, con el objetivo de determinar las posibles interferencias de los excipientes de la formulación en la determinación del principio activo.
Criterio: no debe observarse interferencia de los excipientes de la formulación en la determinación del principio activo.10-15
Precisión: se estudió empleando como muestras seis tabletas del diclofenaco sódico 100 mg retard y se evalúa en dos días diferentes.
Criterio: debe cumplir que los valores de t Student calculada de cada muestra debe ser menor que el valor de t tabulada para un nivel de significación del 95 %.10-15
Influencia del filtrado: se analizaron seis unidades del lote comparándose entre sí los resultados de las muestras filtradas por papel con las muestras filtradas con filtro de línea.
Criterio: los valores de t Student calculada para cada una de las muestras, al compararse estadísticamente los resultados obtenidos de cada uno de los medios filtrantes, debe ser menor que el valor de t tabulado para un nivel de significación del 95 %.10-15
Estabilidad de las soluciones analíticas: se realizaron los análisis según lo establecido en cada prueba de la Farmacopea, se almacenaron las muestras a temperatura ambiente durante 24 horas y después de transcurrido ese tiempo fueron analizadas nuevamente.
Criterio: los valores de absorbancia después de transcurridas las 24 horas, deben encontrarse entre un 98,0-102,0 % con relación a las lecturas iniciales.10-15
Linealidad: para el estudio de la linealidad del sistema se prepararon muestras con diferentes niveles correspondientes a 50, 80, 100, 120 y 150 %.
Criterio: el coeficiente de correlación debe ser mayor o igual que 0,9990, el coeficiente de variación de los factores de respuesta mayor o igual al 5 %, la desviación estándar de la pendiente menor o igual 2 %.10-15
RESULTADOS
EVALUACIÓN DEL DESEMPEÑO PARA EL IFA
Linealidad
La ecuación de la recta de la curva de calibración se obtuvo en el rango de 50-150 %, según la ecuación y=0,5923 X-0,9265, con un coeficiente de correlación lineal de 0,9990. Al aplicar la prueba de significación del intercepto se obtiene una tcal=1,84. Se obtuvo un valor de 3,79 % para el coeficiente de variación de los factores de respuesta al realizar la prueba de linealidad
Precisión
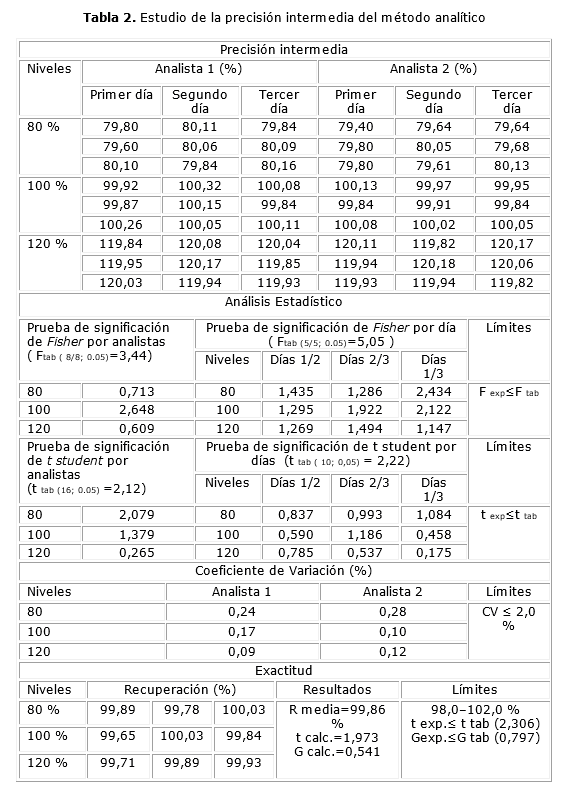
En la tabla 1, se reportan los resultados del estudio de repetibilidad y precisión intermedia para la valoración del IFA.
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DEL IFA EN EL PRODUCTO TERMINADO
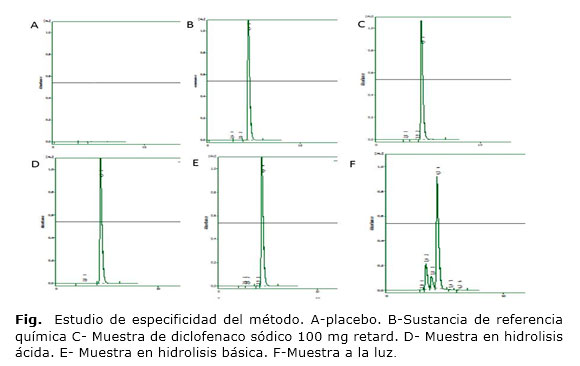
Especificidad: la figura 1 muestra los resultados obtenidos en el estudio de especificidad del método.
Precisión: en el estudio de repetibilidad realizado a una misma muestra en el día por el mismo analista, a través de seis réplicas, se obtuvo un coeficiente de variación igual a 0,24 %.
En la tabla 2 se muestran los resultados del estudio de la precisión intermedia y los obtenidos en el análisis de la exactitud del método.
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA EL ENSAYO DE DISOLUCIÓN
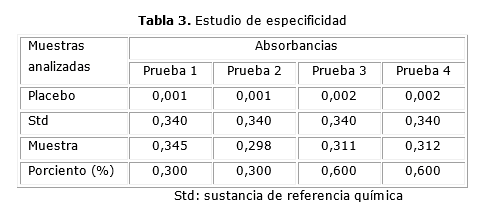
Especificidad: en la tabla 3, se muestran los resultados del estudio de especificidad del método para el ensayo de disolución.
Precisión: Se reportan además los valores de la prueba de la t de Student calculada para cada muestra.
En la tabla 4 se exponen los resultados del estudio de precisión al analizar las tabletas de diclofenaco sódico, en dos días diferentes, así como los resultados de la influencia del filtrado tanto de los ensayos obtenidos empleando muestras filtradas por papel como las muestras filtradas por filtro de línea, así como los valores obtenidos al comparar las medias por la prueba de la t de Student calculada para cada evaluación realizada.
ESTABILIDAD DE LAS SOLUCIONES ANALÍTICAS
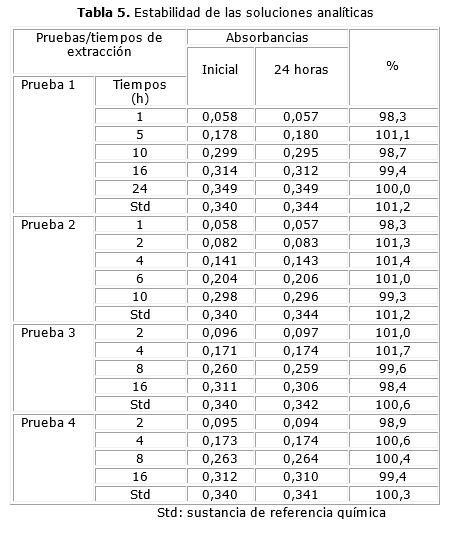
Los resultados de la estabilidad de las soluciones analíticas se exponen en la tabla 5.
Linealidad: la ecuación de la recta de la curva de calibración obtenida en el rango de 50-150 %, se expresa según la ecuación de la recta y=0,0318 X-0,0022, con un coeficiente de correlación lineal de 0,9995. Cuando se aplicó la prueba de linealidad mediante los coeficientes de variación de los factores de respuesta CVf se obtiene como resultado un coeficiente de variación igual a 0,94 %.
DISCUSIÓN
EVALUACIÓN DEL DESEMPEÑO PARA EL IFA
Linealidad: con los resultados obtenidos se demuestra el cumplimiento de la linealidad en el intervalo de concentración estudiado al obtenerse un intercepto no significativo por ser tcal menor que la ttab2,16 y el coeficiente de correlación mayor de 0,9990. El coeficiente de variación de los factores de respuesta CVf demuestra también, la adecuada linealidad al cumplir con el límite establecido menor del 5 %.10
Precisión: los valores demuestran que no existen diferencias significativas entre las precisiones alcanzadas por ambos analistas, para un 95 % de probabilidad, ya que el valor calculado de la prueba de Fisher es menor que el tabulado, así como el valor calculado para la prueba de t Student resultó ser menor que el tabulado para un 95 % de probabilidad y 18 grados de libertad.10
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DEL IFA EN EL PRODUCTO TERMINADO
Especificidad: en los cromatogramas no se obtiene ninguna señal en la zona de interés en el placebo (A), al ser comparado con la señal obtenida para la sustancia de referencia química (B) y la muestra (C), lo que indica que los excipientes o sustancias auxiliares presentes en el producto terminado, no interfieren en la determinación del IFA, demostrándose la especificidad del método evaluado para el control de la calidad del producto terminado.4-10
Los estudios realizados por la adición de la sustancia de referencia química a las muestras de producto terminado demostraron que el pico que se observa en el cromatograma de la muestra de tabletas, se corresponde con el del IFA, ya que se evidencia un aumento de la señal correspondiente, estos resultados permiten corroborar los obtenidos por los cromatogramas (B) y (C), donde los tiempos de retención son similares.
La muestras de producto terminado que se le adicionaron sustancia de referencia A de diclofenaco sódico se observó que la señal de este último no interfería en la determinación del IFA en las tabletas, ya que los tiempos de retención fueron diferentes, estos resultados demostraron que el método era específico para determinar el diclofenaco sódico en presencia del compuesto relacionado A del diclofenaco sódico.
El estudio de especificidad realizado degradando a condiciones drásticas de hidrólisis y fotólisis, a las muestras de placebo demostraron que los excipientes presentes en las tabletas, no eluyen a la longitud de onda empleada. Sin embargo, los resultados de las degradaciones realizadas a la sustancia de referencia química de diclofenaco sódico, si evidencian la degradación del IFA en condiciones de exposición a la luz, observándose la disminución de la señal y la aparición de picos secundarios que no interfieren en la determinación del IFA, lo cual coincide con lo planteado por otros autores referente a la fotosensibilidad de la molécula.16,17
En cuanto a las muestras de tabletas sometidas a condiciones drásticas se observa la disminución significativa en las muestras sometidas a luz con la aparición de picos secundarios, sin interferencias en la determinación del principio activo y se observa una correspondencia con los tiempos de retención observados en la degradación de la sustancia de referencia química.
Los resultados obtenidos demostraron la especificidad del método reportado en la Farmacopea de los Estados Unidos (USP 36), evaluado en las condiciones de trabajo establecidas en este estudio para aplicar en el control de la calidad y el estudio de estabilidad de las muestras de diclofenaco sódico retard de 100 mg de producción nacional.
Precisión: en el estudio de la repetibilidad se obtuvo un coeficiente de variación adecuado lo que demuestra la buena precisión del método según el límite para los métodos cromatográficos CV≤2 %.
Los valores que se obtienen al realizar la comparación de medias y el análisis de varianza por las pruebas de Fisher y t Student, para el estudio de la precisión intermedia demuestran que no existen diferencias significativas entre las precisiones alcanzadas por los analistas en diferentes días para una probabilidad de 0,05 %, ya que el valor de F calculada es menor que la F tabulada, así como para la t Student el valor calculado resulta ser menor que el tabulado lo cual demuestra que no existen diferencias significativas entre las medias alcanzadas.4-10
Exactitud: en la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud al aplicar la prueba de Cochran se obtuvo que la G calculada fue menor que la G tabulada para una probabilidad de 0,05, k=3 y n=3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes indicando que la concentración no influye en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, con un coeficiente de variación de 0,05 %, se obtuvo una t Student calculada menor que la t tabulada. En el rango seleccionado para el estudio de exactitud, los valores de porciento de recobro están dentro de los límites establecidos para los métodos cromatográficos (98-102 %) y los valores del coeficiente de variación, para cada uno de los niveles de concentración estudiados, fueron menores que el 2 %.4-10
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA EL ENSAYO DE DISOLUCIÓN
Especificidad: se observa que no hay interferencia de los excipientes de la formulación en la determinación del principio activo, ya que al realizar el análisis de cada uno de los valores obtenidos en cada prueba los valores de absorbancia obtenidos en el placebo es inferior al 1 % en relación con los valores de absorbancia de las sustancia de referencia química.10,15
Precisión: los resultados del estudio de precisión muestran que en todos los casos no existieron diferencias significativas entre las medias evaluadas en cada tiempo, al obtenerse valores del estadígrafo t de Student menor que t tabulada [t tab (95 %, 5)=2,57] esto nos ofrece un criterio de confiabilidad al seleccionar este método para realizar el ensayo de disolución en las muestras estudiadas.
Influencia del filtrado: no se observaron diferencias significativas entre los resultados alcanzados al compararse con los obtenidos al emplear el papel de filtro, ya que en el tiempo de estudio la t calculada resultó ser menor que la t tabulada [t tab (95 %, 5)=2,57]. Esto permite asegurar que durante la filtración, el filtro utilizado no adsorbe el principio activo ni aporta interferencias al filtrado, por lo que es posible el empleo indistintamente de cualquiera de los filtros estudiados.10
Estabilidad de las soluciones analíticas: las soluciones analíticas se comportaron de manera estable durante 24 horas, cumpliendo con el rango de 98,0-102,0 %, establecido en la regulación 41-2013 del CECMED para la validación de métodos analíticos para los ensayos de disolución, garantizando con este ensayo la repetibilidad de los resultados en el tiempo de estudio.10
Linealidad: la curva de calibración del estudio de linealidad del sistema, se comportó de forma lineal en el intervalo de concentraciones estudiadas, con un adecuado valor del coeficiente de correlación (r≥0,99900). El valor del coeficiente de variación de los factores de respuesta, se encontró dentro de los límites establecidos para la evaluación de este parámetro en la validación (CVf ≤5 %), demostrándose el cumplimiento de la linealidad.10-15
El método analítico validado por Cromatografía líquida de alta resolución, permite aplicar este método para el control de la calidad y estudio de estabilidad de las tabletas de diclofenaco sódico 100 mg retard por ser preciso, exacto y específico.Las condiciones analíticas propuestas para el ensayo de disolución, tomando en cuenta las cuatro pruebas reportadas, brindan criterios de repetibilidad y seguridad en los resultados obtenidos al realizar este estudio en las tabletas de diclofenaco sódico 100 mg retard de producción nacional.
REFERENCIAS BIBLIOGRÁFICAS
1. Rang H, Dale M, Ritter J, Moore P. Antiinflamatorios e inmunosupresores. En: Farmacología. Madrid. Elsevier España. 244-252.2003.
2. Colectivo de autores. Formulario Nacional de Medicamentos. Cuba. CDF-MINSAP; 2011. Disponible en: http:www.bvs.cu/libros_texto/formulario_medicamentos/índice_p.htm
3. Farmacopea de los Estados Unidos (USP 36). [CD-ROM]. Rockville: Mack Printing; New York; 2013. p 3220 - 3221.
4. Zheng J. Formulation and Analytical Development for Low-Dose Oral Drug Products. NJ, USA: John Wiley & Sons, Inc; 2009.
5. Cecmed. Validación de Métodos Analíticos. Regulación No. 41. La Habana: Cecmed; 2007.
6. World Health Organization. A WHO guide to good manufacturing practice (GMP) requeriments, part 2. Validation. Geneva: World Health Organization; 1997.
7. Bliesner DN. Validating Chromatographic Methods: A Practical Guide. NJ, USA: John Wiley & Sons, Inc; 2006.
8. Wegscheider J. Validation of analytical method. In: Guenzler H, editor. Accreditation and quality assurance in analytical chemistry. Berlin: Springer Verlag; 1996.
9. Chan CC, Lam H, Lee YC, Zhang X. Analytical Method Validation and Instrument Performance Verification. Hoboken, NJ; John Wiley & Sons, Inc; 2004.
10. Cecmed. Anexo I de Buenas Prácticas de Laboratorio: Validación de Métodos Analíticos. La Habana: Cecmed; 2013.
11. Cox DC. Guidelines for Dissolution Testing. Vol. 2. Eugene, Oregon: Aster Publishing Corporation; 2001. p. 41-58.
12. Fortunado D. Dissolution Technologies: Dissolution Method Development for Immediate Release Solid Oral Dosage Forms. London: Dissolution Technologies Magazine; 2005.p.12-14.
13. Breier AR, Paim CS, Steppe M. Schapoval EES Development and Validation of Dissolution Tests for Fexofenadine Hydrochloride Capsules and Coated Tablets. J Pharm Pharmaceut Sci. 2005; 8(2):289-298.
14. Hokanson GC. A life cycle approach to the validation of analytical methods during pharmaceutical product development, part 2. Changes and the need for additional validation. Pharm.Tech. 1994;18(16):92-100.
15. Skoug JW. Estrategia para el desarrollo y validación de pruebas de disolución para formas sólidas orales. New York: Pharmaceutical Technology Magazine; 1996.p.8-15.
16. Koutsouba P, Dasenakis M, Hiskia A, Tsipi D. Photochemical studies of the anti-inflammatory drug diclofenac in aqueous solutions. 7th International Conference on Environmental Science and Technology; 3 - 7 Sept. 2001. Ermoupolis - Syros Island, Grecia: ICEST; 2001.
17. Correa O, Ruiz A, Restrepo M. Estandarización de un método por HPLC para cuantificar diclofenaco en muestras de microdiálisis mediante fotoderivatización precolumna. Rev Cubana Farm.2014;48(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152014000100004
Recibido: 13 de julio de 2015
Aprobado: 22 de julio de 2015
Caridad Margarita García Peña . Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave 26 No. 1605 e/ Boyeros y Puentes Grandes. Plaza de la Revolución. La Habana. Cuba. Correo electrónico: caridadgp@infomed.sld.cu