Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina
versão impressa ISSN 0034-7523versão On-line ISSN 1561-302X
Rev cubana med v.36 n.1 Ciudad de la Habana jan.-abr. 1997
De la Prensa Médica Extranjera
Seis años de la hepatitis por virus c
Van der Poel CL, Cuypers HT, Recsink HW
* Tomado de: Lancet (ed esp)1995;26(4):48-52.
Después de más de una década de incertidumbre sobre el agente causal de la hepatitis parenteral no A, no B (HNANB), en 1988 se obtuvo la clonación del virus de la hepatitis C (VHC) a partir de una copia de AND (ADNc) extraído de plasma de chimpancé infectado.1 Posteriormente se demostró que el VHC era la causa de la HNANB en más del 90 % de los casos. Los 6 años siguientes han aportado la caracterización del virus completo, la noción de su variabilidad genética, 3 generaciones de pruebas diagnósticas de anticuerpos, y una experiencia cada vez mayor en la detección del ácido nucleico viral, la epidemiología y el tratamiento antiviral.
VIROLOGÍA
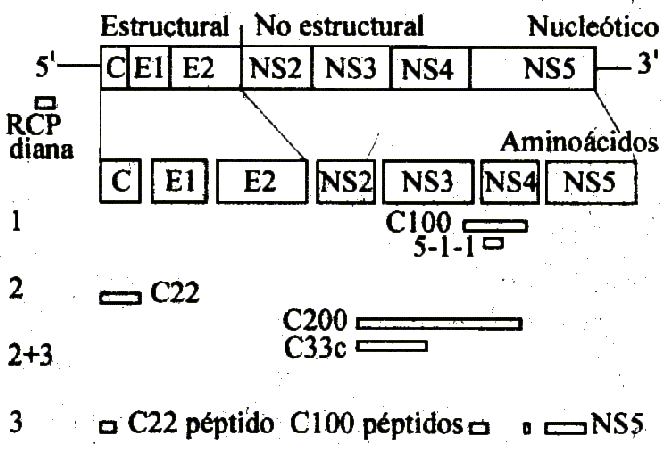
El VHC es un pequeño virus ADN de cadena única, de 30-38 nm de diámetro, con cubierta lipoide. El genoma consiste en un marco grande de lectura abierta de 9.379-9.481 nucleótidos (figura 1).2 En el extremo 5'existe una región terminal de 329-341 nucleótidos con una homología del 92 % entre los diferentes tipos de VHC. Esta región probablemente tenga una función en la traslación del genoma viral, y su carácter altamente conservado la hace útil para la detección diagnóstica del ácido nucleico viral con la amplificación en cadena de la polimerasa del ADNc del VHC. Avanzando por el genoma hallamos la región que codifica el supuesto core del VHC (p22), 2 regiones (E1 y E2) que codifican las glucoproteínas de cobertura (gp33 y gp70), y 4 regiones no estructurales. Estas últimas desempeñan un papel en la replicación del virus y codifican proteasas (NS2, NS3), helicasa (NS3), y una polimerasa ARN-ARN-dependiente (NS5)3 (tabla). Finalmente, las regiones 3'terminales muestran considerables variaciones, tanto en la longitud como la secuencia; en ciertos cultivos existe una cola poli-(rU) y en otros una cola poli-(rA). Actualmente se han clonado ciertos cultivos de VHC que revelan una amplia variación de secuencias. Esta heterogeneidad en la secuencia no se distribuye uniformemente por el genoma, sino que difiere entre las regiones (figura 1). Aparte de la región terminal 5'conservada, el supuesto core y las regiones NS3 están relativamente bien conservadas, de forma que se utilizan los antígenos de estas regiones en los análisis con anticuerpos anti-VHC. Se han descrito do-minios hipervariables en la parte N-terminal de la región de cubierta E2. Las mutaciones secuenciales de esta región probablemente tengan un papel en que el virus pueda escapar a la respuesta inmune del huésped.4 El VHC se clasifica como un género separado al del Flaviviridae. Existen, por lo menos, 6 genotipos de VHC, según un sistema de clasificación propuesto basado en la región 5'terminal y el análisis de la secuencia NS5.5 Otros investigadores han descrito 12 genotipos basados en el análisis de la secuencia E1, y pueden ser necesarios más datos antes de que se logre una clasificación formal.6 Se ha documentado la distribución geográfica de los genotipos del VHC a partir de estudios sobre donantes de sangre en diferentes países (figura 2).
FIGURA 1. Organización del genoma del VHC.
TABLA. Glucoproteínas codificadas por el virus de la hepatitis C y función supuesta3
| Posición | |||
| Gen | Función aminoácido | Glucoproteínas | |
| C | Core | -191 | p21 |
| E1 | Cobertura | 192-383 | gp31 |
| E2/NS1 | Cobertura | 384-809 | gp70 |
| NS2 | Proteasa | 810-1 009 | p70 |
| Helicasa | |||
| NS4 | - | 1 620-2 016 | p8 |
| p27 | |||
| N55 | Replicasa | 2 017-3 003 | p58 |
| Polimerasa | p68 | ||
FIGURA 2. Distribución geográfica de los genotipos del VHC.
Se ilustra la distribución geográfica de los genotipos del VHC predominantes entre los donantes de sangre de diferentes países7 ordenada según prevalencia decreciente.
En casi el 80 % de los casos la infección por el VHC es persistente.8 El mecanismo de tal persistencia es mal comprendido. Entre otros factores potenciales en el escape inmunológico figuran partículas virales defectuosas y replicación extrahepática del virus.9 Durante la infección persistente por el VHC pueden detectarse anticuerpos anti-VHC con distintas especificidades. Como regla, sin embargo, estos anticuerpos no dan lugar a la eliminación del virus o a inmunidadfrente al mismo.8,10 A pesar de numerosos intentos para cultivar el virus in vitro, sólo un reducido número de grupos han logrado el éxito.9 El diagnóstico de infección por VHC descansa, por tanto, en la detección de anticuerpos específicos o en la presencia de ácido nucleico del virus.
Core supuesto (C), cobertura (E) y regiones no estructurales (NS). La homología de los nucleótidos en los cultivos más divergentes se expresa en porcentajes entre las distintas regiones del VHC. La region hipervariable (RHV) se halla en la zona N-terminal de la región E2 de cobertura. Las funciones de las glucoproteínas codificadas se indican más abajo.
DIAGNÓSTICO
PRUEBAS DE CRIBADO CON ANTICUERPOS
Gracias a la generación de clonas que se solapan, la primera clona de VHC cultivada (5-1-1) se amplió hasta producir un antígeno recombinante (C100) para la primera generación de pruebas con anticuerpos anti-VHC mediante un análisis de inmunoabsorción ligado a enzimas (ELISA). Posteriormente, se han expresado otros antígenos VHC recombinantes y péptidos sintéticos para producir, respectivamente, análisis de anticuerpos anti-VHC de segunda y tercera generaciones. Los ELISA anti-VHC de tercera generación (ELISA-3) incluyen antígenos del supuesto core y de las regiones NS3, NS4 y NS5. Los sistemas ELISA-3 se utilizan profusamente en el estudio sistemático de donantes de sangre y resultan más sensibles y específicos que las pruebas de generaciones anteriores.11,12
La eficacia del cribado de donantes de sangre mediante ELISA-3 es prácticamente del 100 % para prevenir la transmisión del VHC a los receptores. Sin embargo, hay dos situaciones en las que las pruebas con anticuerpos pueden no detectar la infección por el VHC. En primer lugar, la presencia de anti-VHC puede llegar a demorarse hasta 6 meses tras la infección primaria, con un período medio entre infección y presencia de anticuerpos detectables de 12 semanas. En segundo lugar, los pacientes inmunodeprimidos (p. ej., receptores de trasplante renal) ocasionalmente sufren la infección por VHC sin anticuerpos detectables; en tales casos es necesaria la reacción en cadena de la polimerasa (RCP) del ADNc del VHC (RCP-ADNc VHC) para detectar la infección. Incluso con una especificidad tan alta (99,7 %) por parte del ELISA-3 anti-VHC, son frecuentes resultados falsos positivos entre los donantes de sangre.12 El valor predictivo positivo de la prueba depende de la prevalencia en la población de donantes, que es muy baja. La reactividad ELISA anti-VHC debería confirmarse mediante análisis suplementarios.
PRUEBAS DE CONFIRMACION
Para la confirmación de resultados positivos en las pruebas ELISA anti-VHC se han obtenido análisis de immunoblot recombinantes (RIBA,Chiron) y análisis con péptidos sintéticos. Los antígenos de VHC se aplican separadamente en tiras de nitrocelulosa y, tras su incubación con suero del paciente, se hacen visibles los patrones de reconocimiento de los anticuerpos anti-VHC. En el sistema RIBA de tercera generación (RIBA-3), profusamente utilizado en Europa, hay péptidos sintéticos a partir del core y las regiones NS4 y antígenos recombinantes de las regiones NS3 y NS5 (figura 3). La preparación con antígenos VHC difiere entre los fabricantes de análisis suplementarios, lo cual, en el caso de antígenos NS3, es importante reconstituir los epítopos conformacionales. La reconstitución óptima del antígeno C33 (derivado NS3) aumenta la sensibilidad del sistema RIBA-3 en comparación con la generación anterior.11 Los resultados del RIBA generalmente se interpretan como positivos cuando se detectan anticuerpos frente a antígenos de más de una región VHC. Un alto porcentaje (75-80 %) de tales personas RIBA-3 positivas sufren viremia, detectada por la RCP-ADNc VHC. Las personas RIBA-3 positivas pero RCP-ADNc VHC negativas pueden haber eliminado el virus de la circulación tras la infección previa, su viremia puede que se halle por debajo del nivel de detección de la RCP o, meramente, representan una reactividad falso positiva de los anticuerpos anti-VHC. La presencia de resultados RCP-ADNc VHC negativos en suero de personas RIBA anti-VHC positivas se correlaciona con la ausencia de inflamación en las muestras de biopsia hepática; esta observación probablemente indica la eliminación del virus.13 Sin embargo, en pacientes con hepatitis C tratados con agentes antivirales, puede reaparecer la viremia por VHC tras un período RCP-ADNc negativo; en tales casos, el ADN del VHC debe haber persistido por debajo del nivel de detección de la RCP-ADNc VHC, o el virus tiene que haber sido secuestrado en compartimientos no sanguíneos. La mayoría de donantes de sangre RIBA-3 positivos, RCP-ADNc VHC negativos, tienen un factor de riesgo para la exposición parenteral al VHC, de forma que la positividad del RIBA-3 en tales casos probablemente represente una verdadera infección VHC más que una reactividad inespecífica.14
FIGURA 3. Antígenos codificados por el VHC expresados con fines diagnósticos y para detección de anticuerpos anti-VHC.
Antígeno codificados por el VHC utilizados para la detección de anticuerpos anti-VHC en las pruebas de anticuerpos de primera (1), segunda (2) y tercera (3) generaciones.
La reactividad de los anticuerpos anti-VHC a menudo se limita a uno de los antígenos VHC en los análisis de confirmación. Tales patrones se interpretan como indeterminados y pueden representar la unión IgG inespecífica, una infección (RCP negativa) resuelta, o una viremia actual. Entre los donantes de sangre sanos, los resultados RIBA indeterminados, especialmente el RIBA-2, suelen indicar reactividad inespecífica; el RIBA-3 es más específico, de forma que ha disminuido notablemente el número de resultados indeterminados en las pruebas RIBA.14 Durante el período inicial de la infección aguda por VHC con respuesta cada vez mayor de los anticuerpos, existe una reactividad RIBA anti-VHC ocasionalmente débil o indeterminada. Rara vez los pacientes son RCP-ADNc VHC positivos pero RIBA indeterminados durante mucho tiempo. Por tanto, las pruebas con resultados RIBA indeterminados deberían ser confirmadas de nuevo mediante RCP-ADNc VHC. Los patrones de reconocimiento anti-VHC para distinguir antígenos VHC en el RIBA posiblemente carezcan de valor pronóstico con respecto a la severidad de la enfermedad, o para la futura desaparición del virus en sangre, como se ha demostrado en un estudio de seguimiento de hepatitis C relacionada con transfusión.8 Se han evaluado pruebas con anticuerpos anti-VHC IgM frente a proteínas del core pero no tienen valor adicional en el diagnóstico de la infección aguda por VHC.
DETECCIÓN DEL VIRUS
A la vista de las limitaciones de los análisis con anticuerpos anti-VHC, suele ser necesaria la detección de viremia por VHC. Puesto que los títulos de ADN del VHC son bajos, debe amplificarse el ácido nucleico. Un protocolo estandarizado consiste en RCP tras un paso de transcriptasa inversa (T1), de esta forma se transcribe el ADN viral al ADNc.15,16
La RCP-ADNc VHC ha evolucionado desde una herramienta para investigación hasta una prueba diagnóstica ampliamente utilizada. Las aplicaciones más frecuentes son: a) confirmación de la infección por VHC en personas con resultados positivos en el RIBA e indeterminados en los anticuerpos anti-VHC; b) diagnóstico precoz en pacientes con hepatitis aguda; c) vigilancia sistemática de la transmisión perinatal, y d) seguimiento del tratamiento con agentes antivirales. Ajustar la técnica de la RCP con fines diagnósticos ha demostrado ser difícil (un panel europeo para la cualificación reveló que sólo el 16 % de los laboratorios lograban resultados fidedignos en la RCP-ADNc VHC).17 La RCP puede emplearse para detectar ADN del VHC en muestras de biopsia hepática así como en suero, y la presencia de RCP-ADNc VHC negativa en suero se correlaciona con la ausencia de ADN del VHC hepático. El análisis de amplificación de plantilla, como la RCP, se destina al cálculo semicuantitativo de la sobrecarga viral en infectados; tales cálculos son importantes para supervisar el tratamiento antiviral. Una carga viral elevada se correlaciona con un mayor número de anomalías histológicas en la muestra de biopsia hepática.18
Para la detección cuantitativa de ADN del VHC se recurre a dos adaptaciones de la RCP-ADNc VHC; a) análisis de dilución limitada, y b) mediación de la concentración de VHC mediante coamplificación del ADN diana mutado sintéticamente. Otro método más preciso se basa en amplificación de señal en un ensayo de hibridación con moléculas de ADN ramificado (ADNb) (Chiron), lo que proporciona una correlación lineal entre la señal de la prueba y el título de virus en un intervalo de 3-4 logs.18 Sin embargo, en análisis con ADNb es aproximadamente 3 logs menos sensible que la RCP-ADNc: el análisis con ADNb del VHC sólo detecta el 70 % de las muestras RCP-ADNc VHC positivas. La importancia cada vez mayor de la detección del ácido nucleico del VHC para el diagnóstico demanda una calidad asegurada y su estandarización; ello se logra más fácilmente comercializando tales análisis. Hace poco se ha introducido en el mercado un ensayo de RCP de VHC con una enzima única para transcripción inversa y polimerización del ADN con resultados prometedores.19 Entre otros métodos figura la reacción en cadena a la ligasa, y el análisis de amplificación basado en ácido nucleico isotérmico autosostenido.
RESULTADOS DE LA AMINOTRANSFERASA
La evaluación clínica de la hepatitis C incluye las determinaciones séricas de aminotransferasa. La hepatitis NANB(C) crónica se caracteriza por un aumento o fluctuación en las concentraciones de alanino aminotransferasa (ALT) o incrementos marginales prolongados de la misma. En el 60 % de las personas con infección por VHC los valores de ALT son normales en estudios transversales y la mayor parte (80 %) de personas asintomáticas con viremia por VHC y valores normales de ALT sufren una hepatitis crónica persistente, a veces crónica activa con o sin cirrosis.20 Por tanto, un resultado normal de ALT en pacientes con infección por VHC se considera de valor diagnóstico limitado.
GENOTIPOS DEL VHC
La distinción entre genotipos del VHC es importante, puesto que la evolución de la enfermedad por VHC y la respuesta al tratamiento antiviral con interferón se correlacionan con el tipo de VHC. El genotipo 1, especialmente subtipo 1b, se ha asociado con hepatopatía crónica más severa, pero con respuesta al tratamiento con interferón.7,21 Finalmente, permite estudiar con análisis de secuencia más detallado la transmisión del VHC, entre personas.
EPIDEMIOLOGÍA, TRANSMISIÓN Y PREVENCIÓN
El VHC se detecta en todo el mundo con prevalencias relativamente altas en Japón, sur de los EE.UU., países europeos de la cuenca mediterránea, África y Oriente Medio, donde el 0,5-1,5 % de los donantes de sangre son anti-VHC positivos. En la Europa del norte, el norte de los EE.UU. y Canadá las prevalencias entre los donantes de sangre son del 0,01-0,05 %. La principal vía de transmisión es la parenteral, de forma que la mayoría de las personas con infección VHC son adictos a drogas parenterales (incluyendo aquellas con drogadicción sólo ocasional) o receptores de productos sanguíneos que en el pasado no se habían sometido a cribado para anti-VHC.22 El cribado de donantes de sangre para anti-VHC mediante análisis de segunda y tercera generaciones ha eliminado prácticamente la hepatitis C postransfusional. Antes de la introducción del cribado de los donantes de sangre y los modernos métodos de inactivación para productos plasmáticos almacenados, casi el 100 % de los pacientes con hemofilia contraían la infección VHC debido a la probable contaminación de todos los concentrados plasmáticos sometidos bien a tratamiento con calor, bien a inactivación química (disolvente-detergente), o bien a ambos, no producen infección por VHC.
Entre otros factores de riesgo por vía parenteral figuran los tatuajes y las punciones accidentales en los profesionales del área sanitaria. Se produce transmisión del VHC a partir de pacientes con viremia en un 3-10 % de los casos de punción accidental. No disponemos de medidas interventivas con inmunización pasiva anti-VHC, y no existen datos sobre la idoneidad del tratamiento precoz con interferón en tales casos. En algunos congresos se han presentado los resultados preliminares sobre vacunación y estudios de provocación mediante estructura de la cubierta del VHC recombinante efectuados en chimpancés, y se ha demostrado cierto efecto protector frente a dosis infecciosas bajas del VHC. Sin embargo, puesto que la infección por VHC supera la respuesta inmune normal y la reinfección acontece en presencia de anticuerpos,10 queda por ver si es factible la inmunización activa o pasiva. Los pacientes sometidos a hemodiálisis pueden haber adquirido el VHC en el pasado no sólo por la vía de la transfusión sanguínea sino también por el propio procedimiento de diálisis. Por consiguiente, resultan apropiadas las medidas para prevenir la transmisión del VHC en las unidades de diálisis.
Los casos de hepatitis C sin evidencia de exposición por vía parenteral se denominan "esporádicos". La transmisión parenteral encubierta mediante agujas y jeringas mal esterilizadas en los años cincuenta y sesenta, y las prácticas de aspiración de sangre en la medicina popular, pueden haber tenido un papel en el pasado, al explicar casos agrupados de infección por VHC en ciudades altamente endémicas de Japón. La diseminación intrafamiliar no está demostrada, aunque la transmisión madre-hijo tiene lugar en el 10 % de las madres ARN del VHC positivas, fundamentalmente cuando los títulos del virus maternos son altos.24 La transmisión sexual del VHC probablemente es rara o esté ausente. En 2 estudios de zonas con baja prevalencia en un total de 92 casos índice RCP-ADNc VHC positivos no se hallaron pruebas de transmisión del VHC a las parejas.25,26 En Japón, en un estudio similar con 154 casos índice, el 16 % de las parejas eran ARN VHC positivos con el mismo genotipo que los casos índice.27 Puede haber factores de confusión en zonas altamente endémicas como Japón: a) en el estudio japonés, no se detectó el VHC en parejas de casos índice durante menos de 10 años, y b) la infección en las parejas se asoció a una mayor duración del matrimonio y, por tanto, a la edad. Tales parejas pudieran haber estado expuestas a los mismos materiales no estériles décadas antes.
CURSO NATURAL Y MANIFESTACIONES CLÍNICAS
La presentación clínica aguda de la hepatitis C se ha documentado principalmente en casos asociados a transfusión en los que el período medio de incubación desde la transfusión al primer incremento de la ALT es de 6-8 semanas (límites, 2-26 semanas). La hepatitis C aguda da síntomas en una minoría de los casos, y la norma es que el curso clínico sea leve. Sólo el 10 % de los pacientes presentan ictericia y, si bien la hepatitis C fulminante ha sido descrita previamente en pacientes con HNANB, en la mayoría de los casos se demostró posteriormente su falta de relación con el VHC.
Las principales consecuencias del VHC se relacionan con la infección crónica. La infección persiste en casi el 80 % de los casos, y generalmente da lugar a una hepatitis crónica persistente o a una crónica activa.20 Los datos agrupados de estudios de seguimiento sobre pacientes con HNANB que posteriormente fueron diagnosticados como hepatitis C demostraron que el 20-30 % desarrollaron cirrosis. La infección por el VHC se asocia a carcinoma hepatocelular (CHC); la incidencia de CHC entre personas infectadas por el VHC probablemente sea baja y difícil de determinar de forma precisa.28 El análisis retrospectivo de 21 receptores de transfusión con CHC asociado al VHC en Japón demostró la progresión a hepatitis crónica, cirrosis y CHC tras un intervalo medio de 10, 19 y 29 años postransfusión, respectivamente.29 La progresión hacia la cirrosis en personas infectadas por el VHC probablemente esté fomentada en presencia de otros factores de riesgo como la coinfección por el virus de la hepatitis B o el de la inmunodeficiencia humana, o agentes hepatotóxicos como el alcohol. Se desconoce si el riesgo de progresión hacia el CHC está influenciado por diferencias en la virulencia de los tipos de VHC. Comunicaciones recientes sobre la persistencia de la infección por VHC y la cronicidad de la hepatopatía asociada dibujan un cuadro más pesimista que el de estudios anteriores en pacientes con HNANB crónica, cuando la determinación de ALT era el único método de seguimiento. Estudios anteriores sobre la que después se designaría como HNANB indicaron que las concentraciones de ALT se normalizarían en el 50 % de los pacientes; el 50 % restante se suponía que sufría una hepatitis crónica. Sin embargo, los análisis de ARN-VHC y el estudio histológico de muestras de biopsia hepática demostraron que las concentraciones normales de ALT encubrían la infección persistente por VHC con hepatitis en curso y progresión a cirrosis. La infección por VHC puede acompañarse también de fenómenos auto-inmunes; por ejemplo, anticuerpos que reaccionan con epítopos de las fracciones microscópicas hígado/riñón (HRM). La reactividad anti-HRM-1 en la hepatitis autoinmune tipo-2 se asocia a infección por el VHC.30 La infección por el VHC se asocia también a la crioglobulinemia mixta tipo II, vasculitis, manifestaciones cutáneas y glomerulonefritis.31
TRATAMIENTO
El tratamiento con interferón alfa (un agente antiviral e inmunomodulador), estudiado en primer lugar por Hoofnagle en 1986, puso de manifiesto una sustancial normalización de las concentraciones de ALT en algunos pacientes con HNANB crónica tratados con dosis decrecientes de interferón durante un período de un año. Desde el punto de vista histológico, más tarde se comprobó que la respuesta al tratamiento mejoraba cuando se empleaban tres dosis semanales de 3-6 MU de interferón alfa. La tasa de respuesta completa al interferón, definida como el porcentaje de pacientes cuyo nivel de ALT se normalizaba tras 6 meses de tratamiento, fue del 50 % según datos agrupados de estudios prospectivos controlados.32 En estos estudios tuvo lugar una respuesta mantenida (es decir, porcentaje de pacientes con ALT normal a los 6 meses de suspender el tratamiento) en casi el 25 % de los casos. La normalización de la ALT fue independientemente de la dosis (1-6 MU, dos-tres veces por semana) y de la duración del tratamiento con interferón (6-12 meses).
Cuando pudo disponerse de RCP--ADNc VHC, el efecto del tratamiento con interferón sobre la viremia debida a VHC pudo supervisarse de forma más directa. Los datos de 6 ensayos controlados con vigilancia mediante RCP-ADNc VHC demostraron una respuesta completa en cerca del 50 % de los pacientes y una respuesta mantenida (ARN del VHC todavía negativo a los 6 meses del cese del tratamiento) en casi el 15-25 % de los casos. Por tanto, las tasas de respuesta global no variaron significativamente al medirse mediante RCP-ADNc VHC o ALT. Sin embargo, los casos que respondieron bien con normalización de la ALT o con desaparición del ARN del VHC no son necesariamente las mismas personas.33 La positividad renovada al ARN del VHC puede ser un indicador más sensible de recidiva tras el tratamiento con interferón que un incremento de la ALT. La ausencia de ARN del VHC se correlaciona mejor con una mejora en las características histológicas hepáticas que la normalización en la ALT. No obstante, los resultados RCP-ADNc VHC negativos no siempre indican eliminación viral, puesto que el virus puede persistir en el hígado, zonas extrahepáticas,9 o en el plasma, por debajo del nivel de detección de la RCP-ADNc VHC.33 En general, la duración prolongada de la infección VHC, la edad avanzada, el desarrollo de hepatitis crónica activa o cirrosis más que hepatitis crónica persistente, la presencia de VHC tipo 1b, y una sobrecarga de virus alta al inicio del tratamiento son factores predictivos de una respuesta menos favorable al interferón.
¿El tratamiento con interferón en el estadio precoz o agudo de la enfermedad previene la progresión a hepatitis crónica? Dos estudios demostraron resultados prometedores en términos de normalización mantenida de ALT y ausencia de ARN del VHC a los 3 años de cesar el tratamiento, así como la normalización o la mejoría de las características histológicas en algunos pacientes. Estos alentadores hallazgos no fueron confirmados en un tercer estudio. Los pacientes tratados con interferón pueden experimentar efectos colaterales molestos12 (es decir, síntomas seudogripales sobre todo al inicio del tratamiento, leucopenia y trombocitopenia; síndromes psiquiátricos a menudo con depresión, y fenómenos autoinmunes con hipo o hipertiroidismo). Tales efectos colaterales son reversibles al cesar el tratamiento con interferón y en parte están relacionados con la dosis.
No ha habido estudios controlados sobre la prevención de la cirrosis o del CHC mediante interferón u otros agentes antivirales. Estas dos complicaciones de la infección por VHC son el principal problema ya que la propia hepatitis C crónica suele ser asintomática. Por tanto, cabe preguntarse si los efectos colaterales y los costes se equiparan a los beneficios del interferón.
La ribavarina, un análogo de la guanosina administrado por vía oral, normalizará las concentraciones de ALT en la mayoría de pacientes con hepatitis C pero el ARN del VHC sigue siendo detectable durante y después del tratamiento. Cuando se suspende el tratamiento con ribavarina, las concentraciones de ALT se alteran de nuevo, y el estudio histológico del tejido hepático muestra escasa o nula mejoría.34 El tratamiento combinado (interferón con ribavarina) es objeto de estudio y puede ser más eficaz para eliminar la viremia. La hepatitis crónica en estadio final con cirrosis descompensada es una indicación de trasplante hepático. Aunque el injerto habitualmente sufre la infección por el VHC poco después del trasplante, la hepatitis leve (histológica) acompañante no menoscaba la supervivencia tras el trasplante.35
REFERENCIAS BIBLIOGRÁFICAS
- Choo Q-L, Kuo G, Weiner AJ et al. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science 1989;244:359-362.
- Houghton M, Weiner AJ, Han J et al. Molecular biology of the hepatitis C viruses: implications for diagnosis, development and control of viral disease. Hepatology 1991;14:383-388.
- Grakoui A, Wychowski C, Lin C et al. Expression and identification of hepatitis C virus polyprotein cleavage products. J Virol 1993;67:1.385-1.395.
- Weiner AJ, Geysen HM, Christopherson C et al. Evidence for immune selection of hepatitis C virus (HCV) putative envelope glycoprotein variants: potential role in chronic HVC infection. Proc Natl Acad Sci USA 1992;89:3.468-3.472.
- Simmonds P, Alberti A, Alter HJ et al. A proposed system for the nomenclature of hepatitis C viral genomes. Hepatology 1994;19:1.321-1.324.
- Bukh J, Purcell RH, Miller RH. At least 12 genotypes of hepatitis C virus predicted by sequence analysis of the putative. El gene of isolates collected worldwide. Proc Natl Acad Sci USA 1993;90:8.234-8.238.
- McOmish F, Yap PL, Dow BC et al. Geographical distribution of hepatitis C virus genotypes in blood donors: an international collaborative survey. J Clin Microbiol 1994;32:884-892.
- Van der Poel CL, Cuypers HTM, Reesink HW et al. Confirmation of hepatitis C virus infection by second generation four-antigen recombinant immunoblot assay and polymerase chain reaction. Lancet 1991;337:317-319.
- Shimizu YK, Iwamoto A, Hijikata M et al. Evidence for in vitro replication of hepatitis C virus genome in a human T-cell line. Proc Natl Acad Sci USA 1992;89:5.477-5.481.
- Lai ME, Mazzoleni AP, Argiolu F et al. Hepatitis C virus in multiple episodes of acute hepatitis in polytransfused thalassaemic children. Lancet 1994;343:388-390.
- Courouce AM, Bouchardeau F, Girault A et al. Significance of NS3 and NS5 antigens in screening for HCV antibody. Lancet 1994;343:853-854.
- Busch MP, Tobler LH, Francis BS et al. Re-instatement of donors who test false-positive in second-generation hepatitis C virus enzyme immunoassay should await availability of licensed third-generation tests. Transfusion 1994;34:130-134.
- Alberti A, Morsica G, Chemello L et al. Hepatitis C viraemia and liver disease in symptom-free individuals with anti-HCV. Lancet 1992;340:697-698.
- Zaaijer HL, Vrielink H, Van der Poel CL et al. New immunoblot resolves indeterminate results for antibody to hepatitis C virus. Transfusion 1994;34:184.
- Weiner AJ. Kuo G, Bradley DW et al. Detection of hepatitis C viral sequences in non-A, non-B hepatitis. Lancet 1990;335:1-3.
- Bukh J, Purcell RH, Miller RH. Importance of primers selection for the detection of hepatitis C virus RNA with the polymerase chain reaction assay. Proc Natl Acad Sci USA 1992;89:187-191.
- Zaaijer HL, Cuypers HTM, Reesink HW et al. Reliability of polymerase chain reaction for detection of hepatitis C virus. Lancet 1993;341:722-724.
- Lau JYN, Davis GL, Kniffen J et al. Significance of hepatitis C virus RNA levels in chronic hepatitis C. Lancet 1993;341:1.501-1.504.
- Tilston P, Morris DJ, Klapper PE et al. Commercial assay for hepatitis C virus RNA. Lancet 1994;344:201-202.
- Esteban JI, López-Talavera JC, Genesca J et al. High rate of infectivity and liver disease in blood donors with antibodies to hepatitis C virus. Ann Intern Med 1991;115:443-449.
- Yoshioka K, Kakumu S, Wakita T et al. Detection of hepatitis C virus by polymerase chain reaction and response to interferon-alpha therapy: relationship to genotypes of hepatitis C virus. Hepatology 1992;16:293-299.
- Van der Poel CL, Cuypers HTM, Reesink HW et al. Risk factors in HCV infected blood donors. Transfusion 1991;31:777-779.
- Makris M, Garson JA, Ring CJA et al. Hepatitis C viral RNA clotting factor concentrates and the development of hepatitis in recipientes. Blood 1993;81:1.898-1.902.
- Ohto H, Terazawa S, Sasaki N et al. Transmission of hepatitis C virus from mothers to infants. N Engl J Med 1994;330:744-750.
- Bresters D, Mauser-Buschoten EP, Reesink HW et al. Sexual transmission of hepatitis C virus. Lancet 1993;342:210-211.
- Gordon SC, Patel AH, Kulesza GW et al. Lack of evidence for the heterosexual transmission of hepatitis C. Am J Gastroentrol 1992;87:1.840-1.851.
- Akahane Y, Kojima M. Sugai Y et al. Hepatitis C virus infection in spouses of patients with type C chronic liver disease. Ann Intern Med 1994;120:748-752.
- Tsukuma H, Hiyama T, Tanaka S et al. Risk factors for hepatocellular carcinoma among patients with chronic liver disease. N Engl J Med 1993;328:1.797-1.801.
- Kiyosawa K, Soderyama T, Tanaka E et al. Interrelationship of blood transfusion, non-A, non-B hepatitis and hepatocellular carcinoma: analysis by detection of antibody to hepatitis C virus. Hepatology 1990;12:671-675.
- Michel G, Ritter A, Gerken G et al. Anti-GOR and hepatitis C virus in autoimmune liver diseases. Lancet 1992;339:267-269.
- Marcellin P, Descamps V, Martinot-Piegnoux M et al. Cryoglobulinemia with vasculitis associated with hepatitis C virus infection. Gastroenterology 1993;104:272-277.
- Bresters D. Hepatitis C treatment. En: Reesink HW, editor. Current studies in haematology and blood transfusion: hepatitis C virus. Basilea: Karger, 1994;121-136.
- Hagiwara H, Hayashi N, Mita E et al. Quantitative analysis of hepatitis C virus RNA in serum during interferon alfa therapy. Gastroenterology 1993;104:877-883.
- Di Bisceglie AM, Shindo M, Fong T-L et al. A pilot study of ribavirin therapy for chronic hepatitis C. Hepatology 1992;16:649-654.
- Feray C, Samuel D, Thiers V et al. Re-infection of liver graft by hepatitis C virus after liver transplantation. J Clin Invest 1992;89:1.361-1.365.