Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.41 n.6 Ciudad de la Habana nov.-dic. 2002
Hospital Clinicoquirúrgico "Abel Santamaría Cuadrado"
Pinar del Río
Estrés oxidativo e infarto agudo del miocardio
Dr. Ariel E. Delgado Rodríguez,1 Dr. José Luis Fernández González,2 Dr. Carlos Brown Sotolongo,1 Dr. Oleg A. León Pimentel,3 Dra. Heydi Flores Podadera4 y Dr. Rafael A. García Portela5
Resumen
Se realizó un estudio prospectivo, longitudinal y descriptivo desde el 1 septiembre del 2000 al 29 de junio del 2002, en el Hospital Clinicoquirúrgico "Abel Santamaría" de Pinar del Río, para conocer el comportamiento del estrés oxidativo en pacientes con infarto agudo del miocardio, que recibían tratamiento trombolítico con estreptoquinasa recombinante. Se conformó una muestra con 70 individuos, subdivididos en un primer grupo de estudio de 35 sujetos con edad mayor de 40 años, fumadores, que presentaban al menos otro factor de riesgo coronario mayor asociado, y que no padecían enfermedades crónicas, excepto hipertensión arterial; y un segundo grupo, de 35 pacientes con similares características, seleccionados de un universo de 155 enfermos recibidos en la Unidad de Emergencias, con diagnóstico confirmado de infarto agudo del miocardio. Se aplicaron las pruebas de hipótesis de proporciones y diferencia entre medias. Se estudiaron los valores de malonildialdehído, catalasa y superóxido dismutasa en ambos grupos. Se comprobó que los valores de los marcadores de estrés oxidativo se elevaron significativamente en los infartados, tanto en el período pretrombolítico como en el postrombolítico. Se demostró que existía correlación significativa entre la presentación de disritmias ventriculares en el período postrombolítico inmediato y la elevación de los valores de los marcadores de estrés oxidativo.
DeCS: ESTRES OXIDATIVO; INFARTO DEL MIOCARDIO/diagnóstico; RADICALES LIBRES; ANTIOXIDANTES/uso terapéutico; CATALASA/uso terapéutico; REPERFUSION MIOCARDICA; SUPEROXIDO DISMUTASA/uso terapéutico.
El estrés oxidativo es un proceso de daño celular desencadenado por radicales libres, principalmente de oxígeno, que puede afectar uno o varios componentes de la célula (proteínas, carbohidratos, lípidos y ácidos nucleicos), lo cual altera seriamente sus funciones.1,2 En los últimos años, cada vez con más frecuencia, se asocia este proceso a los mecanismos patogénicos de diferentes enfermedades (diabetes mellitus, artritis reumatoidea, fibrosis pulmonar, aterosclerosis, cáncer, etcétera) y a procesos fisiológicos como el envejecimiento.2,3
Los radicales libres se definen como especies químicas (átomos, iones o moléculas), con un orbital electrónico impareado. Esto hace a la molécula muy inestable, y por lo tanto, muy reactiva. Actualmente se emplea mucho el término especie reactiva de oxígeno (ERO), teniendo en cuenta moléculas como el peróxido de hidrógeno (H2O2), que no cumplen con la definición de tener electrones impareados en el orbital más externo, pero que son precursores de especies altamente reactivas, como es el radical hidroxilo (OH).2,4,5 Durante muchos procesos bioquímicos celulares, y en condiciones fisiológicas, se producen radicales libres de oxígeno, incluso, su producción puede formar parte de mecanismos defensivos como es el caso de la producción de superóxidos en células fagocitarias.
Los organismos están dotados de un sistema enzimático formado por varias enzimas, entre ellas la superóxido dismutasa (SOD), catalasa (CAT) y glutatión peroxidasa, las cuales intervienen en la reducción de los intermediarios citotóxicos de oxígeno, entonces ocurre la reducción completa de oxígeno, que es el mecanismo fisiológico normal de defensa antioxidante. El grado de daño celular por estrés oxidativo también puede ser cuantificado fielmente por la determinación del malonildialdehído (MDA), que constituye un producto terminal de la peroxidación de lípidos de las membranas celulares.5-11
La cardiopatía isquémica en general, y el infarto agudo del miocardio (IMA) en particular, así como el fenómeno isquemia-reperfusión, constituyen procesos en cuya fisiopatología están presentes los radicales libres. Conceptualmente, el IMA se designa como la necrosis miocárdica aguda de origen isquémico, secundaria, generalmente, a la oclusión trombótica de una arteria coronaria. No solo es una enfermedad frecuente, sino altamente letal, cuya mortalidad durante la fase aguda se ha estimado entre el 20 y el 50 %.7,10,12
A pesar de las características antes descritas, la supervivencia del IMA ha logrado una espectacular mejoría ligada a la administración precoz de fármacos fibrinolíticos, que lisan el trombo oclusivo formado sobre una placa aterosclerosa fisurada o rota.13-14
Teniendo en cuenta investigaciones recientes, que demuestran la participación del estrés oxidativo en la patogenia de la cardiopatía isquémica, así como su papel en algunos procesos secundarios a la reperfusión miocárdica, es que nos hemos motivado a realizar este estudio para comprobar el grado de estrés oxidativo y su comportamiento en pacientes infartados que han recibido tratamiento trombolítico.
Métodos
Se investigó un grupo de pacientes infartados que recibieron tratamiento con medicamento trombolítico (estreptoquinasa recombinante), del 1 de septiembre del 2000 al 29 de junio del 2002, en el Hospital Clinicoquirúrgico "Abel Santamaría Cuadrado" de Pinar del Río. La muestra total estuvo compuesta por 70 pacientes, subdivididos en un primer grupo de estudio constituido por 35 individuos que reunían los siguientes requisitos: edad mayor de 40 años, fumadores de una cajetilla de cigarrillos diaria o menos, que presentaran, al menos, otro factor de riesgo coronario mayor asociado y que no padecieran ninguna enfermedad crónica, a no ser hipertensión arterial como factor de riesgo coronario; dichos individuos fueron seleccionados a partir de acompañantes de pacientes ingresados en nuestro servicio, previo consentimiento de éstos. De un universo de 155 pacientes recibidos en la Unidad de Cuidados Intensivos Emergentes (UCIE) en el período estudiado, con el criterio clínico y electrocardiográfico de infarto agudo del miocardio, se conformó el segundo grupo de estudio, constituido por 35 pacientes, que debían cumplir los mismos requisitos que el primer grupo. Los pacientes incluidos en el segundo grupo de estudio fueron tratados con estreptoquinasa recombinante de producción nacional (Heberquinasa), teniendo en cuenta los criterios siguientes:
Criterios de inclusión14
Presencia de un dolor cardíaco isquémico de más de 30 min de duración, iniciado dentro de las 12 h primeras desde el comienzo de los síntomas y acompañado de un ascenso del segmento ST mayor o igual a 1 mm en 2 o más derivaciones contiguas de los miembros, y mayor o igual a 2 mm en 2 o mas derivaciones contiguas precordiales.
Criterios absolutos de exclusión14
a) Disección aórtica.
b) Sangrado activo.
c) Pericarditis aguda.
d) Hemorragia cerebral previa.
e) Enfermedad vascular intracraneal (aneurisma, malformación arteriovenosa), neoplasia cerebral.
Criterios relativos de exclusión
a) Foco hemorrágico potencial:
- Dentro de los 6 meses anteriores:
· Hemorragia gastrointestinal o genitourinaria o accidente cerebrovascular.
- Dentro de las 2 a 4 sem anteriores:
· Cirugía mayor.
· Biopsia de órganos.
· Punción de vasos no comprimibles.
· Compresión torácica prolongada (resucitación cardiopulmonar).
· Pacientes con evidencia de trauma torácico o que permanecen inconscientes.
· Trauma grave o trauma craneal menor.
· Retinopatía diabética proliferativa.
· Hipertensión grave no controlada (sistólica mayor de 200 mmHg y/o diastó1ica mayor de 120 mmHg).
b) Embarazo.
c) Historia de diátesis hemorrágica, alteración hepática o cáncer.
El procedimiento terapéutico fue iniciado inmediatamente después del recibimiento en la UCIE, este fue llevado a cabo por personal entrenado, utilizando para ello una dosis única de 1,5 millones de unidades internacionales de heberquinasa disuelta en l00 mL de dextrosa al 5 % a pasar en 1 h, con monitoreo cardiovascular constante y supervisión de tensión arterial, frecuencia cardíaca, frecuencia respiratoria y temperatura cada 15 min; se mantuvo siempre un enfermero entrenado a la cabecera del paciente.13-15
Al primer grupo de estudio se le realizaron las determinaciones siguientes: colesterol, malonildialdehído (MDA), actividad de catalasa (CAT) y actividad de superóxido dismutasa (SOD); al segundo grupo de estudio se le realizaron 3 extracciones sanguíneas: una al momento del ingreso, donde se determinaron colesterol, glucemia, hemograma con diferencial, creatinina (para detectar otras posibles patologías asociadas), MDA, CAT y SOD; otra 30 min después de finalizado el tratamiento trombolítico, y una tercera 8 h después de dicho tratamiento, ambas para cuantificar MDA, CAT y SOD. Las muestras fueron tomadas por personal técnico del Departamento de Laboratorio Clínico del Hospital Universitario "Abel Santamaría" según normas técnicas, el plasma para la determinación se obtuvo después de centrifugarlas a 2 000 rev/min en una centrífuga refrigerada Hitachi modelo HIMAC SCR - 7BA; estas se conservaron a -20º C hasta su procesamiento, el cual se realizó por métodos espectrofotométricos, según las Normas PNT/TEC Versión 3, del Centro de Control Biológico del Instituto de Farmacia y Alimentos (IFAL), de Ciudad de La Habana; los resultados se expresaron en nmol/L. El espectrofotómetro utilizado para todas las determinaciones fue un Shimadzu UV-160 de tecnología computadorizada. Todos las determinaciones se realizaron en el laboratorio clínico del Hospital "Abel Santamaría".
Aspectos bioéticos. Consentimiento informado
A todos los pacientes se les informó los objetivos y características del estudio, y se les so1icitó por escrito su consentimiento para participarél, se les explicó que los resultados obtenidos de la investigación serían utilizados para exponerlos en eventos científicos o revistas biomédicas de reconocido prestigio y que podían retirarse en el momento en que así lo so1icitasen.
Bioestadística
Se utilizó el paquete estadístico SYSTAT, versión para WINDOWS '98, para un nivel de ajuste de a = 0,05, opciones de diferencias entre medias y test de hipótesis de proporciones. Para su mejor comprensión los resultados finales se muestran en tablas y figuras.
Resultados
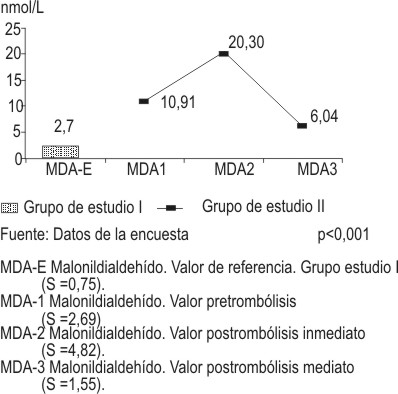
La figura 1 representa el comportamiento del malonildialdehído (MDA) en los grupos estudiados. En el primer grupo de estudio se obtuvo una media de 2,71 ± 0,75 nmol/L. En el segundo grupo se obtuvo para la determinación pretrombólisis una cifra media 5 veces superior a la anterior, lo cual demostró una diferencia estadística altamente significativa (p<0,001); en la determinación postrombólisis inmediata se observó una media que duplicaba las cifras encontradas en la primera medición realizada a los pacientes infartados, cuya diferencia estadística resultó altamente significativa (p<0,01); por último, se encontró una cifra 3 veces inferior a la anterior en la determinación realizada en el período postrombolítico mediato, pero a su vez, 3 veces superior a la dosificación obtenida en el grupo control, diferencias estas que resultaron ser altamente significativas desde el punto de vista estadístico (p<0,01).
FIG. 1. Comportamiento del malonildialdehído.
Fuente: Datos de la encuesta. p<0,001.
MDA-E: Malonildialdehído. Valor de referencia. Grupo estudio I (S = 0,75).
MDA-1: Malonildialdehído. Valor pretrombólisis (S = 2,69).
MDA-2: Malonildialdehído. Valor postrombólisis inmediato (S = 4,82).
MDA-3: Malonildialdehído. Valor postrombólisis mediato (S = 1,55).
La figura 2 representa el comportamiento de la actividad de la enzima catalasa, para el primer grupo de estudio se obtuvo un valor de 66,00 ± 2,79 nmol/L; en el segundo grupo de estudio, la primera muestra arrojó una cifra 12 veces mayor que la anterior, la diferencia estadística fue altamente significativa (p<0,001); la extracción realizada 30 min después de la trombólisis mostró niveles de actividad enzimática de 1 167,69 ± 65,75 nmol/L, estos últimos valores superan una vez y media al obtenido en la extracción pretrombólisis (p<0,01); por último, se obtuvo un valor de 392,02 ± 68,40 nmol/L a las 8 h después del tratamiento trombolítico, que resultó ser casi 3 veces inferior al anterior, pero a su vez 6 veces superior al encontrado en el primer grupo de estudio (p<0,001).
FIG.2. Comportamiento de la actividad de catalasa.
Fuente: Datos de la encuesta . p<0,001.
CAT-E: Catalasa. Valor de referencia. Grupo estudio I (S = 2,79).
CAT-1: Catalasa. Valor pretrombólisis (S = 40.49).
CAT-2: Catalasa. Valor postrombólisis inmediato (S = 65,75).
CAT-3: Catalasa. Valor postrombólisis mediato (S = 68,40).
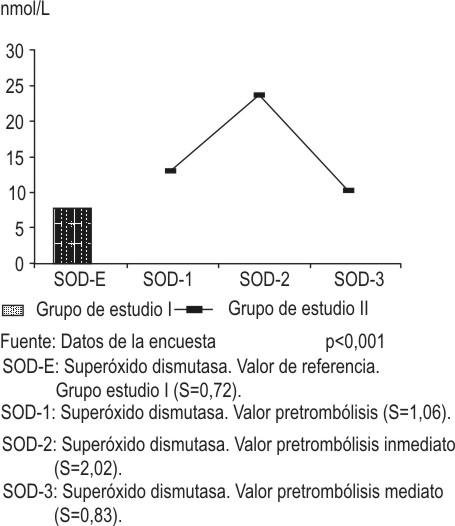
Los niveles de actividad enzimática de superóxido dismutasa son representados en la figura 3, en la cual se observa que en el primer grupo de estudio se obtuvieron medias de SOD de 8,33 ± 0,72 nmo/L. El segundo grupo de estudio alcanzó valores en su primera muestra, una vez y media por encima del primer grupo de estudio, diferencia que resultó estadísticamente significativa (p<0,0l); 30 min después del tratamiento trombolítico se reportaron valores de actividad enzimática de 23,84 ± 2,02 nmol/L, 1,7 veces superior a la anterior y casi 4 superior al primer grupo de estudio, diferencia que también resultó estadísticamente significativa; la determinación pasadas 8 h del tratamiento trombolítico, mostró valores 2,3 veces más bajos que el anterior, pero a su vez 1,2 veces por encima del valor control, diferencias estas significativas desde el punto de vista estadístico (p<0,01).
FIG. 3. Comportamiento de la actividad de superóxido dismutasa.
Fuente: Datos de la encuesta. p<0,001.
SOD-E: Superóxido dismutasa. Valor de referencia. Grupo estudio I (S = 0,72).
SOD-1: Superóxido dismutasa. Valor pretrombólisis (S = 1,06).
SOD-2: Superóxido dismutasa. Valor postrombólisis inmediato. (S =2,02).
SOD-3: Superóxido dismutasa. Valor postrombólisis mediato (S = 0,83).
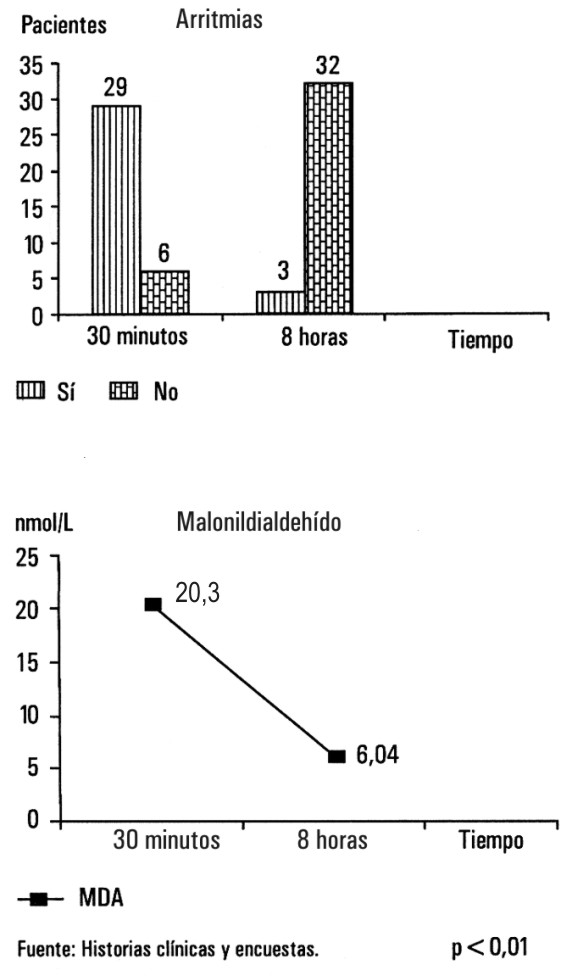
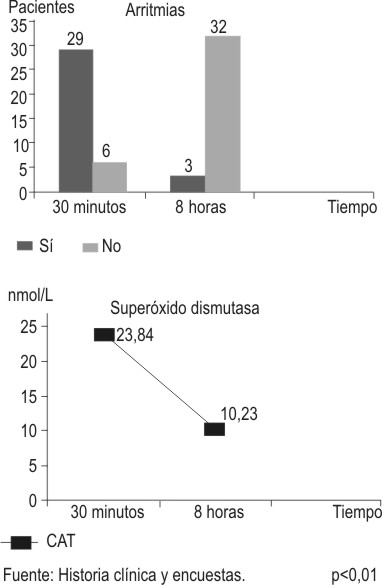
La correlación entre el estrés oxidativo y la aparición de disritmias ventriculares de reperfusión a los 30 min y 8 h después de la trombólisis se representan en las figuras 4, 5 y 6, se observa que 29 pacientes presentaron dicho trastorno del ritmo en los primeros 30 min postrombólisis, mientras que solo 3 lo tuvieron a las 8 h, las diferencias estadísticas fueron altamente significativas entre ambos (p<0,01).
FIG. 4. Correlación entre arritmias de reperfusión y niveles de malonildialdehído.
Fuente: Historias clínicas y encuestas. p<0,01.
FIG.5. Correlación entre arritmias de reperfusión y actividad de catalasa.
Fuente: Historias clínicas y encuestas. p<0,01.
FIG.6. Correlación entre arritmias de reperfusión y actividad de superóxido dismutasa.
Fuente: Historias clínicas y encuestas. p<0,01.
Discusión
Los resultados de la determinación de malonildialdehído (MDA) en los grupos estudiados coinciden plenamente con los reportados por otros autores, los cuales han demostrado que los niveles de MDA son superiores en los pacientes que sufren isquemia miocárdica con respecto a la población sana, y a su vez reportan cifras superiores del subproducto de forma inmediata tras la reperfusión efectiva; dicho fenómeno se explica desde el punto de vista bioquímico ya que en el miocardio isquémico ocurren una serie de cambios enzimáticos entre los que se destaca lo relacionado con la enzima xantino deshidrogenasa, la cual se encuentra, predominantemente, en los endotelios con la función de depurar las xantinas mediante la formación de ácido úrico; cuando dicha enzima pasa a la forma oxidada producto de la isquemia, genera anión superóxido, el cual actúa sobre las membranas celulares oxidando los lípidos a dicho nivel, fenómeno conocido, como peroxidación lipídica, que a su vez genera numerosos subproductos, muchos de ellos tóxicos, entre los cuales se encuentra el MDA, cuya determinación en tejidos, plasma u orina, es uno de los métodos principales de evaluar el estrés oxidativo. Este proceso de formación de radicales libres en condiciones fisiológicas ocurre de forma proporcional, pues es controlado por los mecanismos de defensa antioxidante presentes en el organismo.
Los componentes fundamentales de la reperfusión son: retorno del flujo, reoxigenación, aporte y extracción de metabolitos y alteraciones de la homeostasis iónica (potasio, sodio, calcio y radicales libres); este último fenómeno es el principal responsable de los niveles elevados de MDA una vez ocurrida la reperfusión pues dicho proceso provoca la incorporación a la circulación sistémica de aquellos productos y subproductos generados en la región isquémica. Los niveles de MDA retornan paulatinamente a valores próximos a la normalidad en la medida en que transcurre el tiempo, expresión esta de la estabilidad bioquímica que reaparece poco a poco en el área dañada.2,6,7,11,14,16
El comportamiento enzimático de la catalasa coincide con el reportado en otros estudios similares, en los cuales se demuestra que tras una agresión isquémica al miocardio se ponen en marcha una serie de fenómenos bioquímicos protectores que disminuyen los niveles de radicales libres producidos a ese nivel, dentro de e11os se destaca la catalasa, la cual es una metaloproteína tetramérica, cuyo peso molecular oscila entre 210 y 280 kD, el metal asociado es el hierro, y es una de las enzimas más abundantes de la naturaleza; su actividad catalítica varía en dependencia del tejido de origen y permite la rápida conversión protectora del peróxido de hidrógeno en oxígeno y agua, pues a pesar de que este no es un radical libre, tiene la capacidad de generar el radical hidroxilo en presencia de metales como el hierro. Aunque la catalasa se encuentra en concentraciones inferiores en el corazón respecto a otros tejidos, es significativo su aumento, pues se trata de la respuesta defensiva a un fenómeno bien establecido en el proceso de isquemia-reperfusión, que es la producción de radicales libres, entre los cuales se encuentra el hidroxilo generado por el peróxido de hidrógeno, sobre el cual actúa dicha enzima.2,6,7,9,11,14
En este estudio, la actividad de la SOD determinada en el plasma de los pacientes con IMA antes y después de la reperfusión, arrojó cifras superiores a las obtenidas en el primer grupo de estudio, a pesar de dicha diferencia, significativa desde el punto de vista estadístico; el movimiento en la actividad de dicha enzima fue inferior al encontrado en los otros marcadores de estrés oxidativo analizados (CAT y MDA), comportamiento que coincide con lo reportado en otras investigaciones.
En este estudio se aprecia claramente una estrecha relación entre el pico máximo de los marcadores para estrés oxidativo y la mayor incidencia de arritmias de reperfusión, lo cual coincide con lo reportado en otras investigaciones.14,15 Las arritmias cardíacas que aparecen después del infarto miocárdico agudo han sido estudiadas por numerosos investigadores; solo hacia la década de los 80 es que se le ha dedicado gran interés a las arritmias ventriculares que se producen después de la reperfusión de una arteria coronaria previamente ocluida, por la posibilidad de que este tipo de arritmia pueda llevar a la muerte a pacientes en los que se provoca la liberación de un espasmo coronario o a la lisis de un trombo coronario. Las arritmias que aparecen después de la recirculación sanguínea de una arteria coronaria previamente ocluida, tienen una gran importancia clínica, y al parecer, los mecanismos que condicionan estas arritmias por reperfusión, difieren de los asociados a las arritmias ventriculares por oclusión coronaria. Los radicales libres de oxígeno desempeñan un importante papel en la génesis de dichas arritmias, son considerados mediadores de las alteraciones potencialmente arritmogénicas capaces de alterar las propiedades eléctricas de las células miocárdicas, traen consigo una serie de cambios a dicho nivel entre los que se encuentran la despolarización del potencial de membrana en reposo y la baja duración de la recuperación del potencial de acción, lo cual favorece la aparición de potenciales de acción prematuros; por otro lado ocurre la lipoperoxidación de las membranas celulares, con liberación de compuestos cardiactivos y reducción de la concentración de adenosín trifosfato (ATP), lo que provoca un aumento de los niveles de calcio en las fibras miocárdicas, responsable de los cambios en la contractilidad que traen consigo el fenómeno conocido como stone heart, además de aparición de arritmias. Se ha llegado a plantear que la reperfusión no es siempre beneficiosa al miocardio isquémico, en la actualidad es considerada como la "espada de doble filo de la cardiología moderna."16
Se concluye que los marcadores de estrés oxidativo mostraron sus valores más elevados en el período postrombolítico, el pico máximo se obtuvo en la determinación postrombolítica inmediata, que mostró una diferencia estadística altamente significativa con respecto a las determinaciones pretrombolítica y postrombolítica mediata, respectivamente. Se demostró una significativa correlación entre la aparición de disritmias ventriculares de reperfusión en el período postrombolítico inmediato y el incremento de los marcadores de estrés oxidativo (MDA, CAT y SOD).
Summary
A prospective, longitudinal and descriptive study was conducted at "Abel Santamaría" Clinical and Surgical Hospital of Pinar del Río, from September 1st, 2000, to June 29th, 2002, aimed at knowing the behavior of oxidative stress in patient with acute myocardial infarction that were receiving thrombolytic treatment with recombinant streptokinase. A sample composed of 70 individuals was subdivided into a first study group of 35 subjects over 40, smokers, who presented at least another major associated coronary risk factor and had no chronic diseases, excepting arterial hypertension. The second group was made up of 35 patients with similar characteristics and was selected from a total of 155 patients admitted at the Emergency Unit with confirmed diagnosis of acute myocardial infarction. The values of malonyldialdehyde, catalase and superoxide dismutase were analyzed in both groups. It was proved that the values of the markers of oxidative stress increased significantly among the patients suffering from an infarction both, in the prethrombolytic and in the postthrombolytic period. It was demonstrated the existence of a significant correlation between the presentation of ventricular dysrhythmias in the immediate postthrombolytic period and the elevation of the values of the oxidative stress markers.
Subject headings: OXIDATIVE STRESS; MYOCARDIAL INFARCTION/diagnosis; FREE RADICALS; ANTIOXIDANTS/therapeutic use; CATALASE/therapeutic use; MYOCARDIAL REPERFUSION; SUPEROXIDO DISMUTASE/therapeutic use.
Referencias bibliográficas
- Kalra J, Martha S, Prasad K. Oxigen free-radicals: key factors in clinical disease. Lab Med Int 1994;11(2):16-21.
- Ferreira R. Estrés oxidativo y antioxidantes. Buenos Aires: Bagó; 1998.
- García JC. Especies reactivas de oxígeno: impacto médico. Ciudad de La Habana: Ed. Ciencias Médicas; 1994: 57.
- Sohal RS, Sohal BH, Orr WC. Mitochondrial superoxide and hydrogen peroxide generation, protein oxidative damage and longevity in different species of flies. Free Radic BioI Med 1995;19:499-504.
- Torrens J. Fuentes intracelulares de especies oxidantes en condiciones normales y patológicas. Antioxidantes y calidad de vida 1994;1:16-9.
- Armstrong D, Browne R. The analysis of free radicals, lipid peroxides, antioxidant enzymes and compounds related to oxidative stress. Free Radicals in Diagnostic Medicine. New York: Plenum Press;1994:43.
- Oteisa PA. Modificaci6n oxidativa de proteínas. Antioxidantes y calidad de vida 1995;2:12-20.
- Tzu-Chen Y, Kwang Liang K, Hisn Chen L. Age-dependent increase of mitochondrial DNA delations together with lipid peroxides and superoxide dismutase in human liver mitochondria. Free Radic BioI Med 1994;16:207-14.
- Orr WC, Sohal RJ. Extension of life-span by overexpression of superoxide dismutase and catalase in Drosophila melanogaster . Science 1994;263:1128-30.
- Widman S, Liang Ch, Schenk E, Hood W. Necrosis and free radical scavengers. J Cardiovasc Pharmacol 1994;24(5):694-701.
- Florence TM. The role of free radicals in disease. Aus Ophthal 1995;23:3-7.
- Reyes Salazar IS, Escobar Yandez N, Álvarez Puig N. Mortalidad por infarto agudo del miocardio en una unidad de cuidados intensivos. Rev Cubana Med 1997;36(2):112-6.
- Wang XL, Adachi T, Sim AS, Wilcken DE. Plasma extracellular superoxide dismutase levels in an Australian population with coronary artery disease. Arterioscler Thromb Vasc BioI 1998; 18(12):1915-21.
- San José JM, Vázquez de Prada JA, Pajarón A. Cardiopatía isquémica. Cardona, 1997. Barcelona: Editorial MCR; 1998. P.161-85.
- Olszewer E. Free radicals and reperfusion ischemia. Folha 1998;97(4):223-5.
- Vrbjar N, Zollner S, Haseloff RF, Pissarek M, Blasig IE. Rapping of free radicals in the reperfusion-injured heart. Limitations for pharmacological investigations. Mol Cell Biochem 1998; 186(12):107-15.
Recibido: 26 de septiembre de 2002. Aprobado: 21 de noviembre de 2002.
Dr. Ariel E. Delgado Rodríguez. Martí No. 81, San Luis, Pinar del Río, Cuba.
1 Especialista de I Grado en Medicina Interna. Diplomado en Medicina Intensiva.
2 Especialista de I Grado en Medicina Interna. Especialista de I Grado en Medicina General Integral. Diplomado en Medicina Intensiva.
3 Residente de Segundo Año en Medicina Interna.
4 Residente de Primer Año en Medicina General Integral.
5 Doctor en Ciencias Médicas. Especialista de II Grado en Medicina Interna. Profesor Consultante.