Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523versión On-line ISSN 1561-302X
Rev cubana med v.42 n.1 Ciudad de la Habana ene.-mar. 2003
Hospital Clinicoquirúrgico "Hermanos Ameijeiras"
Servicio de Hematología
Leucemias agudas en pacientes mayores de 60 años
Dra. Lidia Suárez Beyríes,1 Dr. José Carnot Uría,2 Dr. Raúl de Castro Arenas,2 Dr. Jorge Muñío Perurena,3 Dr. Carlos Martínez Hernández,4 Dra. Lisbett Suárez González1 y Dr. Guillermo Pérez Román1
Resumen
Se realizó un estudio descriptivo en 50 pacientes con leucemia aguda y edad media al momento del diagnóstico, de 66 años. Se comprobó leucemia no linfoblástica aguda en el 80 % de los casos y en el 22,5 %, antecedentes de síndrome mielodisplástico u otro trastorno hematológico. Se presentó anemia en el 88 % de los pacientes y niveles séricos elevados de deshidrogenasa láctica en el 60 %. La visceromegalia fue más frecuente en la leucemia linfoblástica aguda. No se obtuvo remisión completa en pacientes con leucemia no linfoblástica aguda y la supervivencia media fue menor de 2 meses. En la leucemia linfoblástica aguda se obtuvo el 22,5 % de remisión completa y una supervivencia media alrededor de 8 meses. Se confirmó el pronóstico desfavorable y la elevada mortalidad de los pacientes ancianos con esta enfermedad.
DeCS: LEUCEMIA NO LINFOCITICA AGUDA/diagnóstico; LEUCEMIA LINFOCITICA AGUDA/diagnóstico; ANCIANO; ANALISIS DE SUPERVIVENCIA.
La leucemia aguda (LA) es una enfermedad maligna originada en la célula progenitora hematopoyética no comprometida, o parcialmente comprometida. Se divide, según la célula de origen, en leucemia linfoblástica aguda (LLA) y leucemia no linfoblástica aguda (LNLA).1
Las células leucémicas sustituyen las células normales de la médula ósea; por lo que afectan su crecimiento y diferenciación; esto explica las principales manifestaciones de la enfermedad: anemia, infecciones como resultado de la granulocitopenia y hemorragias por la trombocitopenia. Otros síntomas menos frecuentes se producen por el acúmulo de células leucémicas en sitios extramedulares como son: piel, huesos, gónadas, senos paranasales, ganglios linfáticos, bazo, sistema nervioso central y otros.2-4
Las LA se presentan en adultos en una incidencia aproximada de 4 ´ 100 000 hab, anualmente.2-5 La LNLA representa el 80 % de las leucemias del adulto, es más frecuente en personas mayores de 60 años, prácticamente triplica la cantidad de los casos, con menos de 45 años.3,4 La LLA se encuentra en el 20 % de las leucemias del adulto, fundamentalmente en mayores de 65 años.6
Se ha tratado de establecer factores que pueden influir en el pronóstico de pacientes con leucemias agudas y sin duda, la edad ha sido identificada como uno de los más importantes. Los pacientes mayores de 60 años tienen índices de remisión y supervivencia significativamente inferiores comparados con pacientes más jóvenes.7
Durante los últimos 5 años, el conocimiento acerca de las características biológicas de los ancianos con leucemias agudas se ha enriquecido y ha permitido explicar los resultados desfavorables en este tipo de pacientes.8 En el proceso de envejecimiento ocurren cambios estructurales y funcionales que conducen a la disminución en la capacidad de reserva de muchos sistemas.9 De esta forma se producen cambios bioquímicos en las enzimas cerebrales; disfunción hepática, renal e inmunológica con aumento de las citoquinas (IL-6, IL-1B, TGF-B); disminución del flujo sanguíneo cerebral y renal; de la capacidad funcional pulmonar, de la función cardiovascular y de la capacidad visual, auditiva y olfatoria.
Estos cambios fisiológicos hacen que la terapéutica de inducción sea menos tolerada, haya mayor riesgo a las infecciones, como consecuencia de la mielosupresión prolongada y que se incremente la mortalidad relacionada con el tratamiento. La edad, por la restricción progresiva de las reservas funcionales de múltiples órganos y sistemas, puede influir en diversos aspectos de la farmacocinética de los agentes citostáticos, y provocar que el metabolismo de los agentes quimioterápicos sea más retardado e incrementen la susceptibilidad del paciente anciano a las complicaciones de los tratamientos. Además, el envejecimiento celular puede reducir la habilidad de los tejidos normales para reparar el daño molecular causado por las drogas antineoplásicas.10
Las LA en el anciano, que se originan de un síndrome mielodisplásico (SMD) u otro trastorno hematológico previamente tratado o no, son consideradas como leucemias secundarias de muy mal pronóstico, por la resistencia incrementada a la quimioterapia, probablemente en relación con la expresión de genes que confieren resistencia.8,11 Se caracterizan además por presentar anormalidades cromosómicas desfavorables y menos precursores hematopoyéticos sanos y, aunque se consiga la remisión completa es con frecuencia, a expensas de células que conservan su capacidad madurativa, pero que pertenecen al clon leucémico, esto produce la denominada remisión completa clonal que tiene más posibilidades de recaer.12
En los ancianos con LLA son más frecuentes los inmunofenotipos desfavorables así como la presencia de cromosoma Ph + o t (9,22) en el 50 % de los casos, aproximadamente; lo que implica un pronóstico adverso.13-15
A pesar del avance en los conocimientos sobre la biología de las leucemias agudas en los últimos 10-15 años, los resultados terapéuticos son en general muy desfavorables. Este estudio tiene como objetivo evaluar las características clínicas y biológicas, la respuesta terapéutica en los casos tratados y la supervivencia en un grupo de pacientes mayores de 60 años con diagnóstico de leucemia aguda atendidos en el Hospital “Hermanos Ameijeiras” entre los años 1983 y 1999.
Métodos
Se realizó un estudio descriptivo y retrospectivo que incluyó a 50 pacientes mayores de 60 años de edad, con diagnóstico de leucemia aguda. Los datos fueron obtenidos de sus historias clínicas.
Las características clínicas y biológicas evaluadas en cada caso fueron: edad, sexo, antecedentes de enfermedad hematológica, síntomas y signos al inicio de la enfermedad, presencia de esplenomegalia, hepatomegalia, adenopatías, fiebre o hemorragias al realizar el examen físico.
En el momento del diagnóstico se evaluaron cifras de hemoglobina, conteo total de leucocitos y plaquetas, valores de transaminasa glutámico-pirúvica (TGP), deshidrogenasa láctica (LDH), creatinina, porcentaje de blastos en sangre periférica y médula ósea; así como el tipo y la variedad de leucemia, según la clasificación planteada por el Grupo Cooperativo Franco-Americano-Británico (FAB).16
En relación con el tratamiento, los pacientes se agruparon teniendo en cuenta el tipo de leucemia y la conducta terapéutica. La respuesta se evaluó como:
- Remisión completa (RC): Médula osea con integridad de los 3 sistemas, menos del 5 % de blastos y ausencia de infiltración en otros órganos.
- No remisión (NR): Presencia o progresión de los parámetros iguales que en el momento del diagnóstico.
En los pacientes sometidos a inducción se determinaron los casos que fallecieron durante el tratamiento.
Las causas de muerte se consideraron relacionadas con la progresión o recurrencia de la enfermedad, con la terapéutica de inducción o con otras enfermedades intercurrentes.
La supervivencia global (SG) se tomó a partir de la fecha del diagnóstico hasta el fallecimiento o el último día de observación en el centro. Las curvas de supervivencia se calcularon por el método de Kaplan Meier.
Resultados
De los 50 pacientes estudiados, 40 (80 %) tuvieron diagnóstico de LNLA y 10 (20 %) como LLA. Las características clínicas al momento del diagnóstico se exponen en la tabla 1. En relación con el sexo, hubo 23 mujeres y 27 hombres, con una edad media de 66 años (rango de 60-86). Nueve pacientes (18 %) tenían antecedentes de SMD y otros trastornos hematológicos previos al diagnóstico y se consideró que padecían una leucemia secundaria, todos fueron diagnosticados como LNLA y representaron el 22,5 % de este tipo de leucemia.
TABLA 1. Características clínicas al momento del diagnóstico de la enfermedad
| LNLA | LLA | Total | |
| Características clínicas | (n=40) | (n=10) | (n=50) |
| Edad (años) (media/rango) | 69 / 60-86 | 64 / 60-73 | 66 /60-86 |
| Sexo (masc/fem) | 18 / 22 | 5 / 5 | 23 /27 |
| Raza [n (%)] | |||
| Blanca | 23(57,5) | 6(60) | 29(58) |
| Negra | 5 (12,5) | 4 (40) | 9 (18) |
| Mestiza | 12 (30) | (-) 12 | (24) |
| Antecedentes de SDM y trastornos hematológicos [n (%)] | 9 (22,5) | (-) | 9 (18) |
| Hepatomegalia | 11(27,5) | 7(70) | 18(36) |
| Esplenomegalia | 4(10) | 6 (60) | 10 (20) |
| Adenopatías | - | 3 (30) | 3 (6) |
| Fiebre | 9 (22,5) | 5 (50) | 14 (28) |
| Hemorragias | 6 (15) | 3 (30) | 9 (18) |
En la tabla 2 se exponen los resultados de laboratorio. En el estudio hematológico al momento del diagnóstico, 44 pacientes presentaron cifras bajas de hemoglobina, inferiores a 110 g/L;14 presentaron leucopenia y 27, leucocitosis, de los cuales, 7 con cifras superiores a 50 x 109 L.
TABLA 2. Datos de laboratorio al momento del diagnóstico de la enfermedad
| LNLA | LLA | Total | ||||
| (n = 40) | (n = 10) | (n = 50) | ||||
| Datos de laboratorio | n | (%) | n | (%) | n | (%) |
| Hemoglobina (g/L) | ||||||
| ³ 110 | 5 | (12,5) | 1 | (10) | 6 | (12) |
| < 110 | 35 | (87,5) | 9 | (90) | 44 | (88) |
| Conteo de leucocitos | ||||||
| < 5 x 109/L | 13 | (32,5) | 1 | (10) | 14 | (28) |
| ³ 5 y <10 x 109/L | 6 | (15) | 3 | (30) | 9 | (18) |
| > 10 y < 50 x 109/L | 15 | (37,5) | 5 | (50) | 20 | (40) |
| > 50 x 109/L | 6 | (15) | 1 | (10) | 7 | (14) |
| Conteo de plaquetas | ||||||
| ³ 100 x 109/L | 11 | (27,5) | 1 | (10) | 12 | (24) |
| > 20 y < 100 x 109/L | 18 | (45) | 5 | (50) | 23 | (46) |
| < 20 x 109/ L | 11 | (27,5) | 4 | (40) | 15 | (30) |
| Blastos en sangre periférica | ||||||
| < 10 % | 16 | (40) | 5 | (50) | 21 | (42) |
| > 10 % y < 50 % | 10 | (25) | 3 | (30) | 13 | (26) |
| ³ 50 % | 14 | (35) | 2 | (20) | 16 | (32) |
| Blastos en médula ósea | ||||||
| < 30 % | 2 | (5) | - | (-) | 2 | (4) |
| ³ 30 % | 38 | (95) | 10 | (100) | 48 | (96) |
| Transaminasa glutámico-pirúrica | ||||||
| < 40 U | 19 | (47,5) | 7 | (70) | 26 | (52) |
| > 40 U | 21 | (52,5) | 3 | (30) | 24 | (48) |
| Deshidrogenasa láctica | ||||||
| < 460 U | 19 | (47,5) | 1 | (10) | 20 | (40) |
| > 460 U | 21 | (52,5) | 9 | (90) | 30 | (60) |
| Creatinina | ||||||
| < 132 mmol/L | 25 | (62,5) | 9 | (90) | 34 | (68) |
| > 132 mmol/L | 15 | (37,5) | 1 | (10) | 16 | (32) |
En médula ósea, 48 pacientes (96 %) tenían más de 30 % de blastos y 2 (4 %) presentaron menos de 30 %, en un caso se trataba de LNLA variedad M3 y en el otro había una mielofibrosis importante.
En la tabla 3 se exponen las variedades morfológicas de la LNLA y LLA. Las variedades M1 y M2 fueron las más frecuentes; se presentaron en 13 pacientes (32,5 %) en cada subtipo.
TABLA 3. Variedades morfológicas de la LNLA y la LLA
| Número | (%) | |
| LNLA (n = 40) | ||
| M0 | 1 | (2,5) |
| M1 | 13 | (32,5) |
| M2 | 13 | (32,5) |
| M3 | 1 | (2,5) |
| M4 | 6 | (15) |
| M5 | 4 | (10) |
| M6 | 1 | (2,5) |
| M7 | 1 | (2,5) |
| LLA (n = 10) | ||
| L1 | 2 | (20) |
| L2 | 7 | (70) |
| L3 | 1 | (10) |
En las LNLA, se aplicó tratamiento de inducción con quimioterapia intensiva a 9 pacientes (22,5 %), 10 (25 %) fueron tratados con bajas dosis de citosar, 12 (30 %) con monoterapia oral y 9 (22,5 %) no recibieron tratamiento quimioterápico. No se logró remisión en ninguno de los pacientes con los diferentes esquemas. En la LLA, se empleó la quimioterapia intensiva en 9 enfermos (90 %) y 1 (10 %) recibió medidas de sostén. Se obtuvo RC en 2 casos (22,2 %).
Los resultados de la inducción con quimioterapia intensiva son expuestos en la tabla 4. Del total de pacientes tratados, 8 (44,4 %) murieron durante la inducción. Se logró RC en 2 casos (11,1 %).
TABLA 4. Resultados de la inducción con quimioterapia intensiva
| LNLA | LLA | Total | ||||
| (n=9) | (n=9) | (n=18) | ||||
| Resultados | n | (%) | n | (%) | n | (%) |
| Remisión completa | - | (-) | 2 | (22,2) | 2 | (11,1) |
| Resistencia | 5 | (55,5) | 3 | (33,3) | 8 | (44,4) |
| Muerte en inducción | 4 | (44,4) | 4 | (44,4) | 8 | (44,4) |
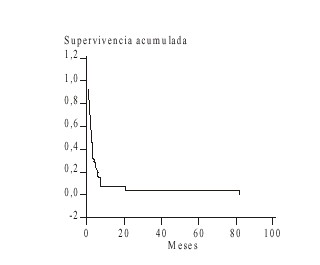
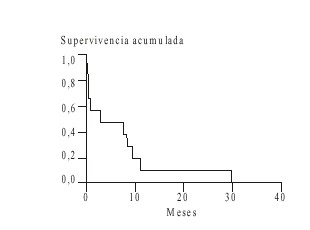
Las causas de muerte se exponen en la tabla 5 y en las figuras 1 y 2, la supervivencia. Fallecieron 49 pacientes de los 50 estudiados: 38 (77,5 %) por persistencia o recurrencia de la enfermedad y 8 (16,3 %) por complicaciones relacionadas con el tratamiento. El método de Kaplan Meier aplicado para el análisis de la supervivencia de los pacientes muestra que para los enfermos con LNLA la supervivencia media fue menor de 2 meses.
TABLA 5. Causas de muerte
| LNLA | LLA | Total | ||||
| (n=39) | (n=10) | (n=49) | ||||
| Causas de muerte | n | ( %) | n | (%) | n | (%) |
| Persistencia o recurrencia de la enfermedad | 32 | (82) | 6 | (60) | 38 | (77,5) |
| Relación directa con el tratamiento | 4 | (10,2) | 4 | (40) | 8 | (16,3) |
| Causas no relacionadas con la enfermedad | 3 | (7,6) | - | (-) | 3 | (6,1) |
FIG. 1. Supervivencia en la leucemia no linfoblástica aguda.
FIG. 2. Supervivencia en la leucemia linfoblástica aguda.
Discusión
En la actualidad existe un incremento acelerado en el número de personas ancianas. Se estima que en los próximos 5 años, la población mayor de 60 años se duplicará y de aquí la importancia de las investigaciones en los enfermos de la tercera edad.10 Diversos estudios han confirmado que la LNLA es el tipo de leucemia que predomina en el anciano,1-4 lo cual coincide con lo hallado en nuestra serie, ya que el 80 % de las LA eran de esa variedad.
En nuestro estudio, la edad media al momento del diagnóstico fue de 66 años, lo cual coincide con muchos reportes sobre pacientes mayores de 60 años con LA, en los cuales la edad media es alrededor de 64 años.7,17,18
Las características biológicas observadas en los pacientes ancianos se asocian a leucemia secundaria, con elevada incidencia de SMD u otro trastorno hematológico previo al diagnóstico y pueden tener anormalidades cromosómicas complejas y bajo índice de RC.18 En nuestro estudio, el diagnóstico de LNLA fue precedido de un SMD en el 22,5 % de los enfermos; similar al realizado por Leith y otros.19
La presencia de hepatosplenomegalia es frecuente en muchos pacientes al diagnóstico; lo cual se considera un factor adverso en el logro de los resultados del tratamiento en la LLA.2-4,6 Otros síntomas como fiebre y hemorragias son comunes para las LA y están relacionados con la producción disminuida de las células hematopoyéticas y la invasión de otros órganos por las células leucémicas.2-4 En el presente trabajo se encontraron la visceromegalia y la fiebre, con mayor frecuencia, en la LLA.
En la literatura actual sobre geriatría se reconoce la anemia como un problema común en el anciano.20,21 En el grupo de pacientes analizados, el 88 % presentó anemia, lo cual coincide con lo reportado por Walters, que observó el 92 % de casos con anemia en una serie de 78 ancianos con LA.22 Vogler y otros estudiaron 24 características clínicas en 112 pacientes mayores de 50 años y consideraron la anemia como un factor desfavorable para el logro de la remisión.23 Sebban, en 69 pacientes ancianos, observó que el 57 % tenía anemia cuando se diagnosticó la enfermedad, factor que estuvo asociado a una supervivencia global acortada.24
El conteo de leucocitos al momento del diagnóstico es un factor determinante para el logro de la remisión y de una supervivencia prolongada para todos los grupos etáreos con LA.2-4 Leith, señala que los pacientes ancianos con conteo de leucocitos por encima de 30 x 109/L tienen una duración de la remisión más corta que los casos con conteo de leucocitos más bajos.19 En nuestro estudio, el 54 % de los casos presentó leucocitosis y el 28 %, leucopenia, lo cual es similar a lo reportado por este autor.19
La trombocitopenia constituye una manifestación común en pacientes con LA.2-4 El 76 % de nuestros pacientes presentó trombocitopenia y de ellos, el 30 % con cifras inferiores a 20 x 109/L. Sebban señala que el conteo de plaquetas inferior a 50 x 109/L está significativamente asociado a una supervivencia más corta y representa un riesgo incrementado de complicaciones durante la inducción.24
En enfermos ancianos con LA, la presencia de blastos en sangre periférica tiene valor diagnóstico y para algunos autores, pronóstico.25,26 Tucker y otros estudiaron 115 pacientes mayores de 60 años e identificaron que el conteo de blastos mayor de 50 x 109/L es un factor desfavorable para la respuesta al tratamiento.27 En nuestro estudio, todos los enfermos tenían blastos en sangre periférica.
Los blastos en médula ósea se encontraron incrementados por encima de 30 % en 48 de los 50 pacientes y en 2, estaban por debajo de esa cifra. Uno correspondió a una LNLA variedad promielocítica (M3) con predominio amplio de células leucémicas en estadio de promielocitos y en el otro, la aspiración medular evidenció una pobre celularidad con escasos blastos, pero en la biopsia de médula ósea se constató mielofibrosis con focos de células blásticas e hiperplasia del sistema megacariopoyético, y los estudios se concluyeron como una variedad M7.
El deterioro de la función renal y hepática influye de forma importante en la evaluación inicial de un paciente con leucemia. Los sujetos mayores de 60 años se ven afectados en el funcionamiento de múltiples órganos y esto conduce a una mayor toxicidad con la quimioterapia utilizada, lo cual eleva la mortalidad.9 En nuestro estudio se encontró que el 32 % de los enfermos tenían niveles elevados de creatinina y el 48 %, de TGP.
Los niveles séricos de LDH en las LA del anciano han sido estudiados por diversos autores y la mayoría considera que una elevación de los mismos es un signo de mal pronóstico.25,26 Ferrara y otros, en una investigación acerca de la asociación de los niveles séricos de LDH y los resultados del tratamiento en pacientes con LNLA, demostraron que valores por encima de 400 U constituyen un factor pronóstico adverso en la respuesta al tratamiento.28 En nuestro trabajo, el 60 % de los casos tenía cifras de LDH superiores a 460 U y fue más frecuente en la LLA (90 %); un estudio similar ha sido descrito por otros autores.3
El grupo FAB ha dividido las LA sobre la base de criterios morfológicos, citoquímicos e inmunológicos con gran valor desde el punto de vista clínico y pronóstico.1,17,29 Diversos estudios han reportado que no existen diferencias en la frecuencia de las variedades de LNLA entre pacientes mayores y menores de 60 años.12,30,31 Algunos autores señalan que la variedad M1 se presenta entre el 15 y el 20 % de todas las LNLA; la M2, entre el 25 y el 30 % y la M4, entre el 20 y el 30 %; éstas son las de mayor frecuencia.2,4 Esos resultados son similares a los nuestros y esas 3 variedades fueron las que predominaron en el presente estudio. En las LLA, el 70 % correspondió al subtipo morfológico L2, lo cual coincide con lo planteado en otros estudios.3
El tratamiento de la leucemia aguda en pacientes de edad avanzada produce una elevada mortalidad por toxicidad y bajo número de RC; y cuando esta última se obtiene es de corta duración.32 Existen publicaciones que evidencian que hay discrepancias acerca de la terapéutica a elegir entre: medidas de sostén solamente, tratamiento con quimioterapia intensiva o con dosis modificadas.8,32 Diferentes reportes reflejan resultados favorables con la terapia antileucémica agresiva en la LNLA del anciano.33 Esto no coincide con nuestra observación ya que no obtuvimos RC en ninguno de los casos tratados con esta variedad de leucemia.
Según Löwenberg, prevalece actualmente la opinión de utilizar la quimioterapia intensiva en pacientes mayores de 60 años con LNLA, si biológicamente están aptos, con lo cual se logra de un 40-55 % de RC luego de 2 ciclos de quimioterapia.34 Tilly y otros en un estudio prospectivo en 87 pacientes, reportan el 52 % de RC con la aplicación de tratamiento antileucémico estándar.35 Sebban y otros realizaron un estudio retrospectivo en 69 pacientes, donde el 48 % alcanzó RC con quimioterapia intensiva, y señalaron que en la decisión del tratamiento deberían considerarse más las condiciones generales del paciente que la edad.24
Las bajas dosis de citosar utilizadas por muchos años, han resultado beneficiosas para enfermos mayores de 60 años con leucemia secundaria, en quienes la quimioterapia intensiva está contraindicada o es inefectiva.8,35 En un estudio comparativo entre la quimioterapia intensiva y las bajas dosis de citosar, realizado por Tilly y otros, no se demostraron diferencias significativas en cuanto al logro de la RC y la supervivencia global.35
La elevada mortalidad es otra característica de las leucemias en el anciano, ya que sus factores intrínsecos, anteriormente mencionados, influyen de forma significativa.8,20,34,36,37 La muerte durante la inducción ocurre en etapa temprana o en fase de hipoplasia medular posquimioterapia, y, generalmente, las principales causas de muerte son las infecciones y las hemorragias.38,39
Las curvas de supervivencia de nuestro estudio en los 2 tipos de leucemias también confirman los argumentos de la mayoría de los autores, acerca del pronóstico desfavorable de estos pacientes.
Los resultados de este trabajo confirman el pronóstico desfavorable y la elevada mortalidad de los pacientes ancianos con leucemia aguda. En la actualidad se ha sugerido que, para obtener mejores resultados, lo principal es realizar una selección adecuada del paciente y si presenta características biológicas desfavorables (Ej. anomalías en el cariotipo y MDR1+) deben ser excluidos de la quimioterapia intensiva por sus pobres resultados y adoptar regímenes paliativos o moderadamente intensivos, para mejorar su calidad de vida y supervivencia.11
Summary
A descriptive study was carried out in 50 patients with acute leukemia aged 66 years as an average at the time of diagnosis. It was proved that non-lymphoblastic leukemia affected 80% of cases whereas 22,5% of them had a history of myelodisplastic syndrome or of other hematological disorders. Anemia was detected in 88% of patients and high serum lactic dehydrogenase levels in 60% of cases. Visceromegalia was more frequent in acute lymphoblastic leukemia. Patients with acute lymmphoblastic leukemia did not show complete remission, with an average survival rate of less than 2 months. On the contrary, complete remission was attained in 22,5% of cases with acute lymphoblastic leukemia and the average survival rate was 8 months approximately. Unfavourable prognosis and high mortality rate among elderly with this disease were confirmed.
Subject headings: LEUKEMIA, NON- LYMPHOCYTIC, ACUTE/diagnosis; LEUKEMIA; LYMPHOCYTIC, ACUTE/diagnosis; AGED; SURVIVAL ANALYSIS.
Referencias bibliográficas
- Kinney MC, Lukens JN. Classification and differentiation of the acute leukemias. En: Lee GR, Foerster J, Lukens J, Paraskevas F, Greer JP, Rodgers GM, eds. Wintrobe’s Clinical Hematology. Vol 2. Philadelphia: Williams & Wilkins; 1999:2209-40.
- Lowenberg B, Delwel RF. The Pathobiology of Human Acute Myeloid Leukemia. En: Hoffman R, ed. Hematology: Basic Principles and Practice. New York: Churchill Livinstone: 1991:708-12.
- Whitlock JA, Gaynon PS. Acute Lymphocytic leukemia. En: Lee GR, Foerster J, Lukens J, Paraskevas F, Greer JP, Rodgers GM, eds. Wintrobe’s Clinical Hematology. Vol 2. Philadephia: Williams & Wilkins; 1999:2241-71.
- Greer JP, Baer MR, Kinney MC. Acute myelogenous leukemia. En: Lee GR, Foerster J, Lukens J, Paraskevas F, Greer JP, Rodgers GM, eds. Wintrobe’s Clinical Hematology. Vol 2. Philadelphia: Williams & Wilkins;1999:2272-320.
- Hirsch-Ginsberg CF. Acute Leukemia. Hematol Oncol Clin North Am 1993;7:1-46.
- Baccarani M, Corbelly G, Amadori S. Adolescent and adult lymphoblastic leukemia prognostic features and outcome of therapy a study of 293 patients. Blood 1982;60:677-84.
- Jeffery T, Sorensen BS, Kenneth G. Effect of age on survival in acute leukemia 1950-1990. Cancer 1993;72:1602-6.
- Manoharan A. Acute myeloblastic leukemia in the elderly biology; prognostic factors and treatment. Int J Hematol 1998,68:235-43.
- Cohen HJ. Biology of aging as related to cancer. Cancer 1994;74(suppl 7):2092-100.
- Balducci L, Coecoran MB. Antineoplastic chemotherapy of the older cancer patient. Hemato Oncol Clin North Am 2000;14:193-212.
- Latagliata R, Pelli MC, Mandelli F. Acute myeloid leukemia in the elderly: per aspera ad astra?. Leuk Res 1999;23:603-13.
- Rowe JM. Treatment of acute myelogenous leukemia in older adults. Leukemia 2000;14:480-7.
- Hoelzer D. Therapy and prognostic factors in adult acute lymphoblastic leukemia. Baillieres Clin Hematology 1994;7:299-320.
- Taylor PR, Reid MM, Proctor SI. Acute lymphoblastic leukemia in the elderly. Leukemia Lymphoma 1994;13:373-80.
- Spoth-Schwalbe E, Heil G, Heimpel H. Acute lymphoblastic leukemia in the elderly: characteristic and outcome with the VAD regimen. Br J Hematol 1994;88:94-100.
- Bennett JM Catovsky D, Daniel MT. The morphological classification of acute lymphoblastic: concordance among observers and clinical correlations. Br J Haematol 1981,47:553-61.
- Lamvik J. Acute Leukemia in Middle Norway 1984-88. Leukemia and Lymphoma 1994;6:65-71.
- Yin L, Johnson P. Prognostic factors in elderly patients with acute myeloid leukemia. Leukemia and Lymphoma 1994;16:51-6.
- Leith C, Kopecky KJ, Godwin J. Acute Myeloid Leukemia in the Elderly: Assessment of Multidrug. Resistance (MDR1) and citogenetics distinguishes biologic subgroups with remarkably distinct responses to standard chemotherapy. A Southwest Oncology Group Study. Blood 1997;89:3323-9.
- Lipschitz DA, Udupa KB, Milton KY, Thompson CO. Effect of age on hematopoiesis in man. Blood 1984;63:502-9.
- Carmel R. Anemia and aging: an overview of clinical, diagnostic and biological issues. Blood Rev 2001;15:9-18.
- Walter RS. Intensive treatment of Acute Leukemia in adults 70 years of age and older. Cancer 1987;60:149-55.
- Vogler WR, Raney M, Winton EF. Prognostic variables in acute myelogenous leukemia (AML)in the elderly. Proc Am Soc Clin Oncol 1983;2:172.
- Sebban C, Archimbaud E, Coifier B. Treatment of acute myeloid leukemia in elderly patients; a retrospective study. Cancer 1988;61:227-31.
- Baudard M, Marie JP, Cadiou M, Viguie F, Zittoun R. Acute myelogenous leukaemia in the elderly: Retrospective study of 325 consecutive patients. Br J Haematol 1994;86:82-91.
- Johnson PR E, Hunt LP, Yin L. Prognostic factors in elderly patients with acute myeloid leukaemia: Development of a model to predict survival. Br J Haematol 1993;95:3000-6.
- Tucker J, Thomas AE, Gregory WM. Acute myeloid leukemia. Haematol Oncol 1990;8:13-21.
- Ferrara F, Mirto S, Serum LDH value as a predictor of clinical outcome in acute myelogenous leukemia of the elderly. Br J Haematol 1996;92:627-31.
- Van den Berghe. Morphology; immunologic and citogenetic (MYC) working classification of the acute myeloid leukemia: Br J Haematol 1998;68:487.
- Beguin Y, Bury J, Fillet G, Lennes G. Treatment of acute non-lymphocytic leukemia in young and elderly patients. Cancer 1985;56:2587-2592.
- Rees JKH , Gray RG, Wheatley K. Dose intensification in acute myeloid leukemia: greater effectiveness at lower cost. Principal report of the Medical Research Council’s AML 9 study. Br J Haematol 1996;94:89-98.
- Lancet JE, Willman CL, Bennett JM. Acute myelogenous leukemia and aging. Clinical Interactions. Hematology/oncology Clin North Am 2000;14:251-67.
- Taylor PR, Reid MM, Stark NM. De novo acute myeloid leukemia in patients over 55 years-old: A population based study of incidence; treatment and outcome-Northem Region Haematology Group. Leukemia 1995;9:231-7.
- Löwenberg B. Treatment of the elderly patient with acute myeloid leukemia. Builleres Clinical Hematology 1996;6:147-59.
- Tilly H, Castaingne S, Bordessoule D. Low-dose cytarabine versus intensive chemoterapy in the treatment of acute non-lymphocytic leukemia in the elderly. J Clin Oncol 1990;8:272-9.
- Hiddeman W, Kern W, Schoch C, Fonatsch C, Heinecke A, Wormann B and Büchner T. Management of acute myeloid leukemia in elderly patiens. J Clin Oncol 1999;17:3569-76.
- Löwenberg B, Downing JR, Burnett A. Acute myeloid leukemia. N Engl J Med 1999;341:1051-62.
- Harosseau JL. Acute myeloid leukemia in elderly. Blood Rev 1998;12:145-57.
- Manoharan A. Acute myeloblastic leukemia in the elderly: biology, prognostic factors and treatment. Int J Hematol 1998;68:235-43.
Recibido: 23 de noviembre de 2001. Aprobado: de diciembre de 2001.
Dra. Lidia Suárez. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". San Lázaro No. 701, entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Hematología.
2 Especialista de II Grado en Hematología. Profesor Auxiliar.
3 Especialista de I Grado en Hematología. Profesor Asistente.
4 Especialista de I Grado en Hematología. Instructor.