Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.42 n.2 Ciudad de la Habana abr.-jun. 2003
La Oncología en Cuba
Instituto Nacional de Oncología y Radiobiología
Ensayo clínico fase I del anticuerpo monoclonal IOR-T1 en linfoma T: farmacocinética y respuesta inmune
Dra. María E. Faxas García,1 Lic. Marta E. Guerra Yi,2 Dr. Alejandro Álvarez3 y Lic. Carlos Calderón4
Resumen
Como parte del ensayo clínico fase I con el anticuerpo monoclonal murino IOR-T1 (AcM IOR-T1) con dosis repetidas (200-800 mg) en pacientes que padecían llinfoma T cutáneo, se estudió la farmacocinética y la respuesta contra la proteína del ratón (HAMA) en los 10 pacientes tratados. Se observó una gran variación individual en la concentración máxima en suero estimada a las 2 h. El tiempo de vida media del AcM fue entre 13,93 y 19,6 h. La mayoría de los pacientes desarrolló anticuerpos contra el AcM IOR-T1. La presencia de este segundo anticuerpo no alteró significativamente la farmacocinética del AcM administrado.
DeCS: ENSAYOS CLINICOS FASE I/métodos; LINFOMA DE CELULA T CUTANEO/quimioterapia; ANTICUERPOS MONOCLONALES/farmacocinética.
Además de los tratamientos clásicos en Oncología, nuevas modalidades, donde se incluyen los anticuerpos monoclonales (AcMs), se evalúan en los pacientes con linfoma T cutáneo (LTC).1 Sin embargo, los ensayos clínicos con AcMs murinos han tenido diferentes obstáculos, como la imposibilidad de que el Ac alcance las células neoplásicas, la heterogeneidad antigénica, la aparición de células tumorales que no expresan el antígeno previamente identificado y la posible modificación de la farmacocinética del anticuerpo en circulación producto de la respuesta contra la proteína murina.2
El AcM murino IOR-T13 se generó en 1982, en el Instituto Nacional de Oncología y Radiobiología (INOR) y es producido a gran escala en el Centro de Inmunología Molecular (CIM). Luego de un reporte previo que mostró el efecto terapéutico con su uso tópico se realizó un ensayo clínico fase I en pacientes con linfoma T cutáneo utilizando 3 niveles de dosis, por vía endovenosa.4
En el presente trabajo se caracteriza la farmacocinética y la respuesta inmune en los pacientes estudiados.
Métodos
En este ensayo se incluyeron 10 pacientes, 8 de ellos con LTC, variedad micosis fungoides y 2 con linfomas T con manifestaciones cutáneas que no habían respondido a los tratamientos habituales y que ha sido reportado anteriormente.4
Se planificaron 3 niveles de dosis total de 200 mg (2 pacientes), 400 mg (4 pacientes) y 800 mg (4 pacientes) repartidas en 4 infusiones, 2 veces por sem durante 2 sem. Los pacientes incluidos en el último nivel de dosis no recibieron la cantidad propuesta por toxicidad.
Las determinaciones del AcM IOR-T1 en suero se realizaron antes de cada infusión, en la primera hora, al completarse la misma y después de 6, 12, 24 y 48 h. Se utilizó un ensayo inmunoenzimático indirecto específico para IgG de ratón (ELISA).4
El rango de detección fue entre 5-1 200 ng/mL y la precisión en términos de coeficiente de variación fue del 6 % para la repetibilidad y de 9,4 % para la reproducibilidad.
Análisis de la farmacocinética
Se consideró una cinética monoexponencial C(t) = A exp (-at). Se ajustó un modelo de regresión lineal por individuo en cada infusión para los niveles de dosis totales de 200 y 400 mg. A partir de esos resultados se calcularon los parámetros farmacocinéticos, tiempo de vida media (t½), área bajo la curva (AUC), volumen de distribución (Vd) y aclaramiento plasmático (Clp) de acuerdo con las expresiones t½=1n2/a, AUC = A/a, Vd = Q/AUC.k y C1p = Q/AUC; donde Q se refiere a la dosis y k a la constante de distribución.
Se realizaron análisis de varianza no paramétricos para determinar si existían diferencias significativas entre las 4 infusiones en cuanto a los parámetros farmacocinéticos.
Determinación de la respuesta contra la proteína del ratón (HAMA)
Se realizó mediante un ensayo inmunoenzimático indirecto y se tomaron muestras antes, durante y al finalizar el tratamiento. Se detectaron anticuerpos de los isotipos IgM, IgG e IgA.
Los valores considerados como negativos se obtuvieron de 23 sueros de personas aparentemente sanas. Su absorbancia para las diferentes inmunoglobulinas fue la siguiente: IgG = 0,38+/- 0,21; IgM = 0,1+/- 0,08; IgA = 0,07+/-0,06.
Se consideraron como positivos los valores por encima de las medias de las cifras de los controles con 2 desviaciones estándares. El coeficiente de variación para la repetibilidad fue menor del 10 % y para la reproducibilidad menor de 15 %.
Resultados
Farmacocinética
En la dosis de 200 mg las cifras máximas del AcM IOR-T1 en suero se alcanzaron a las 2 h después de la administración de los primeros 50 mg (782 ng/mL en promedio) y decrecieron a partir de las 24 h. A las 72 h de concluir el tratamiento, el AcM no se detecta en suero. El mismo patrón se observa en la dosis de 400 mg, con variabilidades individuales entre los 4 pacientes.
En los 2 grupos, el AUC decrece con el tiempo hasta ser mínima en la cuarta infusión. En el primer nivel de dosis el Clp ascendió en el transcurso de las infusiones, mientras en el segundo decreció. El Vd crece según las infusiones en ambos grupos. El t½ estuvo entre 13,93 y 19,67 h, no se observaron diferencias significativas entre las 4 infusiones ni entre los 6 pacientes evaluados. En la tabla se muestran estos resultados.
La farmacocinética en el tercer nivel de dosis fue diferente. En un paciente, los títulos de AcM fueron siempre bajos, con máximo de 100 ng/mL; en los 3 restantes existió un aumento a partir de la primera administración y no disminuyeron las cifras de inmunoglobulina como en los pacientes de los 2 niveles inferiores. Se detectó presencia del AcM hasta una semana después de concluido el tratamiento.
TABLA. Farmacocinética en la dosis de 200 mg y 400 mg
| Dosis 200 mg | Dosis 400 mg | |||||||
| AUC | Vd | C1p | t½ | AUC | Vd | C1p | t½ | |
| Inf. | (h/ug/mL) | (mL/kg) | (mL/kg/h) | (horas) | (h/ug/mL) | (mL/kg) | (mL/kg/h) | (horas) |
| 1 | 10,35 | 64,05 | 5,45 | 18,51 | 6,05 | 159,4 | 62,33 | 16,79 |
| 2 | 3,76 | 88,46 | 15,69 | 13,93 | 7,33 | 326,02 | 13,27 | 15,73 |
| 3 | 3,85 | 175,74 | 12,95 | 19,35 | 4,77 | 395,50 | 22,57 | 19,09 |
| 4 | 2,51 | 307,11 | 22,12 | 19,67 | 1,59 | 1 878,0 | 105,01 | 15,78 |
Respuesta de anticuerpos contra la inmunoglobulina de ratón
La misma fue a predominio de IgG y se incrementó en 6 de los 8 pacientes evaluados, no se pudo realizar en los pacientes 3 y 4. La IgM y la IgA aumentaron en 4 y 3 pacientes, respectivamente.
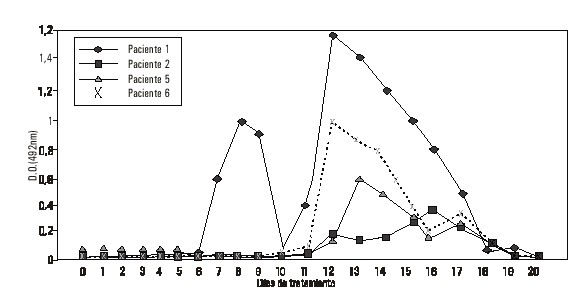
El ascenso de los títulos de IgG se detectó alrededor de los días 12 y 13, con excepción del paciente 1 (200 mg) en el que se produce un primer aumento a la semana de haber comenzado el tratamiento, este disminuye a las 48 h y reaparece el día 12, cuando también se detectaron títulos altos de IgM y de IgA.
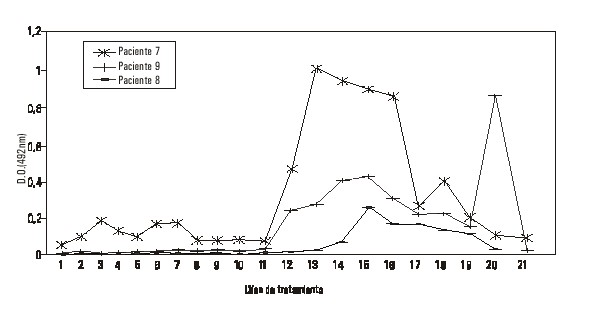
En el nivel de dosis 800 mg, no se detectan Ac en el paciente 10 mientras que en los pacientes 7 y 8 hubo respuesta de IgM, con títulos discretos en el paciente 8 y predominio de respuesta IgA en el paciente 7.
En las figuras 1 y 2 aparecen los resultados de la respuesta a la IgG.
FIG. 1. Respuesta HAMA (IgG) en los pacientes 1, 2, 5 y 6.
FIG. 2. Respuesta HAMA (IgG) en los pacientes 7, 8 y 9.
Discusión
Los estudios con diversos AcM murinos muestran que el t½ varía entre 11 y 35 h,5 por lo que los resultados obtenidos con el t½ del AcM IOR-T1, entre 13,23 y 19,09 h forman parte del rango mencionado. Dado que no se encontraron diferencias significativas ni entre las infusiones ni entre los 2 niveles de dosis, se puede concluir que es posible mantener un nivel del AcM IOR-T1 relativamente constante de inmunoglobulinas hasta la dosis de 400 mg totales.
Al comparar los 3 niveles de dosis, se aprecian diferencias en las concentraciones del Ac, fundamentalmente en los niveles 2 y 3. Los pacientes incluidos en el estudio se encontraban en diferentes estadios de su enfermedad y habían sido tratados previamente. Esta condición propicia que existan diferencias en la expresión de la molécula CD6 en las células tumorales de los pacientes y en el volumen tumoral; así, aunque se administren dosis similares de un anticuerpo la relación inmunoglobulina-CD6 no siempre es equivalente. Otro elemento a considerar, es que a pesar de que en un presente y es posible que se adhieran a estas células.
En general, la respuesta HAMA se detectó en 7 de los 8 pacientes evaluados, sin relación con la dosis recibida. El desarrollo de esta respuesta fue fundamentalmente a partir del día 13, lo que coincide con lo reportado por otros autores que indican que la respuesta HAMA aparece entre los días 12 y 22.
Resultados previos sugieren que si las dosis están comprendidas entre 200 y 600 mg, el grado de respuesta contra la proteína murina es similar, independientemente de si se realiza una administración única o múltiple, conclusión que concuerda con los resultados de este estudio.5 En particular, el paciente 1 desarrolló anticuerpos contra la proteína del ratón rápidamente, pero éste, a diferencia del resto, fue tratado previamente utilizando el AcM IOR-T1 por vía tópica y la aparición de los anticuerpos se relaciona con una respuesta inmune secundaria más temprana e intensa. Diversos autores reportan que los pacientes tratados con dosis repetidas de AcM murinos desarrollan respuesta HAMA y dicha respuesta se asocia con disminución de la eficacia terapéutica.5-6 Por otra parte, no faltan asociaciones entre respuesta idiotípica y buena respuesta clínica en los pacientes tratados con el AcM 17-1A.7 La importancia de la red de anticuerpos en este sistema en particular no se puede precisar por no haberse realizado una evaluación completa y aunque no todos los enfermos pudieron estudiarse con la frecuencia deseada, la aparición de este segundo anticuerpo no parece limitar en términos absolutos la respuesta antitumoral que se alcanza con el AcM IOR-T1 con resultados similares a otros anticuerpos que actualmente se ensayan en la práctica médica oncológica.
Summary
As part of the stage I clinical trial with the murine monoclonal antibody IOR-T1 at repeated doses (200-800 mg) in patients carriers of cutaneous T-cell lymphoma, the pharmacokinetics and the response against the mouse protein (HAMA) were studied in the 10 patients under treatment. It was observed a great individual variation in the maximum concentration in serum, which was estimated at 2 hours. The mean life time of the monoclonal antibody was between 13.93 and 19.6 hours. Most of the patients developed antibodies against the monoclonal antibody IOR-T1. The presence of this second antibody did not alter signficantly the pharmacokinetics of the administered monoclonal antibody.
Subject headings: CLINICAL TRIALS, PHASE I/methods; LYMPHOMA, T-CELL, CUTANEOUS/drug therapy; ANTIBODIES, MONOCLONAL/pharmacokinetics.
Referencias bibliográficas
- Jahn S, Asadullah K, Walden P, Sterry W. Cutaneous malignant lymphomas. Immunol Today 1998;19(3):70-3.
- Foss FM, Kuzeln TM. Novel treatment approaches for cutaneous T cell lymphoma. En: MS Tallman, LI Gordon, eds. Diagnostic and therapeutic advances in hematologic malignancies. Philadelphia:WB Saunders; 1999:227-40.
- García CA, Gavilondo J, Vázquez AM, Amador JF, Tormo B, Fernández A. Obtención de hibridomas de ratón productores de anticuerpos monoclonales que reconocen células T humanas. II Caracterización de los anticuerpos monoclonales IOR-T1 e IOR-T2. Interferón y Biotec 1984;1:29-39.
- Faxas ME, Barroso MC, Ortiz AR, García CA. Observaciones clínicas de la fase I con el anticuerpo monoclonal IOR-T1 en pacientes con linfoma T cutáneo. Rev Cubana Oncol 1999;15(1):36-42.
- Khazaeli MB, Saleh MN, Wheeler RH, Huster WJ, Holden H, Carrano R, et al. Phase I trial of multiple large doses of murine monoclonal antibody CO17-1A. II Pharmacokinetics and Immune response. Cancer Inst 1988;80:937-42.
- Blanco I, Kawatsu R, Harrison K, Leichner P, Augustine S, Baranowska-Kortylewicz J, et al. Antiidiotypic response against murine monoclonal antibodies reactive with tumor-associates antigen TAG-72. J Clin Immunol 1997;17:96-106.
- Frodin JE, Faxas ME, Hagstrom B, Lefvert AK, Masucci G, Nilsson B, et al. Induction of anti-idiotypic (ab2) and anti-anti-idiotypic (Ab3) antibodies in patients treated with the mouse monoclonal antibody 17-1A (ab1). Relation to the clinical outcome. An important effector function? Hybridoma 1991;10(4):412-31.
Recibido: 15 de febrero del 2002. Aprobado: 26 de febrero del 2002.
Dra. María E. Faxas García. Instituto Nacional de Oncología y Radiobiología. Calle 29 esquina a E, El Vedado, Ciudad de La Habana, Cuba. mefaxas@infomed.sld.cu
1 Especialista de II Grado en Inmunología. Investigador Titular.
2 Licenciada en Matemática. Investigadora Agregada.
3 Especialista de I Grado en Inmunología.
4 Licenciado en Física. Investigador Agregado.