Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.42 n.4 Ciudad de la Habana jul.-ago. 2003
Laboratorio de Investigaciones del SIDA
Fracaso del tratamiento antirretroviral y terapias de salvamento. Revisión actualizada
Dr. Héctor Manuel Díaz Torres,1 Dr. Ignacio Ruibal Brunet 2 y Dra. Julieta Sánchez Ruiz3
Resumen
Se mencionaron los descubrimientos que constituyen hitos en la búsqueda de una terapéutica efectiva contra el VIH/SIDA y se recordó que aún no se ha desarrollado una vacuna eficaz ni se ha alcanzado a gran escala el limitado objetivo de convertir esa infección en una condición crónica y manejable. Se revisaron brevemente las estrategias de terapia antirretroviral, la definición y causas del fracaso terapéutico, el papel de la resistencia del VIH a los antirretrovirales como causa de fracaso de la terapia y se hizo referencia a resultados de investigación sobre la prevalencia de distintas mutaciones que confieren resistencia en nuestro país y se comentaron sus implicaciones en relación con la terapéutica antirretroviral. Se revisaron las terapias de salvamento que se proponen en la actualidad y se valoró la importancia de las mismas para enfrentar los retos de la asistencia médica en pacientes con opciones terapéuticas limitadas.
DeCS: SINDROME DE INMUNODEFICIENCIA ADQUIRIDA; TERAPIA COMBINADA/efectos adversos; VACUNAS CONTRA SIDA/efectos adversos.
En 1981 se diagnosticaron los primeros pacientes con síndrome de inmunodeficiencia adquirida (SIDA);1 apenas 3 años después se identificó su agente causal, el virus de la inmunodeficiencia humana (VIH)2 y sólo se tardó 5 años en identificar la primera droga con actividad antirretroviral.3 Se puede afirmar que nunca antes se progresó tanto en tan poco tiempo en el enfrentamiento a una gran epidemia. Desde entonces, el desarrollo de la terapia ha transitado cronológicamente por importantes hitos que relacionamos a continuación:4-15
| 1981 | Se reportaron los primeros casos de SIDA. |
| 1983 | Se aisló el agente causal, posteriormente se le denominó VIH en 1986. |
| 1984 | Se identificaron líneas celulares apropiadas para cultivar el virus, lo que permitió investigar la actividad antiviral de fármacos conocidos, como ribavirina y suramina. |
| 1985 | Se reportó la actividad antiviral del interferón, el foscarnet y la azidotimidina (AZT) |
| 1986 | Se logró demostrar la actividad antirretroviral de la AZT en casos con SIDA. |
| 1987 | La Administración de Drogas y Alimentos (FDA) de Estados Unidos de América (USA) otorgó licencia para el uso de la AZT. |
| 1989 | Fueron descubiertos aislamientos del VIH con resistencia a la AZT. |
| 1991-92 | Se comprobó el rápido desarrollo de resistencia frente a las monoterapias. |
| 1993 | La combinación de 3 antirretrovirales logró, in vitro, detener la replicación viral. |
| 1993-95 | Se determinó que no existe latencia virológica. |
| 1996-98 | Se sintetizaron los inhibidores de la proteasa del VIH. Impacto de la terapia combinada. Avances en el conocimiento de la resistencia. Definen el fracaso terapéutico. |
| 1998-02 | Desarrollo de nuevas estrategias y enfoques de la terapia antirretroviral. |
Sin embargo, a pesar de los importantes descubrimientos de los últimos 15 años, aún hoy no se cuenta con vacunas preventivas ni terapéuticas de verdadera eficacia y con el empleo de la terapia antirretroviral todavía no se ha logrado supresión significativa y estable de la replicación viral, por lo que es aún objeto de revisión y análisis para tratar de alcanzar a gran escala el objetivo de convertir a la infección por VIH en una condición crónica y manejable.
Desde 1995 se han introducido nuevos medicamentos y se han cambiado las estrategias terapéuticas, con lo que se ha logrado reducir o casi suprimir la replicación del VIH-1 por períodos de 2 a 3 años, tiempo relativamente prolongado si se compara con etapas precedentes.16,17 Esto ha facilitado la recuperación lenta y parcial del sistema inmune,18 lo que permite la reducción de las complicaciones oportunistas (neoplasias e infecciones) en más del 50 %, con incremento significativo de la supervivencia y de la mejoría de la calidad de vida.19 Sin embargo, la erradicación del VIH-1 sigue siendo un objetivo no alcanzable20,21 y resulta esencial mantener suprimida la replicación viral para evitar el desarrollo del SIDA, lo que sólo se puede lograr si los pacientes aceptan y toleran potentes y complejos tratamientos.14,22
El arsenal de medicamentos actualmente disponible puede dividirse en 2 grupos que actúan en sitios diferentes del ciclo de replicación viral:23 los inhibidores de la enzima reverso-transcriptasa (RT) y los que inhiben la actividad de la proteasa viral. Los antirretrovirales del primer grupo se subdividen en inhibidores de la RT análogos de nucleósidos, zidovudina (ZDV, AZT, azidotimidina o retrovir), didanosina (ddI, videx), zalcitabina (ddC, HIVID), estavudina (d4T, zerit), lamivudina (3TC, epivir), abacavir (ABC, ziagen), emtricitabine* (FTC), lodenoside* (LOD), tenofovir (TDF, viread), y combivir (AZT / 3TC); inhibidores de la RT no análogos de nucleósidos, nevirapine (NVP, viramune), delavirdine (DLV, rescriptor), efavirenz (EFV, Sustiva), emivirine* (EMV) y loviride* (LOV) e inhibidores de la RT análogos de nucleótidos representados por el adefovir divipoxil (ADV). El grupo de inhibidores de la proteasa está integrado por saquinavir (SQV, invirase / fortovase), indinavir (IDV, crixivan), ritonavir (RTV, norvir), nelfinavir (NFV, viracep), amprenavir (APV, agenerase), atazanavir* (ATV), tipranavir* (TPV) y la combinación lopinavir / ritonavir (kaletra). Además se cuenta con la hidroxiurea o hydrea (HU), inhibidora de la síntesis de ácido desoxirribonucleico (ADN) en las células y con nuevas combinaciones fijas de las drogas ya mencionadas que aparecen con diversos nombres comerciales, como el trizivir (abacavir / AZT / 3TC). Los antirretrovirales aún no aprobados por la FDA se señalan con un asterisco.24 El ciclo de replicación viral, que permite comprender el mecanismo de acción de estos medicamentos, así como las dosis, esquemas terapéuticos, interacciones medicamentosas y efectos adversos no son abordados en esta revisión.
La estrategia actual de terapia antirretroviral exige un tratamiento combinado, temprano, secuencial e individualizado.13-15, 22-24 Combinado con 3 o más drogas, porque las monoterapias y biterapias inducen resistencia rápidamente por selección de las variantes resistentes de la cuasiespecie;25-27 porque el virus existe como un enjambre de secuencias interrelacionadas y no como una secuencia única repetida y la presión de la droga permite la replicación de las variantes no sensibles a la medicación.28 Temprano, según los marcadores de progresión sustitutivos de las manifestaciones clínicas.9 Secuencial, tomando del arsenal sucesivas combinaciones. Individualizado, mediante la selección de la mejor combinación para cada paciente.29 La tabla 1 muestra las combinaciones preferidas, las alternativas y las que no se recomiendan.13,22,24
Tabla 1. Combinaciones de antirretrovirales
| Preferidas (Una droga A + una combinación B) | |||
| A | B | Alternativas | No se recomienda* |
| Indinavir | AZT + ddI | Nevirapine o delavirdine + una combinación B | d4T + AZT |
| Nelfinavir | d4T + ddI | ddC + ddI | |
| Ritonavir | AZT + ddC | ddC + 3TC | |
| Saquinavir | AZT + 3TC | ddC + d4T | |
| Ritonavir + Saquinavir | d4T + 3TC | ||
| Efavirenz | ddI + 3TC |
* Por antagonismo farmacológico, mayor toxicidad y falta de eficacia.
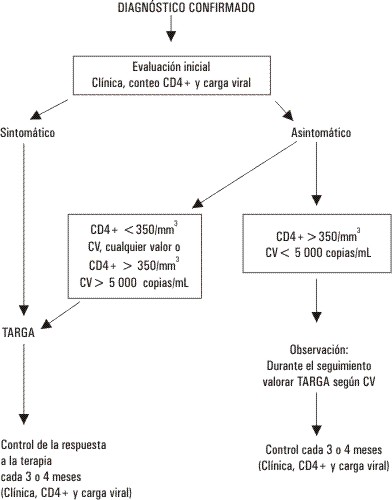
Como no se puede esperar a la aparición de manifestaciones clínicas para iniciar una terapia porque la intervención resultaría tardía, se necesitan marcadores sustitutivos de la clínica para monitorear el tratamiento. En la actualidad se han convertido en imprescindibles la medición de la carga viral en copias de ARN / mL y el conteo total de células CD4+.30 En la tabla 2 se señalan los valores críticos a partir de los cuales se recomienda el inicio de la terapia.13,22,24 En la figura presentamos un algoritmo para la indicación de la terapia antirretroviral en la infección crónica por VIH que consideramos interpreta de forma resumida y sencilla el consenso actual.22,24 Existen otros algoritmos para el tratamiento de la infección aguda, la exposición ocupacional y la prevención de la transmisión materno infantil.13
Tabla 2. Criterios para recomendar inicio de TARGA
| CD4+ (Cél/ mm3) | Copias ARN / mL | ||
| < 5 000 | 5 000-30 000 | > 30 000 | |
| < 350 | Iniciar | Iniciar | Iniciar |
| 350-500 | Considerar | Iniciar | Iniciar |
| >500 | Diferir | Considerar | Iniciar |
Fig. Algoritmo general de tratamiento antirretroviral.
La terapia combinada ha recibido diversas denominaciones: "triterapia", terapia combinada convergente o divergente, según se combinen drogas que actúan inhibiendo la misma enzima o enzimas diferentes del ciclo de replicación viral, terapia antirretroviral altamente activa o de alta eficacia (TAAE) y, recientemente, terapia antirretroviral de gran actividad (TARGA). Consideramos que la sustitución de "alta eficacia" por "gran actividad" resulta más apropiada, si se tiene en cuenta que con todas las combinaciones empleadas a diferentes plazos siempre ocurrirá fracaso terapéutico por diversas causas, lo que obligará a cambiar progresivamente las combinaciones y finalmente, al uso de las llamadas terapias de salvamento o de rescate.
Entre los beneficios de la TARGA deben señalarse la disminución de la morbilidad y la mortalidad en las poblaciones donde se ha introducido y generalizado su práctica (en EE. UU. este parámetro decreció del 29,5 al 8,8 % en 1997), el aumento promedio del conteo global de células CD4+, la disminución de la carga viral a niveles que permiten la acción del sistema inmune, la disminución de la tasa de transmisión madre a hijo, la prevención de las infecciones oportunistas y la posibilidad de reducir el riesgo de transmisión.15,31 Sin embargo, no deben desconocerse sus riesgos potenciales o desventajas, como el surgimiento de las variantes o mutantes resistentes a la presión de las drogas y el desarrollo precoz de resistencia ante el tratamiento temprano, así como la posibilidad de transmisión de virus resistente y la toxicidad a largo plazo de las terapias prolongadas, que pueden limitar las alternativas futuras de tratamiento.32
Se ha demostrado que la replicación viral en el tejido linfoide es superior en más de 10 veces a la observada en periferia.9 También se sabe que sólo se detiene la aparición de resistencia cuando la carga viral se mantiene a niveles indetectables por métodos ultrasensibles,33 capaces de detectar menos de 20 copias de ARN / mL, lo que está en relación con el control efectivo de la replicación viral en el tejido linfoide. Cuando no se cumple este requisito, se corre el riesgo de que la replicación en este tejido facilite la multiplicación de las variantes resistentes.9,33 Esta es una de las conclusiones más trascendentes en relación con la terapia y el desarrollo de resistencia.
Fracaso terapéutico. Definición y causas
Esta situación se define en 3 escenarios esenciales. Desde el punto de vista virológico consiste en no lograr disminuir la carga viral por debajo del límite inferior de detección del sistema empleado. Desde el punto de vista inmunológico significa no aumentar el conteo de células CD4+ sobre el nivel basal y por encima del nivel de seguridad para evitar infecciones oportunistas y desde un enfoque clínico se considera fracaso cuando no se logra detener la progresión de la enfermedad.34
El desarrollo de resistencia se considera la causa más importante de fracaso terapéutico,33,34 a lo que también contribuyen la falta de adherencia a la terapia, la intolerancia a la medicación, variaciones individuales de la farmacocinética, interacciones medicamentosas, compartimientos llamados "sitios santuarios", que por inaccesibles a la medicación sirven de reservorios porque a ellos no llega o llega mal la mayoría de los antirretrovirales. Estos sitios son el sistema nervioso central, testículos, próstata, retina y los macrófagos. También contribuye al fracaso terapéutico la resistencia a la fosforilación intracelular de los análogos de nucleósidos que solamente actúan al ser fosforilados por las quinasas de las células en actividad. En las células donde no hay fosforilación (inactivas), el virus se mantiene viable.34
En Cuba, investigaciones recientes encontraron que la prevalencia de mutaciones de resistencia a los inhibidores de la RT análogos de nucleósidos fue de 27,6 % en pacientes previamente tratados y de 7,4 % en no tratados, mientras que para los no análogos de nucleósidos fue de 5,3 % y 0 %, respectivamente. La resistencia a los inhibidores de la proteasa viral sólo se encontró en el 5,3 % de los individuos con terapia combinada previa y no se encontró resistencia multidroga.35 Estos resultados permiten asegurar que, en nuestro medio, la resistencia a los antirretrovirales como causa de fallo terapéutico es una problemática clínicamente manejable mediante el uso racional de la TARGA.
Terapias de salvamento
Para el paciente con opciones terapéuticas limitadas, en el que el fallo terapéutico y las condiciones que lo propician limitan las posibilidades de combinaciones útiles se han propuesto estrategias de salvamento o rescate:34,36,37 Reciclado, que consiste en volver a usar combinaciones que ya se usaron en el pasado, fundamentalmente las que se retiraron por causas ajenas a la resistencia. Mega-terapia, que incluye combinaciones de hasta 9 drogas, el problema fundamental de esta opción es la alta tasa de reacciones adversas. Intensificación, cuando se agregan otros antirretrovirales a una combinación en uso. Asociación a inmunomoduladores, para mantener activadas las células blanco, facilitar la acción de los antirretrovirales y coadyuvar al restablecimiento de la función inmune después de la reducción de la carga viral en el tratamiento secuencial. Interrupción planificada de la terapia (IPT), también llamada estructurada, estratégica, programada o "terapia de descanso" del inglés drugs hollidays, constituye otro tipo de terapia de salvamento.38-40 Esta modalidad resulta de mucho interés y hasta popular, por lo que a continuación comentaremos sus aspectos más relevantes: Desde los comienzos de la TAAE en 1996, los pacientes, por falta de adherencia a la medicación, y sin consulta previa, comenzaron a "descansar" de la terapia,38 lo que motivó referencias anecdóticas sobre los efectos de esta conducta, posteriormente, en febrero de 1998 en la V Conferencia sobre Retrovirus e Infecciones Oportunistas se reportó el caso del "Paciente de Berlín", conocido por la favorable evolución después de una modalidad de IPT. En resumen, este paciente comenzó triterapia en cuanto presentó manifestaciones de retrovirosis aguda acompañando a la seroconversión, posteriormente hizo 2 interrupciones por complicaciones intercurrentes (epididimitis y hepatitis); en la primera interrupción se observó rebote de la carga viral, pero en la segunda se mantuvo por debajo de 500 copias/mL. Reinició el tratamiento brevemente y después se mantuvo sin terapia y con carga viral por debajo de 500 copias/mL por más de 2 años.41
Se sabe que la IPT generalmente va seguida de rebote por el incremento significativo de la carga viral. Pero este incremento se debe en un 30 a 60 % a virus salvaje, que sustituye las secuencias con mutaciones de resistencia por variantes carentes de ellas y por tanto sensibles a la acción de los antirretrovirales, lo que brinda la posibilidad de reintroducir la medicación con mejores resultados.42,43
Con el uso de la IPT se espera estimular la respuesta inmune contra el VIH después que la viremia ha sido suprimida por el tratamiento, lo que tendría el efecto de una "autovacunación", mejorar la calidad de vida y disminuir los efectos colaterales y los costos, tema de interés para países en vías de desarrollo; y por último, revertir el predominio de las secuencias resistentes al tipo salvaje, para facilitar el éxito de otras terapias de salvamento, como la mega-terapia y la intensificación.39-44 Sin embargo, también se plantean limitaciones potenciales de la IPT como la falta de un efecto duradero, la aparición de resistencia cuando los ciclos de tratamiento e interrupciones se inician precozmente, la recurrencia de los síntomas de retrovirosis aguda y la repoblación de los reservorios durante los rebotes.44,45
Se han usado 2 tipos fundamentales de IPT, las interrupciones cortas y las largas. En el caso de las cortas se comienza y detiene el tratamiento según un calendario de semanas sí/semanas no; con esta modalidad se reportan menos rebotes y existe mayor probabilidad de mantener conteos estables de células CD4+. Con la modalidad de interrupciones prolongadas, el calendario se diseña en meses si/meses no, el tratamiento se interrumpe cada vez que el conteo de células CD4+ alcance valores superiores a 350 células / mL. Con este esquema son frecuentes los rebotes y caídas del conteo celular .23,38-40
En la IX Conferencia sobre Retrovirus e Infecciones Oportunistas (CROI), realizada en febrero de 2002, se evaluaron los resultados de la IPT en la infección aguda y en los pacientes crónicamente infectados (Hirschel B. Strategic Treatment Interruptions: Where are we ? 9na CROI 2002; S18). En el primer caso se han incluido pocos pacientes en los ensayos y hasta el 60 % mantuvo viremias por debajo de 5 000 copias de ARN / mL durante un año sin tratamiento y se detectaron, in vitro, evidencias de potenciación de la respuesta inmune específica de las células CD4 y CD8 contra el VIH. En el caso de la infección crónica se encontró que del 11 al 25 % de los casos incluidos mantuvieron como promedio menos de 5 000 copias de ARN / mL después de 4 ciclos de 2 semanas sí/4 semanas no, seguido de 12 sem de interrupción. Se observó, in vitro, estimulación de la respuesta citotóxica de linfocitos (CTL) específica; sin embargo, la mayor respuesta CTL se evidenció en los pacientes con más altos rebotes de la viremia y la respuesta CTL no se correlacionó con el control de la viremia en ausencia de terapia. Se concluyó que en estos casos se necesita una estimulación inmune adicional, como parte de una terapia combinada secuencial que complemente a la IPT, tanto en el marco de las terapias de salvamento como en el tratamiento de la infección aguda o crónica en pacientes que no están en estadios avanzados.
La disminución da la carga viral ante mega-terapia o intensificación ha resultado más frecuente en pacientes que estaban previamente en "descanso" del tratamiento, de la misma forma el reciclado parece ser más efectivo si es precedido por un período de interrupción del tratamiento, por lo cual se ha planteado que la IPT debe preceder a estas modalidades de terapias de salvamento. Por otra parte, se ha observado que los pacientes en quienes se ha logrado el control efectivo de la replicación con el tratamiento antirretroviral también presentan deterioro inmunológico que con frecuencia impide el aumento del conteo celular después de la interrupción; en estos casos, cuando se han empleado esquemas de tratamiento secuencial que incluyen medicamentos con acción inmunomoduladora como la interleucina II, se han obtenido mejores resultados.23,39,40
Como el arsenal terapéutico actualmente disponible no permite erradicar la infección y el objetivo de convertir al SIDA en una condición crónica y manejable enfrenta el problema frecuente del fracaso del tratamiento antirretroviral, las terapias de salvamento constituyen opciones de gran importancia en el tratamiento del paciente en estadios avanzados.
Sin embargo, las terapias de salvamento, incluyendo la IPT, aún no se recomiendan para su uso extensivo en la práctica clínica. En la actualidad están en desarrollo múltiples ensayos clínicos con mayor número de pacientes y mejor diseñados con el objetivo de obtener evidencias suficientes sobre el verdadero papel de estas estrategias en la atención al paciente VIH/SIDA, conocer los resultados de estos estudios ayudará, sin dudas, a enfrentar esta compleja tarea.
Summary
Those discoveries that are milestones in the search for an effective therapeutics against HIV/AIDS are stressed and it is reminded that an efficient vaccine has not been developed yet and that it has not been possible to attain the limited objective of turning that infection into a chronic and manageable condition at a large scale. The strategies of antiretroviral therapy, the definition and causes of the therapeutic failure, and the role of the HIV resistance to the antiretroviral agents as a cause of the failure of therapy are briefly reviewed. Reference is made to the results of the research on the prevalence of different mutations granting resistance in our country. The implications in relation to the antiretroviral therapeutics are also commented upon. The salvage therapies proposed at present are reviewed and their importance to face the challenges of medical assistance in patients with limited therapeutic options is assessed.
Subject headings: ACQUIRIED IMMUNODEFICIENCY SYNDROME; COMBINED MODALITY THERAPY/adverse effects; AIDS VACCINES/ adverse effects.
Referencias bibliográficas
- CDC. Pneumocystis carinii pneumonia. MMWR 1981;30:250.
- Barré-Sinoussi F, Cherman JC, Rey F, Nugeyre M T, Montagnier L. Isolation of a T- lymphotropic retrovirus from a patient at risk for AIDS. Science 1983;220 (4599):868-71.
- Fischl MA, Richman DD, Grieco MH, Gottlieb MS, Volderding PA, Lastin OL, et al. The efficacy of azidothymidine (AZT) in the treatment of patients with AIDS and AIDS-related complex. A double-blind, placebo-controlled trial. N Engl J Med 1987;317:185-91.
- Hirsch Martin S. Antiviral drug development for the treatment of human immunodeficiency virus infections. Am J Med 1988;85 (2A):182-6.
- Larder Brendan A, Darby Graham, Richman Douglas D. HIV with Reduced Sensitivity to Zidovudine (AZT). Isolated During Prolonged Therapy. Science 1989;243:1731-4.
- Larder BA, Chesebro B, Richman DD. Susceptibilities of Zidovudine susceptible and resistant human immunodeficiency virus isolates to antiviral agents determinated by using a quantitative plaque reduction assay. Antimicrob Agents Chemother 1993;34:436-41.
- Chow YK, Hirsch MS, Merrill DP, Bechtel LJ, Eron JJ, Kaplan JC, et al. Use of evolutionary limitation of HIV-1 multidrug resistance to optimize therapy. Nature 1993;361:650-4.
- Piatak M, Saag MS, Yang LC, Clark SJ, Kappes JC, Luk KC, et al. High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR. Science 1993;259: 1749-54.
- Pantaleo G, Graziosi C, Demarest JF, Butini L, Montroni M, Fox CH, et al. HIV infection is active and progressive in lymphoid tissue during the clinically latent stage of disease. Nature 1993;362 (6418):355-8.
- Coffin JM. HIV population dynamics in vivo: implications for genetics variation, pathogenesis, and therapy. Science 1995;267:483-9.
- Ho D. Viral counts in HIV infection. Science 1996;272:1124-5.
- Carpenter CC, Fischl MA, Hammer SM, Hirsch MS, Jacobsen DM, Katzenstein DA, et al. Antirretroviral therapy for HIV infection in 1997 : updated recomendations of the international AIDS society USA panel. JAMA 1997;277: 1962-69[ STANDARDIZEDENDPARAG]
- CDC. Guidelines for the use of antirretroviral agents in HIV infected adults and adolescents. MMWR 1998;47 (RR-05):43-82.
- Condra H. Resisting resistance: maximizing the durability of antirretroviral therapy. Ann Inter Med 1998;128:951-3.
- Torres RA, Barr M. Impact of combination therapy for HIV infection on in patient census. N Engl J Med 1997;21:1531-2.
- Gulick RM, Mellors JW, Havlir D, Eron JJ, González C, McMahon D, et al. Treatment with Indinavir, Zidovudine and Lamivudine in adults with Human Immunodeficiency Virus infection and prior Antiretroviral Therapy. N Engl J Med 1997;337:734-9.
- Gulick RM, Mellors JW, Havlir D, Eron JJ, González C, McMahon D, et al. Simultaneous vs sequential initiation of therapy with Induinavir, Zidovudine and Lamivudine for HIV-1 infection: 100 week follow-up. JAMA 1998;280 (1):35-41.
- Autran B, Carcelain G, Li TS, Blanc C, Mathez D, Tubiana R, et al. Positive effects of combined antirretroviral therapy on CD4+ T cell homeostasis and function in advanced HIV disease. Science 1997;277:112-6.
- Mouton Y, Alfandari S, Valette M, Cartier F, Dellamonica P, Humbert G, et al. Impact of protease inhibitors on AIDS defining events and hospitalizations in 10 French AIDS reference centers. AIDS 1997;11(12):F101-F105.
- Chun TW, Carruth L, Finzi D, Shen X, DiGuiseppe JA, Taylor H, et al. Quantification of latent tissue reservoirs and total body viral load in HIV-1 infection. Nature 1997;387 (6629):183-8.
- Dornadula G, Zhang H, Van Uiter B, Stern J, Livornese L, Ingerman MJ, et al. Residual HIV-1 RNA in blood plasma of patients taking suppressive highly active antiretroviral therapy. JAMA 1999;282 (17):1627-32.
- Carpenter CC, Cooper DA, Fischl MA, Gatell JM, Garzzard BG, Hammer SM, et al. Antiretroviral therapy in adults: updated recommendations of the International AIDS Society - USA Panel. JAMA 2000;283 (3):381-90.
- Scherey G. The HIV Trial Guide. A guide to major studies, trials and acronyms of HIV anti-retroviral therapy. Alphen a/d Rijn. The Netherlands: Van Zuiden Communications BV; 2002: 3-14.
- US Dept of health and Human Services and Henry J Kaiser Family Foundation. Guidelines for the Use of Antiretroviral Agents in HIV-Infected Adults and Adolescents. Published at: http://www.hivatis.org/. February 4; 2002. Accessed April 10, 2002.
- D´Aquila RT, Jonson VA, Welles SL, Japour AJ, Kuritzkes DR, DeGruttola V, et al. Zidovudine resistance and HIV-1 disease progression during antirretroviral therapy (116B/ 1179). Ann Intern Med 1995;122:401-8.
- Land S, McGavin C, Lucas R, Birch C. Incidence of zidovudine-resistant human immunodeficiency virus isolated from patients before, during and after therapy. J Infect Dis 1992;166:1139-42.
- Haseltine WA, Wong-Staal F. The molecular biology of the AIDS virus. Scientif Am 1988;259:203-8.
- Coffin JM. HIV viral dynamics. AIDS 1996;10 (Supl 3):S75-84.
- Hirsch MS, Conway B, D´Aquila RT, Johnson VA, Brun-Vézinet F, Clotet B, et al. Antiretroviral drug resistance testing in adults with HIV infection: implications for clinical management. International AIDS Society-USA panel. JAMA 1998;279:1984-91.
- Mellors JW, Muñoz A, Giorgi JV, Margolick JB, Tassoni CJ, Gupta P, et al. Plasma viral load and CD4+ lymphocytes as prognostic markers of HIV-1 infection. Ann Intern Med 1997;126 (12):946-54.
- Baker R. 3-Drug Therapy Reduces Deaths and New AIDS-Related Illnesses by 50 %. Bull Experim Treat AIDS 1997 (March):3-4.
- Wainberg MA, Friedland G. Public health implications of antiretroviral therapy and HIV drug resistance. JAMA 1998; 279:1977-83
- Gunthard H, Wong J, Ignacio C, Gautelli JC, Riggs NL, Havlir DV, et al. HIV replication and genotypic resistance in blood and lymphonodes after a year of potent antiretroviral therapy. J Virol 1998;72 (3):2422-8.
- Erice A, Moreno S, Gatell JM. Significado clínico de la resistencia del VIH a los
antirretrovirales. En: Resistencia del VIH a los fármacos antirretrovirales. Barcelona: Ediciones Antares; 1999: 123-31.
- Ruibal-Brunet I, Cuevas MT, Díaz-Torres H, Villahermosa ML, Noa-Romero E, Vázquez de Parga E, et al. Genotypic resistance mutations to antiretroviral drugs in HIV-1B and non-B subtypes from Cuba. Pam Am J Public Health 2001;10 (39):174-9.
- American Foundation for AIDS Research (amfAR). A guide to international HIV/AIDS Research, Treatment and Clinical Trials. Salvage Options and Goals. Summer 2002. Publisher at: www.amfar.org / Global link
- Chavanet P, Grappin M, Buison M, Gourdon F, Cabie A, et al. Randomized salvage therapy with Saquinavir-Ritonavir versus Saquinavir-Nelfinavir for highly protease inhibitor- experienced HIV infected patients. HIV Clin. Trials 2001;2 (5):408-12.
- Cheonis N. Structured Treatment Interruption: Future Protocol or Wisful Thinking ? Bull Experim Treat AIDS 2000;13 (1):32-8.
- American Foundation for AIDS Research (amfAR). A guide to international HIV/AIDS Research, Treatment and Clinical Trials. Structured (And Unstructured) Treatment Interruptions. Summer 2002. Publisher at: www.amfar.org / Global link
- Gulick RM. Structured Treatment Interruption in Patients Infected with HIV. A New Approach to Therapy ? Drugs 2002; 62 (2):245-53
- Lisziewicz J, Rosenberg E, Lieberman J,Jessen H, Lopalco L, Siliciano R, et al. Control of HIV despite the iscontinuation of antiretroviral therapy. N engl J Med 1999;340:1683-4. García F, Plana M, Ortiz GM, Bonhoeffer S, Soriano A, Vidal C, et al. The virological and inmunological consequences of structured treatment interruptions in chronic HIV-1 infection. AIDS 2001;15 (9):F 29-40.
- Izopet J, Massip P, Souyris C, Sandres K, Puissant B, Obadia M, et al. Shift in HIV resistance genotype after treatment interruption and short-term antiviral effect following a new salvage regimen. AIDS 2000;14:2247-55.
- Dybul M, Chun TW, Yoder C, Hidalgo B, Belson M, Hertogs K, et al. Short-cycle structured
intermittent treatment of chronic HIV infection with highly active antirretroviral therapy : effects on virologic, immunologic, and toxicity parameters. Proc Natl Acad Sci USA 2001; 98 (26):15161-6.
- Martínez-Picado J, Morales-Lopetegia K, Wrinb T, Pradoa J, Frostc SD, Cristos J, et al. Selection of drug-resistant HIV-1 mutants in response to repeated structured treatment interruptions. AIDS 2002;16:895-9.
- Taffe P, Rickenbach M, Hirschel B, Opravil M, Furrer H, Janin P,et al. Impact of occasional short interruptions of HAART on the progression of HIV infections. Result from a cohort study. AIDS 2002;16 (5):747-55.
Recibido: 16 de octubre de 2002. Aprobado: 3 de mayo de 2003.
Dr. Héctor Manuel Díaz Torres. Laboratorio de Investigaciones del Sida (Lisida). Carretera de Tapaste y Ocho Vías, San José de Las Lajas, La Habana, Cuba. Correo electrónico: cicdc@nfomed.sld.cu
1 Especialista de I Grado en Medicina Interna. Master en Infectología. Investigador Auxiliar (LISIDA).
2 Especialista de II Grado en Microbiología. Investigador Auxiliar (LISIDA).
3 Especialista de I Grado en Medicina Interna. Master en Infectología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras."