Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523versión On-line ISSN 1561-302X
Rev cubana med v.42 n.4 Ciudad de la Habana jul.-ago. 2003
Centro de Ingeniería Genética y Biotecnología
Hepatitis B. Una problemática mundial
Dr. Octavio Lorenzo Alfonso Ruiz1 y Dra. Massiel del Rosario Quijano2
Resumen
Se considera que el virus causante de la hepatitis B es un grave problema de salud en la población mundial en la actualidad, ya que a pesar de existir una vacuna preventiva contra esta enfermedad, se reporta un ascenso alarmante en el número de casos portadores del virus; además, constituye una de las principales causas de fallo hepático fulminante, cirrosis hepática y carcinoma hepatocelular. Teniendo en cuenta esta problemática se recomienda el empleo de algunas drogas como el interferón y lamivudina, que tienen buena aceptación en la práctica médica, aunque la respuesta de los pacientes a estos fármacos tienda a ser variable. Esto, obviamente ha desencadenado una revolución en la industria farmacéutica mundial, que se encuentra enfocada en la obtención y desarrollo de nuevos productos que generen tentativamente una mejor respuesta en los pacientes portadores de la enfermedad y de esta forma prevenir la indicación del trasplante hepático.
DeCS: HEPATITIS B/quimioterapia; VIRUS DE LA HEPATITIS B; INTERFERON ALFA/uso terapéutico; LAMIVUDINE/uso terapéutico.
La hepatitis B es producida por el virus perteneciente a la familia de los Hepadnaviridae; este virus es considerado una de las principales causas de fallo hepático fulminante, cirrosis hepática (CH) y carcinoma hepatocelular; además, por su alta incidencia y gravedad de la enfermedad es considerado en la actualidad la novena causa de muerte en el mundo.1 Se reportan 2 billones de personas infectadas y alrededor de 300-350 000 000 que evolucionan hacia la cronicidad, estas cifras pudieran considerarse aún más alarmantes si tenemos en cuenta que en los países pobres, estos datos estadísticos son menos fidedignos y de las propias características inherentes al virus, el cual es considerado 100 veces más infectivo que el HIV y se ha detectado que puede sobrevivir en muestras de sangre seca, expuestas durante 1 sem.
En EE.UU., a pesar de la introducción de una vacuna efectiva contra esta enfermedad desde el 1980, se estiman cifras de 1 000 000 de portadores del virus; 300 000 casos nuevos cada año y alrededor de 15 000-30 000 nuevos diagnósticos con la forma crónica de la enfermedad2 y, según algunos estadistas, se espera que la cifra de los enfermos crónicos ascienda a 1,7 000 000 de personas para el 2010. En Cuba se produce, y se exporta a diferentes países, una vacuna preventiva contra la hepatitis B, nombrada comercialmente como Heberbiovac. No obstante, a pesar del gran número de compañías farmacéuticas que producen y suministran estas vacunas, existen cifras mundiales preocupantes en cuanto al número de enfermos.
El virus de la hepatitis B (VHB) tiende a evolucionar de forma variable después del cuadro agudo a la forma crónica de un 5-100 %; de estos, el 25-33 % tiende a desarrollar una CH o carcinoma hepatocelular.3 En el caso particular de los pacientes crónicos, la supervivencia varía en dependencia de la edad, la cifra de bilirrubina y ascitis; por lo que los datos relacionados con la supervivencia en un período de 5 años, se muestran en relación con el estado de compensación o descompensación de la CH; el 84 % en los casos compensados y el 14 % en los pacientes descompensados.4 En el caso puntual de la forma aguda de la enfermedad, esta puede desarrollar como complicación la necrosis hepática masiva o submasiva y, en algunos casos, evolucionar al fallo hepático fulminante; se detecta una mortalidad que puede exceder el 80 hasta el 90 % en ausencia de la indicación certera de transplante de hígado.
Características generales del virus
El VHB está formado por una molécula de ADN circular, pequeña y de doble cadena parcial; constituida por 32 00 pares de bases. En su genoma se han identificado los siguientes genes: el gen S (incluyendo las fracciones pre-S1 y pre-S2) que codifican para el antígeno de superficie (AgsHB); los genes C y pre-C que codifican el antígeno del core (AgcHB), y el antígeno e (AgeHB), respectivamente. También el gen P que codifica para la ADN polimerasa, esencial en la replicación viral y el gen X responsable de la expresión del antígeno x (AgxHB), este último, a pesar de no existir un conocimiento certero de su implicación biológica y pato-biológica, se conoce que el producto de este gen actúa sobre secuencias regulatorias del VHB y otros agentes virales, además activa la transcripción de secuencias promotoras celulares.5,6 En términos evolutivos, este virus tiene 2 tendencias opuestas: generar un alto grado de mutaciones por el empleo de la reversotranscriptasa, que no posee capacidad de edición, y por otra parte, la disposición compacta del genoma que previene la variabilidad genética que pueda ocurrir. Los mecanismos de replicación y transcripción viral cometen errores en la organización nucleotídica, lo cual lleva a la producción de variantes genotípicas que parecen explicar comportamientos clínicos variables a diferentes drogas.7
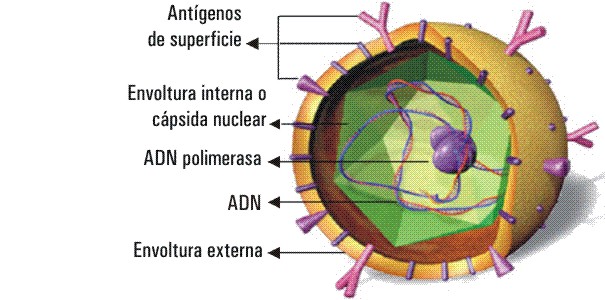
El virus en su estructura está formado por una doble capa. La cubierta externa es una bicapa de fosfolípidos a la cual se acoplan AgsHB; mientras que la cubierta interna o cápsida nuclear está compuesta por AgcHB que recubre y protege la maquinaria genética del virus (fig.).
FIG. Estructura del VHB
Este virus puede clasificarse según genotipos y subtipos virales. Los genotipos caracterizados actualmente son el A, B, C, D, E, F y G; mientras que los subtipos virales descritos son: ayw1,ayw2, ayw3, ayw4, ayr, adw2, adw4, adrq- y adrq+ (tabla 1). En el caso de los subtipos, se ha demostrado que son el resultado de diferentes antígenos en la proteína S y que están relacionados con sustituciones aminoacídicas dentro de la secuencia de esta proteína, como la que tiene lugar en la posición 122 (d o y) y 160 para r o w.8
Tabla 1. Relación entre los genotipos y subtipos del VHB
| Genotipo | A | B | C | D | E | F | G |
| Subtipos asociados | adw2(ayw1) | adw2ayw1 | adradrq-ayradw | ayw2ayw3ayw4 | ayw4(adw2) | adw4q- | adw2 |
Nota: Los subtipos que se encuentran en paréntesis, se describen raramente en el genotipo especificado.
Tanto los subtipos como los genotipos que se han podido caracterizar tienen una distribución geográfica variable; por ejemplo, los subtipos adw predominan en América, Australia, África del Norte, Mediterráneo Oriental, Europa Oriental, India, Asia Central y del Norte; en el caso del adr, tiene una mayor distribución en países como China, Sureste Asiático, Japón e Islas del Pacífico; el adr y adw, en Malasia, Tailandia, Indonesia y Nueva Guinea.
Los genotipos virales también muestran una distribución geográfica característica, relación con las diferentes formas de evolución de la enfermedad y respuesta a la terapia establecida. En cuanto a su distribución geográfica, por ejemplo, el genotipo A se ha podido encontrar en áreas del Noreste de Europa, América del Norte, Filipinas, Hong-Kong y en el Sur de África; el genotipo B, principalmente en la población indígena del Sureste Asiático y el genotipo C, en las Islas del Pacífico y Japón. El genotipo D se plantea que tiene una distribución universal, aunque se encuentra con mayor frecuencia en regiones como Sur de Europa, África del Norte y en la India; el genotipo E, se distribuye en América Central y del Sur. Finalmente, la distribución geográfica más frecuente del genotipo G es en países como Francia y EE.UU.; no obstante, por el fenómeno de migración que ocurre mundialmente, estos genotipos pudieran tener una distribución más dinámica.
La variabilidad que existe en relación con el nivel de respuesta al tratamiento y evolución de la enfermedad en los diferentes genotipos, es algo que debe tenerse en cuenta; tal es el ejemplo puntual del comportamiento variable en los pacientes portadores del genotipo B en relación con el genotipo C; este último se asocia a una evolución hepática severa, se destaca una mayor proporción en suero de los niveles de ADN viral y una mayor frecuencia de mutaciones en el sitio promotor del core, que a su vez se relaciona con una pobre respuesta a la terapia con interferón alfa .9
Este virus tiene la característica de sufrir mutaciones que pueden repercutir con el nivel de respuesta inmunológica al virus, la forma de evolución de la enfermedad y su respuesta a las diferentes drogas; tal es así que hasta el momento actual se ha descrito un gran número de mutaciones en el genoma del VHB; la mayoría de estas parecen ser "silentes", o no relevantes desde el punto de vista clínico. No obstante, se han descrito mecanismos de evasión de supervivencia inmunológica en el huésped, como en los mutantes de escape S; incremento de la severidad de la enfermedad, relacionados con mutaciones en la región del core, sitio promotor del core o pre-core; fenómenos de resistencia a los agentes antivirales por mutaciones en la ADN polimerasa y carcinogénesis hepatocelular dado por los mutantes X.10
Opciones terapéuticas
El tratamiento más difundido y aprobado en el tratamiento de las hepatitis B es el interferón y lamivudina; aunque en la actualidad el arsenal terapéutico se ha incrementado con la incorporación de nuevas drogas que se encuentran en diferentes fases de investigación (tabla 2).
Tabla 2. Drogas para el tratamiento de la hepatitis B
| Nombre de la droga | Mecanismo | Estado |
| Interferones. (actualmente existe una gran variedad de compañías que lo comercializan) | ||
| Interferón | Antiviral e inmunomodulador | Aprobado por la FDA en 1991 |
| Intron A® | ||
| Wellferon® Roferon® | ||
| Infergen® | ||
| Heberon alfa R (Cubano) | ||
| Existen otros | ||
| Análogos de nucleósidos (interfiere con la ADN polimerasa viral, empleada por el VHB para su replicación) | ||
| Lamivudina(Epivir-HBV®) | Inhibidor de la ADN polimerasa | Aprobado por la FDA en 1998 |
| Adefovir dipivoxil | Inhibidor de ADN polimerasa | Fase III |
| DAPD (amdoxovir) | Inhibidor de ADN polimerasa | Fase II |
| L-FMAU (clevudine) | Inhibidor de ADN polimerasa | Fase II |
| FTC (Coviracil®) | Inhibidor de ADN polimerasa | Fase III |
| L-dT, NV-02B (Telbivudine) | Inhibidor de ADN polimerasa | Fase III |
| Monval-LdC, NV-02C (Valtorcitabine) | Inhibidor de ADN polimerasa | Fase II |
| Fluoro-L y D nucleósidos | Inhibidor de ADN polimerasa | Preclínica |
| Entecavir | Inhibidor de ADN polimerasa | Fase III |
| AM365 | Inhibidor de ADN polimerasa | Fase II |
| ACH-126,443 (L-Fd4C) | Inhibidor de ADN polimerasa | Fase II |
| MCC478 | Pro-droga análogo de nucleósido | Fase I |
| Racivir | Inhibidor de ADN polimerasa | - |
| Robustaflavon | Inhibidor de ADN polimerasa | Preclínica |
| ICN 2001-3 | Inhibidor de ADN polimerasa | Preclínica |
| Antivirales no nucleósidos | ||
| Bam 205 | "Moléculas pequeñas" | Fase II/III |
| XTL-001 | Anticuerpos monoclonal humano | Fase II |
| Nonyl-DNJ | Inhibidor de proteínas de unión | Preclínica |
| HepBZyme | Ribozima resistente a nucleasas | Preclínica |
| Amplificadores y/o inductores de la respuesta inmune (No-IFN) | ||
| Theradigma | Inmunoestimulador | Fase II |
| Thymosina alpha-1(Zadaxin®) | Inmunoestimulador | Fase II con lamivudina. Aprobado como "Orphan Drug" en EUA |
| Vacuna HBV DNA (Genevax®) | Inmunoestimulador | Fase I |
| Vacuna PreS1/S2 (Hepagene®) | Inmunoestimulador | Preclínica |
| Antígeno VHB | Tolerancia oral | Preclínica |
| EHT899 | Proteína viral oral | Fase II |
| Tratamiento a posexposición y postrasplante hepático | ||
| Nabi-HBV® | Inmunoglobulina VHB | Aprobada por FDA en el 1999 |
| BayHep B® | VHB Inmunoglobulina | Aprobada por FDA en el 1977 |
| Anti-Hepatitis B | VHB Inmunoglobulina | Aprobada por FDA en el 2001 |
En el caso del interferón alfa, el cual ha sido ampliamente estudiado desde el punto de vista experimental y ha sido licenciado para el tratamiento en las hepatitis B desde el 1992, se ha comprobado que su efectividad es limitada, ya que solamente el 33 % de los casos tratados responde adecuadamente; se ha detectado una inefectividad en la fase de mutación del pre-core.11,12 La mutación más frecuente que ha sido detectada en esta región, y la más asociada con una pobre respuesta al IFN, es la que consiste en la sustitución en la posición 1896 de guanina por adenina, con lo cual se crea un codón de terminación que interrumpe precozmente la traducción del AgeHB, por lo que estos mutantes no producen dicho antígeno.13 Estos mutantes se han podido aislar con mayor frecuencia en el Mediterráneo y países del Oriente, en contraste con América del Norte, Este de Europa y la región del Sur de África, donde este hallazgo es altamente infrecuente.14,15
Otra droga que tiene una buena aceptación en el tratamiento de estos pacientes es la lamivudina; no obstante, se ha descrito efecto de resistencia a esta droga en un 15 a un 30 % de los pacientes tratados durante 1 año y alrededor del 58 % después de 2 años de tratamiento, como se pudo detectar en un grupo de asiáticos.16 Estos casos descritos como resistentes a la droga cursan con persistencia de la carga viral, por la existencia de mutantes descritos como YMDD en la región conservada de aminoácidos: tirosina, metionina, aspartato; estas mutaciones tienen lugar en el dominio C (catalítico) del gen que codifica para la enzima ADN polimerasa, responsable de la replicación viral.17,18 La mutación descrita con mayor frecuencia en estos casos resistentes al tratamiento, consiste en la sustitución de valina o isoleucina por metionina en el residuo 552. Otras mutaciones que se han descrito en orden de frecuencia es la 528 y 555; esta última asociada además con el tratamiento con fanciclovir.19,20 No obstante, a pesar de que estas drogas tienen un buen grado de aceptación en la práctica médica, deben evaluarse las restantes drogas que se encuentran en diferentes fases de investigación, que quizás puedan incluso combinarse con las ya existentes y lograr un producto de mayor alcance en cuanto a efectividad terapéutica.
Trasplante de hígado
La opción de trasplante de hígado en pacientes portadores de VHB constituyó un gran problema desde sus inicios porque esta variante no elimina el virus, e incluso se plantea que sin una profilaxis adecuada, se sufren recurrencias después del trasplante de órgano en un 80 a un 100 % de los casos, se asocia con una evolución rápida hacia la cronicidad y con tendencia al fallecimiento del paciente durante el primer año.21 Los pacientes que son clasificados antes del transplante como ADN+ al VHB o que presentan antígeno positivo "e" de VHB (HBeAg) tienen un mayor riesgo a la recurrencia, a pesar de la profilaxis posoperatoria. También se ha tenido en cuenta la clasificación según el genotipo viral; en el caso particular del A que es común en EE.UU., han sido inmunizados con la vacuna recombinante contra la hepatitis B o el anticuerpo policlonal Energix-B, posterior al trasplante y se ha logrado una baja recurrencia en este genotipo viral.22
Summary
Is is considered that the virus causing hepatitis B is a serious health problem for world population nowadays, since despite existing a preventive vaccine against this disease, it is reported an amazing increase of the number of cases carrying the virus. Besides, it is one of the main causes of fulminant hepatic failure, liver cirrhosis and hepatocellular carcinoma. Taking into account this problem, it is recommended the use of some drugs, such as interferon and lamiduvine that are well accepted in medical practice, although the response of the patients to these drugs tends to be variable. This, obviously, has produced a revolution in the world pharmaceutical industry that is focused on the obtention and development of new products that generate temptingly a better response among those patients carriers of the disease, allowing to prevent the indication of liver transplantation.
Subject headings: HEPATITIS B/drug therapy; HEPATITIS B VIRUS; INTERFERON -ALPHA/therapeutic use; LAMIVUDINE /therapeutic use.
Referencias bibliográficas
- Vivek Raj. Treatment of hepatitis B. Clin Cornerstone 2001;3(6):24-36.
- Garcia G, Petrovic LM, Vierling JM. Overview of hepatitis B and transplantation in the Hepatitis B patient. Semin Liver Dis 2000;20:3-6.
- Maddrey WC. Hepatitis B - an important public health issue. Clin Lab 2001;47:51-5.
- Jongh FE de, Janssen HL, Man RA de, Hop WC, Schalm SW, van Blankenstein M. Survival and prognostic indicators in hepatitis B surface antigen-positive cirrhosis of the liver. Gastroenterology 1992;103:1630-5.
- Grop PJ. Hepatitis B: virus, pathogenesis and treatment. Vaccine 1998;16:S11-S16.
- Henkler F. Koshy R. Multiple functions of the hepatitis B virus X proteins. Viral Hepatitis Rev 1996;2:143-59.
- Kidd-Ljunggren KK. Genetic variability in hepatitis B viruses. J Gen Virol 2002;10: 18197-0.
- Norder H. Subtyping of HBV at the genomic level by site-directed amplification. En: Viral Hepatitis and liver Disease. 1991. p. 195-99.
- Kao JH. Hepatitis B genotypes and the response to interferon therapy. J Hepatol 2000;33: 998-1002.
- Minuk GY. Hepatitis B Viral Mutants and their Relevance to the Health Care System. Canada Comminic Dis Report 2001;27S3.
- Main J, McCarron B, Thomas HC. Treatment of chronic viral hepatitis.
Antiviral Chem Chemother 1998;9:449-60.
- Zein N. Interferons in the management of viral hepatitis.
Cytokines Cell Mol Ther 1998;4:229-41.
- Erhardt A. Mutations of the core promoter and response to interferon treatment in chronic replicative hepatitis B. Hepatology 2000;31:716-25.
- Laras A, Koskinas J, Avgidis K, Hadziyannis SJ. Incidence and clinical significance of hepatitis B virus precore gene translation initiation mutations in e antigen-negative patients. J Viral Hepatitis 1998;5:241-8.
- Bowyer S.M, van Staden L, Kew MC, Sim JG. A unique segment of the hepatitis B virus group A genotype identified in isolates from South Africa.
J Gen Virol. 1997;78:1719-29.
- Liaw YF, Chien RN, Yeh CT, Tsai SL, Chu CM. Acute exacerbation and hepatitis B virus clearance after emergence of YMDD motif mutation during lamivudine therapy. Hepatology 1999; 30:567-72.
- Ling R., Mutimer D. Ahmed M. Selection of mutations in the hepatitis B virus polymerase during therapy of transplant recipients with lamivudine.
Hepatology 1996;24:711-3.
- Tipples GA, Ma MM, Fischer KP, Bain VG, Kneteman NM, Tyrrell DL. Mutation in HBV RNA-dependent DNA polymerase confers resistance to lamivudine in vivo.
Hepatology 1996;24:714-7.
- Allen MI, Deslauriers M. Lamivudine Clinical Investigation Group. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Hepatol 1998;27 (6):1670-7.
- Xiong X, Yang H, Westland CE, Zou R, Gibbs CS. In vitro evaluation of hepatitis B virus polymerase mutations associated with famciclovir resistance. Hepatol 2000;31(1):219-24.
- Ben-Ari Z, Mor E, Shapira Z, Tur-Kaspa R. Long-term experience with lamivudine therapy for hepatitis B virus after liver transplantation. Liver Transpl 2001;7:113-7.
- Ishitani MB, Devarbhavi H, Cohen A. Outcome of liver transplantation for hepatitis B virus (HBV) varies by HBV genotype. Abstract 46. Liver Transpl 2001;7:C-12.
Recibido: 27 de septiembre de 2002. Aprobado: 20 de noviembre de 2002.
Dra. Massiel del Rosario Quijano. Centro de Ingeniería Genética y Biotecnología. Correo electrónico: : massiel.rosario@cigb.edu.cu
1 Especialista de I Grado en Cirugía General. Centro de Investigaciones Médico Quirúrgicas.
2 Especialista de I Grado en Bioquímica Clínica. Centro de Ingeniería Genética y Biotecnología.