Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523versión On-line ISSN 1561-302X
Rev cubana med v.42 n.6 Ciudad de la Habana nov.-dic. 2003

Centro Nacional de Electromagnetismo Aplicado
La electroterapia: una alternativa terapéutica para el tratamiento de tumores
Lic. Luis Bergues Cabrales1 y Dra. Liliana Gómez Luna2
Resumen
La electroterapia es la terapia con corriente eléctrica directa de baja intensidad. Se utiliza en medicina como alternativa terapéutica para tratar tumores, es de bajo costo y mínimos efectos adversos. En diferentes estudios in vitro e in vivo se ha demostrado el marcado efecto antitumoral de la corriente eléctrica directa, en muchos casos se obtiene la regresión (o cura) completa de los tumores. La corriente eléctrica directa potencia la acción antineoplásica de la radioterapia y quimioterapia, minimiza los efectos colaterales que éstas inducen en el organismo. En esta revisión bibliográfica sobre la corriente eléctrica directa se han resumido los resultados más importantes obtenidos en el tratamiento de tumores, sus efectos antineoplásicos y colaterales, así como sus posibles mecanismos de acción.
DeCS: TERAPIA POR ESTIMULACIÓN ELÉCTRICA/métodos; NEOPLASMAS; TERAPIAS ALTERNATIVAS.
El cáncer o enfermedad neoplásica constituye la segunda causa de muerte en Cuba y en el mundo. La cirugía, radioterapia y la quimioterapia (modalidades convencionales para el tratamiento del cáncer) son invasivas y costosas, y no han dado aún una respuesta completa al tratamiento de esta enfermedad.1 Por otra parte, los investigadores han centrado todas sus esperanzas en la terapia génica, como única vía para la cura total del cáncer. El conocimiento de las bases moleculares de la neoplasia proporciona la posibilidad de intervención específica por terapia génica mediante la introducción del material genético para propósitos terapéuticos. Al respecto, algunos caminos de terapia génica han sido desarrollados para tratar el cáncer: compensación de la mutación, inmunopotenciación genética, quimioterapia molecular, inhibición de la angiogénesis, oncólisis replicativo del vector, y la quimiosensibilización y radiosensibilización. Los ensayos clínicos han sido iniciados para evaluar la seguridad, toxicidad y eficacia de cada una de estas aproximaciones, basadas en los resultados preclínicos promisorios.2
Estas razones hacen que muchos investigadores, en su afán de dar una respuesta completa o parcial al problema del cáncer, propongan alternativas terapéuticas efectivas y eficaces, como: la hipertermia,3 electroquimioterapia,4 campos electromagnéticos5 y la electroterapia (ET).6-10 La efectividad de estas modalidades terapéuticas, solas o combinadas con las terapias convencionales, ha sido demostrada en animales y en seres humanos. En el caso de las terapias combinadas, se ha obtenido una potenciación de los efectos citotóxicos y una reducción de los efectos adversos de las terapias convencionales.
En 1776 se sugirió por primera vez que la electricidad podía tener un papel relevante en el tratamiento de tumores.11 En las últimas 3 décadas, el número de reportes científicos, relacionados con el uso de la ET en el tratamiento de los tumores sólidos se ha incrementado vertiginosamente. El primero en utilizar la ET para el tratamiento de tumores malignos humanos fue Nordeström, en 1978, quién trató pacientes con cáncer de pulmón.12 A partir de los resultados de Nordeström, se ha extendido el uso de la ET al tratamiento de otros tumores humanos, como: pulmón, hígado, piel, pecho, esófago y cabeza.13-17 El trabajo más completo citado en seres humanos fue el realizado por Xin,16 en el cual se resume la experiencia de 10 años de tratamiento de tumores con CED en 8 240 pacientes desahuciados, a los cuales no se les pudo aplicar ninguno de los métodos terapéuticos convencionales, por su delicado estado de salud. De los 8 240 pacientes, 7 642 y 598 casos presentaron tumores malignos y benignos, respectivamente. La proporción de supervivencia para 1, 2 y 5 años de los pacientes con tumores malignos fue de 89,2; 56,0 y 36,0 %, respectivamente. Sin embargo, la proporción de supervivencia para 1, 2 y 5 años de los pacientes con tumores benignos fue de 100,0; 96,8 y 94,3 %, respectivamente.
Basado en la experiencia adquirida por los investigadores del grupo de Bioelectricidad, del Departamento de Bioingeniería y Equipos, del Centro Nacional de Electromagnetismo Aplicado y de los hospitales de Santiago de Cuba, en el tratamiento de tumores experimentales con CED y la experiencia existente en el mundo, en el tratamiento de tumores in vitro, en animales de laboratorio y en seres humanos, en este trabajo se hace un resumen de la experiencia nacional e internacional, en el cual se muestran los principales resultados obtenidos en el tratamiento de tumores con CED, así como sus posibles mecanismos de acción.
Estudios sobre la actividad antineoplásica de la CED
Los diferentes estudios realizados in vitro,7 en animales8-10,18-23 y en seres humanos,12-17 han demostrado que la CED de baja intensidad puede ser utilizada satisfactoriamente en el tratamiento local de tumores sólidos malignos y benignos porque induce una marcada regresión, en muchos casos se logra la regresión (o cura) completa de los tumores, que se corrobora por la disminución del volumen tumoral (regresión parcial o total de los tumores), incremento del porcentaje de necrosis de los tumores (mayor al 70 %), retardo del crecimiento tumoral y aumento del tiempo de duplicación de los tumores (en más de 3 veces).
La regresión parcial (más del 50 % de destrucción del tumor) se ha observado en los primeros 10 d después de aplicada la CED, mientras que la regresión completa siempre se ha observado después de los 20 d de aplicada.
De los resultados obtenidos en estos estudios se ha evidenciado que la regresión parcial o completa depende de la dosis de CED, estimulación de los componentes celulares y humorales del sistema inmune y del tipo de tumor. Se ha comprobado, además, que la CED induce la formación de productos tóxicos en el tumor, provenientes de las reacciones electroquímicas,7-10, 12-19, 22 los que provocan severos cambios en su metabolismo,8, 9, 17, 19 potencial transmembrana de las células cancerosas que lo componen,6, 21 y en su pH.8-10,12,19,22 Por la ocurrencia de estas reacciones electroquímicas en los tumores, muchos investigadores han denominado a la ET como terapia electroquímica.
En los estudios in vitro e in vivo se han utilizado diferentes modelos de tumores, los cuales se han inoculado en medios de cultivo7 y hospederos (ratones, ratas, conejo, perro y hombre).8-23 Entre los modelos de tumores experimentales utilizados se pueden mencionar: tumor de Ehrlich, fibrosarcoma Sa-37, sarcomas (Sa-1, Sa-180), melanoma B16, SV-40, adeno-12, AML-4, Morris hepatoma, 3924-A, entre otros,8-10, 18-26 sin embargo, en los tumores humanos se han usado los viscerales y superficiales, exceptuando los de la sangre y los ascíticos.12-17
La dosis está referida a los diferentes parámetros que se imponen durante la terapia con CED, los cuales fueron variados. Entre estos parámetros se pueden mencionar: carga eléctrica (intensidad y tiempo de aplicación de la CED), configuración de los electrodos (par de electrodos o multielectrodos); tipo de terapia (anódica, catódica, de campo o todos los electrodos insertados directamente en el tumor); cantidad de estímulos de CED (un sólo estimulo o más de un estímulo), y si la CED se usa sola, o combinada con las otras formas convencionales de tratamiento de tumores.
Se ha medido un conjunto de parámetros que permiten evaluar la efectividad y citotoxicidad de la CED, los cuales se han obtenido mediante estudios histológicos y anatomopatológicos,8-26 técnicas de imágenes como la resonancia magnética nuclear de imágenes, RMNI),8,27 espectroscopia de resonancia magnética nuclear, ERMN8 e infrarroja cercana, EIC,28 así como el empleo de otras técnicas de análisis químico.9,10,12-27
Otros estudios han estado dirigidos a la medición de los parámetros bioeléctricos en diferentes modelos de tumores, mediante los potenciales bioeléctricos29,30 y la técnica de bioimpedancia eléctrica.31,32 Los principales resultados que se han obtenido de estos estudios son:
- Los tumores presentan mayor permitividad eléctrica y conductividad eléctrica que los tejidos sanos adyacentes.31,32
- Los tumores son más electronegativos que los tejidos sanos circundantes a éstos.29,30
- La densidad de corriente eléctrica observada por la técnica de RMNI corresponde con la parte activa del tumor, esto indica que la corriente eléctrica que circula por el tumor sólo fluye por la parte viva de éste.27,33,34
Estos resultados han sido explicados porque los tumores presentan un contenido de agua mayor que los tejidos sanos; las células cancerosas se despolarizan, sus cargas migran hacia las membranas, lo cual hace que la polaridad de éstas sea más negativa.
Estas causas pueden explicar:
- Por qué los tumores se comportan como mejores conductores con respecto al tejido sano.
- La diferencia de electrosensibilidad encontrada en diferentes modelos experimentales de tumores, sometidos a la misma dosis de CED.
- El mínimo daño inducido en el organismo.
Para un mejor entendimiento de los resultados obtenidos en los estudios in vitro e in vivo se han propuesto un conjunto de modelos matemáticos,35-39 los cuales han permitido:
- Mejor conocimiento de los parámetros cinéticos y fisiológicos de los tumores no tratados y de los tratados con CED.
- Mejora del diseño de nuevas estrategias terapéuticas.
- Mejor entendimiento y esclarecimiento de los diferentes procesos que se inducen en el tumor una vez aplicada la CED.
A través de estos modelos se conoce que los parámetros eléctricos de los tumores y la potencia que se disipa en éstos después de aplicada la CED,6,33,39 los parámetros cinéticos y fisiológicos de los tumores no tratados y los tratados con CED38 y la descripción cualitativa de las interacciones del hospedero y de los componentes celulares y humorales del sistema inmune con el tumor, bajo la acción citotóxica de la CED.35-37
Toxicidad de la corriente eléctrica directa
En los estudios que se han llevado a cabo para evaluar el efecto citotóxico de la CED en los tejidos sanos circundantes al tumor y en el resto del organismo, se ha corroborado que éste es mínimo. Sin embargo, se ha encontrado que la CED induce daños severos en el hígado y en los riñones y alteraciones en los parámetros químicos de la sangre, y lleva a la muerte a los animales, cuando la carga eléctrica que se suministra al tumor y su periferia excede de 10,6 C (terapia anódica) y 20,6 C (terapia catódica).8,9 Estas alteraciones han sido minimizadas usando configuración de multielectrodos, todos insertados en el tumor.17,18,20,23,26
Algunos estudios han reportado que la CED minimiza los efectos tóxicos de la radioterapia, quimioterapia y de algunos modificadores de la respuesta biológica cuando se combina con las mismas.13-15,22,24-26,40-46 En estos estudios se ha reportado una reducción en más del 10 % de los efectos adversos de estas terapias convencionales cuando se combinan con la CED. Esto ha sido explicado porque al combinarse estas terapias, se utilizan dosis de citostáticos y de radiación de un octavo a un décimo menor que la requerida por estas modalidades para que tengan el mismo efecto antitumoral cuando se aplican por sí solas.
Todos los resultados obtenidos con la aplicación de la CED, sola o combinada con otras modalidades terapéuticas, han sido verificados en estudios in vitro7 y mediante diferentes parámetros determinados por estudios hematológicos, inmunológicos e histológicos,8-10,12-26,30,40-43 técnicas de RMNI,8,16,27,28 ERMN,8 EIC28 y de otras técnicas de análisis químico de la sangre.9,10,16,18,20,22
¿ Favorece la CED la citotoxicidad de las otras terapias antineoplásicas?
Algunos estudios han mostrado una potenciación del efecto antitumoral de la CED cuando ésta se combina con otras modalidades terapéuticas para el tratamiento del cáncer: como la radioterapia,41,43,44 quimioterapia,13-15,40,42,43 hipertermia,22 ciertos modificadores de la respuesta biológica24-26,45,46 y el láser.47
Zhu y Chou22 observaron que la combinación de la CED con la hipertermia induce una potenciación de la efectividad antitumoral de la CED y una reducción del 80 % del tiempo de aplicación de esta terapia combinada comparado con los tiempos de aplicación de estas terapias empleadas por separado. Según los autores, lo anterior sucede porque la acción de la temperatura sobre las células cancerosas, inducida por la hipertermia, se favorece en medios ácidos, inducidos por la CED.
En el caso de la combinación de la CED con la quimioterapia y con la radioterapia se ha reportado una potenciación del efecto antitumoral de las mismas en más de 20 veces cuando se compara con el efecto antitumoral de estas modalidades terapéuticas aplicadas por separado.13-15,40-44 Similares resultados se han obtenido cuando la CED se combina con algunos modificadores de la respuesta biológica.24-26,45,46 En este caso, se ha encontrado que la CED estimula los componentes celulares (polimorfonuclear neutrófilo, serie monocitos-macrófagos, linfocitos T [CD8+]), células NK) y humorales (TNF-a, IL-2, interferón-g) del sistema inmune. La evaluación de la respuesta de las células inmunes bajo la acción de la CED, también ha sido evaluada en estudios in vitro, se cita que éstas se activan bajo la acción citotóxica de la CED.7 El papel del sistema inmune en la destrucción de los tumores, una vez aplicada la CED, también ha sido propuesto por otros autores.20,22
Mecanismos de acción de la CED
Los resultados obtenidos en los diferentes estudios in vitro e in vivo demuestran que la terapia con CED de baja intensidad es una modalidad de tratamiento de tumores loco-regionales, efectiva, económica y de mínima invasividad. Se ha demostrado que la CED retarda significativamente el crecimiento de los diferentes tumores.7-10,12-26,28,30,41-47 En algunos de estos estudios se ha obtenido la regresión completa de los tumores.9,12-18,22,24-26,41-43,47
Para explicar estos resultados se ha propuesto un conjunto de mecanismos de acción de la CED, entre los que se pueden mencionar: inducción de fuerzas bioeléctricas y cambios en el potencial bioeléctrico,29,30,33 cambios en el pH local (alrededor de los electrodos) y en la temperatura inducida en el tumor,7-10,12-19,40-44 alteración del potencial transmembrana de las células cancerosas,6,21 ionización del tejido,22 presencia de productos tóxicos provenientes de las reacciones electroquímicas7-10,12-20,22,23,40-44 y la acción simultánea de las reacciones electroquímicas, fundamentalmente aquellas que involucran a las especies reactivas del oxígeno, y la estimulación de los componentes celulares y humorales del sistema inmune.20,23
En alguno de estos estudios se ha demostrado que el material del electrodo, hecho de oro, platino, plata, cobre y bronce, depositado en el tumor por las reacciones electroquímicas, inducidas por la acción citotóxica de la CED, no constituye el mecanismo antitumoral primario.7,8,10,13,19 Bergues y otros20 propusieron que el pH no desempeña el papel primario en la destrucción de los tumores sino que facilita a los productos tóxicos, generados por las reacciones electroquímicas y de los elementos celulares y humorales activados del sistema inmune, a que penetren al interior del tumor.
¿Por qué la electroterapia no se ha establecido como terapia definitiva?
A pesar de la propuesta de los mecanismos antitumorales de la CED, aún el modo de acción de ésta no ha sido completamente dilucidado, lo que ha traído como consecuencia que no se haya proporcionado una respuesta satisfactoria para los diferentes resultados obtenidos en los estudios in vitro e in vivo. Existen interrogantes que han imposibilitado que la electroterapia sea reconocida en la Oncología Clínica como una modalidad terapéutica más para el tratamiento de tumores sólidos.
De forma general aún no quedan esclarecidas preguntas como:
- ¿Cuáles son los mecanismos antitumorales primarios de la CED involucrados en la destrucción de los tumores?
- ¿A qué se debe la diferencia de electrosensibilidad observada en los tumores?
- ¿Cuál es el rango de dosis de CED, por tumor, para el cual se obtiene la máxima destrucción de éste y el mínimo daño al resto del organismo?
- ¿Qué informaciones adicionales pueden ser obtenidas a partir de las variables medidas?
El camino de la CED en este campo está abierto. Su carácter promisorio ha hecho que en países como China, Japón, Slovenia, EE.UU., Francia y Suecia, los investigadores se dediquen a desentrañar las interrogantes surgidas para que el mundo pueda disponer sin reparos de esta alternativa terapéutica.
Experiencias en Cuba
Desde hace 4 años, en el Centro Nacional de Electromagnetismo Aplicado (CNEA), de la Universidad de Oriente, en estrecha coordinación con los hospitales Oncológico "Conrado Benítez", Provincial "Saturnino Lora" e Infantil Norte "Juan de la Cruz Martínez Maceira," de Santiago de Cuba se viene utilizando la CED en el tratamiento de tumores malignos en animales de laboratorio (fase preclínica).20,21,23,35,36 El grupo de investigación viene trabajando, desde 1998, en las 4 interrogantes antes mencionadas.
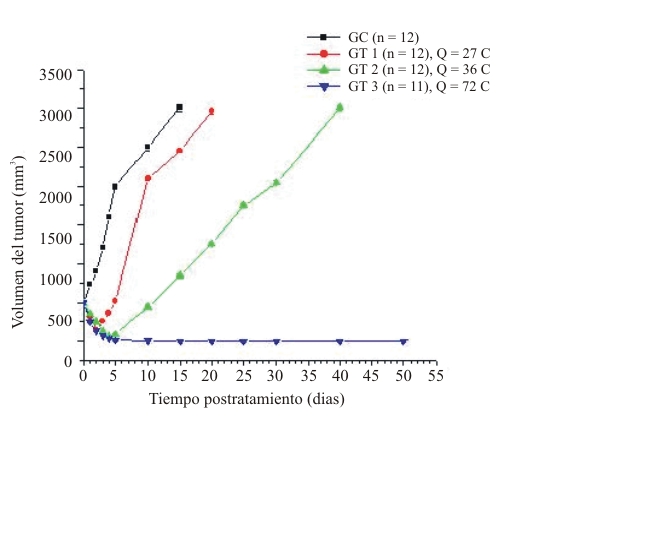
Durante este período, la realización y repetición de diferentes experimentos ha permitido demostrar el marcado retardo del crecimiento de los tumores tratados con CED, comparado con el de los tumores no tratados, así como la regresión completa de estos (fig.). En esta figura se muestra que la regresión de los tumores es mayor en la medida que la carga eléctrica suministrada es mayor. Para una carga eléctrica mayor a 72 C se obtuvo la regresión completa del tumor de Ehrlich. Los hallazgos patológicos evidencian un proceso inflamatorio agudo marcado, un alto grado de infiltración de los polimorfonucleares y altos porcentajes de necrosis inducidos en los tumores tratados, después de 24 h de aplicada la CED (tabla).
Figura. Regresión de los tumores para diferentes cargas de corriente eléctrica directa
Tabla. Porcentaje de necrosis de los tumores en los grupos tratados GT1, GT2, GT3 y su correspondiente control después del primer día de aplicada la corriente eléctrica directa (CED)
| Grupos experimentales | Tiempo después de aplicada la CED (días) | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| GC | 20,1±2,6 [N=6] | 22,3±2,9 [N=6] | 24,7±3,2 [N=6] | 26,5±4,6 [N=6] | 28,4±3,9 [N=6] | 30,0±4,1 [N=6] |
| GT1 | 50,9±2,1 [N=6] | 55,1±3,2 [N=6] | 62,3±2,9 [N=6] | 68,4±3,8 [N=6] | 60,7±3,5 [N=6] | 55,8±4,8 [N=6] |
| GT2 | 60,0±3,2 [N=6] | 68,2±3,8 [N=6] | 74,7±4,2 [N=6] | 80,9±4,7 [N=6] | 80,2±5,2 [N=6] | 75,6±4,5 [N=6] |
| GT3 | 70,2±3,6 [N=6] | 85,3±4,2 [N=6] | 90,8±4,9 [N=6] | 95,5±5,3 [N=6] | 97,2±6,2 [N=6] | 96,3±5,7 [N=6] |
N: Representa el número de tumores por grupo experimental.
GC: Grupo de tumores no tratado. Estos se mantuvieron bajo las mismas condiciones experimentales que los tumores tratados, pero no se le suministró CED.
GT1: Grupo de tumores tratado con 4 mA durante 30 min y tipo de terapia anódica: un ánodo insertado dentro del tumor y un cátodo insertado subcutáneamente a 10 mm del borde del tumor.
GT2: Grupo de tumores tratado con 4 mA durante 30 min y tipo de terapia anódica: dos ánodos insertados dentro del tumor y un cátodo insertado subcutáneamente a 10 mm del borde del tumor.
GT3: Grupo de tumores tratado con 4 mA durante 30 min y tipo de terapia multielectrodo: 5 ánodos y un cátodo insertados dentro del tumor.
Estos resultados han permitido la propuesta de un posible mecanismo de acción a partir del cual algunas investigaciones se están dirigiendo en esa dirección.20 Los mismos también han permitido explicar la diferencia de electrosensibilidad de los tumores (en proceso de revisión por los árbitros de la Bioelectromagnetics), así como la proposición de una nueva modalidad terapéutica selectiva para el tratamiento de tumores, la cual se viene trabajando, en nuestro grupo de investigación, desde el año 2001.
Summary
Electrotherapy is the therapy with low intensity direct electric current. It is used in medicine as a therapeutic alternative to treat tumors, its cost is low and its adverse effects are minimum. In different in vitro and in vivo studies, it has been showed the marked antitumoral effect of the direct electric current. The complete regression (or cure) of tumors is achieved in many cases. The direct electric current potentiates the antineoplastic action of radiotherapy and chemotherapy, and reduces the side effects that they induce in the organism. The most important results obtained in the treatment of tumors, its antineoplastic and side effects, as well as its possible mechanisms of action have been summarized in this bibliographic review.
Subject headings: ELECTRIC STIMULATION THERAPY/methods; NEOPLASMS; ALTERNATIVE THERAPIES.
Referencias bibliográficas
- Steel GG. Basic clinical radiobiology. 2nd ed. New York:Oxford University Press, 1997.
- Buchsbaum DJ, Curiel DJ. Gene therapy for the treatment of cancer. Cancer Biother Radiopharm 2001;16:275-88.
- Jarros BJ. Interstitial instrumentation for therapeutic ultrasonic heating: modeling the discrete blood vessels. IEEE Trans Instrum Means 2000;49:260-4.
- Serša G, Štabuc B, Cemažar M, Miklavcic D, Zvonimir R. Electrochemotherapy with cisplatin: clinical experience in malignant melanoma patients. Clin Cancer Res 2000;6:863-7.
- Rosch PJ. Magnetotherapy for cancer, heart disease, pain and aging. Health Stress 1997;6:7-12.
- Vodovnik L, Miklavcic D, Serša G. Modified cell proliferation due to electrical currents. Med Biol Eng Comput 1992;30:CE21-8.
- Batista U, Miklavcic D, Serša G. Low level direct current-cell culture fibroblast model. Bioelectrochem Bioenerg 1994;35:99-101.
- Dodd NJF, Moore JV, Taylor TV, Zhoo S. Preliminary evaluation of low level direct current therapy using magnetic resonance imaging and spectroscopy. Phys Med 1993;4:2-8.
- Griffin DT, Dodd NFJ, Moore JV, Pullan BR, Taylor TV. The effects of low level direct current therapy on a preclinical mammary carcinoma: tumor regression and systemic biochemical sequelae. Br J Cancer 1994;69:875-8.
- Miklavcic D, Serša G, Kryžanowski M, Novakovic S, Bobanovic F, Golouh R. Tumor treatment by direct electric current tumor temperature y pH, electrode material and configuration. Bioelectroch Bioenerg 1993;30:209-20.
- Hiller H. Fundamentals of treatment with direct current. Arch Phys Ther 1965;17:67-8.
- Nordenström BEW. Preliminary clinical trials of electrophoretic ionization in the treatment of malignant tumors. IRCS Med Sci 1978;6:537-40.
- Nordeström BEW, Eksborg S, Beving H. Electrochemical treatment of cancer. II. Effect of electrophoretic influence on adriamycin. Am J Clin Oncol 1990;13:75-88.
- Ito H, Hashimoto S. Experimental study of the antitumor activity of direct current-an effective adjuvant therapy in radiation. Gan To Kagakiu Ryoha 1989;16:1405-11.
- Matsushima Y, Amemiga R, Liu JS. Direct current therapy with chemotherapy for the local control of lung cancer. Nippon San Chiryo Gakki Shi 1989;24:2341-8.
- Xin YL. The electrical advance in application of EchT within the past ten years. Report of the Chinease Medical Foundation and China-Japan Friendship Hospital, Beijing, China 1998: 1-10.
- Xin YL, Xue FZ, Ge BS, Zhao FR, Shi B, Zhang W. Electrochemical treatment of lung cancer. Bioelectromagnetics 1997;18:8-13.
- Chou CK, McDougall JA, Ahn C, Vora N. Electrochemical treatment of mouse and rat Fibrosarcomas with direct current. Bioelectromagnetics 1997;18:18-24.
- Li KH, Xin YL, Gu YN, Xu BI, Fan D, Ni BF. Effects of direct current on dog liver: possible mechanisms for tumor electrochemical treatment. Bioelectromagnetics 1997;18:2-7.
- Bergues LC, Camué HC, Pérez RB, Súarez CR, Hinojosa RA, Montes de Oca LG, et al. Electrochemical treatment of mouse Ehrlich tumor with direct electric current. Bioelectromagnetics 2001;22:316-22.
- Bergues LC, Camué HC, Pérez RB, Hinojosa RA, Montes de Oca LG, Súarez CR, et al. Efectos de la corriente eléctrica directa en el tumor murino subcutáneo de Ehrlich. I: estudios de necrosis y volumen del tumor en estadios avanzados. Rev Bras Cancerol 1998;44:203-10.
- Zhu F, Chou CK. Effects of combined electrochemical treatment and hyperthermia of mouse tumors. Proceedings of the 18th Annual International Conference IEEE Engineering Med Biology 1996;17:14-6.
- Bergues LC, Camué HC, Pérez RB, Súarez CR, Hinojosa RA, Montes de Oca LG, et al. Efectos de la corriente eléctrica directa en el tratamiento de tumores. Rev Cubana Oncol 2000;16:30-4.
- Serša G, Golouh R, Miklavcic D. Anti tumor effect of tumor necrosis factor combined with electrotherapy on mouse sarcoma. Anti Cancer Drugs 1994;5:69-74.
- Serša G, Miklavcic D. Combined treatment of murine SA 1 tumors by human leukocyte interferon alpha and electrotherapy. Radiol Oncol 1993;27:280-5.
- Serša G, Miklavcic D, Batista U, Novakovic S, Bobanovic F, Vodovnik L. Antitumor effect of electrotherapy alone or in combination with interleukin-2 in mice with sarcoma and melanoma tumors. Anti-Cancer Drugs 1992;3:253-60.
- Serša I, Beravs K, Dodd NJF, Zhao S, Miklavcic D, Demsar F. Electric current density imaging of mice tumors. Magn Reson Med 1997;37:404-9.
- Jarm T, An DJ, Jean Belehradek Jr, Mir LM, Serša G, Cemažar M, Kotnik T, Pušenjak J, Miklavcic D. Study of blood perfusion with Patent Blue Staining method in LPB fibrosarcoma tumors in inmuno-competent and inmuno-deficient mice after electrotherapy by direct current. Radiol Oncol 1997;31:33-8.
- Miklavcic D, Serša G, Kryžanowski M, Novakovic S, Reberšek S. Tumor bioelectric potential and its possible exploitation for tumor growth retardation. J Bioelectr 1990;96:133-49.
- Habal MB, Schauble MK. Electropotential differentiation of normal and tumor tissue. Surg Forum 1967;18:88-90.
- Grant JP, Spyrou NM. Complex permittivity differences between normal and pathological tissues. Mechanisms and medical significance. J Bioelectricity 1985;4:149-58.
- Smith DG, Potter SR, Lee BR, Ko WW, Drummond WR, Telford JK, Partin AW. In vivo measurement of tumor conductiveness with the magnetic bioimpedance method. IEEE Trans Biomed Eng 2000;47:1403-5.
- Miklavcic D, Šemrov D, Valencic V, Serša G, Vodovnik L. Tumor treatment by direct electric current: computation of electric current and power density distribution. Electr Magnetobiol 1997;16:119-28.
- Serša I, Jarh O, Demšar F. Magnetic resonance microscopy of electric currents. J Magn Reson Ser A 1994;111:93-9.
- Bergues LC, Camué HC, Pérez RB, Hinojosa RA, Montes de Oca LG, Fong AR et al. Influencia de la acción citotóxica de la corriente eléctrica directa en la interacción hospedero - células cancerosas. Rev Mex Ing Biomed 1999;4:97-103.
- Bergues LC, Camué HC, Pérez RB, Hinojosa RA, Montes de Oca LG. Influencia de la acción citotóxica de la corriente eléctrica directa en la interacción linfocitos T-células cancerosas. Rev Bras Cancerol 2001;46:265-74.
- Vodovnik L, Miklavcic D. A theoretical approach to perturbation of biological systems by electrical currents. Electr Magnetobiol 1995;14:51-62.
- Miklavcic D, Jarm T, Karba R, Serša G. Mathematical modelling of tumor growth in mice following electrotherapy and bleomycin treatment. Math Comp Simulation 1995;39:597-602.
- Šemrov D, Miklavcic D. Calculation of the electrical parameters in electrotherapy of solid tumors in mice. Comp Biol Med 1998;28:439-48.
- Serša G, Novakovic S, Miklavcic D. Potentiation of bleomycin antitumor effectiveness by electrotherapy. Cancer Letter 1993;69:81-4.
- Nischiguchi I. The antitumor activity of direct current. An effective adjuvant therapy to irradiaton. Nippon Igako Hoshasen Gakkai Zasshi 1987;47:621-8.
- Matsushima Y, Takakashi I, Hagiwara K, Konaka C, Miura H, Kato H, Koshiishi Y. Clinical and experimental studies of antitumoral effects of electrochemical therapy (ECT) alone or in combination with chemotherapy. Eur J Surg Suppl 1994;574:59-67.
- Nakayama T, Ito H, Hashimoto S. Antitumor activities of direct current (DC) therapy combined with fractioned radiation or chemotherapy. Nippon Igako Hoshasen Gakkai Zasshi 1988;48:1269-75.
- Azavedo E, Suane G, Nordenstroem B. Radiological evidence of response to electrochemical treatment of breast cancer. Clin Radiol 1991;43:84-7.
- Bobanovic F, Klampfer L, Miklavcic D. The effect of direct current on NK cell activity. Trans BRAGS 1991:11-20.
- Chudomell V, Soucek T, Hroba A. Positive effect of direct current on cytotoxicity of human lymphocytes. Neoplasma 1989;36:573-82.
- Maintz D, Fischbach R, Schafer N, Turler A, Kugel H, Schafer H, Lackner K. Local therapy of liver metastases of colorectal carcinomas. Laser therapy vs. direct current treatment in the rat model. Rofo Forstschr Geb Rontgonstr Neuen Bildgeb Verfahr 2001;173:471-7.
Recibido:21 de junio de 2001. Aprobado: 3 de junio de 2002.
Dr. Luis Bergues Cabrales. Centro Nacional de Electromagnetismo Aplicado (CNEA). Universidad de Oriente. GP 4078. Santiago de Cuba 90 400, Cuba. Correo electrónico: bergues@cnea.uo.edu.cu
1 Licenciado en Física. División de Bioingeniería y Equipos. Centro Nacional de Electromagnetismo Aplicado.
2 Doctora en Ciencias Bioquímicas. Departamento de Biología. Universidad de Oriente.