Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523versión On-line ISSN 1561-302X
Rev cubana med v.44 n.1-2 Ciudad de la Habana ene.-abr. 2005
Centro de Investigaciones Medicoquirúrgicas
Servicio de Trasplante
Síndrome hepatopulmonar. Presentación de 1 caso y revisión
Dr. Julio César Hernández Perera,1 Dra. Marcia Samada Suárez,2 Dr. Ángel Abreu Cruz,3 Dr. Leslie Ramos Robaina,4 Dra. Evelín Elsbiet Lara Molina5 y Dr. Fernando Fidel González Castillo6
Resumen
Se sabe que el síndrome hepatopulmonar (SHP) ocurre cuando se produce hipoxemia secundaria a vasodilatación microvascular pulmonar en pacientes con enfermedades hepáticas o hipertensión portal. Se debe considerar en el diagnóstico diferencial de la disnea y la hipoxemia. Se hizo una revisión de la entidad después de presentar a una paciente de 10 años de edad, atendida por padecer una cirrosis criptogenética y una hipoxemia severa. Se estableció el diagnóstico después de realizar ecografía transtoráxica contrastada.
Palabras clave: Síndrome hepatopulmonar, cirrosis hepática, hipoxemia, hipertensión portal, trasplante hepático.
The hepatopulmonary syndrome (HPS) occurs when pulmonary microvascular dilatation causes hypoxemia in patients with liver diseases or portal hypertension. It is found in between 4–29% of patients with liver diseases and should be considered in the differential diagnosis of dyspnoea or hypoxemia. In this work a review of the syndrome is made after the presentation of 10 years old female evaluated as consequence the presence of liver cirrhosis and a severe hypoxemia. The diagnostic of HPS was made after a contrast transthoracic echocardiography.
Abreviaturas: AP (anteroposterior), anti-VHC (anticuerpos contra el virus de la hepatitis C), AgsHB (antígeno de superficie del virus de la hepatitis B), anti-HBc (anticuerpos contra el antígeno del core del virus de la hepatitis B)
Los síntomas respiratorios se pueden encontrar, aproximadamente, en el 70 % de los pacientes con hepatopatías.1 En sujetos con enfermedades hepáticas o hipertensión portal, se deben considerar síndromes adicionales al diagnóstico diferencial de la disnea de los pacientes habituales. Frente a estas situaciones, uno está primeramente obligado a considerar las enfermedades que pueden ser capaces de provocar a la vez, una enfermedad pulmonar y hepática, como ocurre en la sarcoidosis y en el déficit de α1-antritipsina; así como aquellas afecciones pulmonares que pueden suceder de forma independiente a la enfermedad hepática. Existen otras circunstancias en las cuales la disfunción pulmonar puede ser resultado de una enfermedad hepática, como ocurre en la disnea ocasionada por trastornos restrictivos frente a una ascitis importante, en el hidrotórax y como resultado de una complicación vascular pulmonar como el síndrome hepatopulmonar (SHP).
El SHP es reconocido cada vez con mayor frecuencia en las enfermedades hepáticas, se estima que puede estar presente entre un 4 y un 29 % de los pacientes cirróticos.2-7 Este diagnóstico merece la atención en cualquier paciente que padezca de una hepatopatía crónica y, específicamente, en aquellos en los que la disnea aparece después del advenimiento de signos de disfunción hepática. En el siguiente trabajo se presenta a una paciente remitida a nuestro servicio por padecer de una cirrosis hepática criptogenética con manifestaciones de disnea e hipoxemia severa de varios meses de evolución y en quién se establece el diagnóstico final de un SHP. Por ser esta entidad poco diagnosticada en nuestro medio, se realiza a partir de este caso, una revisión donde se aborda la definición, la fisiopatología, las manifestaciones clínicas y las conductas para el diagnóstico y tratamiento
Presentación del caso
Paciente de 10 años de edad, del sexo femenino, que tiene antecedentes de colestasis intrahepática del lactante. Por esta razón se siguió y se le realizaron varios estudios serológicos en busca de hepatitis crónica por virus B (AgsHb) con resultados negativos. A los 3 meses de edad se le diagnostica por la especialidad de gastroenterología pediátrica una cirrosis hepática de causa desconocida. A partir del año 2002 se constata la presencia de una cianosis periférica, que motivó atención médica. Se le realizaron múltiples estudios que incluyeron varios ecocardiogramas con resultados normales, con lo que se descartan procesos patológicos de origen cardíaco. A partir de esa fecha ha sufrido 2 episodios de neumonías que han requerido ingreso en unidades de cuidados intensivos. Por todo lo anterior se decide su ingreso para estudio y tratamiento.
Al interrogatorio se recoge la existencia de una llamativa cianosis distal, así como cansancio cuando realiza esfuerzos de moderada intensidad. Al efectuar el examen físico se constata como datos de interés médico, la coloración violácea de los labios (Labios en Caimito), cianosis periférica y acropaquias en los 4 miembros. Los resultados de los estudios hematológicos se resumen en la tabla 1.
Tabla 1. Resultados de los estudios hematológicos
| Parámetro | Resultado | Valor de referencia |
| Hematológicos | ||
| Hemoglobina | 15,1 g/dL | 12-14,5 g/dL |
| Hematócrito | 43 | 37-48 |
| Leucocitos | 5,9 x 109/L | 4,3-10,8 x 109/L |
| Plaquetas | 160 x 109/L | 150-350 x 109/L |
| Eritrosedimentación | 4 mm/h | 0-20 mm/h |
| Fibrinógeno | 334 mg/dL | 300-400 mg/dL |
| Tiempo de protombina (paciente/control) | 12,4 s / 12 s | ± 3 s el control |
| Tiempo parcial de tromboplastina | 31 s | 30-60 s |
| Hemoquímica | ||
| Aspartato-aminotranferasa | 190 U/L | < 40 U/L |
| Alanino-aminotranferasa | 85 U/L | < 50 U/L |
| Gammaglutamil-transpeptidasa | 287 U/L | < 50 U/L |
| Bilirrubina total | 50 µmol/L | < 17 µmol/L |
| Bilirrubina directa | 24 µmol/L | < 5,1 µmol/L |
| Creatinina | 47 µmol/L | < 130 µmol/L |
| Proteínas totales | 64 g/L | 55-80 g/L |
| Albúmina | 35 g/L | 35-55 g/L |
| Glucemia | 3,4 mmol/L | 3-6,4 mmol/L |
| Colesterol | 4,7 mmol/L | < 5,2 mmol/L |
| Triglicéridos | 0,57 mmol/L | < 1,8 mmol/L |
En la ecografía abdominal se informa la existencia de un hígado de ecoestructuctura heterogénea, desorganizado, con disminución de la vascularización, marcada disminución del calibre de los vasos portales intrahepáticos con aumento de la ecogenicidad de sus paredes; los vasos suprahepáticos también están afinados; el eje esplenoportal está permeable, y el bazo mide 100 mm. La radiografía de tórax AP, a distancia de telecardiograma evidenció un índice cardiotoráxico normal, con reforzamiento de la trama pulmonar bilateral de aspecto intersticial; no se definieron lesiones óseas ni de partes blandas. El electrocardiograma mostró un ritmo cardíaco sinusal con un índice de Sokolov positivo. Los marcadores serológicos de hepatitis virales (anti-VHC, AgsHB y anti-HBc) y HIV fueron negativos. La alfa-fetoproteína mostró cifras normales.
Se le realiza gasometría arterial en posición de pie y en decúbito supino, que mostró hipoxemia importante en ambos estados, que se incrementaba evidentemente en la posición de pie (tabla 2).
Tabla 2. Resultados de la gasometría arterial en posición de parado y en decúbito supino
| Parámetro | De pie | Acostado | Referencia |
| pH | 7,45 | 7,44 | 7,35-7,45 |
| pCO2 | 27,5 mmHg | 28,4 mmHg | 35-45 mmHg |
| pO2 | 40,8 mmHg | 48,7 mmHg | 95-100 mmHg |
| HbO2 | 73,8 % | 82,1 % | 97-100 % |
| HCO3 | 21,1 mEq/L | 21,4 mEq/L | 21-25 mEq/L |
| EB | -3,4 mEq/L | -3,3 mEq/L | 0 + 2,5 mEq/L |
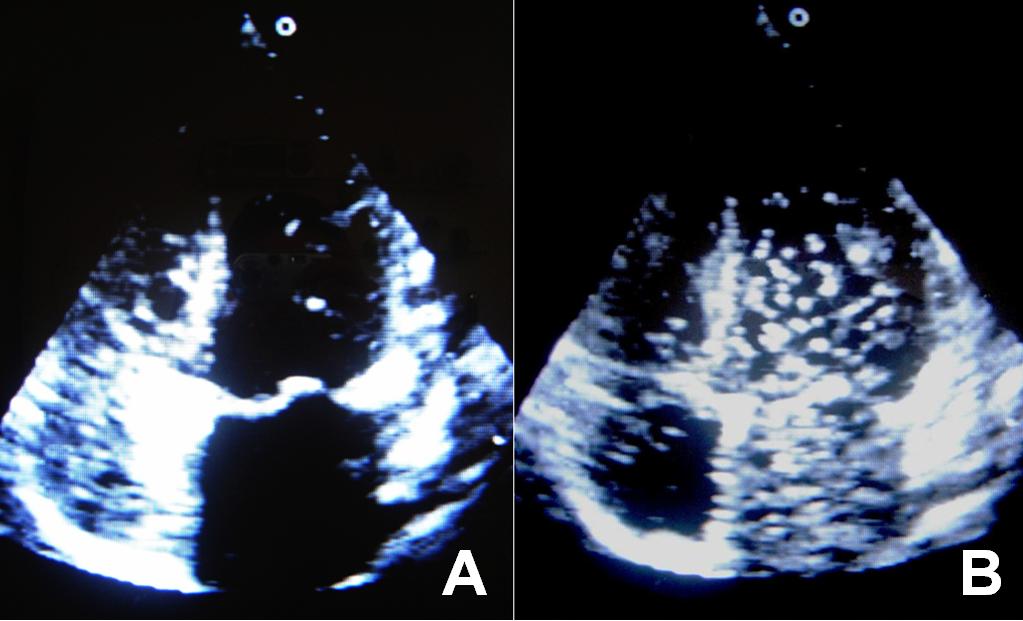
Ante los elementos señalados se sospecha la existencia de un SHP y se indica, para confirmar el diagnóstico, un ecocardiograma transtoráxico con contraste salino y una gammagrafía pulmonar con macroagregados de albúmina marcados con 99mTc. La primera de estas pruebas imagenológicas confirmó en el estudio simple, la normalidad de las estructuras cardíacas. Posterior a la administración intravenosa de solución salina agitada, al nivel de la vena basílica derecha, se visualiza la presencia de contraste en las cavidades derechas, y después del cuarto al quinto latido cardíaco, en las cavidades izquierdas. Se confirma de esta manera, la existencia de cortocircuito de derecha a izquierda al nivel de la circulación pulmonar (fig. 1).
Fig. 1. Imágenes del ecocardiograma con contraste salino. (A) Momento donde se visualiza la aparición del contraste en las cavidades derechas. (B) Momento donde aparece el contraste en las cavidades izquierdas, entre el cuarto y quinto latido después de la aparición del contraste en las cavidades derechas.
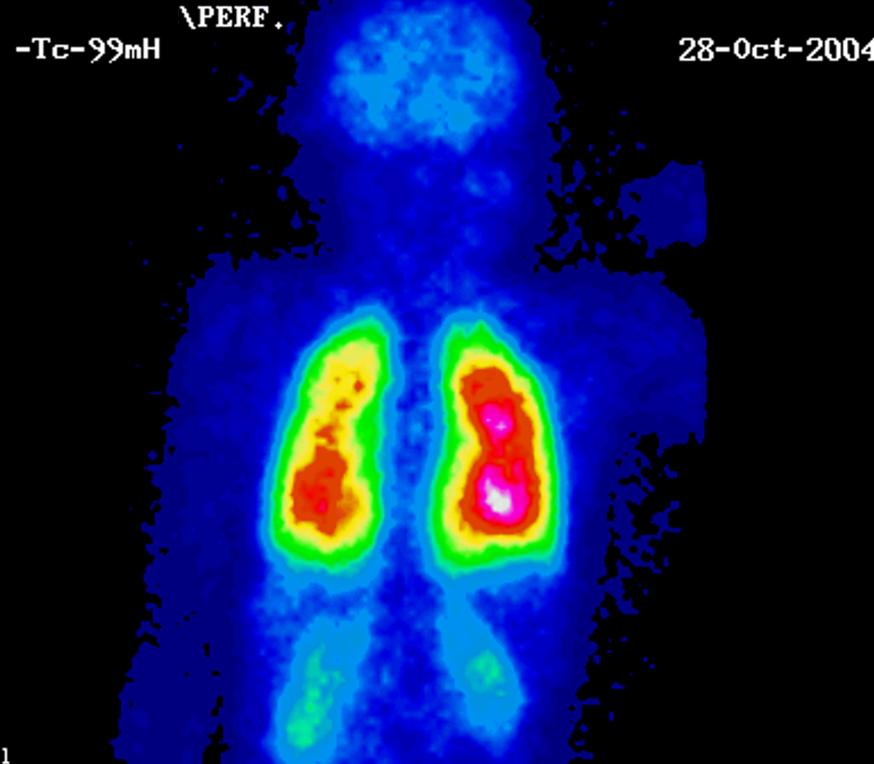
La gammagrafía de pulmón con macroagregados de albúmina, muestra una distribución del radiofármaco de forma sistémica. Este hallazgo corrobora también la existencia del cortocircuito de derecha a izquierda al nivel pulmonar (fig. 2) y con ello la ratificación del diagnóstico de SHP.
Fig. 2. Imágenes de la gammagrafía pulmonar con macroagregados de albúmina marcado con 99mTc, donde se observa distribución sistémica del radiofármaco en cerebro y riñón, aparte del pulmón.
Discusión
El SHP hace referencia a la relación clínica existente entre una enfermedad hepática y la vasodilatación pulmonar, que puede ocasionar un trastorno de la oxigenación arterial. Este puede definirse por la tríada clínica dada por enfermedad hepática o hipertensión portal, incremento del gradiente alveolo/arterial de oxígeno y vasodilatación pulmonar. En publicaciones iniciales se pensaba que solo se manifestaba en pacientes con hipertensión portal y cirrosis, y es en estas condiciones donde más se diagnostica. No obstante, en la actualidad se reconoce que puede acontecer tanto en hepatopatías crónicas como agudas, sin hipertensión portal, hipertensión portal prehepática y obstrucción venosa hepática sin cirrosis.8 Por tal razón, se asegura que para el desarrollo de un SHP no se requiere la existencia de una disfunción hepática severa y no en pocas ocasiones se presenta en pacientes con una enfermedad hepática relativamente ligera.9 El síndrome puede acontecer como una alteración aislada en pacientes con enfermedades hepáticas, o puede combinarse con otras alteraciones cardiovasculares o pulmonares, como por ejemplo derrame pleural y obstrucción al flujo aéreo en pacientes que son además fumadores.
Fisiopatología: El sello distintivo del síndrome es el desarrollo de dilatación microvascular dentro de la circulación pulmonar, con pobre, e incluso, ausente reactividad vascular a la hipoxia. La causa de esta alteración se cree que sea multifactorial y dentro de estas, la más importante parece estar relacionada con la hipertensión portal. Este último fenómeno es causante de una perfusión intestinal alterada con una consecuente tasa elevada de traslocación bacteriana y de endotoxinas; un proceso que estimula a su vez, la liberación de mediadores vasoactivos, como el factor de necrosis tumoral alfa (TNF-α), monóxido de carbono (CO) y óxido nítrico (ON).10-12
También el sistema de endotelina, y especialmente la activación y la expresión amplificada de algunos de sus receptores, se vinculan con la producción aumentada de ON, por lo que estos hallazgos han permitido implicarlos también en la patogénesis del SHP. El ON es un importante vasodilatador, particularmente dentro de la circulación pulmonar y su alta concentración puede derivar en una amplia vasodilatación intrapulmonar.10,13-15 Adicionalmente, el ON induce la hemoxigenasa-1 con la consiguiente producción de CO, que contribuye como un factor más, en la vasodilatación.11,16
La microdilatación vascular altera la relación difusión-perfusión, que ocasiona finalmente la hipoxemia ante la imposibilidad de que las moléculas de oxígeno alcancen la parte central de la corriente sanguínea que atraviesa el capilar pulmonar.
Manifestaciones clínicas: En la mayoría de los pacientes, los signos y síntomas correspondientes a la enfermedad hepática constituyen el motivo principal de consulta y sólo en el 18 % de los pacientes se presenta disnea como síntoma capital.
No obstante, se puede afirmar que la disnea es el síntoma principal y más frecuente en el SHP. Su inicio es generalmente insidioso y con exacerbación ante el ejercicio. Como en estos pacientes se presenta una vasodilatación pulmonar predominante en los campos pulmonares medio e inferior, otro hecho importante es el desarrollo de disnea o empeoramiento de la hipoxemia inducido por el ortostatismo, que aunque no es patognomónico, su presencia sugiere el diagnóstico.3 Estos signos se describen como platipnea (disnea que se exacerba en la posición de pie) y ortodeoxia (hipoxemia que se exacerba en la posición de sentada, pero se alivia en la posición de decúbito supino).
En estos enfermos es frecuente encontrar dedos en palillos de tambor y cianosis distal, por lo que constituyen signos específicos de SHP, cuando se muestran en enfermos con enfermedad hepática o hipertensión portal.17
No se conoce con exactitud la historia natural del síndrome. En estos pacientes, la mortalidad se incrementa de forma significativa, independientemente de la severidad de la hepatopatía de base. Por estas razones, el pronóstico es considerado como ominoso, su curso lentamente progresivo y aunque la causa de la muerte suele estar relacionada con la enfermedad hepática, la calidad de vida de estos pacientes se ve notablemente empeorada por los trastornos respiratorios.
Diagnóstico: El diagnóstico de la enfermedad incluye en primer lugar la existencia de una enfermedad hepática o manifestaciones de hipertensión portal. Después de hacer una cuidadosa historia clínica y un examen físico detallado, se debe descartar la existencia de otras patologías causantes de disnea, como la enfermedad pulmonar obstructiva crónica, la insuficiencia cardíaca, la neumonía, la cardiopatía isquémica, entre otras.
Una vez que se han excluido otras causas frecuentes de disnea, y existen dedos en palillos de tambor o platipnea, debe considerarse el diagnóstico de SHP. La gasometría arterial demuestra en estos casos la existencia de una hipoxemia, que puede ser modificada a los cambios ortostáticos (ortodeoxia).
El ecocardiograma contrastado es el estudio indicado para el diagnóstico de esta enfermedad. Si existe cortocircuito de derecha a izquierda al nivel pulmonar, las cavidades izquierdas se opacifican por el contraste después del tercer latido de haber aparecido en el lado derecho. Si un paciente con una hepatopatía o una hipertensión portal presenta hipoxemia y hallazgos ecocardiográficos que demuestran la existencia de un cortocircuito de derecha a izquierda al nivel pulmonar, se establece el diagnóstico definitivo de SHP. Por su parte, la gammagrafía pulmonar con macroagregados de albúmina sirve para corroborar el diagnóstico de SHP y para establecer la fracción de cortocircuito al nivel pulmonar.
Tratamiento: Se han investigado múltiples tratamientos farmacológicos para el SHP. Una de las estrategias ha sido administrar sustancias que contrarresten el efecto de una hipotética sustancia vasodilatadora causante del síndrome o administrar vasoconstrictores para contrarrestar la vasodilatación. Los beneficios y la eficacia obtenidos con la administración de octreótido (análogo sintético de la somatostatina), bismesilato de almitrina, indometacina y plasmaféresis, han sido desfavorables.18 Algunos reportes de casos han sugerido discreta mejoría de la oxigenación y del grado de vasodilatación pulmonar con el empleo del ácido acetil salicílico, polvo de ajo (allium sativum) y azul de metileno, pero sin elementos aún de utilidad como tratamiento a largo plazo.18-20
Hasta el presente, el único tratamiento efectivo disponible para los pacientes con SHP, es el trasplante hepático. Se reporta en la literatura, que aproximadamente el 85 % o más de los sujetos a quienes se les practica un trasplante de hígado, experimentan una mejoría significativa o una completa resolución de la hipoxemia.21 No obstante, el tiempo de mejoría varía ampliamente y puede tomar más de un año.22 De forma adicional, la mortalidad postrasplante se incrementa de manera significativa en los enfermos con SHP severo, por lo que la detección temprana de esta alteración es importante en pacientes con enfermedades hepáticas crónicas.23,24
En conclusión, el SHP es una complicación de una enfermedad hepática o una hipertensión portal, y la severidad de la enfermedad hepática no revela de forma confiada el desarrollo del síndrome. La enfermedad se sospecha en cualquier paciente con hepatopatía que presente hipoxemia o disnea, y la evaluación debe incluir una adecuada confección de la historia clínica, examen físico, gasometría arterial, radiografía de tórax y ecografía transtoráxica contrastada. La presencia en el ecocardiograma de un retraso en la presencia de contraste en las cavidades izquierdas confirma el diagnóstico. El tratamiento consiste en el control de los síntomas con suplemento de óxigeno y el trasplante hepático, si hay hipoxemia significativa, aún cuando la enfermedad hepática no sea severa. Muchos pacientes son tratados de forma efectiva con el trasplante hepático, aunque se puede requerir de hasta un año, para solucionar la hipoxemia. Por otra parte, el SHP incrementa la morbilidad y la mortalidad de los pacientes con enfermedad hepática, incluyendo aquellos que reciben un trasplante hepático. Actualmente, aunque existen algunos reportes de casos interesantes y pequeños estudios, no existe una terapia medicamentosa efectiva.
Summary
Hepatopulmonary syndrome. A case report and review
It is known that the hepatopulmonary syndrome (HPS) occurs when hypoxemia is secondary to pulmonary microvascular vasodilation in patients with hepatic diseases or with portal hypertension. It should be considered in the differential diagnosis of dyspnea and hypoxemia. A review of the entity was made after presenting a 10-year-old patient that received medical attention for suffering from cryptogenetic cirrhosis and severe hypoxemia. The diagnosis was attained after performing constrast transthoraxic echography.
Key words: Hepatopulmonary syndrome, hepatic cirrhosis, hypoxemia, portal hypertension, liver transplantation.
Referencias bibliográficas
1. Gaines DI, Fallon MB. Hepatopulmonary syndrome. Liver Intern. 2004:24;397-401.
2. Schenk P, Schoniger-Hekele M, Fuhrmann V, Madl C, Silberhumer G, Muller C. Prognostic significance of the hepatopulmonary syndrome in patients with cirrhosis. Gastroenterology 2003;125:1042–52.
3. Naeije R. Hepatopulmonary syndrome and portopulmonary hypertension. Swiss Med Wkly 2003;133:163–9.
4. Schenk P, Fuhrmann V, Madl C, Funk G, Lehr S, Kandel O wet al. Hepatopulmonary syndrome: prevalence and predictive value of various cut offs for arterial oxygenation and their clinical consequences. Gut 2002;51:853–9.
5. Gupta D, Vijaya DR, Gupta R, Dhiman RK, Bhargava M, Verma J et al. Prevalence of hepatopulmonary syndrome in cirrhosis and extrahepatic portal venous obstruction. Am J Gastroenterol 2001;96:3395–9.
6. Martinez GP, Barbera JA, Visa J, Rimola A, Pare JC, Roca J t al. Hepatopulmonary syndrome in candidates for liver transplantation. J Hepatol 2001;34:651–7.
7. Lange PA, Stoller JK. The hepatopulmonary syndrome. Ann Intern Med 1995;122: 521–9.
8. Kaymakoglu S, Kahraman T, Kudat H, Demir K, CakalogluY, Adalet I et al. Hepatopulmonary syndrome in noncirrhotic portal hypertensive patients. Dig Dis Sci 2003;48:556–60.
9. Abrams GA, Jaffe CC, Hoffer PB, Binder HJ, Fallon MB. Diagnostic utility of contrast echocardiography and lung perfusion scan in patients with hepatopulmonary syndrome. Gastroenterology 1995;109:1283–8.
10. Nunes H, Lebrec D, Mazmanian M, Capron F, Heller J, Tazi KA et al. Role of nitric oxide in hepatopulmonary syndrome in cirrhotic rats. Am J Respir Crit Care Med 2001; 164:879–85.
11. Carter EP, Hartsfield CL, Miyazono M, Jakkula M, Morris KG Jr, McMurtry IF. Regulation of heme oxygenase-1 by nitric oxide during hepatopulmonary syndrome. Am J Physiol Lung Cell Mol Physiol 2002;283:L346-53.
12. Strassburg CP. Shock liver. Best Pract Res Clin Gastroenterol 2003;17:369–81.
13. Cremona G, Higenbottam TW, Mayoral V, Alexander G, Demoncheaux E, Borland C, et al. Elevated exhaled nitric oxide in patients with hepatopulmonary syndrome. Eur Respir J 1995;8:1883–5.
14. Rolla G, Brussino L, Colagrande P, Dutto L, Polizzi S, Scappaticci E, et al. Exhaled nitric oxide and oxygenation abnormalities in hepatic cirrhosis. Hepatology 1997;26:842–7.
15. Fallon MB, Abrams GA, Luo B, Hou Z, Dai J, Ku DD. The role of endothelial nitric oxide synthase in the pathogenesis of a rat model of hepatopulmonary syndrome. Gastroenterology 1997;113:606–14.
16. Zhang J, Ling Y, Luo B, Tang L, Stockard C, Grizzle WE et al. Analysis of pulmonary heme oxygenase-1 and nitric oxide synthase alterations in experimental hepatopulmonary syndrome. Gastroenterology 2003;125:1441–51.
17. Fallon M, Abrams G. Pulmonary dysfunction in chronic liver disease. Hepatology 2000;32:859–65. 18. Abrams 19. Song JY, Choi JY, Ko JT, Bae EJ, Kim HS, Noh CI et al. Long-term aspirin therapy for hepatopulmonary syndrome. Pediatrics 1996;97:917–20. 20. Rolla G, Bucca C, Brussino L. Methylene blue in the hepatopulmonary syndrome. N Engl J Med 1994;331:1098. 21. Lange PA, Stoller JK. The hepatopulmonary syndrome: effect of liver transplantation. Clin Chest Med 1996;17:115–23. 22. Philit F, Wiesendanger T, Gille D, Boillot O, Cordier J. Late resolution of hepatopulmonary syndrome after liver transplantation. Respiration 1997;64:173–5. 23. Arguedas MR, Abrams GA, Krowka MJ, Fallon MB. Prospective evaluation of outcomes and predictors of mortality in patients with hepatopulmonary syndrome undergoing liver transplantation. Hepatology 2003;37:192–7. 24. Krowka MJ, Porayko MK, Plevak DJ, Pappas SC, Steers JL, Krom RA, et al. Hepatopulmonary syndrome with progressive hypoxemia as an indication for liver transplantation: case reports and literature review. Mayo Clin Proc 1997;72:44–53. Recibido: 2 de febrero de 2005. Aprobado: 24 de marzo de 2005. Dr. Julio César Hernández Perera. Centro de Investigaciones Medicoquirúrgicas (CIMEQ), Servicio de Trasplante. Calle 216 y 11b, Siboney, Playa, Ciudad de La Habana, Cuba. Correo electrónico: julio.hernandez@infomed.sld.cu jchernandez@cimeq.sld.cu 1 Especialista de I Grado en Medicina Interna. Investigador Agregado. Instructor. Servicio de Trasplante. Centro de Investigaciones Medicoquirúrgicas.
2 Especialista de II Grado en Gastroenterología. Investigador Auxiliar. Servicio de Trasplante. Centro de Investigaciones Medicoquirúrgicas.
3 Especialista de II Grado en Cardiología. Servicio de Cardiología. Centro de Investigaciones Medicoquirúrgicas.
4 Especialista de I Grado en Medicina Interna. Investigador Agregado. Servicio de Trasplante. Centro de Investigaciones Medicoquirúrgicas.
5 Especialista de I Grado en Medicina Interna. Instructor. Servicio de Trasplante. Hospital Clinicoquirúrgico Hermanos Ameijeiras.
6 Especialista de I Grado en Medicina Interna. Servicio de Trasplante. Hospital Clinicoquirúrgico Hermanos Ameijeiras. Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons