Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.45 n.1 Ciudad de la Habana ene.-mar. 2006
Hospital Clinicoquirúrgico “Hermanos Ameijeiras”
Mucormicosis gástrica en paciente diabética con trasplante hepático. Presentación de 1 caso
Dra. Evelín E. Lara Molina,1 Dr. Andrés M. Savío López,2 Dr. Ramón Soliva Domínguez,3 Dr. Fernando González Castillo4 y Dr. Ernesto Arteaga5
Resumen
Se presentó un caso de mucormicosis gástrica en una serie de 18 pacientes que han recibido trasplante hepático en un período de 2 años en este centro. Se trató de una paciente diabética tipo 2 de 57 años, con cirrosis hepática alcohólica estadio C de Child-Pugh. Se le realizó trasplante ortotópico de hígado sin complicaciones y se utilizó esquema inmunosupresor con prednisona, ciclosporina y azatioprina. Evolutivamente, se presentó episodio neurológico de excitación y después sepsis respiratoria por Acinetobacter sp y Pseudomona sp que llevaron al distrés y, posteriormente, al fallo múltiple de órganos, además de sangrado digestivo alto a los 6 d de evolución. La paciente falleció a los 13 d del trasplante. En la necropsia se encontraron hifas de Mucor en tejidos gástricos. Se realizó diagnóstico post mortem, en una paciente con factores predisponentes como diabetes mellitus, tratamiento inmunosupresor, y sepsis bacteriana asociada. Se corroboró que es el único caso de mucormicosis gástrica reportado entre 5 772 necropsias realizadas en este centro.
Palabras clave: Mucormicosis gástrica, trasplante hepático, inmunodeficiencia, mortalidad.
La mucormicosis es una infección micótica sistémica y oportunista, rara y frecuentemente fatal, causada por hongos zigomicetos del orden Mucorales. Los zigomicetos tienen una amplia variabilidad clínica y se presentan casi siempre en sujetos inmunodeprimidos o con enfermedades de base, y muy rara vez en huéspedes normales.1
La clase zigomicetos incluye no sólo el orden Mucorales, sino también el Entomophtorales.2,3 Los hongos pertenecientes al orden Mucorales producen generalmente infecciones agudas y angioinvasivas en inmunodeprimidos, con una mortalidad elevada, 4 mientras que los del orden Entomophtorales causan infecciones crónicas subcutáneas o nasofaciales en sujetos inmunocompetentes en regiones tropicales o subtropicales.5 Los géneros más frecuentemente aislados en casos clínicos entre los Mucorales son Rhizopus, Absidia, Rhizomucor y Mucor.6 Son hongos filamentosos, ubicuos y se encuentran en el suelo, en plantas, estiércol, y material putrefacto. Como patógenos aerógenos, afectan en primer lugar los senos paranasales y pulmones. 7,8 Sus hifas son anchas, no tabicadas, en forma de cintas y ramificadas en ángulo recto, lo cual, junto a la característica invasión de las grandes y pequeñas arterias, permite su diagnóstico histopatológico.1,9
Después de la aspergillosis y la candidiasis, la mucormicosis es la tercera causa más frecuente de infección invasiva por hongos.10-12 Afecta típicamente a pacientes con al menos uno de los siguientes estados inmunocomprometedores: enfermedad hematológica maligna, neutropenia, uso de altas dosis de corticosteroides, diabetes mellitus, cetoacidosis diabética, trasplante de órganos, tratamiento con deferoxamina, trauma y quemaduras.13 Los Mucorales penetran en el hombre por vía inhalatoria, por inoculación percutánea o por ingestión, y se describen 5 formas clínicas de presentación de la enfermedad: rino-orbito-cerebral, cutánea, pulmonar, diseminada y gastrointestinal.14
La presentación clínica de la mucormicosis depende en ocasiones de la condición subyacente del paciente. La forma más común es la rino-orbito-cerebral (40-49 %), más frecuente en los pacientes diabéticos, seguida de la cutánea (10-16 %), la pulmonar (10-11 %), más frecuente en los afectados por enfermedades hematológicas malignas, la diseminada (6-11 %) y, en último lugar, la gastrointestinal (2-11 %).15-20 Adicionalmente, la mucormicosis constituye una pequeña proporción de las infecciones micóticas invasivas en los pacientes que han recibido algún trasplante. En el trasplante hepático se reporta una incidencia de sólo 0-1,6 %.17,21,22 Considerando lo infrecuente de la forma gastrointestinal, el hallazgo de mucormicosis gástrica en una paciente diabética con trasplante hepático (el cuarto de nuestra serie de trasplantes de hígado) es, a nuestro juicio, de interés por su baja frecuencia y por la lección que representó para nuestro grupo, por lo que juzgamos útil su presentación.
Presentación del caso
Se realizó trasplante ortotópico de hígado a una mujer de 57 años de edad con antecedentes de diabetes mellitus tipo 2, hipertensión arterial y cirrosis hepática pos-alcohólica estadio C, según clasificación de Child-Pugh-Turcotte. No hubo complicaciones quirúrgicas, con buena reperfusión del injerto, aunque con síndrome pos-reperfusión expresado en arritmia e hipertensión pulmonar transitorias, que respondieron a las medidas convencionales.
En las primeras 24 h del posoperatorio evolucionó con hemodinamia estable, nivel de conciencia normal y oxigenación adecuada, lo cual permitió separarla de la ventilación mecánica. En el perfil hepático se registró la elevación esperada de las enzimas de citolisis por daño de preservación, correspondiente con biopsia hepática de tiempo cero que confirmó infiltrado linfoide inespecífico en algunos espacios porta y dilatación sinusoidal con leucocitos polimorfonucleares, expresión de hepatitis reactiva a la manipulación, sin signos de esteatosis o vasculitis. El tratamiento inmunosupresor consistió en corticoesteroides, ciclosporina A Neoral Ò y azatioprina.
A las 48 h aparece disfunción neurológica con intranquilidad, desorientación, lenguaje incoherente, sin focalización motora y con tomografía axial computadorizada de cráneo que no evidenció lesión cerebral, y que fue atribuido a posible neurotoxicidad por ciclosporina, a la cual podían haber contribuido el uso de metilprednisolona en el transoperatorio y posoperatorio inmediato, y la hipocolesterolemia propia de la insuficiencia hepática con que llegó la paciente al trasplante. Aparecen además estertores húmedos, y alteraciones hemogasométricas en rango de daño pulmonar, por lo que se acopla nuevamente a la ventilación mecánica previa sedación. De esta manera, el seguimiento objetivo del estado neurológico fue imposible. Se registra febrícula y posteriormente fiebre de 39º C, continúa durante 9 h, a pesar de la medicación y medidas antitérmicas. Se inició tratamiento con meropenem. En las secreciones traqueales, abundantes y fétidas, se aisló Acinetobacter sp, también demostrado en hemocultivos, resistente a todos los antimicrobianos, así como Pseudomona sp.
Evolutivamente, se produjo deterioro de la función renal y aparecieron signos de disfunción hepática, pues a pesar de la disminución gradual de las enzimas de citolisis, los parámetros indicativos de función de síntesis como colesterol, albúmina y factores de la coagulación persistieron bajos.
El quinto día se caracterizó por estabilidad hemodinámica, febrícula y presencia de secreciones traqueales purulentas. Sin embargo, en el sexto día aparece hipotensión arterial sostenida que respondió mal a la administración de volumen y al apoyo con dobutamina. Se aspiró sangre abundante por la sonda nasogástrica. En el séptimo día se plantea síndrome de respuesta inflamatoria sistémica con fallo múltiple de órganos, sustentado por las disfunciones hepática, respiratoria, neurológica y del tubo digestivo. Aparece íctero marcado y de nuevo la fiebre, por lo que se suspende la inmunosupresión para combatir la sepsis. No se logró recuperación hemodinámica, empeoró el fallo multiorgánico y se produjo la muerte a los 13 d del trasplante.
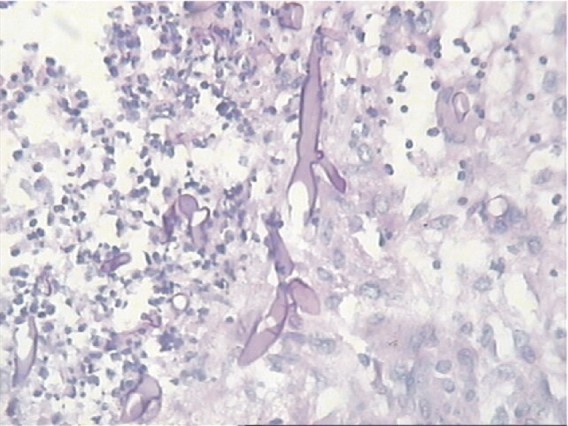
En la autopsia, además de los hallazgos correspondientes a los trastornos descritos, se identifica una úlcera gástrica aguda con la presencia de hifas anchas, no tabicadas, correspondientes a hongos del orden Mucorales (figs.1 y 2).
Fig. 1. Imagen a mayor aumento del proceso inflamatorio con extensa necrosis donde se destacan las hifas gruesas tabicadas con ramificaciones. PAS 400x.
Fig. 2. Plata Metinamina de Grocott 400x.
Discusión
La mucormicosis gastrointestinal es la forma más rara de presentación de la enfermedad, y generalmente se adquiere cuando las esporas son ingeridas con comida o mucus contaminado.23 Curiosamente, esta forma clínica de la mucormicosis sistémica fue descrita por Paltouf desde 1885 en su artículo "Micosis mucorina". 24 El síntoma más frecuente es la molestia o dolor en epigastrio, aunque puede presentarse con dolor tipo cólico, diarreas, hematemesis y melena.6,25-27 Los segmentos del tubo digestivo más frecuentemente involucrados son el estómago y el intestino delgado.28 En el caso que describimos, por el deterioro neurológico inicial y la ventilación mecánica posterior no fue posible identificar algunos de los síntomas descritos, pero sí se comprobó el sangrado digestivo alto. Para explicarlo, se planteó la presencia de una úlcera gástrica aguda, pero no se tomó biopsia de la misma por las condiciones de la paciente, quien, dada la disfunción hepática descrita, también presentaba trastornos de la coagulación. Por consiguiente, no se realizó diagnóstico de la enfermedad in vivo.
La única manera de diagnosticar la mucormicosis es visualizar las hifas características en el tejido correspondiente o en muestras de esputo, exudados o raspado, que se cultivan posteriormente en el laboratorio.2 En el caso de una mucormicosis sospechada debe obtenerse una biopsia del sitio de infección, lo cual puede ser difícil según la afección de base del paciente,3,23 como ocurrió en nuestro caso. Generalmente, el diagnóstico pre-mortem de la mucormicosis es difícil, aunque de manera infrecuente se reportan casos de diagnóstico con el paciente vivo.21,29-32
La importancia clínica de la mucormicosis radica en su alta mortalidad, entre 75 y 80 %, y en el caso de la enfermedad diseminada, de más del 95 %.7 Se ha reportado incluso hasta un 100 % de mortalidad en 46 pacientes con trasplantes de órganos sólidos con zigomicosis diseminada revisados en la literatura,25 aún recibiendo tratamiento específico. Vera y otros describen 42 casos de mucormicosis gástrica en pacientes que había recibido trasplantes, luego de una revisión de todos los reportes disponibles hasta enero del 2002, con una mortalidad del 98 %.32 Por estas razones, es necesario no sólo considerar la enfermedad como posibilidad diagnóstica, sino además evaluar y tratar de modificar los factores de riesgo a los cuales se asocia.
Entre las condiciones del paciente que pueden favorecer el desarrollo de mucormicosis, la acidosis metabólica, que interfiere con la capacidad de la transferrina de unirse al hierro, conduce al aumento de las concentraciones de éste en los tejidos, lo cual favorece el crecimiento del hongo.33 Otra condición favorecedora es la disfunción de neutrófilos y monocitos, como se produce en la diabetes mellitus o bajo el tratamiento inmunosupresor. Los corticosteroides inhiben la fagocitosis ejecutada por los neutrófilos y la ciclosporina inhibe la producción de linfoquinas. Se reporta además el efecto de la azatioprina, a dosis mayores de 2 mg/kg, lo cual predispone a las infecciones en pacientes con trasplantes.26 De manera general, los pacientes con trasplantes de órganos sólidos tienen un mayor riesgo de mucormicosis, sobre todo luego del tratamiento del rechazo agudo con pulsos de esteroides, OKT3 o globulina antitimocítica.13,21 La infección por citomegalovirus en sujetos con trasplantes de órganos sólidos también se ha asociado con mucormicosis.34-36 El requerimiento de grandes volúmenes de hemoderivados intraoperatorios, las infecciones bacterianas y la realización de retrasplante se han reportado como factores de riesgo adicionales para mucormicosis en sujetos con trasplantes de hígado,13 en los que la incidencia de esta fungosis llega al 1,6 % y constituye el 11- 42 % de todas las enfermedades micóticas.20-22
En este centro, un hospital de tercer nivel de atención y con volumen considerable de pacientes receptores de trasplantes de riñón, corazón, médula ósea y hepáticos, se reportó un caso de mucormicosis diseminada en paciente con lupus eritematoso sistémico, en el que se demostraron las hifas en áreas de trombosis cerebral, hepática y renal.37 Sin embargo, el nuestro es el único caso reportado con mucormicosis gástrica entre las 5 772 autopsias realizadas durante 10 años, lo cual contribuye a demostrar lo infrecuente de su presentación.
En conclusión, en el caso que presentamos existían varios factores de riesgo para la aparición de esta grave infección, como la diabetes mellitus, el tratamiento inmunosupresor y la infección bacteriana coexistente. La aparición de sangrado digestivo pudo ser un indicio de la toma vascular que caracteriza a la mucormicosis, en este caso en su infrecuente presentación gástrica, la cual, de haberse diagnosticado, podría haber recibido tratamiento específico con anfotericín B, aunque la respuesta al mismo no suele ser favorable en muchos pacientes.
Summary
Gastric mucormycosis in a female diabetic patient with liver transplant. A case report
A case of gastric mucormycosis in a series of 18 patients that have received liver transplant in a period of 2 years in this centre, was presented. She was a type II diabetic patient aged 57 with Child-Pugh stage C alcoholic liver cirrhosis. An orthotopic liver transplant was performed without complications and an immunosuppressive scheme with prednisone, cyclosporin, and azathioprine. Evolutively, she presented a neurological episode of excitement and then respiratory sepsis due to Acinetobacter sp and Pseudomona sp that led to distress and, later, to multiple organ failure, in addition to high digestive bleeding at 6 days of evolution. The patient died at 13 days of the transplant. Mucor's hyphas were found in the gastric tissues on the necropsy. Post mortem diagnosis was made in a patient with predisposing factors, such as diabetes mellitus, immunosuppressive treatment and associated bacterial sepsis. It was corroborated that it is the only case of gastric mucormycosis reported among 5772 necropsies performed in the centre.
Key words: Gastric mucormycosis, liver transplant, immunodeficiency, mortality.
Referencias bibliográficas
1. Ausina Ruiz J. Micosis profundas causadas por hongos oportunistas. En: Farreras Rozman. Medicina Interna. 14ta ed. Ediciones Harcourt; 2000. (www.harcourtes.2005)
2. Sugar AM. Mucormycosis. Clin Infect Dis 1992;14 (Suppl. 1):126-9.
3. Eucker J, Sezer O, Graf B, Possinger K. Mucormycoses. Mycoses. 2001; 44:253-60.
4. Herbrcht R, Letscher-Bru V, Bowden RA., Kusne S, Anaissiee EJ, Graybill JR et al. Treatment of 21 cases of invasive mucormycosis with anphotericin B colloidal dispersion. Eur J Clin Microbiol Infect Dis 2001;20:460-6.
5. Azadeh B, McCarthy DO´B, Dalton A, Campbell P. Gastrointestinal zygomicosis: two case reports. Histopathology 2004;44:298-9.
6. Rinaldi GM. Zygomycosis. Inf Dis Clin North Am 1989;3:19-41.
7. Pagano L, Ricci P, Tonso A, Nosari A, Cudillo L, Montillo M et al. Mucormycosis in patients with haematological malignancies: a retrospective clinical study of 37 cases. Br J Haematol 1997:99:331-6.
8. Chimelli L, Mahler-Araujo MB. Fungal infections. Brain Pathol 1997;7:613-27.
9. Bennett JE. Mucormycosis. En: Harrison´s Principles of Internal Medicine. 15th ed. Mc Graw-Hill; 2001.
(www. harrisononline.com, 2005)
10. Hagensee ME, Bauwens JE, Kjos B, Bowden RA. Brain abscess following marrow transplantation: experience at the Fred Hutchinson Cancer Research Center . Clin Infect Dis 1994;19:402-8.
11. Bodey GP, Vartivarian S. Aspergillosis. Eur J Microbiol Infect Dis 1989; 8:413-37.
12. Pagano L, Ricci P, Nosari A. F, Tonso A, Buelli M, Montillo M et al. Fatal haemoptysis in pulmonary filamentous mycosis: an underevaluated cause of death in patients with acute leukemia in haematological complete remission: a retrospective study and review of literature. Br J Haematol 1995;89:500-5.
13. Prabhu RM, Patel R. Mucormycosis and entomophthoramycosis: a review of the clinical manifestations, diagnosis and treatment. Clin Microbiol Infect 2004;10 (Suppl. 1):31-47
14. Ribes JA, Vonover-Sams CL, Baker DJ. Zygomycetes in human disease. Clin Microbiol Rev 2000;13:236–301.
15. Sugar AM. Agents of mucormycosis and related species. En: Mandell GI, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 5th ed. New York: Churchill Livingstone, 2000; 2685-95.
16. Chakrabarti A, Kumar P, Padhye AA, Chatha L, Singh SK, Das A et al. Primary cutaneous zygomycosis due to Saksenaea vasiformis and Apophysomyces elegans. Clin Infect Dis 1997;24:580-3.
17. Espinel-Ingroff A, Oakley LA, Kerkering TM. Opportunistic zygomycotic infections. Mycopathologia 1987;97:33-41.
18. Kontoyiannis DP, Wessel VC, Bodey GP, Rolston VI. Zygomycosis in the 1990s in a tertiary-care cancer center. Clin Infect Dis 2000;30:851–6.
19. Lee FY, Mossad SB, Adal KA. Pulmonary mucormycosis: the last 30 years. Arch Intern Med 1999;159:1301-9.
20. Wajszczuk CP, Dummer JS, Ho M, Van Thiel TE, Iwatsuki S, Shaw B. Fungal infections in liver transplant recipients. Transplantation 1985;40:347-53.
21. Jiménez C, Lumbreras C, Aguado JM, Loinaz C, Paseiro G, Andrés A et al. Successful treatment of Mucor infection after liver or pancreas-kidney transplantation. Transplantation 2002;73:476-80.
22. Castaldo P, Stratta RJ, Wood RP, Markin RS, Patil KD, Shaefer MS et al. Clinical spectrum of fungal infections after orthotopic liver transplantation. Arch Surg 1991;126:149-56.
23. Mir N, Edmonson R, Yeghen T, Rashed H. Gastrointestinal mucormycosis complicated by arterio-enteric fistula in a patient with non Hodgkin´s lymphoma. Clin Lab Haematol. 2000;22:41-3.
24. Paltouf A. Mycosis mucorina. Virchow´s Arch 1885;102:543-64.
25. Singh N, Gayowski T, Singh J, Yu VL. Invasive gastrointestinal zygomycosis in a liver transplant recipient: case report and review of zygomycosis in solid-organ transplant recipients. Clin Infect Dis 1995;20:617-20.
26. Martinez EJ, Cancio MR, Sinnott J, Tt Vincent AL , Brantley SG. Nonfatal gastric mucormycosis in a renal transplant recipient. South Med J 1997; 90:341-4.
27. Calle S, Klatsky S. Intestinal phycomycosis (mucormycosis). Am J Clin Pathol 1966;45:264-72.
28. Parfrey NA. Improved diagnosis and prognosis of mucormycosis. A clinicopathological study of 33 cases. Medicine 1986;65:113-23.
29. Gonzalez CE, Couriel DE, Walsh TJ. Disseminated zygomycosis in a neutropenic patient: successful treatment with amphotericin B lipid complex and granulocyte colony-stimulating factor. Clin Infect Dis 1997; 24:192-6.
30. St.-Germain G, Robert A, Ishak M, Tremblay C, Claveau S. Infection due to Rhizomucor pusillus: report of four cases in patients with leukemia and review. Clin Infect Dis 1993;16:640-5.
31. Rangel-Guerra RA, Martínez HR, Sáenz C, Bosques-Padilla F, Estrada-Bellmann I. Rhinocerebral and systemic mucormycosis. Clinical experience with 36 cases. J Neurol Sci 1996;143:19-30.
32. Vera A, Hubscher SG, McMaster P, Buckels JA. Invasive gastrointestinal zygomycosis in a liver transplant recipient: case report. Transplantation 2002;73 (1):145-7.
33. Artis WM, Fountain JA, Delcher HK, Jones HE. A mechanism of susceptibility to mucormycosis in diabetic ketoacidosis: transferrin and iron availability. Diabetes 1982;31:1109-14.
34. Ruffini E, Baldi S, Rapellino M, Cavallo A, Parola A, Robbiano F et al. Fungal infections in lung transplantation. Incidence, risk factors and prognostic significance. Sarcoid Vasc Diff Lung Dis 2001;18:181-90.
35. Baraia J, Munoz P, Bernaldo de Quiros JC, Bouza E. Cutaneous mucormycosis in a heart transplant patient associated with a peripheral catheter. Eur J Clin Microbiol Infect Dis 1995;14:813-5.
36. Stas KJ, Louwagie PG, Van Damme BJ, Coosemans W, Waer M, Vanrenterghem YF. Isolated zygomycosis in a bought living unrelated kidney transplant. Transplant Int 1996;9:600-2.
37. Pérez MD, Hernández PJ, Vázquez A, Rojas A, Álvarez C. Mucormicosis y trombosis múltiple en una paciente con lupus eritematoso sistémico. Rev Cubana Med 1988;27 (3):93-8.
Recibido: 30 de agosto de 2005. Aprobado: 24 de septiembre de 2005.
Dra. Evelin E. Lara Molina. San Lázaro No. 409 entre Manrique y Campanario, Ciudad de La Habana, Cuba. CP 10200. Correo electrónico: evelin.lara@infomed.sld.cu
1Especialista de I Grado en Medicina Interna. Instructora.
2Especialista de II Grado en Cirugía General. Instructor.
3Especialista de I Grado en Cirugía General.
4Especialista de I Grado en Medicina Interna.
5Especialista de II Grado en Anatomía Patológica.