Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.45 n.3 Ciudad de la Habana jul.-sep. 2006
Hospital Clinicoquirúrgico Hermanos Ameijeiras
Utilización y valor predictivo de la determinación de anticuerpos antinucleares en un Hospital de Referencia Nacional de Salud
Dra. Elena Kokuina,1 Dra. Araceli Chico,2 Dr. Miguel Estévez,2 Dr. Dionisio Pérez,3 Dra. Ángela Gutiérrez4 y Dr. Celso Cruz5
Resumen
Se hizo una revisión retrospectiva de datos clínicos y demográficos en un Hospital de Referencia Nacional de Salud de 950 camas. Se tomó una muestra consecutiva de pacientes hospitalizados y ambulatorios con solicitud médica de anticuerpos antinucleares por inmunofluorescencia indirecta (AAN-IFI) en un período de 18 meses para definir el valor predictivo positivo (VPP) y negativo (VPN) de los AAN-IFI, anticuerpos anti-DNA de doble cadena (anti-DNAdc) y anti-antígenos nucleares extraíbles (anti-ENA) para el diagnóstico del LES y de las conectivopatías, y el VPP y VPN de los AAN-IFI para la detección de los anticuerpos anti-DNAdc y anti-ENA. Se halló que 2 113 pacientes han sido referidos para la determinación de AAN-IFI, de los cuales a 273 se les determinó además anticuerpos anti-DNA de doble cadena (anti-DNAdc) y a 233 anti-antígenos nucleares extraíbles (anti-ENA); 651fueron registrados con el diagnóstico de enfermedad del tejido conectivo (ETC) y de estos, 97 con lupus eritematoso sistémico (LES). Los valores predictivos de los resultados positivos de AAN-IFI para las ETC y el LES fueron de 59,8 y 22,8 %, respectivamente, mientras que el de anti-ENA para las ETC fue 99,0 %, y el de anti-DNAdc para el LES fue 97,3 %. Los valores predictivos de los resultados negativos de AAN-IFI para las ETC y el LES fueron de 76,0 y 99,7 %, respectivamente, mientras que el de anti-ENA para las ETC fue 28,4 %, y el de anti-DNAdc para el LES fue 87,9 %. Se concluyó que la mayor parte de los resultados de AAN-IFI fueron negativos y solicitados en pacientes sin conectivopatías, lo que dio lugar a valores predictivos bajos y una utilidad clínica cuestionable. Estos datos sugieren una sobreutilización inadecuada de la prueba de AAN-IFI, fuera de un contexto clínico lógico. Esta situación puede corregirse con una esmerada preselección de los pacientes basada en la presencia de varios criterios clínicos reconocidos de las conectivopatías.
Palabras clave: Anticuerpos antinucleares, valor predictivo, utilidad clínica.
La técnica para la detección de anticuerpos antinucleares mediante inmunofluorescencia indirecta (AAN-IFI) fue desarrollada por Friou en 19571 e introducida en Cuba en 1983, en el Laboratorio de Inmunología del Hospital Clinicoquirúrgico Hermanos Ameijeiras. El valor clínico del método de AAN-IFI se ha establecido mediante la determinación de su sensibilidad y especificidad para el diagnóstico del lupus eritematoso sistémico (LES) y otras enfermedades del tejido conectivo o conectivopatías.2,3 Sin embargo, como la presencia de los anticuerpos antinucleares no es exclusiva de las conectivopatías porque pueden detectarse además en otras condiciones clínicas de diversa naturaleza, se precisa definir el significado clínico exacto de un resultado positivo y negativo de AAN-IFI, lo que se representa por su valor predictivo, que es la característica más informativa de una prueba para la toma de decisiones diagnósticas diarias.4
AAN-IFI es el método de inicio en el estudio de anticuerpos antinucleares y sus resultados deben constituir una guía de las investigaciones subsiguientes de las especificidades antinucleares, de modo que los resultados positivos justifiquen la búsqueda de especificidades particulares, mientras que los resultados negativos permitan concluir el estudio de los anticuerpos antinucleares. Este trabajo se ha diseñado para definir el valor predictivo positivo (VPP) y negativo (VPN) de los AAN-IFI, anticuerpos anti-DNA de doble cadena (anti-DNAdc) y anti-antígenos nucleares extraíbles (anti-ENA) para el diagnóstico del LES y de las conectivopatías, y el VPP y VPN de los AAN-IFI para la detección de los anticuerpos anti-DNAdc y anti-ENA.
Métodos
El Laboratorio de Inmunología del Hospital Clinicoquirúrgico Hermanos Ameijeiras asiste a la población cubana adulta referida de las comunidades urbanas y suburbanas de todas las provincias del país. Se realizó un estudio retrospectivo descriptivo mediante la revisión de datos clínicos y demográficos de pacientes mayores de 14 años consecutivos hospitalizados y ambulatorios con solicitud médica de determinación de AAN-IFI desde enero de 2003 hasta julio de 2004. Se tomaron los datos referentes a la edad, sexo, diagnóstico de referencia, especialidad médica de referencia, y resultados de AAN-IFI, anti-DNAdc y anti-ENA del software modular GALEN (Softel, Habana) para registro y análisis de datos hospitalarios. Los pacientes fueron agrupados según el diagnóstico de referencia en 6 categorías nosológicas arbitrarias: lupus eritematoso sistémico (LES), enfermedades del tejido conectivo o conectivopatías (ETC) distintas al LES, enfermedades reumáticas distintas a las ETC, enfermedades autoinmunes distintas a las ETC, enfermedades no reumáticas no autoinmunes y síndromes aún no diagnosticados. El diagnóstico de LES fue establecido según los criterios aceptados.5 Las ETC distintas al LES comprendieron la artritis reumatoidea, la esclerosis sistémica progresiva, el síndrome de Sjögren, la polimiositis, la dermatomiositis, la enfermedad mixta del tejido conectivo, el lupus crónico discoide y la conectivopatía indiferenciada, esta última se refiere a pacientes que presentaron combinaciones inespecíficas de síntomas de enfermedades del tejido conectivo, las cuales son insuficientes para cumplir los criterios diagnósticos de las conectivopatías mencionadas anteriormente.6 Las enfermedades reumáticas distintas a las ETC agruparon las espondiloartropatías, la osteoartritis, el reumatismo de tejidos blandos y otras enfermedades musculoesqueléticas; las enfermedades autoinmunes distintas a las ETC comprendieron enfermedades autoinmunes hematológias, neurológicas, y específicas de órgano; y las enfermedades no reumáticas no autoinmunes incluyeron enfermedades infecciosas, alérgicas, tumorales y misceláneas.
Determinación de anticuerpos antinucleares
La detección de AAN-IFI se realizó sobre cortes de criostato de hígado de rata. Los resultados se consideraron positivos en la dilución 1:10 del suero y estos se clasificaron según la intensidad de fluorescencia en la escala de 4º, se identificaron además 4 patrones de fluorescencia nuclear.3 Los anticuerpos anti-DNAdc y anti-ENA fueron determinados según solicitudes médicas. La determinación de los anticuerpos anti-DNAdc se realizó por IFI sobre preparaciones de Crithidia luciliae.7 Los sueros fueron analizados en la dilución de 1:10 y se consideraron como positivas las muestras que mostraban fluorescencia del mitocondrión y del núcleo del mismo hemoflagelado.7 Los sueros controles negativos y positivos de AAN y anticuerpos anti-DNAdc fueron gentilmente donados por el Laboratorio de Inmunología del Instituto Nacional de Enfermedades Respiratorias (México, DF). La determinación de anticuerpos anti-ENA comprendió la detección de anticuerpos frente a un surtido de antígenos extraíbles como: Sm, nRNP, Ro(SS-A), La(SS-B), Scl-70 y Jo-1 y se realizó mediante ensayo inmunoenzimático de fase sólida, ELISA (Sigma Diagnostics, St. Louis). En caso de resultados múltiples por paciente, se consideraron únicamente los resultados del primer estudio de autoanticuerpos.
Análisis estadístico
Se utilizó la prueba de X2 para comparar proporciones. Se consideró como significante el valor de p < 0,05. La sensibilidad, la especificidad, el valor predictivo positivo (VPP) y negativo (VPN) de los distintos autoanticuerpos se determinó según fórmulas convencionales.
Resultados
Frecuencia de los resultados positivos de AAN-IFI, patrones e intensidad de fluorescencia
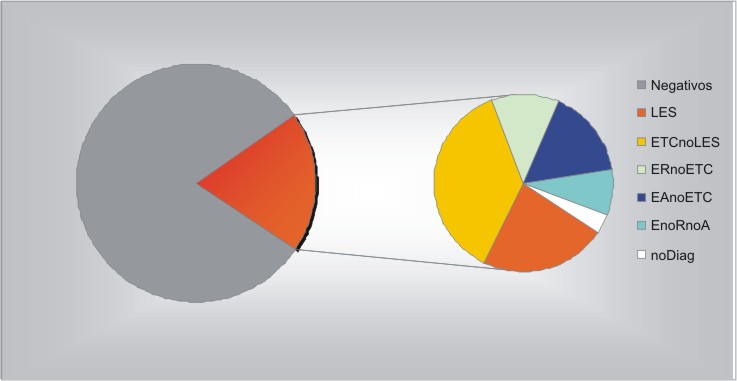
En el período analizado fueron remitidos 2 113 pacientes a este laboratorio para la detección de anticuerpos antinucleares. La frecuencia de AAN-IFI en esta población fue de 19,1 % (403/2113). La edad promedio de los pacientes con AAN-IF positivos fue de 42,2 años (rango de edad de 15 a 73 años); mientras que la de los pacientes con AAN-IFI negativos de 41,9 años (rango de edad de 14 a 79 años). Los pacientes mayores de 65 años representaron el 10,2 % (41/403) de los resultados de AAN-IFI positivos y el 6,6 % (112/1710) de los resultados de AAN-IFI negativos (p < 0,02). La relación mujer: hombre de los AAN-IFI positivos fue de 5,7: 1,0 (343 : 60); y de los AAN-IFI negativos de 4,5:1 (1397:313) ( p > 0,05 ). Se remitieron 97 pacientes con LES; 554 con conectivopatía no LES; 669 con enfermedad reumática no conectivopatía; 380 con enfermedad autoinmune no conectivopatía; 298 con enfermedad no reumática no autoinmune y 115 sin diagnóstico. Las distintas categorías de diagnóstico de referencia asociadas con resultados positivos de AAN-IFI se muestran en la figura 1. Los porcentajes de resultados positivos de AAN-IFI en las distintas categorías diagnósticas se muestran en la figura 2. Las solicitudes de AAN-IFI fueron formuladas por especialistas en reumatología (24,0 %), medicina interna (21,0 %), nefrología (10,0 %), dermatología (9,0 %), hematología (8,0 %), medicina general integral (8,0 %), gastroenterología (6,0 %), neurología (5,0 %), endocrinología (2,0 %) y otros (7,0 %). Las solicitudes de anti-DNAdc y anti-ENA correspondieron a especialistas en reumatología (72,0 %), medicina interna (17,0 %) y otros (11,0 %).
Fig. 1. Categorías diagnósticas asociadas con 403 resultados positivos de anticuerpos
antinucleares (AAN-IFI)(cuña color rojo del pastel izquierdo).
LES: Lupus eritematoso sistémico, n:92 (22,8 %). ETCnoLES: Conectivopatías distintas al LES, n:149 (37,0 %). ERnoETC: Enfermedades reumáticas no conectivopatías. 49 (12,2 %). EAnoETC: Enfermedades autoinmunes no conectivopatías, n:65 (16,1 %). EnoRnoA: Enfermedades no reumáticas no autoinmunes, n:34 (8,4 %). Sin diagnóstico, n:14 (3,5 %).
Fig. 2. Resultados de anticuerpos antinucleares (AAN-IFI) en pacientes con lupus eritematoso sistémico
(LES,AAN-IFI+: 94,9 %, n:97), otras enfermedades del tejido conectivo (ETC,AAN-IFI+: 26,9 %, n:554), enfermedades reumáticas no conectivopatías (ERnoETC,AAN-IFI+: 7,3 %, n:669), enfermedades autoinmunes no conectivopatías (EAnoETC,AAN-IFI+: 17,1 %, n:380), enfermedades no reumáticas no autoinmunes (EnoRnoA,AAN-IFI+: 11,4 %, n:298) y sin diagnóstico (AAN-IFI+: 12,2 %, n:115 ).
La tabla 1 presenta la distribución de los patrones de fluorescencia y de los grados de intensidad de fluorescencia en las muestras positivas de AAN-IFI. Los patrones individuales prevalecieron sobre los múltiples, considerados como la presencia de más de un patrón de fluorescencia (233 vs. 170), y dentro de los primeros el más frecuente fue el patrón homogéneo (58,8 %), seguido por el granular (36,5 %), el nucleolar (3,0 %) y el periférico (1,7 %). La presencia de patrones múltiples estuvo asociada a la intensidad de fluorescencia superior a grado I (p < 0,001). La distribución de los grados de intensidad de fluorescencia y la presencia de patrones múltiples en pacientes con conectivopatías (tabla 2) fue desigual en relación al resto de pacientes AAN positivos (p < 0 ,001; p < 0 ,001), lo que se asoció con que el 78,0 % de los resultados de intensidad de fluorescencia mayor de grado I y el 78,2 % de los resultados de patrones múltiples correspondieron a pacientes con conectivopatías. El patrón periférico, la presencia de patrones múltiples y la intensidad de fluorescencia mayor de grado I se encontraron con una frecuencia significativamente mayor en pacientes con LES (p < 0,001; p < 0,001; p < 0,001). Otros patrones no se asociaron de forma significativa a ninguna enfermedad o categoría de enfermedades.
Tabla 1. Distribución de los patrones de fluorescencia en relación con los grados
de intensidad de fluorescencia de los resultados positivos de anticuerpos antinucleares (AAN-IFI)
| Grados de intensidad de fluorescencia | | ||||
| I | II | III | IV | ||
| Patrón homogéneo | 87 | 37 | 10 | 3 | 137 |
| Patrón periférico | 0 | 2 | 0 | 2 | 4 |
| Patrón granular | 43 | 23 | 11 | 8 | 85 |
| Patrón nucleolar | 3 | 3 | 1 | 0 | 7 |
| >1patrón | 29 | 65 | 62 | 14 | 170 |
| Total | 162 | 130 | 84 | 27 | 403 |
Significancia: p < 0,001.
Tabla 2. Distribución de los resultados de anticuerpos antinucleares (AAN-IFI) según
la intensidad de fluorescencia en pacientes con conectivopatía y con otro diagnóstico
| Grados de intensidad de fluorescencia | Total | ||||
| I | II | III | IV | ||
| Pacientes con conectivopatía | 53 | 88 | 75 | 25 | 241 |
| Pacientes sin conectivopatía | 109 | 42 | 9 | 2 | 162 |
| Total | 162 | 130 | 84 | 27 | 403 |
Significancia: p < 0,001.
Valor predictivo positivo y negativo de los AAN-IFI, anti-ENA y anti-DNAdc para el diagnóstico de las ETC y del LES
Fueron registrados 651 pacientes con el diagnóstico de referencia correspondiente a cualquier ETC incluido el LES, de los cuales el 37,0 % (241/651) fueron positivos de AAN-IFI. El porcentaje de resultados positivos de AAN-IFI en pacientes sin ETC ha sido de 11,1 % (162/1462). La sensibilidad, especificidad y los valores predicitvos positivo y negativo de los AAN-IFI para las ETC se muestran en la tabla 3. De los 233 pacientes estudiados para los anti-ENA, 194 correspondieron a pacientes con ETC; y de los 99 resultados positivos de estos anticuerpos, 98 correspondieron a pacientes con ETC, lo que permitió calcular la sensibilidad, especificidad, y los valores predictivos positivo y negativo de los anti-ENA para las ETC (tabla 3).
Tabla 3. Sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo
de los anticuerpos antinucleares (AAN-IFI) y anti-ENA para cualquier enfermedad del tejido conectivo.
| Sensibilidad | Especificidad* | Valor predictivo positivo* | Valor predictivo negativo* | |
| AAN-IFI | 37 ,0 | 88 ,9 | 59 ,8 | 76 ,0 |
| Anti-ENA | 50 ,5 | 97 ,4 | 99 ,0 | 28 ,4 |
* Estos indicadores fueron calculados respecto al total de pacientes con AAN-IFI o anti-ENA realizados.
Nota: Los resultados se expresan en porcentajes.
La prevalencia del LES en nuestro laboratorio fue de 4,6 % ( 97 pacientes con diagnóstico de LES en un total de 2 113 pacientes estudiados). De los 97 pacientes con diagnóstico de LES, 92 fueron positivos de AAN-IFI (fig. 2), y 73 fueron positivos de anti-DNAdc, lo que se correspondió con una sensibilidad de 94,9 % y una especificidad de 84,6 % de los AAN-IFI; y una sensibilidad de 75,3 % y una especificidad de 98,9 % de los anti-DNAdc para esta enfermedad (tabla 4).
Tabla 4. Sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo
de los anticuerpos antinucleares (AAN-IFI) y anti-DNAdc para el lupus eritematoso sistémico
| Sensibilidad | Especificidad* | Valor predictivo positivo* | Valor predictivo negativo* | |
| AAN-IFI | 94 ,9 | 84 ,6 | 22 ,8 | 99 ,7 |
| Anti-DNAdc | 75 ,3 | 98 ,9 | 97 ,3 | 87 ,9 |
* Estos indicadores fueron calculados respecto al total de pacientes con AAN-IFI
o anti-DNAdc realizados. Nota: Los resultados se expresan en porcentajes.
De las 403 muestras positivas para AAN-IFI, solo 92 pertenecieron a pacientes con LES (fig. 1), y de las 1 710 negativas de AAN-IFI, 1 705 a pacientes sin ese diagnóstico, lo que se correspondió con los VPP y VPN de AAN-IFI mostrados en la tabla 4. De los 75 resultados positivos de anti-DNAdc, 73 correspondieron a pacientes con LES, y de los 198 negativos, 174 a pacientes sin el diagnóstico de LES, lo que permitió calcular los VPP y VPN de la tabla 4.
Valor predictivo positivo y negativo de AAN-IFI para la detección de anticuerpos anti-DNAdc y anti-ENA
Del total de 2 113 pacientes con solicitud de determinacion de AAN-IFI, a 273 se les determinaron además los anticuerpos anti-DNAdc y a 233, los anticuerpos anti-ENA. Los anticuerpos anti-DNAdc se encontraron en 75 de los 273 pacientes (27,5 %); y los anti-ENA en 99 de los 233 (42,5 %) pacientes analizados. La concurrencia de los anti-DNAdc y los anti-ENA se presentó en 23 de los 134 (17,2 %) pacientes en quienes fueron determinados ambos. La sensibilidad y los valores predictivos positivo y negativo de los AAN-IFI para la detección de anticuerpos anti-DNAdc y anti-ENA se muestran en la tabla 5. La frecuencia de aparición de los anticuerpos anti-DNAdc y anti-ENA en correspondencia con los distintos patrones y grados de intensidad de fluorescencia de AAN-IFI se representa en las tablas 6 y 7. La distribución de los anti-DNAdc y los anti-ENA fue diferente entre los distintos patrones de fluorescencia (p < 0,001; p < 0,05, respectivamente). Mientras el 100 % de las muestras de patrón periférico y el 80,2 % de las de patrones múltiples fueron positivas para la presencia de los anti-DNAdc; el 61,5 % de las muestras de patrón granular y el 65,2 % de las de patrones múltiples fueron positivas para los anti-ENA (tabla 6). La distribución de los anti-DNAdc y los anti-ENA fue diferente también entre los grados de intensidad de fluorescencia (p < 0,001 para ambas). Las muestras de grado I de AAN-IFI carecían de anti-DNAdc (0,0 %); mientras que el 84,0 % y el 80,0 % de las muestras de grado IV de AAN-IFI fueron positivas para los anti-DNAdc y los anti-ENA, respectivamente (tabla 7).
Tabla 5. Sensibilidad, valor predictivo positivo y valor predictivo negativo de los anticuerpos
antinucleares (AAN-IFI) para la presencia de anticuerpos anti-DNAdc y anti-ENA
| Sensibilidad | Valor predictivo positivo | Valor predictivo negativo | |
| Anti-DNAdc | 98,7 | 49,0 | 99,2 |
| Anti-ENA | 93,9 | 58,1 | 91,8 |
Nota: Los resultados se expresan en porcentajes.
Tabla 6. Probabilidades de presencia de anticuerpos anti-DNAdc y anti-ENA según
el patrón de fluorescencia de anticuerpos antinucleares (AAN-IFI)
| Patrón de fluorescencia | Significancia | |||||
| Homogéneo | Periférico | Granular | Nucleolar | >1patrón | ||
| a-DNAdc | 11,8 | 100,0 | 6,7 | 0,0 | 80,2 | p<0,001 |
| a-ENA | 36,4 | 0,0 | 61,5 | 20,0 | 65,2 | p<0,05 |
Nota: Los resultados se expresan en porcentajes.
Tabla 7. Probabilidades de presencia de anticuerpos anti-DNAdc y anti-ENA según
la intensidad de fluorescencia de anticuerpos antinucleares (AAN-IFI)
| Intensidad de fluorescencia | Significancia | ||||
| I | II | III | IV | ||
| a-DNAdc | 0,0 | 39,4 | 59,7 | 84,0 | p<0,001 |
| a-ENA | 30,0 | 35,1 | 75,0 | 80,0 | p<0,001 |
Nota: Los resultados se expresan en porcentajes.
Discusión
La determinación de anticuerpos antinucleares es una prueba clave para diagnosticar enfermedades del tejido conectivo y representa una de las solicitudes más frecuentes en un laboratorio de inmunología de un hospital clínico general. Sin embargo, los anticuerpos antinucleares pueden presentarse también en diversas condiciones clínicas y no clínicas. La utilización inapropiada de la determinación de anticuerpos antinucleares puede provocar diagnósticos falsos y tratamientos innecesarios de los pacientes. Su sobreutilización pudiera resultar en gastos adicionales además de los que conciernen a estas determinaciones, por las potenciales remisiones a especialistas de reumatología e indicaciones de otras pruebas para corroborar el diagnóstico sugerido por un resultado positivo falso de anticuerpos antinucleares. En este estudio retrospectivo hemos clasificado los pacientes referidos a nuestro laboratorio durante un período de 18 meses para la determinación de AAN-IFI, anticuerpos anti-DNAdc y anti-ENA con el objetivo de calcular el valor predictivo de estas pruebas para el diagnóstico del LES y de las conectivopatías.
Ha sido importante conocer que 19,1 % de los pacientes remitidos a este laboratorio para la determinación de ANA-IFI fueron positivos para esta prueba. El acentuado predominio del sexo femenino en pacientes con resultados positivos de AAN-IFI (85,1 %) se correspondió con similar desproporción a favor de este sexo en la población de estudio, por lo que no se encontraron diferencias significativas en la distribución de resultados positivos de AAN-IFI entre ambos sexos. A pesar de que las mujeres desarrollan con mayor frecuencia enfermedades del tejido conectivo, la capacidad de producir autoanticuerpos antinucleares resultó equivalente en ambos sexos, lo que también ha sido señalado por otros autores.9
Se ha descrito el efecto de la edad sobre los resultados de AAN-IFI.9,10 El grupo con resultados positivos de AAN-IFI incluyó una proporción significativamente mayor de pacientes mayores de 65 años respecto al grupo con resultados negativos de AAN-IFI (10,2 vs. 6,6 %). Resultados similares fueron encontrados por Slater y otros,10 lo que junto a la baja prevalencia de conectivopatías en personas mayores de 65 años, exige cautela para establecer el diagnóstico de estas enfermedades en pacientes de edad avanzada con AAN-IFI positivos.
Hemos comprobado que en nuestra población, al igual que se ha señalado en otras poblaciones de origen caucasoide,11,12 los resultados positivos de AAN-IFI están asociados tanto con enfermedades del tejido conectivo como con enfermedades distintas a las conectivopatías, las cuales pueden ser autoinmunes o no autoinmunes. Sin embargo, los pacientes con conectivopatías se destacaron del resto por el mayor grado de intensidad de fluorescencia y la presencia de patrones múltiples de los AAN-IFI. Estas características, además de la presencia del patrón periférico, fueron distintivas, pero no exclusivas, en los pacientes con LES. Estos resultados concuerdan con el criterio de que la probabilidad de una enfermedad del tejido conectivo es mayor cuando los títulos de AAN-IFI son más altos.13
El método de AAN-IFI clasificó prácticamente todos los pacientes con el diagnóstico de LES (94,9 %) y una notable proporción de los pacientes con conectivopatías (37,0 %). Estas cifras de sensibilidad, así como las de especificidad de AAN-IFI fueron similares a las que son aceptadas generalmente para estas enfermedades.5,14,15 La sensibilidad y la especificidad del método indican la proporción de verdaderos positivos y verdaderos negativos de una enfermedad determinada. Desde el punto de vista clínico, sin embargo, no es suficiente conocer cuántos de los pacientes con una enfermedad dada tienen la prueba positiva, porque los pacientes acuden a la consulta sin un diagnóstico establecido. Más bien, el dilema consiste en conocer cuántos de los pacientes con una prueba positiva tienen la enfermedad asociada. Esta probabilidad está dada por el valor predictivo positivo de la prueba. El valor predictivo positivo es altamente dependiente de la prevalencia de la enfermedad en la población donde se aplica la prueba. Por ejemplo, la detección de los autoanticuerpos en la población general generará solo resultados limitados, pues la prevalencia de las conectivopatías en la población general es baja, por otra parte, la aplicación de la prueba en un grupo de pacientes con eritema malar, artritis y hematuria proporcionará un valor predictivo alto, ya que la probabilidad pre-prueba de los pacientes con estas características de tener un LES es también alta. En este estudio, los valores predicitvos positivos de AAN-IFI para el LES y las conectivopatías fueron bajos (22,8 y 59,8 %, respectivamente), lo que se explica por la relativamente baja prevalencia de estas enfermedades en nuestra población de estudio. Sólo el 4,6 % de los pacientes con solicitud médica de AAN-IFI tenían el diagnóstico de LES, y el 30,8 % de cualquier conectivopatía. Valores predicitvos aún más bajos de AAN-IFI para el LES y las conectivopatías se han registrado en otros estudios.10,14,15 Algunos de estos estudios se habían efectuado en pacientes diagnosticados por médicos generales y no por especialistas, como en nuestro caso, donde la mayoría de las solicitudes han sido formuladas por médicos de diferentes especialidades clínicas, entre las cuales ocuparon un lugar importante los reumatólogos (24,0 %) y los internistas (21,0 %). Slater y otros10 pudieron probar que el valor predictivo positivo de los AAN-IFI para las conectivopatías aumentó significativamente cuando los AAN-IFI fueron solicitados por los reumatólogos (69 %), en comparación cuando fueron solicitados por otros especialistas (10 %), lo que fue atribuido a la alta prevalencia de estas enfermedades en la población de pacientes reumatológicos. Para incrementar el valor predictivo de los AAN-IFI se han propuesto estrategias dirigidas a seleccionar a los pacientes sospechosos de LES sobre la base de más de un criterio clínico para la clasificación de esta enfermedad. La adecuada selección de los pacientes que requieren la prueba de AAN-IFI sobre la base de varios criterios clínicos establecidos para el LES mejora notablemente el valor predictivo positivo de esta prueba al aumentar la probabilidad de la enfermedad en el grupo a examinar.4,16
La identificación de anticuerpos antinucleares específicos como anti-DNAdc y anti-ENA aumentó notablemente los valores predictivos positivos hasta alcanzar un nivel de importancia diagnóstica real en la práctica clínica. El valor predictivo positivo de los anti-ENA y anti-DNAdc para las conectivopatías y para el LES fueron muy altos (99,0 y 97,3 %, respectivamente), lo que se debió a una proporción muy baja de falsos positivos, que guardó relación con la alta especificidad de estas pruebas (97,4 y 98,9 %, respectivamente), y a un número más reducido de solicitudes de estos anticuerpos formuladas, además, fundamentalmente por reumatólogos (72,0 %).
Los valores predicitvos negativos tanto de los AAN-IFI, como de los anti-DNAdc para el LES fueron altos (99,7 y 87,9 %, respectivamente); mientras que los de AAN-IFI y anti-ENA para el diagnóstico de cualquier conectivopatía fueron inferiores (76,0 y 28,4 %, respectivamente), lo que se relacionó con la elevada proporción de falsos negativos de estos autoanticuerpos para las conectivopatías en general. El elevado valor predictivo negativo de los AAN-IFI para el LES indica que esta prueba es utilizada más bien para confirmar la ausencia del LES que para sumar otro criterio diagnóstico, como lo han concluido otros estudios.4,15-17
Los resultados cualitativos y cuantitativos de AAN-IFI han demostrado la variedad esperada de patrones de fluorescencia, el patrón más repetido fue el homogéneo. La presencia de patrones múltiples estuvo asociada a mayor intensidad de fluorescencia nuclear. Algunos de los patrones de fluorescencia proporcionaron información definitiva de la especificidad del anticuerpo antinuclear, como el patrón periférico que se asoció con la presencia absoluta de anticuerpos anti-DNAdc; y el patrón nucleolar, que significó ausencia de estos anticuerpos. Este resultado es consistente con el hecho de que los anticuerpos anti-DNAdc producen patrón periférico en el método de los AAN-IFI.18 Los patrones múltiples se asociaron a una alta probabilidad de presencia de anticuerpos anti-DNAdc (80,2 %) y anti-ENA (65,2 %), lo que le añade mayor significado patogénico a la expresión de patrones múltiples de los AAN-IFI. Kang y otros9 encontraron que la presencia de anti-DNAdc depende tanto de los patrones como de los títulos de AAN-IFI; mientras que la presencia de anti-ENA depende solamente de los títulos de inmunofluorescencia. Peene y otros19 señalaron que a mayor intensidad de fluorescencia de AAN-IFI, mayor es la probabilidad de detectar anticuerpos antinucleares específicos. Según nuestro estudio, la probabilidad de los anticuerpos anti-DNA fue nula en el grado I de intensidad de fluorescencia y aumentó hasta el 84,0 % en el grado IV; mientras que los anti-ENA, aunque se distribuyeron en todos los grados de fluorescencia, se presentaron con mayor frecuencia en los grados III (75,0 %) y IV (80,0 %). Nuestros datos indican la importancia de los patrones y el grado de fluorescencia para predecir la probabilidad de los anticuerpos anti-DNAdc y anti-ENA; y una recomendación práctica que se desprende es que las muestras con grado I de fluorescencia en AAN-IFI no merecen ser investigadas para anti-DNAdc, al menos que existan argumentos clínicos potentes a favor del LES; sin embargo, la determinación de anti-ENA es pertinente con cualquier grado de fluorescencia de AAN-IFI.
La sensibilidad de los AAN-IFI para la detección de especificidades antinucleares ha sido alta, especialmente para los anticuerpos anti-DNAdc (98,7 %); al igual que el valor predictivo negativo para la presencia de estos anticuerpos (99,2 %), lo que destaca a los AAN-IFI como un excelente método para el cribado de los anticuerpos anti-DNAdc y descarta prácticamente la presencia de estos anticuerpos en muestras negativas de AAN-IFI. La sensibilidad elevada del método de AAN-IFI para el LES y para la detección de especificidades antinucleares, junto con su fácil realización y relativamente bajo costo indican que este método posee todas las características para ser empleado como prueba de inicio del diagnóstico inmunológico de las enfermedades del tejido conectivo, mientras que la determinación de los anticuerpos anti-DNAdc y anti-ENA por su mayor especificidad y valor predictivo positivo serán más eficaces como pruebas de segundo nivel. El enfoque escalonado en el diagnóstico inmunológico de las enfermedades del tejido conectivo permite el uso adecuado y económico de las determinaciones de anticuerpos antinucleares y ha sido recomendado por los expertos en las pautas elaboradas para esos fines.20,21
Este estudio permitió concluir que la mayoría de los resultados del método de AAN-IFI fueron negativos e indicados para condiciones clínicas distintas a las conectivopatías, lo que ha dado lugar a numerosos falsos positivos y, en consecuencia, a valores predictivos bajos. Estos datos apuntan hacia la sobreutlilización inadecuada de los AAN-IFI, con intención de excluir, más que de confirmar, un diagnóstico. La reducción del uso inadecuado de los AAN-IFI se podría lograr mediante una preselección esmerada de los pacientes sobre la base de más de un síntoma o criterio clínico reconocido para clasificar las conectivopatías. Nuestros resultados enfatizan y confirman la importancia de la investigación clínica dirigida a alcanzar la utilización más apropiada de las determinaciones de anticuerpos antinucleares para diagnosticar las enfermedades del tejido conectivo.
Summary
Use and predictive value of the determination of antinuclear antibodies in a national health reference hospital
A retrospective review of the clinical and demographic data was made in a teaching hospital of 950 beds. A consecutive sample of inpatients and outpatients with medical request of indirect immunofluorescence antinuclear antibodies test (IIF-ANA) in a period of 18 months was taken to define the positive predictive value (PPV) and the negative predictive value (NPP) of the IIF-ANA, anti-dsDNA antibodies, and anti-extractable nuclear antigens (anti-ENA) for the diagnosis of SLE and connectivopathies. The PPV and the NPP of the IIF-ANA for the detection of anti-DNA antibodies and anti-ENA were also calculated. It was found that 2 113 patients had been referred for the determination of IIF-ANA, of whom 273 were determined anti-doble strand DNA antibodies (anti-dsDNA) and 233 anti-extractable nuclear antigens (anti-ENA). 651 were registered with diagnosis of connective tissue disease (CTD), and 97 of them with systemic lupus erythematosus (SLE). The predicitive values of the positive results of IFI-ANA for the CTD and SLE were 59.8 and 22.8 %, respectively, whereas this same value of the anti-ENA for the CTD was 99.0 %, and that of the anti-dsDNA for the SLE was 97.3 %. The predictive values of the negative results of the IFI-ANA for the CTD and the SLE were 76.0 and 99.7 %, respectively. The predictive value of the negative results of the anti-ENA for the CTD was 28.4 % and that of the anti-dsDNA for the SLE was 87.9 %. It was concluded that most of the results of the IIF-ANA were negative and they were required for patients without connectivopathies, which gave rise to low predictive values and to a questionable clinical usefulness. These data suggest an inadequate overuse of the IIF-ANA test out of a logical clinical context. This situation may be corrected with a careful preselection of the patients based on the presence of various recognized clinical criteria of the connectivopathies.
Key words: Antinuclear antibodies, predictive value, clinical usefulness.
Referencias bibliográficas
1. Friou GJ. Clinical application of lupus serum-nucleoprotein reaction using fluorescent antibody technique (abstr). J Clin Invest. 1957;36:890.
2. Kokuina E, Pérez E, Gerónimo H. Células HEp-2 como substrato para la determinación de anticuerpos antinucleares. Rev Cubana Hematol Inmunol Hemoter. 1991;7:62-3.
3. Kokuina E, Pérez E, Valdés E, Castell C. Evaluación de dos métodos de pesquisaje de anticuerpos antinucleares. Rev Cubana Hematol Inmunol Hemoter. 1992;8:42-9.
4. Keren DF, Hedstrom DL. Contemporary approaches to anti-nuclear antibody serology. J Clin Lig Assay. 1999;22:50-5.
5. ACR Ad Hoc Committee. Guidelines for referral and management of systemic lupus erythematosus in adults. American College of rheumatology Ad Hoc Committee on systemic lupus erythematosus guidelines. Artritis Rheum. 1999;42:1785-96.
6. Mosca M, Tavoni A, Neri R, Bencivelli W, Bombardieri S. Undifferentiated connective tissue diseases: the clinical and serological profiles of 91 patients followed for at least one year. Lupus. 1998;7:95-100.
7. Kokuina E, García I, Suárez J, Chico A, Casas N: Determinación de anticuerpos anti-DNA de doble cadena sobre preparación nacional de Crithidia luciliae. Univ Diag. 2000;1:18-21.
8. Galen RS. Use of predictive value theory in clinical immunology. En: Rose NR, Friedman H, Fahey JL, eds. Manual of Clinical Laboratory Immunology. 3a. ed. Washington DC: Academic Society for Microbiology; 1986. p. 966.
9. Kang I, Siperstein R, Quan T, Breitensein ML. Utility of age, gender, ANA titer and pattern as predictors of anti-ENA and -dsDNA antibodies. Clin Rheumatol. 2004;23:509-15.
10. Slater CA, Davis RB, Schmerling RH. Antinuclear antibody testing. Arch Intern Med. 1996;156:1421-5.
11. Shiel WC, Jason M. The diagnostic associations of patients with antinuclear antibodies referred to a community rheumatologist. J Rheumatol. 1989;16:782-5.
12. Lawlor K, Thompson J, Pope J. Arthritis testing by family physicians. Not enough bang for the buck? Arthritis Rheum. 1996;39:suppl:S72.
13. Shmerling RH. Diagnostic tests for rheumatic disease: clinical utility revisited. South Med J. 2005;98:704-11.
14. Emlen W, O'Neill L. Clinical significance of antinuclear antibodies. Arthritis Rheum. 1997; 40:1612-8.
15. Suarez-Almazor ME, Gonzalez-Lopez L, Gamez-Nava JI, Belseck E, Kendall CJ, Davis P. Utilization and predictive value of laboratory tests in patients referred to rheumatologists by primary care physicians. J Rheumatol. 1998;25:1980- 5.
16. Hochberg MC, Schmidt MC, Funk KL, Sutton JD, Stevens MB. Validity and yield of a two-stage screening procedure for systemic lupus erythematosus. Clin Exp Rheumatol. 1983;1:67-71.
17. Bizzaro N, Wiik A. Appropriateness in anti-nuclear antibody testing: From clinical request to strategic laboratory practice. Clin Exp Rheumatol. 2004;22:349-55.
18. Colglazier CL, Sutej PG. Laboratory testing in the rheumatic diseases: a practical review. South Med J. 2005; 98:185-91.
19. Peene I, Meheus L, Veys EM, De Keyser F. Detection and identification of antinuclear antibodies (ANA) in a large and consecutive cohort of serum samples referred for ANA testing. Ann Rheum Dis. 2001;60:1131-6.
20. Solomon DH, Kavanaugh AJ, Schur PH and the American College of Rheumatology ad hoc Committee on Immunologic Testing Guidelines. Evidenced-based guidelines for the use of immunologic tests: antinuclear antibody testing. Arthritis Rheum. 2002;47:434-44.
21. Tozzoli R, Bizzaro N, Tonutti E, Villalta D, Bassetti D, Manoni F, et al. Guidelines for the laboratory use of autoantibody tests in the diagnosis and monitoring of autoimmune rheumatic diseases. Am J Clin Pathol. 2002;117:316-24.
Recibido: 28 de julio de 2006. Aprobado: 5 de octubre de 2006.
Dra. Elena Kokuina. Hospital Clinicoquirúrgico Hermanos Ameijeiras. San Lázaro No.701, entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba. CP 10300.
1Especialista de II Grado en Inmunología Clínica. Profesora Auxiliar.
2Especialista de II Grado en Reumatología. Profesora Auxiliar.
3Especialista de I Grado en Reumatología.
4Especialista de II Grado en Bioestadística. Profesora Auxiliar.
5Especialista de II Grado en Laboratorio Clínico. Profesor Auxiliar.