Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina
versão On-line ISSN 1561-302X
Rev cubana med v.46 n.2 Ciudad de la Habana jul.-set. 2007
Hospital Clinicoquirúrgico “Hermanos Ameijeiras”
Servicio de Nefrología
Frecuencia, factores de riesgo e impacto en la supervivencia, de las principales causas clínicas de disfunción del injerto en el primer mes del trasplante renal
Dr. Gerardo Borroto Díaz,1 Dra. Sinay García Nidetz,2 Dr. Carlos Guerrero Díaz,1 Dra. Asela Infante Suárez2 y Dra. Martha Verónica González Álvarez2
Resumen
Se realizó un estudio retrospectivo, descriptivo y de corte transversal tomando como universo de estudio todos los pacientes con trasplantes renales donantes cadáver en el Servicio de Nefrología del Hospital Clinicoquirúrgico “Hermanos Ameijeiras” en el período comprendido entre los años 1984 y 2005. La muestra quedó constituida por 275 enfermos: 184 hombres y 91 mujeres. Se determinaron las principales causas clínicas de disfunción del injerto en los primeros 30 d del postrasplante, factores de riesgo asociados y repercusión en la supervivencia del injerto. Las variables cualitativas quedaron expuestas en tablas de frecuencia; se determinó la significación estadística al aplicarle la prueba de chi cuadrado. Se detallaron las variables cuantitativas según sus valores medios y comparadas por un test de comparación de media (prueba T). Se evaluó la influencia de cada variable sobre la posibilidad de conservar el injerto en el tiempo empleando un método univariado (Kaplan y Meir).
Palabras clave: Trasplante renal, postrasplante inmediato, complicaciones, factores de riesgo, supervivencia.
El perfeccionamiento de las técnicas de extracción y preservación de órganos para trasplante, los adelantos en las técnicas quirúrgicas, el empleo de nuevos y potentes inmunosupresores, así como la mejor valoración clínica de las complicaciones ha permitido lograr cada vez mejores resultados en la supervivencia de los injertos renales y elevar la calidad de vida de los enfermos con un trasplante renal (TR) funcionante.
Unidades de TR de países desarrollados con experiencia, exciben supervivencia de los injertos que superan el 90 % al año y el 70 % a los 5 años, para riñones obtenidos de donante cadáver y mayores al 95 y el 80 % para el año y los 5 años, respectivamente, si la víscera proviene de un donante vivo.1, 2
El problema consiste en que en nuestro medio no logramos los resultados anteriores y la supervivencia del injerto al año se sitúa entre el 65 y 70 %, cae posteriormente a cerca del 40 % cuando las estadísticas se refieran a los 5 años (Borroto G, Guerrero C. Resultados del trasplante renal en el Hospital “Hermanos Ameijeiras”, Forum de Ciencia y Técnica, Hospital Clinicoquirúrgico “Hermanos Ameijeiras”, La Habana; 2000). Resulta preocupante el hecho de exhibir un 20 % menos que lo reportado en la literatura, dados estos marcadores por una elevada tasa de complicaciones.
Nuestra hipótesis se basa en que muchas de estas complicaciones que producen disfunción del injerto se presentan en los primeros 30 d de evolución del mismo y constituyen procesos cardinales para la supervivencia posterior del TR.
Nuestra investigación detallará los principales cambios clínicos que afectan el funcionamiento del TR ocurridos en el primer mes dentro de los que se encuentran: la necrosis tubular aguda (NTA), la reacción inmunológica aguda de rechazo (RA) y la toxicidad aguda por ciclosporina A (Tx CsA), entre otras.3
Con el objetivo de conocer la frecuencia de las principales causas clínicas de disfunción del injerto en los primeros 30 d de vida de nuestros TR, los factores de riesgo para la aparición de las mismas, así como determinar la influencia de estas en la supervivencia posterior del riñón trasplantado, se realizará la presente investigación, con el fin práctico de, una vez determinadas estas condicionales, dirigir nuestros esfuerzos a evitar su aparición y de esta forma lograr elevar los resultados.
Métodos
Se realiza un estudio retrospectivo y descriptivo. El universo está conformado por los pacientes con trasplantes renales donante cadáver del Servicio de Nefrología, en el período comprendido entre los años 1984 (comienzo de la actividad de TR en el centro) hasta el 2005. Se desechan las pancartas que no permiten la recogida adecuada de la información.
Procedimientos
La información se obtiene de la revisión de las historias clínicas especiales (pancartas) utilizadas en estos enfermos, de las que se recogen los siguientes datos:
- Fecha de trasplante: día/ mes/ año.
- Edad del receptor: años cumplidos en el momento del trasplante.
- Sexo del receptor.
- Edad del donante: años.
- Tratamiento inmunosupresor profiláctico. las variables posibles son: ciclosporina A, prednisona y azatioprina (CsA – Pred – AzA), o (CsA – Pred) y (Pred- AzA).
- Tiempo de isquemia fría: horas.
- Tiempo de isquemia caliente secundaria o tiempo de sutura: minutos.
- Necrosis tubular aguda: Es la ausencia de función del injerto con necesidad de diálisis en el postrasplante inmediato.
- Tiempo de duración de la NTA: días.
- Reacción inmunológica de rechazo agudo: Estudio histológico: biopsia del injerto, según Banff 2003.4.
- Tiempo de aparición del RA: Período (días) que va desde la realización del TR hasta el diagnóstico de RA.
- Nefrotoxicidad aguda por CsA: Deterioro funcional del injerto que se produce por los efectos deletéreos del uso de la CsA a cuyo diagnóstico se puede llegar de 2 formas:
– Histológico: Biopsia renal.
– Clínico. - Pérdida del injerto: sí o no. Retirada de la inmunosupresión, con instauración de la terapéutica dialítica.
- Fecha de pérdida del injerto: día/ mes/ año.
Procesamiento y análisis de la información
Las variables como: enfermedad de base, tratamiento inmunosupresor, NTA, RA y Tx CsA, quedaron expuestas en tablas de frecuencia; se determinó significación estadística (SE) o no al aplicarles la prueba de chi cuadrado, SE si p< 0,05.
Otras como: edad del receptor y del donante, tiempo de NTA y de RA fueron detalladas según sus valores medios y comparadas por un test de comparación de medias (prueba T) SE si p < 0,05.
El análisis estadístico fundamental estuvo dirigido a conocer la frecuencia de aparición de estas complicaciones en los primeros 30 d del TR y su influencia en la supervivencia del mismo, para esto último se evaluó la influencia de cada variable sobre la posibilidad de conservar el injerto en el tiempo. Para esto se empleó un método univariado que consistió en la construcción de líneas en el tiempo de posibilidad de conservar el injerto por el método de Kaplan y Meir y la comparación de estas curvas con un test de rango logarítmico (SE p< 0,05).
Los resultados se expresaron en tablas y curvas representativas, lo que posibilitó que mediante el proceso de análisis y síntesis se arribara a conclusiones.
Resultados
La frecuencia y duración de la NTA y su relación con algunos factores de riesgo se plasman en la tabla 1. La frecuencia de NTA, fue del 40 %, mientras que el 60 % no presentó esta complicación. La media de duración fue de 16,92 d. Al analizar la presencia de NTA según sexo, se puso de manifiesto una incidencia muy semejante, lo cual no resultó una diferencia significativa (p = 0,132). Al estudiar la variable edad, comprobamos que tanto los receptores como los donantes fueron mayores cuando existió NTA, que cuando no presentaron esta complicación. Estadísticamente significativo resultaron los tiempos de isquemia fría y caliente secundaria, mayores en los enfermos con NTA, lo cual corrobora que constituyen factores de riesgo de peso en la aparición de esta complicación. En cuanto al tratamiento inmunosupresor utilizado como profilaxis del rechazo se observa que en aquellos enfermos en quienes se indicó la CsA, tanto en una pauta triple, 48 % (CsA, Pred y AzA), como doble, 43,8 % ( CsA y Pred.), tuvieron mayor frecuencia de NTA y más duradera: 19,04 y 17,2 d, respectivamente, que en los que no se empleó esta droga, sino tratamiento con Pred. y AzA 31,7 % y 16,41 d. Estos resultados fueron estadísticamente significativos (p = 0,0032).
Tabla1. Frecuencia y duración de la necrosis tubular aguda, según factores de riesgo
| Factores de riesgo | Con NTA | Sin NTA | X de duración | SE | ||
| N | (%) | N | (%) | (días) | ||
| Necrosis tubular aguda | 110 | (40) | 165 | (60) | 16,92 | |
| Sexo | ||||||
| Masculino | 70 | (38) | 114 | (62) | 17,51 | p = 0,132 |
| Femenino | 40 | (43,6) | 51 | (56,4) | 15,93 | |
| Edad del receptor (X) | 42,36 | 37,97 | p = 0,0658 | |||
| Edad del donante (X) | 37,46 | 34,71 | p = 0,0753 | |||
| Isquemia fría en horas (X) | 25,3 | 20,5 | p = 0,00371 | |||
| Isquemia caliente secundaria (min) | 72,8 | 43,6 | p = 0,031 | |||
| Tratamiento inmunosupresor | ||||||
| CsA–Pred-Aza | 50 | (48) | 54 | (52) | 19,04 | p 0 0,0032 |
| CsA-Pred | 21 | (43,8) | 27 | (56,2) | 17,2 | |
| AzA-Pred | 39 | (31,7) | 84 | (68,3) | 16,41 | |
X :Media. SE: Significación estadística, p < 0,05.
La frecuencia y el comportamiento de algunos de los factores de riesgo facilitadores de la reacción inmunológica aguda se exponen en la tabla 2. Se evidencia que no existieron diferencias significativas en la frecuencia en cuanto al sexo (p = 0,062), el tiempo medio de aparición (p = 0,058), 8,63 d en las féminas vs. 8,37 en los hombres. La edad media del receptor fue ligeramente mayor en los enfermos con rechazo (39,09 años vs. 38,4) al igual que la de los donantes (34,06 vs. 33,33), pero sin significado estadístico (p = 0,821). La frecuencia de aparición de rechazo según el protocolo de tratamiento inmunosupresor profiláctico utilizado, es alta en las 3 combinaciones utilizadas, pero evidentemente mayor en aquellos enfermos en los que se empleó una combinación convencional sin CsA cuya frecuencia fue de 66,7 %. En los casos con terapia doble a base de CsA y Pred, la incidencia fue del 50 % y en aquellos con triple terapia CsA, Pred y AzA fue de 46,2 %. El tiempo medio de aparición del mismo fue similar en los 2 esquemas que utilizaron CsA, 9,12 en la duple y 9,62 en la triple terapia, pero evidentemente menor (p = 0,0012) en los casos con tratamiento convencional, 6,12 d. En esta tabla se constata cómo incide el daño isquemia reperfusión en la aparición de la crisis inmunológica. Quedó estadísticamente comprobado (p = 0,0017) que la presencia de NTA favorece al desarrollo de rechazo 72,7 % vs. 27,3 %, mientras que en los que no presentaron NTA se invierte la relación pues solo 45,5 % tiene rechazo y el 54,5 % no. La media de diagnóstico del mismo, contradictoriamente fue mayor en los enfermos con NTA, 8,67 d, que en los que no tuvieron daño isquémico estructural, 7,19. Como reflejo de las aseveraciones anteriores se comportaron los tiempos de isquemia fría, cuyo valor medio fue significativamente mayor en los paciente con rechazo, 24,5 vs. 20,2 h en los que no tuvieron crisis inmunológica (p = 0,0018), al igual que la isquemia caliente secundaria que, como era de esperar, fue mayor, 68,2 vs. 40,5 min, en presencia de deterioro funcional inmunológico (p = 0,001).
Tabla 2. Frecuencia de rechazo en el primer mes y factores de riesgo
| Factores | Presencia de rechazo | X de aparición (días) | SE | |||||
| Sí | N | (%) | No | N | (%) | |||
| Frecuencia | 155 | (56,36) | 120 | (43,64) | ||||
| Sexo | ||||||||
| Masculino | 56 | (61,5) | 35 | (38,5) | 8,63 | p =0,062 | ||
| Femenino | 99 | (53,8) | 85 | (46,2) | 8,37 | p = 0,058 | ||
| Edad del receptor (años) | 39,09 | 38,48 | p = 0,094 | |||||
| Edad del donante (años) | 34,06 | 33,33 | p = 0,821 | |||||
| Presencia de NTA | ||||||||
| Sí | 80 | (72,7) | 30 | (27,3) | 8,67 | p = 0,0017 | ||
| No | 75 | (45,5) | 90 | (54,5) | 7,19 | |||
| Isquemia fría (horas) | 24,5 | 20,2 | p = 0,0018 | |||||
| Isquemia caliente secundaria (min) | 68,2 | 40,5 | p = 0,001 | |||||
| Tratamiento inmunosupresor | ||||||||
| CsA–Pred-Aza | 48 | (46,2) | 9,62 | p = 0,0012 | ||||
| CsA-Pred | 24 | (50) | 9,12 | |||||
| AzA-Pred | 83 | (66,7) | 6,12 | |||||
X: Media. SE: Significación estadística, p < 0,05.
En un total de 152 enfermos que utilizaron CsA ya fuese en doble o triple terapia, la nefrotoxicidad aguda en el primer mes se presentó en 56 casos para un 20,4 %, lo cual se plasma en la tabla 3 que además relaciona la aparición de esta complicación con algunas de las variables catalogadas como de riesgo para la misma. Ni la edad media de los receptores y los donantes, ni la distinción del receptor de acuerdo con el sexo evidenció diferencias significativas al compararlos según la presencia o no de nefrotoxicidad por este inmunosupresor. Lo contrario se observa al analizar el comportamiento del daño isquemia – reperfusión que facilita la aparición del daño ciclosporínico, pues este se encontró en el 29,5 % de los enfermos con NTA que usaron esta droga, mientras que de los que no presentaron NTA usando CsA solo el 12,3 % tuvo evidencias clínicas o histológicas de nefrotoxicidad (p = 0,0012). Los tiempos de isquemias fría y caliente secundaria también fueron significativos al aplicarles un test de comparación de medias y compararlos con los que no tuvieron toxicidad por CsA: p = 0,0015 y p = 0,0016, respectivamente.
Tabla 3. Nefrotoxicidad aguda por ciclosporina A en el primer mes de trasplante según factores de riesgo
| Factores | Presencia de nefrotoxicidad | SE | |||||
| Sí | N | (%) | No | N | (%) | ||
| Frecuencia | 31 | (20,3) | 121 | (79,7) | |||
| Edad del donante (X años) | 43,4 | 37,2 | p = 0,096 | ||||
| Edad del receptor (años) | 42,6 | 38,5 | p = 0,086 | ||||
| Sexo del receptor | |||||||
| Masculino | 19 | (19,3) | 80 | (80,7) | p = 0,0759 | ||
| Femenino | 12 | (22,6) | 41 | (77,4) | |||
| Presencia NTA | |||||||
| Sí | 21 | (29,5) | 50 | (70,5) | p = 0,0012 | ||
| No | 10 | (12,3) | 71 | (87,7) | |||
| Isquemia fría (horas) | 25,7 | 19,8 | p = 0,0015 | ||||
| Isquemia caliente secundaria (min) | 71,6 | 42,8 | p = 0,0016 | ||||
X: Media. SE: Significación estadística, p < 0,05.
El análisis del impacto de las diferentes complicaciones abordadas en el estudio en la supervivencia del trasplante, se lleva a cabo al tener en cuenta la probabilidad de conservar el injerto en el tiempo de acuerdo con la presencia o no de estas eventualidades y su significado estadístico obtenido al aplicarle un test de rango logarítmico. Así en la figura 1, se pone de manifiesto que aquellos enfermos con NTA tienen menos probabilidades en el tiempo de permanecer con un injerto funcionante lo cual es evidentemente estadístico (test de long rank, p = 0,0003).
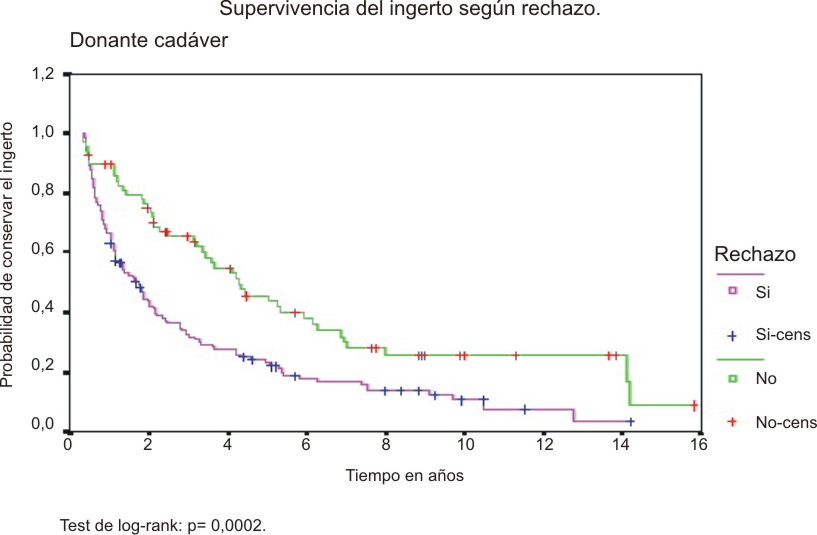
Es evidente igual que los enfermos que padecen de un episodio inmunológico agudo durante el primer mes, tendrán una supervivencia del injerto menor que los que no lo presentan y esto se pone de manifiesto incluso desde los primeros años de vida del implante renal (fig. 2).
Fig.1. Supervivencia del injerto según necrosis tubular aguda.
Fig.2. Supervivencia del injerto segun rechazo
Discusión
La NTA es la primera causa de ausencia de función inmediata del injerto.
En nuestra serie pudimos verificar la aseveración anterior. Rainiene encontró una frecuencia de NTA del 21,3 % en 183 trasplantes renales de donante cadávér por muerte encefálica realizados desde enero del 2000 a diciembre del 2004 en la universidad de Vilnius, Lituania. Él, como nosotros verificó una edad mayor en los receptores con NTA y una edad media mayor en los donantes, cuando se asocio, un riñón obtenido de un donante mayor de 55 años, implantado a un receptor de 60 o más años, con un tiempo de isquemia fría superior a las 24 h, la aparición de esta complicación fue superior al 80 %.5
Uno de los aspectos involucrados en la producción de la NTA y comprobada por nosotros su influencia es el tratamiento inmunosupresor, el uso de inhibidores de la calcineurina (CsA y FK 506), que por su mecanismo de acción producen vasoconstricción de la arteriola aferente y, por ende, disminución del flujo sanguíneo renal, se vinculan por si solos o en coordinación con los factores antes mencionados a la presencia de NTA.
Shaffer demostró que un régimen inmunosupresor libre de anticalcineurínicos se asocia a bajas tasas de NTA y este era muy beneficioso para evitarla sobre todo en donantes marginales (edades extremas, tiempos de isquemias prolongados o patologías asociadas con posibilidad de daño nefronal).6
Los inhibidores de la calcineurina no solo facilitan la aparición de la NTA, sino que una vez desarrollada la misma, perpetúan el daño isquémico y por lo tanto enlentecen el tiempo de generación de la célula tubular. En el presente estudio quedó demostrado que no solo fue más frecuente la NTA en los enfermos que utilizaron la CsA en los protocolos inmunosupresores de inducción, sino además fue más severa, dado esto por un tiempo medio de recuperación más largo.
Existe clara asociación entre la presencia de NTA y la supervivencia del injerto renal. La aparición de esta complicación en el postrasplante inmediato se relaciona con la pérdida del 20 % de los injertos al año y todavía superior si concomita con la existencia de rechazo agudo.7 Por otra parte, la función retardada de etiología isquémica es uno de los bien definidos factores potencializadores en la aparición de la nefropatía crónica y esta es la primera causa de pérdida de los TR después del año.8
Najarian ejemplifica los anteriores planteamientos en su estudio, donde mostró elevada supervivencia del trasplante al año, 96 %, en individuos con función inmediata del injerto, similar a los donantes vivos, inferior, 86 %, en sujetos con función renal inicial lenta y creatininas elevadas, pero menores a 3,5 mg/dL en el día 7 y baja 72 % en aquellos con NTA y creatinina superiores a esa cifra a la semana. Él concluye que la calidad de la función inicial del injerto es un importante predictor de la evolución posterior del mismo.9
De los sucesos indeseables en la evolución del TR el que más ha acaparado la atención de los profesionales dedicados a esta actividad, es la reacción inmunológica de rechazo. Clásicamente se ha dicho que su frecuencia y tiempo de aparición dependen en gran medida del tratamiento inmunosupresor utilizado. Así con el uso de esteroides y azatioprina, la incidencia de rechazo se espera entre un 40 y 60 % y su aparición en la primera semana de vida del injerto. Posteriormente, con el advenimiento de la CsA mejoraron ostensiblemente los resultados, se reportaron frecuencias de rechazos con esta droga en triple terapia con azatioprina y esteroides entre 17 y 30 % y su aparición entre el noveno y decimoquinto días.
En los momentos actuales, con el uso de las modernas y potentes drogas se ha logrado reducir la aparición de rechazo a cifras entre 10 y 15 %, así como retardarlo y atenuar sus síntomas, lo cual ha hecho más complejo su diagnóstico.10
Otros factores de riesgos citados para esta complicación han sido: la edad del receptor y los donantes, se dice que en las edades avanzadas existe menor frecuencia de rechazo, dado esto por la disminución de la potencialidad inmunológica del receptor.11 Algunos autores han citado al sexo del receptor, planteando una mayor frecuencia en el masculino, lo cual pudiera explicarse por una respuesta inmunológica más potente. Esto también ha sido validado para los receptores de raza negra, en los que se plantea además una menor biodisponibilidad y absorción de algunos inmunosupresores.12 Se dice que en la isquemia y la NTA, la denudación de las células epiteliales tubulares, hace más visibles los antígenos HLA clase II y por ende más inmunogénico al injerto, a esto se suma al arribo de mediadores y células inflamatorias que propicia el daño isquémico y la necrosis. Un factor adicional y por ende el retraso en el diagnóstico del rechazo que propicia la presencia de NTA, al no existir los principales heraldos clínicos de la reacción inmunológica como son, la caída del volumen urinario y el ascenso de la creatinina sérica.
Yu LX comprueba que la presencia de tiempos prolongados de isquemia fría mayores a 24 h, NTA y daño isquémico severo en las biopsias del injerto pretrasplante se asocian a altas tasas de rechazo, poniendo en evidencia la asociación entre isquemia y crisis inmunológica aguda.13
Anderson reporta una incidencia de rechazo en pacientes con NTA, bajo tratamiento profiláctico triple, casi idéntica a la nuestra de un 54,3 %, muy superior en su estudio a la de los enfermos sin NTA (28,4 %).14
El tiempo medio de aparición de la crisis inmunológica en los enfermos sin NTA fue menor que en aquellos con daño tubular isquémico, esto mas que una precocidad en la aparición del rechazo, traduce un retardo en el diagnóstico de este en los pacientes con NTA.
More15 y Velázquez16 coinciden que la presencia de rechazo en el período inicial del trasplante (menos de 3 meses), impacta negativamente en la probabilidad de conservar el órgano a largo plazo. El primero observó una disminución de la supervivencia al año del 15 al 20 % en los enfermos estas condicionales. Nuestros hallazgos son muy similares a los de estos autores.
La nefrotoxicidad por CsA que aparece en el primer mes de evolución del injerto es aguda y aunque potencialmente reversible, se reportan frecuencias que van desde un 5 a un 25 % en la literatura revisada. Las cuales dependen de: tipo de formulación utilizada, sandimun (15 – 20 %) o neoral (5 – 15 %), modo de monitorización de los niveles sanguíneos de la droga, C0 > C2, frecuencia de las dosificaciones y tipo de diagnóstico (clínico o morfológico).17,18
Cataneo en un estudio cuyos resultados son muy parecidos a los nuestros, encontró una frecuencia de nefrotoxicidad aguda por CsA, en los primeros 30 d del trasplante, de 17,8 %, asociado a la presencia de NTA y edades avanzadas de donantes y receptores.19
En nuestra serie encontramos una alta frecuencia de toxicidad por CsA, dada por el uso de la formulación sandimun de absorción más incierta, dificultades con el monitoreo del medicamento, realizado por C0, utilización en terapia doble con prednisona o triple con azatioprina y prednisona, altas tasas de NTA , prolongados tiempos de isquemias y edad media superior en los receptores con esta complicación, citados todos por la literatura como factores de riesgo para el efecto tóxico de esta droga.
Quedó demostrado además que las 3 causas de disfunción del injerto estudiadas, que aparecen en los primeros 30 d de evolución del trasplante impactan nefastamente en la supervivencia posterior de los riñones implantados.
Summary
Frequency, risk factors and effect of the main clinical causes of graft dysfunction in the first month of renal transplant on survival
A retrospective, descriptive and cross-sectional study of all cadaveric renal transplant recipient patients was made at the Nephrology Service of "Hermanos Ameijeiras" clinical and surgical hospital from 1984 to 2005. The sample was made up of 275 patients, that is, 184 males and 91 females. The main clinical causes of graft dysfunction in the first 30 days after transplantation, the associated risk factors and the impact on graft survival were determined. Frequency tables showed the qualitative variables and Chi square test served to estimate statistical significance. Quantitative variables were specified according to their mean values and then compared using a mean comparison test (T test). The effect of each variable on the possible preservation of graft in the course of time was evaluated through a univariate method (Kaplan and Meir).
Key words: Renal transplant, immediate postransplantation, complications, risk factors, survival.
Referencias bibliográficas
1. US Renal Data System.Excerpst from the USRDS 2003 annual data report: atlas of end stage renal disease in the United State. Am J Kidney Dis. 2003;42 (Suppl 5):4-224.
2. Expert Group on Renal Transplantation. European Best Practice Guidelines For renal Transplantation. Nephrol Dial Transplant. 2000;15( Suppl 7):14-24.
4. Racusen LC, Colvin RB, Solez K, Mihatsch MJ. Antibody –mediated rejection criteria– an addition to the Banff 97 classification of renal allograft rejection. Am J Transplant. 2003;3:708.
5. Rainiene T, Asakiene E, Zelvys A, Dainys B. Delayed graft function and its impact on the antigraft response after cadaver kidney transplantation. Drugs Agings. 2005;22(5):433-49.
6. Shaffer D, Langone A, Nylander W. A pilot protocol of a calcineurin-inhibitor free regimen forkidney transplant recipients of marginaldonor kidneys or with delayed graft function. Clin Transplant. 2003;17(suppl 9):31-4.
7. Boratynska M, SzepietowskiT, Szewezy KZ. Acute rejection and delayed graft function-risk factors of graft loss. Ann Transplant. 2006;1(2):19-22.
8. Gonwa TA, Mai ML, Smith LB, Levy ME. Delayed or slow graft function is a risk factor to chronic nephropaty. Clin Transplant. 2002;16(2):144-9.
9. Najarian JS, Gillingham KJ, Cuthrland DE, Reinsmoen NL. The impact of the quality of initial graft function on cadaver kidney Transplant. Transplantation. 1994;57(6): 812-6.
10. Pallardo Mateu LM, Sancho Calabuig A, Capdevila Plaza L, Franco Esteve A. Acute rejection and late renal transplant failure: risk factors and prognosis. Nephrol Dial Transplant. 2004;19(suppl 3):38-42.
11. Hoshinaga K, Aikawa A, Murai M, Yamamoto H, Hirayama N. Regimen of Tacrolimus-based immunosuppresion with basiliximab, mycophenolato mofetil, and low dose steroid reduce acute rejection in kidney transplants. Transplant Proc. 2005;37(4):1762-3.
12. Fleiner F, Buddek L. Differences in reporting of acute rejection between American white and black patients. Transplant Proc. 2005;37(5):2048-50.
13. Yul X, Zeng LH, Fu SJ, Miao Y. Quality renal graft function is predictor and risk factor or rejection. Di Yi Jun Yi Da Xue Bao. 2005;28(7):812-6.
14. Anderson P, Williams M, Trade P. Delayed renal allograft function and acute rejection. Transplantation. 1993.28(4):1206-12.
15. More T, Couber TJ, Denis C. Impact of the acute rejaction in survival or renal allograft. Transplant. 2001;26(4):1832-6.
16. Velázquez M, Rivas T, Martínez M. Factores que inciden en la supervivencia del injerto renal. Nefrología. 1998;16(4):168-72.
17. Grinyo JM, Cruzado JM. Cyclosporine nephrotoxicity. Tranplant Proc. 2004;36(suppl):240S-242S.
18. Ferrareso M, Ahio I, Edefonti A, Vigano S. C0 or C2 driven cyclosporine monitoring in pediatric kidney transplant recipient. Pediatr Transplant. 2005;9(30):328-31.
19. Cattaneo D, Perico N. Gaspari F, Remuzzi G. Nephrotoxic aspect of cyclosporine. Transplant Proc. 2004;36(2 suppl):234S-239S.
Recibido: 17 de febrero de 2007. Aprobado: 7 de julio de 2007.
Dr. Gerardo Borroto Díaz. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba.
1Especialista de II Grado en Nefrología.
2Especialista de I Grado en Nefrología.