Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523versión On-line ISSN 1561-302X
Rev cubana med v.46 n.4 Ciudad de la Habana oct.-dic. 2007
Temas actualizados
Hospital Clinicoquirúrgico "Hermanos Ameijeiras"
Hemorragia intracerebral espontánea
Dr. Claudio E. Scherle Matamoros,1 Dr. Jesús Pérez Nellar2 y Dr. Héctor Roselló Silva3
Resumen
Se conoce que la hemorragia intraparenquimatosa es una afección frecuentemente grave y se asocia a elevada mortalidad. Se afirma que menos del 30 % de los enfermos sobreviven 5 años después del ictus inicial y pocos recuperan su total independencia funcional. Se realizó una revisión sobre los factores de riesgo, la fisiopatología y los problemas frecuentes implicados en el tratamiento médico. Se halló que, según los resultados del estudio prospectivo STICH, la cirugía no ha demostrado beneficios superiores al tratamiento médico.
Palabras clave: Hemorragia intracerebral, ictus, tratamiento.
La hemorragia intracerebral espontánea (HIC) es una colección de sangre dentro del parénquima cerebral producida por una rotura vascular espontánea, no traumática. Puede estar totalmente localizada en el interior del tejido cerebral o abrirse a los ventrículos cerebrales o al espacio subaracnoideo.1 Se denomina primaria cuando es causada por la rotura de un vaso arterial del encéfalo cuya pared se ha debilitado por procesos degenerativos (arteriolosclerosis, angiopatía amiloide). La HIC secundaria es aquella producida por la rotura de vasos congénitamente anormales (aneurismas saculares, fístulas y malformaciones arteriovenosas), de vasos neoformados (hemorragia intratumoral), o de vasos afectados por inflamación aséptica o séptica (vasculitis, aneurismas micóticos). Aproximadamente el 10 % de las HIC se producen en el interior de tumores cerebrales muy vascularizados (gliomas, meningiomas y adenomas hipofisarios) o metastáticos.
Epidemiología
La HIC representa entre el 10 y el 15 % del total de las enfermedades cerebrovasculares.2 La incidencia aumenta con la edad. Es más frecuente después de los 55 años y en sujetos de raza negra o japoneses, en los que la incidencia se duplica con respecto al resto de la población.3 La mitad de los pacientes fallecen en las primeras 48 h, y la mortalidad al año y a los 5 años es de 42 y 27 %, respectivamente.4 Se conoce que la presencia de los alelos ε2 y ε4 en genes que codifican para la apolipoproteína E están asociados a un riesgo 3 veces mayor de recidiva de la hemorragia después de un sangrado inicial,5 con un índice de mortalidad a los 30 d entre 35 y 52 %.6 De manera similar al ictus isquémico la admisión en unidades de ictus disminuye la mortalidad del 69 al 52 %.6
Factores de riesgo
Aproximadamente el 60 al 70 % de los casos pueden ser atribuidos a la HTA. La hipertensión sistodiastólica implica un riesgo más elevado de HIC, seguido de la elevación aislada de la presión sistólica.7 La HIC hipertensiva se localiza en estructuras irrigadas por arterias perforantes con cambios de arteriolosclerosis (arteria recurrente de Heubner, lenticuloestriadas, talamogeniculadas). Las localizaciones más comunes son en los ganglios básales (putamen y cápsula interna en 40 a 50 %), lobar 15 a 25 %, talámica 10 a 20 %, núcleo caudado 8 %, puente 8 % y cerebelo 8 %.2
El alcohol y el tabaquismo son igualmente factores de riesgo controlables2,7 y la diabetes mellitus es un factor de riesgo adicional, pero no está bien establecido si el control de la glucemia permite disminuir el riesgo de hemorragia.8
El tratamiento con anticoagulantes incrementa el riesgo de HIC de 7 a 10 veces.9 La asociación de un antiagregante plaquetario y de un fármaco antivitamina K duplica el riesgo de HIC, y si la dosis de aspirina es superior a 1 225 mg semanales el riesgo se triplica.10,11 Las HIC por anticoagulantes ocasionan una mortalidad superior a la hipertensiva y es dependiente de la dosis de la droga antivitamina K.12 La complicación más grave de la trombólisis endovenosa en un ictus isquémico es la HIC. Su incidencia varía de 6 a 11 % según el protocolo empleado. Estas hemorragias son más voluminosas, graves y mortales, o producen grados de morbilidad más intensos.13
La forma esporádica de la angiopatía cerebral amiloidea es la causa del 5-10 % de las HIC espontáneas en el anciano. Desde el punto de vista patológico se caracteriza por el depósito de material amiloide en las capas medias y adventicias de las arterias corticales y piales de mediano y pequeño calibre. El diagnóstico es neuropatológico, pero la sospecha clínica se establece en presencia de hemorragias subcorticales, con frecuencia múltiples y recidivantes, en ancianos normotensos con deterioro cognitivo y leucoaraiosis en la tomografía axial computarizada (TAC).14
Pronóstico
Los 3 factores asociados a mal pronóstico son el aumento de volumen del hematoma, la presencia de sangre ventricular y el estado de conciencia.15 En sujetos alcohólicos o ancianos, la atrofia cerebral les permite tolerar hemorragias relativamente importantes, sin embargo en jóvenes ocurre lo inverso. Contrario a lo aceptado durante años, el volumen de la HIC aumenta más del 33 % en las 3 primeras horas, después de su presentación, en cerca del 38 % de los pacientes.16 El resangrado es raro después de las primeras 24 h.
Cuadro clínico
Las manifestaciones clínicas son insuficientes para diferenciar un hematoma de un ictus isquémico, incluso de otras causas de déficit neurológico.Complementar el examen clínico con neuroimágenes es fundamental tanto para el diagnóstico definitivo como para realizar un tratamiento especifico.
El cuadro clínico más característico de una HIC es el de un paciente que, estando en actividad, presenta un déficit focal, con características que corresponden a la ubicación del hematoma (tablas 1, 2 y 3), asociado a cefalea y vómitos. Posteriormente, puede aparecer compromiso progresivo de conciencia que lleva al paciente al coma. En el examen se pueden encontrar cifras de presión arterial elevadas, signos de déficit focal provocado por el hematoma y signos de herniación cerebral. Sin embargo, lo más frecuente es que se presenten con escasas manifestaciones clínicas, y sólo sea posible su diagnóstico con el apoyo de la neuroimagen.1,2
Tabla 1. Síntomas, según localización del hematoma
| Localización | Síntomas |
| Putamen | Hemiparesia contralateral, déficit sensitivo contralateral, paresia de la mirada conjugada contralateral, hemianobsia homónima |
| Caudado | Hemiparesia contralateral leve, paresia de la mirada conjugada contralateral (rara) |
|
| Síndrome sensitivo contralateral, afasia, nistagmo de convergencia, paresia de la mirada conjugada contralateral o ipsilateral, desviación de la mirada hacia abajo, hemiparesia contralateral |
Tabla 2. Síntomas, según localización del hematoma
| Localización | Síntomas |
| Protuberancia | Cuadriparesia, síndrome de enclaustramiento. Paresia de la mirada horizontal bilateral, miosis, inestabilidad autonómica, coma |
| Cerebelo | Ataxia, parálisis de la mirada conjugada ipsilateral, signos de tallo cerebral, toma de conciencia |
Tabla 3. Síntomas, según localización del hematoma
| Lobar | Síntomas |
| Frontal | Hemiparesia contralateral, paresia de la mirada conjugada contralateral, afasia motora, abulia |
| Temporal | Afasia sensitiva, hemianopsia homónima contralateral |
| Parietal | Déficit hemisensorial, cortical, hemiparesia contralateral, defecto visual contralateral |
| Occipital | Hemianopsia homónima contralateral |
El examen de elección es la TAC de cráneo sin contraste, que tiene una sensibilidad cercana al 100 % y mostrará la ubicación del hematoma, su volumen, su eventual drenaje a ventrículos y espacio subaracnoideo.16 Puede complementarse con contraste, si existe duda sobre alguna patología subyacente como malformaciones arteriovenosas, tumores, aneurismas y trombosis de senos venosos cerebrales. El volumen del hematoma puede calcularse de 2 maneras. Una, a través de mediciones realizadas en el tomógrafo en una reconstrucción tridimensional, y la otra, multiplicando sus 3 diámetros dividido por 2. Para ello se selecciona el corte tomográfico en el que la hemorragia tiene su mayor diámetro (A), se mide el ancho (B) en un plano perpendicular a A, y el grosor se obtiene multiplicando el número de cortes en que la hemorragia es visible por el espesor de los cortes.17
Volumen (cm3) = (A × B × C) / 2
Tratamiento hemostático precoz
La gravedad de la hemorragia y el riesgo de aumento de volumen del hematoma explican la necesidad de antagonizar el efecto de las drogas anticoagulantes que se estén empleando. Si ocurre bajo tratamiento con heparina fraccionada o no, está indicado el sulfato de protamina. En el caso de los antiagregantes plaquetarios debe suministrarse concentrado de plaquetas.
El momento de retomar el tratamiento anticoagulante está en dependencia del riesgo de embolismo. Por ejemplo, el reemplazamiento valvular mitral por una válvula mecánica más fibrilación auricular, tiene un riesgo alto de tromboembolismo, por lo que es necesario reiniciar el tratamiento anticoagulante precozmente.18
La racionalidad de un tratamiento hemostático precoz para limitar la extensión de la hemorragia comienza a establecerse con el uso del factor VII recombinante activado, cuando es administrado por vía endovenosa en las primeras 4 h de iniciado el ictus. Los resultados preliminares del estudio NovoSeven indican que el empleo de este fármaco es capaz de disminuir la mortalidad y mejorar la recuperación funcional a los 90 d, con un bajo riesgo de complicaciones tromboembólicas.19
Manejo de las cifras de tensión arterial
Numerosos estudios muestran la relación entre la severidad de la hipertensión arterial y un peor pronóstico neurológico por el riesgo de sangrado y aumento de volumen del hematoma.20,21 Por otro lado, disminuir los niveles de tensión arterial podrían reducir la perfusión en el tejido que rodea el hematoma y agravar el estatus clínico del paciente. Investigaciones con imagen por resonancia magnética (IRM) y tomografía por emisión de positrones, no demuestran la presencia de zona de penumbra isquémica en la periferia de la HIC, al menos, en colecciones de 16,9 ± 17,2 mL, ni de disturbios de la autorregulación cerebral en las primeras 24 h.22,23 Las recomendaciones actuales son tratar de manera agresiva la HTA severa, para disminuir la TAM por debajo de 130 mmHg y mantenerla entre 100 y 120 mmHg.24
Tratamiento de la hipertensión endocraneal (HEC)
La HEC es el factor que más contribuye a la mortalidad después de un sangrado intracraneal. Deben evitarse la hipoxemia, la hipertermia, las convulsiones y todas las circunstancias que eleven la presión intracraneal por alguna vía. Se recomienda la elevación de la cabeza unos 30º y evitar la postura en rotación del cuello porque produce compresión yugular. Ante la necesidad de realizar un abordaje venoso profundo es importante optar por la vía de la subclavia para no limitar el drenaje venoso cerebral.25
El mecanismo de acción del manitol a pesar de su uso cotidiano permanece incompletamente definido, y los 2 efectos principales que se le atribuyen son osmótico y hemodinámica.26 Dosis altas de manitol 20 % (1-1,5 g/kg) en un bolo seguido de 0,25-0,50 g/kg cada 4-6 h son preferibles a dosis pequeñas.27 Sin embargo, pueden provocar depleción de volumen y acumularse en la sustancia blanca. Una alternativa es suministrar dosis únicas según la PIC o el estado de conciencia del paciente. Una adecuada sustitución de volumen con soluciones isotónicas es esencial para mantener el estado de euvolemia.26
El uso de solución salina hipertónica (SSH) una vez que el manitol comienza a peder su efecto es una alternativa. Como la barrera hematoencefálica es impermeable al ión sodio, se establece un gradiente que facilita el movimiento de agua del cerebro al espacio intravascular. Evidencias recientes indican que la SSH tiene un efecto más efectivo para el control de la PIC, aunque las concentraciones óptimas no han sido bien establecidas. La mayoría de los estudios clínicos han empleado concentraciones de 7,5 o al 3 % en infusiones de 20 a 40 mL/h, disminuyéndola progresivamente para evitar la hiponatremia y el edema de rebote.28
Tratamiento quirúrgico
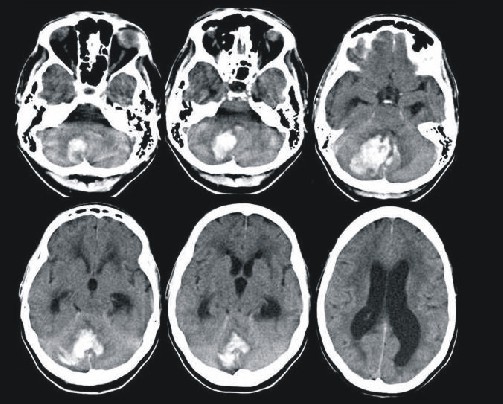
El estudio STICH, recientemente concluido es la única investigación prospectiva, al azar a gran escala que evalúa el interés por la cirugía en la HIC. Compara los resultados entre cirugía precoz y tratamiento médico en las primeras 72 h de iniciado el ictus, y no demuestra ningún beneficio del tratamiento neuroquirúrgico. Sin embargo, el análisis estadístico por subgrupos muestra una tendencia casi significativa a un beneficio de la cirugía cuando el hematoma se encuentra a 1 cm o menos de la corteza cerebral.29 Los resultados de este estudio no deben ser interpretados como la ausencia absoluta de beneficio de la cirugía en la HIC. Existen situaciones en las que el tratamiento quirúrgico está indicado. Por ejemplo, la derivación ventricular en pacientes con hidrocefalia aguda, en los hematomas lobares secundarios a una ruptura aneurismática, en hemorragias superficiales en sujetos jóvenes con signos de enclavamiento y en hemorragias cerebelosas con signos de compresión del tronco cerebral. 30 (fig.).
Fig. Hematoma cerebeloso con hidrocefalia asociada.
Summary
Spontaneous intracerebral hemorrhage
It is known that intraparenchymatous hemorrhage is a frequently severe affection and that it is associated with an elevated mortality. It is asserted that less than 30 % of the sick survive 5 years after the initial stroke and a few recovered their total functional independence. A review was made on the risk factors, the physiopathology and the common problems involved in the medical treatment. According to the results of the STICH prospective study, surgery has not showed better benefits than the medical treatment.
Key words: Intracerebral hemorrhage, stroke, treatment.
Referencias bibliográficas
1. Delgado G, Aymerich N, Herrera M. Anales Sis San Navarra. 2000;23(Supl. 3):129-37.
2. Qureshi AI, Tuhrim S, Broderick JP, Batjer HH, Hondo H, Hanley DF. Spontaneous intracerebral hemorrhage. NEJM. 2001;344:1450-60.
3. Qureshi AI, Giles WH, Croft JB. Racial differences in the incidence of intracerebral hemorrhage: effects of blood pressure and education. Neurology. 1999;52:1617-21.
4. Fogelholm R, Murros K, Rissanen A, Avikainen S. Long-term survival after primary intracerebral haemorrhage: a retrospective population-based study. J Neurol Neurosurg Psychiatry. 2005;76:1534-8.
5. O’Donnell HC, Rosand J, Knudsen KA, Furie KL, Segal AZ, Chiu RI, et al. Apolipoprotein E genotype and the risk of recurrent lobar intracerebral hemorrhage. NEJM. 2000;342:240-5.
6. Ronning OM, Guldvog B, Stavem K. The benefit of an acute stroke unit in patients with intracranial haemorrhage: a controlled trial. J Neurol Neurosurg Psychiatry. 2001;70:631-4.
7. Feldmann E, Broderick JP, Kernan WN, Viscoli CM, Brass LM, Brott T, et al. Major risk factors for intracerebral hemorrhage in the young are modifiable. Stroke. 2005;36:1881-5.
8. Grillo P, Velly L, Bruder N. Accident vasculaire cérébral hémorragique: nouveautés sur la prise en charge. Annales Françaises d’Anesthésie et de Réanimation. 2006;25:868-73.
9. Fogelholm R, Eskola K, Kiminkinen T, Kunnamo I. Anticoagulant treatment as a risk factor for primary intracerebral haemorrhage. J Neurol Neurosurg Psychiatry. 1992;55:1121-4.
10. He J, Whelton PK, Vu B, Klag MJ. Aspirin and risk of hemorrhagic stroke: a meta analysis of randomized controlled trials. JAMA. 1998;280:1930-5.
11. Thrift AG, McNeil JJ, Forbes A, Donnan GA. Risk of primary intracerebralhaemorrhage associated with aspirin and non-steroidal anti-inflammatory drugs: case-control study. BMJ. 1999;318:759-64.
12. Rosand J, Eckman MH, Knudsen KA, Singer DE, Greenberg SM. The effect of warfarin and intensity of anticoagulation on outcome of intracerebral hemorrhage. Arch Intern Med. 2004;164:880-4.
13. Schellinger P, Fiebach J, Mohr A, Ringleb P, Jansen O, Hacke W. Thrombolytic therapy for ischemic stroke-A review. Part I-Intravenous thrombolysis. Crit Care Med. 2001;29:1812-8.
14. Vinters HV. Cerebral amyloid angiopathy. A critical review. Stroke. 1987;18:311-24.
15. Hemphill 3rd JC, Bonovich DC, Besmertis L, Manley GT, Johnston SC. The ICH score: a simple, reliable grading scale for intracerebral hemorrhage. Stroke. 2001;32:891-7.
16. Brott T, Broderick J, Kothari R, Barsan W, Tomsick T, Sauerbeck L, et al. Early hemorrhage growth in patients with intracerebral hemorrhage. Stroke. 1997;28:1-5.
17. Gebel JM, Sila CA, Sloan MA, Granger CB, Weisenberger JP, Green CL,et al. Comparison of the ABC/2 estimation technique to computer-assisted volumetric analysis of intraparenchymal and subdural hematomas complicating the GUSTO-1 trial. Stroke. 1998;29:1799-801.
18. Eckman MH, Rosand J, Knudsen KA, Singer DE, Greenberg SM. Can patients be anticoagulated after intracerebral hemorrhage? A decision analysis. Stroke. 2003;34:1710-6.
19. Mayer SA, Brun NC, Begtrup K, Broderick J, Davis S, Diringer MN, et al. Recombinant activated factor VII for acute intracerebral hemorrhage. NEJM. 2005;352:777-85.
20. Fogelholm R, Avikainen S, Murros K. Prognostic value and determinants of first-day mean arterial pressure in spontaneous supratentorial intracerebral hemorrhage. Stroke. 1997;28:1396-400.
21. Ohwaki K, Yano E, Nagashima H, Hirata M, Nakagomi T, Tamura A. Blood pressure management in acute intracerebral hemorrhage: relationship between elevated blood pressure and hematoma enlargement. Stroke. 2004;35:1364-7.
22. Schellinger PD, Fiebach JB, Hoffmann K, Becker K, Orakcioglu B, Kollmar R, et al. Stroke MRI in intracerebral hemorrhage: is there a perihemorrhagic penumbra? Stroke. 2003;34:1674-9.
23. Powers WJ, Zazulia AR, Videen TO, Adams RE, Yundt KD, Aiyagari V, et al. Autoregulation of cerebral blood flow surrounding acute (6 to 22 hours) intracerebral hemorrhage. Neurology. 2001;57:18-24.
24. Mayer SA, Rincon F. Treatment of intracerebral haemorrhage. Lancet Neurol. 2005;4:662-72.
25. Rabinstein AA. Treatment of cerebral edema. The Neurologist. 2006;12:59-73.
26. Diringer MN, Zazulia AR. Osmotic therapy: fact or fiction? Neurocrit Care. 2004;1:219-34.
27. Cruz J, Minoja G, Okuchi K. Major clinical and physiological benefits of early high doses of mannitol for intraparenchymal temporal lobe hemorrhages with abnormal pupillary widening: a randomized trial. Neurosurgery. 2002;51:628-37.
28. Battison C, Andrews PJ, Graham C, Petty T. Randomized, controlled trial on the effect of a 20% mannitol solution and a 7.5 % saline/6 % dextran solution on increased intracranial pressure after brain injury. Crit Care Med. 2005;33:196-202.
29. Mendelow AD, Gregson BA, Fernandes HM, Murray GD, Teasdale GM, Hope DT, et al. Early surgery vs. initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial. Lancet. 2005;365:387-97.
30. St Louis EK, Wijdicks EF, Li H. Predicting neurologic deterioration in patients with cerebellar hematomas. Neurology. 1998;51:1364-9.
Recibido: 10 de mayo de 2007. Aprobado: 2 de septiembre de 2007.
Dr. Claudio E. Scherle Matamoros. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Unidad de Ictus, Piso 8 A. San Lázaro No. 701 entre Belascoaín y Marqués González, municipio Centro Habana, Ciudad de La Habana, Cuba. Correo electrónico: csm@infomed.sld.cu
1Especialista de II Grado en Neurología.
2Doctor en Ciencias Médicas. Especialista de II Grado en Neurología. Profesor Titular.
3Especialista de II Grado en Neurología. Profesor Titular.