Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.47 n.1 Ciudad de la Habana ene.-mar. 2008
TRABAJOS ORIGINALES
Frecuencia de insulinorresistencia y/o déficit secretor de insulina y su relación con factores de riesgo para la hiperglucemia en pacientes con trasplantes renales
Frequency of insulin resistance and/or insulin secretory deficit and its connection with risk factors for hyperglycaemia in patients with kidney transplants
Gerardo Borroto DíazI; Malicela Barceló AcostaII; Carlos Guerrero DíazI; Martha Verónica González ÁlvarezIII; Asela Infante SuárezIII
IEspecialista de II Grado en Nefrología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Servicio de Nefrología. La Habana, Cuba.
IIEspecialista de II Grado en Endocrinología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Servicio de Endocrinología. La Habana, Cuba.
IIIEspecialista de I Grado en Nefrología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Servicio de Nefrología. La Habana, Cuba.
RESUMEN
La resistencia a la insulina y el déficit en la secreción pancreática de esta hormona son los factores patogénicos de la hiperglucemia asociada al trasplante renal, proceso frecuente y multifactorial que complica la evolución de estos enfermos. Se le realizó a 83 pacientes a los que se les había efectuado trasplantes renales, durante su seguimiento en consulta externa, una PTGO de 2 h con dosificación de insulina, determinando mediante los índices HOMA S y B %, la presencia de resistencia insulínica (48 %) y la disminución de la secreción hormonal (23,1 %) para conocer la frecuencia de estos trastornos, el papel de la deficiencia en la secreción y/o acción de la insulina y su asociación con factores de riesgo, excluyendo el tratamiento inmunosupresor. Se constató una elevada frecuencia de trastornos en el metabolismo de la glucosa (50 %) y evidente asociación con los factores considerados de riesgo para la hiperglucemia postrasplante. Se halló que la mayor edad del receptor, el mayor tiempo en diálisis, así como un índice de masa corporal elevado, más ganancia de peso al tercer mes del trasplante, la historia familiar de diabetes, la infección por el virus de la hepatitis C y la cifras elevadas de triglicéridos pretrasplante, resultaron estadísticamente significativos en los enfermos con índices insulínicos patológicos.
Palabras clave: Hiperglucemia asociada al trasplante, insulinorresistencia, déficit insulínico, índices HOMA, trasplante renal, factores de riesgo.
ABSTRACT
Insulin resistance and the deficit in the pancreatic secretion of this hormone are the pathogenic factors of hyperglycaemia associated with kidney transplant, a frequent and multifactorial process that complicates the evolution of these patients. A PTGO of 2 h with dosage of insulin was performed among 83 patients who had undergone renal transplants during their follow-up at the outpatient department. Insulin resistance (48 %) and the decrease of hormonal secretion (23.1 %) were determined by using the indexes HOMA S and B % in order to know the frequency of these disorders, the role of the deficiency in the secretion and/or action of insulin and its association with risk factors, excluding the immunosuppressive treatment. A high frequency of disorders in the glucose metabolism (50 %) and an evident association with factors considered as risk for posttransplant hyperglycaemia were confirmed. It was found that the oldest age, the longest time under dialysis, as well as an elevated body mass index, plus weight gain at the third month of the transplant, the family history of diabetes, the hepatitis C virus infection and the high figures of pretransplant triglycerides, were statistically significant in patients with pathological insulin indexes.
Key words: Hyperglycaemia associated with transplant, insulin resistance, insulin deficit, HOMA indexes, kidney transplant, risk factors.
INTRODUCCIÓN
La tolerancia a la glucosa es un balance entre la capacidad secretoria de insulina por las células beta del páncreas y la respuesta de los tejidos insulinosensitivos. Para que exista diabetes postrasplante (DMPT) se requieren 2 defectos: resistencia insulínica (RI) por los tejidos que normalmente responden a esta hormona y deficiencia relativa de insulina (DI).1
La RI es la alteración patogénica más precoz de la diabetes mellitus postrasplante.2 Se conoce que en estadios iniciales esta RI se compensa con la hipersecreción de insulina por las células beta, ambas condicionales, son los procesos precoces que facilitan la aterogénesis.3
Para que aparezca hiperglucemia y DMPT es necesario que haya disminución de la secreción aumentada (compensatoria) de las células beta, la fatiga de dichas células comienza poco antes que se desarrolle clínicamente la DMPT.4
Por lo que en la patogenia de la DMPT deben reconocerse varias etapas:
a) RI inicial con hiperinsulinemia compensadora y euglucemia.
b) Fatiga de las células beta con aumento de la glucemia posprandial.
c) Hiperglucemia de ayuno.
d) Diagnóstico clínico de DMPT.
Por esto resulta más adecuado referirse al término de hiperglucemia asociada al trasplante, que incluye las definiciones siguientes:
· Diabetes mellitus de nuevo inicio o postrasplante renal (DMPT).
· Glucemia en ayuna alterada. (GAA).
· Glucemia alterada 1 h después de una sobrecarga de glucosa (G1hA).
· Tolerancia a la glucosa alterada (PTGA).
Estos términos agrupan más completamente a la población con más comorbilidades cardiovasculares, pues está probado que al igual que la DMPT, las 3 últimas denominaciones se asocian a mayor riesgo de procesos ateroscleróticos.
El tratamiento inmunosupresor desempeña un papel clave en las condicionales patogénicas de los trastornos del metabolismo hidrocarbonado en los sujetos con trasplantes renales. Los esteroides son fármacos vinculados con la RI y la deficiencia en la secreción de insulina por el páncreas se ha asociado fundamentalmente al efecto tóxico directo del tacrolimus y la ciclosporina A.5,6
Nuestra hipótesis es que ambos mecanismos, RI y DI, se asocian a otros múltiples factores de riesgo presentes en el entorno de los enfermos que viven con un injerto renal funcionante, determinarlos precozmente y reconocer los procesos facilitantes es de suma importancia para desarrollar las acciones preventivas encaminadas a impedir el daño que emana de los mismos.
Los factores de riesgo en la aparición de la DMPT, además de la inmunosupresión, son varios. Se han citado la influencia genética, la historia familiar de diabetes, la edad avanzada, el sexo masculino, el test de tolerancia a la glucosa alterado pretrasplante, el tipo de donante, ciertos fenotipos de antígenos mayores de histocompatibilidad, la enfermedad que provocó la enfermedad renal crónica terminal (ERC-T), la hepatitis por virus C y el citomegalovirus (CMV), la frecuencia y el número de rechazos, valores bajos de adiponectin, la desnutrición tanto por exceso como por defecto, la distribución visceral de la grasa, la ganancia excesiva de peso después del trasplante, la disfunción del injerto, el uso de medicamentos hipotensores como los betabloqueadores o diuréticos y otras muchas condicionantes que parecen actuar produciendo insulinorresistencia o la disminución de la secreción de la hormona.7-12
Se realiza la presente investigación para conocer la frecuencia de la insulinorresistencia o el déficit de la secreción de insulina determinados por los índices Homeostasis Model Assessment (HOMA), cuyo uso ha sido validado en esta población de pacientes, además determinar su papel en la patogenia de los trastornos del metabolismo de la glucosa en nuestros enfermos y correlacionarlos con algunos de los factores de riesgo excepto el tratamiento inmunosupresor.
MÉTODOS
Se realizó un estudio transversal y descriptivo, para lo cual se efectuó PTG oral de 2 h, con dosificación de insulina, a un grupo de pacientes con TR, seguidos por consulta externa, que cumplieron los criterios de elegibilidad. Los resultados se correlacionaron con factores considerados de riesgo para el trastorno de los hidratos de carbono en estos enfermos.
Criterios de elegibilidad
Criterios de inclusión
· Supervivencia del injerto mayor de 1 año.
· Filtrado glomerular teórico= 70 mL/min (fórmula de Cocroft y Gault).
Tratamiento inmunosupresor con prednisona, ciclosporina A y azatioprina, siguiendo en todos el mismo protocolo. Dada la homogenización del tratamiento decidimos obviar el efecto del mismo en los resultados obtenidos.
Criterios de exclusión
· Diagnóstico de diabetes mellitus anterior al trasplante renal.
A todos los pacientes se les solicitó su consentimiento para participar en la investigación. La muestra quedó constituida por 83 pacientes.
Variables del estudio
Se determinaron variables como: sexo, historia familiar de diabetes, infección por el virus de la hepatitis C, tiempo en diálisis (meses), IMC, colesterol pretrasplante (Cpt), triglicéridos pretrasplante (TGpt), diferencia entre el peso en el momento del TR y al tercer mes de evolución del injerto (P3-P0), así como uso de drogas hipotensoras y diuréticos.
Se estudiaron además:
· Glucemia en ayunas (GA), mmol/L.
· Glucemia a la hora (G1h), mmol/L.
· Insulinemia en ayunas (Ia), µUI/mL.
· Interpretación de la PTG: según criterios de la ADA:13
a) DMPT.
b) Prueba de tolerancia a la glucosa alterada (PTGA).
c) Glucemia en ayuna alterada (GAA):= 5,6 mmol/L.
d) Glucemia a la hora alterada (G1hA):= 10 mmol/L.
e) Prueba de tolerancia a la glucosa normal (PTGN).
Se estimó la insulinorresistencia, según:
· Homa-S: índice de sensibilidad a la insulina; muestra de ayunas: 14
Glucemia x insulinemia/22,5 > 3,2 y
Se estimó la secreción de insulina:
· HOMA-% B: índice de secreción de insulina.14
20 x insulinemia en ayunas/glucemia en ayuna-3,5. El punto de corte es 100 %, esto permitió valorar el:
· Estado de secreción de insulina por las células beta del páncreas y la sensibilidad de los tejidos a la hormona categorizándose en las variables siguientes:
a) Resistencia a la insulina (RI): HOMA S mayor de 3,2.
b) Deficiencia secretoria de insulina (DI): HOMA B % menor de 100.
c) Normal (N).
Análisis estadístico
Las variables expuesta por valores de media como: tiempo en diálisis, edad del receptor al momento de realizar la PTG, IMC pretrasplante y ganancia de peso al tercer mes de trasplante (relación P3-P0), se analizaron las diferencias entre grupos al aplicar la prueba Kruskal Wallis. Aquellas cuyos resultados se plasman en tablas de frecuencias dentro de las que se incluyen: sexo del receptor, historia familiar de diabetes, antecedentes o no de hepatitis C y uso de drogas hipotensoras o diuréticas, se compararon mediante la prueba de chi-cuadrado.
Para hacer un análisis multivariado que nos diera la influencia independiente de las variables trabajadas se aplicó una regresión logística nominal.
En todos los casos se consideró significación estadística (SE) si p < 0,05.
La información se procesó en forma de tablas que permitieron posteriormente, mediante el empleo del análisis y la síntesis, elaborar conclusiones.
RESULTADOS
La tabla 1 expone el comportamiento de la PTG realizada en 83 pacientes, lo cual nos evidenció que el 50 % de los que habían recibido un trasplante, que conformaron este grupo, tenían en mayor o menor escala, dificultades para controlar la glucemia, la otra mitad de la muestra arrojó resultados normales 42 (50 %).
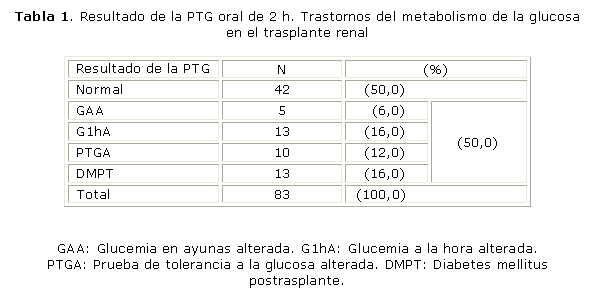
El cálculo de los índices de secreción y resistencia periférica a la acción de la insulina, validados por el método HOMA B % y HOMA S, arrojó que el 48 % de los casos pesquisados (40 pacientes) tienen disminuida la sensibilidad de sus tejidos periféricos a la acción de la hormona pancreática (RI), en 19 (23 %) se detectó deficiencia en la secreción hormonal, lo cual demuestra que la mayoría de los TR de nuestra muestra, 59 (71 %), poseen las condiciones fisiopatológicas esenciales para el desarrollo de los trastornos del control de la glucemia. En el resto, 24 (29 %), la interpretación de los índices fue normal.
Al correlacionar las variables de riesgo más importantes para la hiperglucemia de nuevo inicio después del TR (excepto las drogas inmunosupresoras) con la interpretación de los índices de insulina, aquellos pacientes con RI o DI presentan al compararlos con los enfermos cuyos índices fueron normales, mayor edad, tiempo en diálisis, mayor IMC pretrasplante, ganancia de peso al tercer mes, más alta frecuencia de historia familiar de diabetes y hepatitis C (tabla 2).

Las variables mayor edad del receptor (p= 0,031, 95 % IC: 1,01-1,19), historia familiar de diabetes (p= 0,011, 95 % IC: 1,64-2,3), infección por el virus C de la hepatitis (p= 0,009, 95 % IC: 1,66-36, 46), ganancia de peso al tercer mes de trasplante (p= 0,036, 95 % IC: 1,04-3,37) y triglicéridos pretrasplante (p= 0,005, 95 % IC: 8,19-35,40) resultaron, en el análisis multivariado, factores de riesgo independientes para la resistencia insulínica.
La deficiencia en la secreción de insulina estuvo facilitada, como factores de riesgo independientes en este estudio, por la edad avanzada del receptor (p= 0,001, 95 % IC: 1,07-1,30), los antecedentes familiares de diabetes (p= 0,023, 95 % IC: 0,09-12,63), la hepatitis C (p= 0,014, 95 % IC: 1,56-5, 67), así como las cifras más altas de triglicéridos pretrasplante (p= 0,04, 95 % IC: 2,09-65,62), según se muestra en las tablas 3a y 3b, del análisis multivariado, regresión logística múltiple.
DISCUSIÓN
La mejoría de todos los aspectos clínicos y quirúrgicos involucrados en la evolución del TR, así como los avances en la medicación inmunosupresora, han motivado un incremento en las tasas de supervivencia de injertos y pacientes, y han adquirido entonces un protagonismo relevante las complicaciones metabólicas, dentro de las cuales la hiperglucemia asociada al trasplante ocupa un lugar relevante.
En la génesis de los disturbios metabólicos de comienzo posterior al TR, la RI es la complicación central, generada sin duda por el uso de esteroides, pero donde otra serie de factores desempeñan un papel cardinal en su presentación.
Mora, de la división de Endocrinología de la universidad de Dallas, Texas, publicó recientemente una revisión de la DMPT. Como factores patogénicos expone el papel primordial de la resistencia hísitica periférica a la acción de la insulina. Desde el punto de vista fisiopatológico se refiere a su similitud con la diabetes tipo 2 y reconoce que la ERC es un estado de RI que se agrava después con el uso de esteroides en el TR, a lo que se añade una segunda etapa de defecto en la secreción de insulina producido por los anticalcineurínicos.15
Hjelmesarth,16 en un estudio muy similar al presente, determinó la IR mediante el HOMA-R y encontró mayor tasa de PTGA que la nuestra, 55 vs. 12,5 %, similar de DMPT y menor de PTGN, en todos los grupos halló valores elevados del índice de HOMA-R muy parecido a lo reportado por nosotros.
Dentro de los factores que propician la aparición de la RI está la edad avanzada de los receptores vinculada a la misma mediante una disminución del número de receptores para la hormona o una deficiencia de magnesio.17
Otro factor que interviene en la RI es el mayor tiempo en diálisis del receptor. La uremia es un estado de RI, motivado por el efecto de las toxinas retenidas, el hiperparatiroidismo secundario y los trastornos del calcio, fósforo y la vitamina D, la sobrecarga de hierro por transfusiones o el tratamiento de la anemia para suplementar el uso de la eritropoyetina. Es también la ERC-T un estado de inflamación crónica al igual que las infecciones por el virus de la hepatitis C y el citomegalovirus, en los cuales la liberación de citoquinas y factores de la inflamación motivan la insensibilidad periférica a la hormona pancreática.18,19
Otra variable muy vinculada a la RI es la obesidad y la distribución visceral de la grasa. Los adipocitos de la grasa visceral son muy activos metabólicamente y tienen menos receptores insulínicos. La ganancia excesiva de peso es frecuente después de un TR exitoso y la acumulación centrípeta de la grasa está favorecida en estos enfermos por el uso de los esteroides, esto explica que hayamos encontrado mayor IMC al momento del trasplante y que se haya producido ganancia de peso superior al tercer mes en los enfermos con HOMA R mayor de 3,2.20
Es obvio que en el desarrollo de la DMPT se encuentran presentes factores genéticos que producen un microambiente propicio para, bajo el influjo de factores externos, desencadenar esta temible complicación,21 esto quedó demostrado por el hallazgo de una mayor frecuencia de antecedentes de diabetes en los individuos de esta serie que desarrollan el disturbio de los hidratos de carbono después del trasplante renal, lo que coincide con la literatura revisada.
Nosotros pudimos corroborar estas aseveraciones en el presente estudio y las variables antes comentadas constituyeron factores de riesgo para la aparición de RI, tanto en el estudio univariado como multivariado, no así las otras variables estudiadas como, el sexo del receptor, la presencia de rechazo, el uso de hipotensores y diuréticos y las cifras de colesterol pretrasplante.
Con el paso del tiempo, las necesidades de hipersecreción insulínica por las células beta impuesta por la RI, para poder mantener la glucemia en valores normales, lleva al agotamiento de las mismas con la resultante disminución en la secreción de la hormona, favorecida por los factores tóxicos medicamentosos ya mencionados (anticalcineurínicos) y las infecciones virales (CMV y virus C de la hepatitis). Este déficit en la secreción de insulina lo encontramos en el 23 % de los pacientes estudiados y, como era de esperar, en aquellos con más tiempo de evolución de la enfermedad.
La RI y el DI son los factores patogénicos que propician la DMPT y constituyen complicaciones que se suceden en el tiempo para dar lugar a la imposibilidad de poder controlar las cifras de glucosa plasmática en estos enfermos.
Nam, para investigar la patogénesis y los posibles factores de riesgo para la DMPT, realizó una PTG oral con dosificación de insulina a 114 TR y encontró que los niveles de glucemia en ayunas y a las 2 h así como el radio glucemia/insulinemia en ayunas son posibles indicadores de disfunción de las células beta y pudieran ser predictores de DMPT, su hipótesis es que la disfunción de las células beta más que la RI puede ser el factor fundamental en la patogénesis de la DMPT.22
A la DI en el presente estudio se vincularon significativamente, la edad avanzada del receptor que sin duda lo hace más vulnerable al agotamiento de la secreción hormonal y también más sensible a los fármacos anticalcineurínicos. La infección por el virus C de la hepatitis con su efecto citopático directo en las células beta y la disminución del metabolismo de las drogas anticalcineurínicas, por la disfunción hepática que produce, propician su acción tóxica pancreática. La predisposición genética también parece estar presente en la DI al encontrar en nuestra serie mayor frecuencia, significativamente estadística, de antecedentes familiares de diabetes en los enfermos.
En el presente estudio, el IMC, la ganancia de peso, la frecuencia de rechazo, el sexo de los receptores, el colesterol pretrasplante y el uso de drogas hipotensoras o diuréticas no constituyeron factores de riesgo para la aparición de DI.
Las cifras elevadas de triglicéridos pretrasplante, que resultaron significativamente estadísticas tanto para la RI como para la DI al compararlas con las de los pacientes que no presentaron estas condicionales son, a nuestro juicio, una imagen en espejo de las situaciones que, según hemos venido detallando, favorecen la aparición de trastornos metabólicos asociados al TR y dentro de los cuales la hiperglucemia postrasplante resultó ser muy frecuente pues se observó en la mitad de la muestra estudiada.
Podemos concluir que con la realización de la PTG de 2 h se pudo evidenciar la alta frecuencia de los trastornos del metabolismo hidrocarbonado en esta población de enfermos, dados por GAA, G1hA, PTGA y DMPT. El incremento de la resistencia a la acción insulínica en los tejidos insulinosensibles y la deficiencia de la secreción de esta hormona constituyen, sin duda, las bases fisiopatogénicas de las dificultades en el control glucémico.
Factores como la mayor edad del receptor, la historia familiar de diabetes, infección por el virus C de la hepatitis, mayor IMC, más ganancia de peso y cifras elevadas de triglicérido pretrasplante facilitan el desarrollo de los trastornos hidrocarbonados, elevan la resistencia a la insulina y/o disminuyen la secreción pancreática a juzgar por la relación entre estos y los índices insulínicos, lo cual confirma los resultados del primer estudio.
La realización de una PTG oral de 2h con dosificación de insulina y utilización de los índices HOMA constituyen herramientas sencillas y muy útiles en el pesquisaje y diagnóstico de los trastornos de la glucemia en esta población de enfermos, sobre todo en individuos con factores de riesgo asociados.
REFERENCIAS BIBLIOGRÁFICAS
1. Wheleer DC, Krentz AJ. New-onset diabetes after transplantation. Br J Hosp Med. 2007;68(4):190-4.
2. Borroto G, Barceló M, Guerrero C, Alonso C. Insulinorresistencia en el trasplante renal. Rev Cubana Invest Biomed. 2002;21(4):241-7.
3. Hjelmesaeth J, Jenssen T, Hagen M, Egeland T, Hartmann A. Determinants of insulin secretion after renal transplantation. Metabolism. 2003;52(5):573-8.
4. Fernández Balsells M. Succesful pancreas and kidney transplantation a view of metabolic control. Clin transplant. 2005;12(6):582-7.
5. Ruals BM, Alves R. Diabetes mellitus after renal transplant. Acta Med Port. 2006;9:233-5.
6. Araki M, Ismail HR, Flechner LM. Posttransplant diabetes mellitus in kidney transplant recipients receiving calcineurin or mTOR inhibitor drugs. Transplantation. 2006;15(3):335-41.
7. Sezer S, Uyar M, Arat Z, Ozdemir FN. Risk factors for development of posttransplant diabetes mellitus in renal transplant recipients. Transplant Proc. 2006;38(2):529-32.
8. Andrade Sierra J, Contreras AM, Monteon FJ, Celis A. Risk factors and incidence of posttransplant diabetes mellitus in Mexican kidney recipients. Transplant Proc. 2006;37(8):961-6.
9. Borroto G, Batista F, Barceló M, Guerrero C. Frecuencia y factores de riesgo de la diabetes mellitus postrasplante renal. Rev Cubana Med. 2002;41(4):24-8.
10. Kamar N, Mariat C, Delahousse M, Dantal J, Najjar AA, Cassuto E. Diabetes mellitus after kidney transplantation: a French multicentre observational study. Nephrol Dial Transplant. 2007;29(13):156-60.
11. Shah T, Kasravi A, Huang E, Hayashi R, Young B, Cho YW et al. Risk factors for development of new-onset diabetes mellitus after kidney transplantation. Transplantation. 2006;82(12):1673-6.
12. Joss N, Staatz CE, Thomson AH, Jardine AG. Predictors of new onset diabetes after renal transplantation. Clin Transplant. 2007;21(1):136-43.
13. American Diabetes Association. Diagnosis and clasification of diabetes mellitus. Diabetes Care. 2004;27(S 1):S5-S10.
14. Martínez B, Blanco C. Utilización de métodos sencillos para el diagnóstico de la resistencia a la insulina. Endocrinología. 1998;34(5):145-7.
15. Mora PF. Post-transplantation diabetes mellitus. Am J Med Sci. 2005;32(2):86-94.
16. Hjelmesarth M, Kiberd M, Panek R, Kiberd BA. New onset diabetes mellitus post-kidney transplantation. Clin Transplant. 2006;20(5):634-9.
17. Kamar N, Mariat C, Delahousse M, Lefrancois N, Dantal J, Benhamou P. New onset diabetes mellitus incidence and risk factors in kidney transplantation: results of the observational cross-sectional study diapason. Transplant Proc. 2006; 38(7):2295-7.
18. Joss N, Staatz CE, Thomson AH, Jardine AG. Predictors of new onset diabetes after renal transplantation. Clin Transplant. 2007;21(1):136-43.
19. Kishi Y, Sugawara Y, Tamura S, Kaneko J, Matsui Y, Makuuchi M. New-onset diabetes mellitus after living donor liver transplantation: possible association with hepatitis C. Transplant Proc. 2006;38(9):2989-92.
20. Kent PS. Issues of obesity in kidney transplantation. J Ren Nutr. 2007;17(2):107-13.
21. Borroto G, Guerrero C. Pérez P, Lorenzo A. ¿Es la diabetes mellitus postrasplante una complicación genéticamente determinada? Rev Cubana Med. 2006;45(4):56-9.
22. Nam JH, Mun JL. Beta-cell dysfuntion rather than insulin resistance is the main contributing factor for the development of post renal transplantation diabetes mellitus. Transplantation. 2001;71(10):1417-23.
Recibido: 28 de diciembre de 2007.
Aprobado: 27 de febrero de 2008.
Dr. Gerardo Borroto Díaz. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba. Habana 3, CP 10300.














