Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.48 n.2 Ciudad de la Habana abr.-jun. 2009
TEMAS ACTUALIZADOS
Batería neurofisiológica para la neuromonitorización del coma y el diagnóstico de la muerte encefálica
Neurophysiologic test battery for neuromonitoring of comatose patients and brain death diagnosis
Calixto Machado CurbeloI; Liana Portela HernándezII; Maria G. García RocaIII; Jesús Pérez NellarIV; Claudio E. Scherle MatamorosV
I Doctor en Ciencias. Especialista de II Grado en Neurología y Neurofisiología Clínica. Investigador Titular. Instituto de Neurología y Neurocirugía. La Habana, Cuba.
II Especialista de II Grado en Neurofisiología Clínica. Hospital Universitario "Calixto Garcia" La Habana, Cuba.
III Especialista de II Grado en Neurofisiología Clínica. Hospital Universitario "Calixto Garcia" La Habana, Cuba.
IV Doctor en Ciencias Médicas. Especialista de II Grado en Neurología. Profesor Titular. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
VEspecialista de II Grado en Neurología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
RESUMEN
Se hizo una revisión sobre la aplicación de los potenciales evocados multimodales (PEM) para la neuromonitorización del coma, y como pruebas confirmatorias, en el diagnóstico de la muerte encefálica (ME). Los resultados presentados demuestran el valor de los PEM en la predicción del curso evolutivo del paciente comatoso, al predecir el deterioro de la función encefálica, lo que permite que el médico pueda tomar medidas terapéuticas tempranas, antes de que se establezcan lesiones encefálicas irreversibles. La alta resolución temporal de estas pruebas, capaces de detectar cambios funcionales del encéfalo en milisegundos, las hace idóneas para la neuromonitorización de pacientes críticos. En relación con la aplicación de los PEM y el electrorretinograma (ERG) como pruebas confirmatorias en el diagnóstico de la ME, se encontraron patrones electrofisiológicos característicos que indican la ausencia de la conducción sensorial en 3 vías diferentes, dentro de la cavidad craneana. No obstante, al considerarse una batería de pruebas confirmatorias y no como técnicas aisladas, permite optimizar el estudio electrofisiológico, y aumentar la confiabilidad diagnóstica. Por otro lado, por la resistencia de los PEM y del ERG a la hipotermia, al empleo de barbitúricos, anestésicos, a intoxicaciones por diferentes fármacos, a la anoxia, etc., permite aplicar dicha batería de pruebas para reducir el tiempo de observación requerido para establecer el diagnóstico definitivo de la ME, y confirmar dicho diagnóstico en situaciones que dificulten ese proceder.
Palabras clave: Coma, muerte encefálica, neuromonitorización, potenciales evocados multimodales, electrorretinograma.
ABSTRACT
Authors reviewed on application of multimodality evoked potentials (MEP) for coma neuromonitoring and as confirmatory tests in brain death (BD) diagnosis. Results presented demonstrate the MEPs value in forecast of evolution course of comatose patients, allowing prediction of brain function deterioration and thus, physician may take early therapeutic measures before establishment of irreversible brain lesions. The high time resolution of these tests allows an early detection of bran function changes, making them suitable for neuromonitoring of critical patients. In relation to MEPs and the electroretinogram (ERG) application, as confirmatory tests in the diagnosis of BD, characteristic electrophysiological patterns are found showing a lack of sensorial conduction in three different pathways within the skull. However, when considering a confirmatory test battery but not as isolated techniques, it is possible to optimize the electrophysiological study and to increase diagnostic reliability. By other hand, due to MEPs and ERG resistance to hypothermia, to use of barbiturates, to anesthetics, to intoxications from different drugs, to anoxia, etc, it is possible to apply such test battery in decreasing observation time required to establish the definite diagnosis of BD, and to confirm this diagnosis in clinical circumstances that make difficult this diagnostic procedure.
Key words: Coma, brain death, neuromonitoring, multimodality evoked potentials, electroretinogram.
INTRODUCCIÓN
Desde tiempos remotos, el hombre ha conocido que el comportamiento consciente normal depende de un encéfalo sano y que los trastornos de la conciencia son signos de insuficiencia del funcionamiento encefálico.1-5
Dos componentes fisiológicos rigen la conducta consciente del ser humano: el contenido y el despertar, conocido también como capacidad para la conciencia. El contenido de la conciencia representa la suma de las funciones mentales cognitivas, afectivas y otras funciones corticales superiores, mientras que el despertar está estrechamente vinculada a la aparición de la vigilia.1,2,6-14
Por tanto, los mecanismos de la conciencia, reflejan tanto del nivel de vigilia, que depende fundamentalmente del sistema reticular activador ascendente (SRAA) y la suma de funciones cognitivas afectivas, que se relaciona básicamente con el funcionamiento de la corteza cerebral, así como otras procesos funcionales complejos relacionados con la percepción, la orientación con respecto a sí y al medio, la actividad motora y el planeamiento conductual, que dependen de complejos mecanismos físicos y sicológicos con los cuales el sistema límbico y el cerebro (cerebrum) individualizan y enriquecen la conciencia y la conducta.11,13,15-19
Según Plum y Posner, un individuo consciente logra una total relación con el medio externo e interno, mientras que en el coma sucede lo opuesto, es decir, una carencia total de la relación consigo mismo y con el medio externo, a pesar de que el sujeto sea estimulado fuertemente.1,2
La necesidad de mantener estrecha vigilancia en pacientes con riesgos inminentes de morir ha hecho necesario el desarrollo de una especialidad médica, la medicina intensiva, así como de salas especiales como las Unidades de Cuidados Intensivos (UCI). De este modo, se ha podido lograr en las últimas décadas indudables avances en el desarrollo de sistemas de ventilación, en el monitoreo continuo de distintas variables fisiológicas, en la estandarización de nuevas terapéuticas, etc., de manera que los pacientes con trastornos de la conciencia pueden permanecer con vida por tiempos prácticamente ilimitados.20-22
Desde el punto de vista clínico ha sido necesario desarrollar escalas para el seguimiento de los pacientes en coma, de modo que se pueda objetivar la situación clínica del enfermo en un momento determinado, así como durante su evolución clínica. Teasdale y Jennett introdujeron la Escala de Glasgow para el Coma (EG), la cual ha sido ampliamente empleada en todo el mundo.23-28 Sin embargo, en la literatura se encuentran alrededor de 50 escalas para la valoración del coma. Por supuesto, la mayoría de los autores plantean determinados aspectos novedosos en sus escalas tomando casi siempre como punto de referencia a la EG. No obstante, esta última ha sido, sin lugar a dudas, la más empleada en la mayoría de los centros hospitalarios del mundo.
Por otro lado, a pesar de que para el seguimiento del paciente en coma la evaluación neurológica es insustituible, desde un punto de vista práctico no es posible que el personal médico y de enfermería puedan examinar al enfermo de manera continua; además, es frecuente que en ellos concurran situaciones que limitan los resultados del examen clínico: en la anestesia, en la narcosis barbitúrica usualmente empleada para prevenir el aumento de la presión intracraneana en el trauma craneal, el uso de relajantes de la fibra muscular esquelética para favorecer la ventilación asistida, etc.3,29-32
En las últimas décadas se han desarrollado técnicas neurofisiológicas que han mostrado su utilidad para la evaluación funcional del sistema nervioso: los potenciales evocados sensoriales (PE), que permiten evaluar objetivamente diferentes vías sensoriales, y que al igual que el EEG, son técnicas no invasivas que pueden repetirse tantas veces como se quiera sin riesgo alguno para el paciente. Por otro lado, el desarrollo de equipos de propósito específico ha permitido obtener registros de calidad, aún en las condiciones difíciles de una unidad de cuidados intensivos.33-43
Los potenciales evocados, en contraposición al examen neurológico, son altamente resistentes a la hipotermia, a la intoxicación por drogas, al uso de anestésicos, a la narcosis barbitúrica y por el contrario, el uso de agentes paralizantes de la fibra muscular esquelética hace posible obtener registros aún mejores, libres de contaminación electromiográfica. Esto ha dado lugar a que en la literatura hayan aparecido en años recientes numerosos trabajos acerca de la aplicación de los PE para el estudio del coma.44-52
Dentro de las distintas modalidades de PE, los potenciales evocados auditivos del tronco encefálico (PEATC) y los potenciales evocados somatosensoriales de corta latencia para la estimulación del nervio mediano (PES), han sido los que mejores resultados han mostrado en el diagnóstico neurológico, ya que presentan poca variabilidad en sujetos normales y se pueden obtener registros de calidad aún en las situaciones adversas que concurren en una UCI.42,53-61
Las pruebas neurofisiológicas pueden contribuir en la evaluación del coma en 3 aspectos fundamentales. La inmensa mayoría de las publicaciones sobre la aplicación de estas pruebas para el estudio de pacientes comatosos trata sobre los 2 primeros aspectos, o sea, el diagnóstico y el pronóstico de los enfermos a largo plazo. Éstas facilitan el diagnóstico diferencial entre comas metabólicos y estructurales, así como la localización topográfica de las lesiones, ya sean supratentoriales o infratentoriales. Diferentes autores señalan que un estudio neurofisiológico en las horas iniciales de la evolución de un paciente en coma, permite pronosticar con alta confiabilidad acerca de la calidad de la vida, si el enfermo no muere.62-65
Sin embargo, el tercer aspecto, relacionado con el neuromonitoreo, ha sido muy poco estudiado. La detección precoz de una arritmia cardíaca puede permitir un tratamiento a tiempo y prevenir un paro cardiocirculatorio. También, la predicción de que en el curso evolutivo de un enfermo se va a producir un deterioro de la función encefálica, permitiría tomar determinadas medidas terapéuticas, antes de que se establecieran lesiones encefálicas irreversibles.46,57,66-68
A pesar de la mejor atención que se ofrezca a un paciente en coma, en muchas ocasiones ocurre pérdida total de las funciones integradas en el encéfalo, a pesar de que otros órganos del cuerpo mantengan su integridad.69-75
Durante siglos, la ausencia irreversible de la función cardiorrespiratoria espontánea se consideró como determinante de la muerte del individuo. Sin embargo, con el desarrollo de la terapia intensiva, sobre todo a partir de la segunda mitad del presente siglo, fue posible suplir aquellas funciones reconocidas hasta ese momento como vitales. Esto motivó una verdadera revolución en el concepto de la muerte, cuando la atención se desplazó hacia definiciones basadas en considerar la pérdida definitiva de funciones integradas en el encéfalo.62,71,76-79
El advenimiento de la cirugía de los trasplantes de órganos, primero con el trasplante del riñón en los años 50 y después, de forma más sorprendente, con el trasplante del corazón en los años 60, provocó un interés especial en determinar la muerte basada en criterios neurológicos. No obstante, es importante subrayar que el concepto de muerte encefálica (ME), sinónimo de muerte del individuo, no surgió para beneficiar la trasplantología, sino que fue una consecuencia del desarrollo de la terapia intensiva.8,15,62,63,71,76,80,81
DESARROLLO
El diagnóstico de la ME como muerte del individuo ha dado lugar a que distintos países e instituciones hayan elaborado sus criterios diagnósticos. Con vistas a dar respuesta al Código Civil Cubano, la Comisión Nacional para la Determinación y Certificación de la Muerte elaboró un documento, la Resolución # 90 de Salud Pública, que presenta la metodología para diagnosticar la muerte, agrupados en los llamados signos ciertos de la muerte, y que constituye la base legal para el diagnóstico de la muerte en nuestro país.62,82,83
En dicha resolución se discute que el diagnóstico de la ME es eminentemente clínico, pero existen 2 grupos fundamentales de pruebas confirmatorias: aquellas que evalúan la ausencia definitiva de circulación intracraneal y las que evalúan la ausencia de actividad bioeléctrica cerebral. Dentro de las pruebas para determinar la ausencia de actividad bioeléctrica encefálica, la Comisión propuso el uso de una batería de pruebas confirmatorias conformada por potenciales evocados multimodales (PEM) y el electrorretinograma (ERG).44,65,75,82-91
El examen clínico neurológico es sensible a condiciones potencialmente reversibles, que pueden aparentar el estado de ME, como son: la hipotermia, la intoxicación por drogas depresoras del sistema nervioso central, el uso de anestésicos, la narcosis barbitúrica, la anoxia, el coma postraumático, etc. Debido a estas limitaciones del examen clínico neurológico, la mayoría de las escuelas exigen un período de observación del enfermo una vez que se encuentre supuestamente en el estado de ME, que varía entre 6, 12, 24 h, etc. Sin embargo, a medida que se prolonga el tiempo de permanencia del paciente en este estado, los mecanismos de control circulatorios, tanto periféricos como cardíacos, se deterioran y ello puede provocar daños irreversibles en los posibles órganos a trasplantar.47,74,92-94
En contraposición al examen neurológico, los PEM y el ERG son altamente resistentes a las condiciones potencialmente reversibles que pueden aparentar la ME por lo que han aparecido diversas publicaciones sobre la aplicación los PEM y el ERG para diagnosticar la ME.50,95-98 Sin embargo, en la mayoría de dichas investigaciones se aplica estas pruebas de forma aislada, por lo que no existe un consenso general acerca de su utilidad en este sentido y, por lo tanto, no se incluyen rutinariamente en los criterios para dicho diagnóstico. La Comisión Nacional propuso el uso de esta batería neurofisiológica como pruebas confirmatorias para el diagnóstico de la ME.65,75,82,83 Desde un punto de vista científico no son obligatorias, pero se preconiza su uso en las siguientes situaciones:
. En condiciones que dificultan el diagnóstico de ME.
· Ausencia de lesión destructiva cerebral demostrable por evidencia clínica o por neuroimagen.
· Con el objetivo de complementar el diagnóstico y de acortar además el período de observación instrumental.
· En el caso particular de que la etiología causante del coma sea de localización infratentorial.
Neuromonitorización del paciente en coma
Para la neuromonitorización del coma hemos propuesto los potenciales evocados auditivos de tronco encefálico (PEATC) y los potenciales evocados somatosensoriales de corta latencia (PES).62,87,89,90,91,99 Inmediatamente antes de estudiar a los enfermos, deben ser evaluados clínicamente de forma conjunta por 2 especialistas. La evaluación clínica se llevará a cabo mediante la aplicación de la EG (fig. 1). La metodología para ambas modalidades es la siguiente:
Potenciales evocados auditivos de tronco encefálico
Se aplican estímulos auditivos en forma de chasquidos o "clicks" de polaridad alterna de 0,1 milisegundos (ms) de duración, presentados monoauralmente a través de audífonos electromagnéticos TDH, a una frecuencia de 20/s y a una intensidad de 70 dB (nPL). Se presenta en el oído contralateral un ruido blanco de -40 dB (nPL).85,87,91
Se conforma una derivación a partir de electrodos de aguja colocados subdérmicamente en Cz, y en la mastoide del oído estimulado (A1 o A2) y un electrodo tierra en Fpz (Sistema Internacional 10-20). El ancho de banda de los amplificadores fue de 100-1500 Hz. Al menos se obtiene de 2 a 3 repeticiones de cada potencial registrado con un tiempo de análisis de 10 ms.
Variables de los PEATC
· Latencia de la onda I = LI
· Latencia de la onda II = LII
· Latencia de la onda III = LIII
· Latencia de la onda IV = LIV
· Latencia de la onda V = LV
· Intervalo interpico = I-V
· Intervalo interpico = I-III
· Intervalo interpico = III-V
· Amplitud de la onda I = AI
· Amplitud de la onda III = AIII
· Amplitud de la onda V = AV
· Logaritmo de AI= LnAI+1
· Logaritmo de AIII= LnAIII+1
· Logaritmo de AV= LnAV+1
Potenciales evocados somatosensoriales de corta latencia
Se aplican estímulos eléctricos en forma de pulsos cuadrados de 0,1 ms de duración a una frecuencia de 5/s, sobre el nervio mediano al nivel de la muñeca. La intensidad en miliamperes se ajustó hasta lograr una contracción visible del dedo pulgar. Se conformará un montaje de 3 canales, también mediante electrodos de aguja.86,87,91,100
a) C3' ó C4', o sea, 2 cm por detrás de los puntos C3 y C4 (Sistema Internacional 10-20) referidos contra Fpz (derivación céfalo-cefálica). C3' ó C4' referidos contra punto de Erb contralateral (Erbc) al estímulo (derivación céfalo-cefálica).
b) C3' ó C4' contra Erbc (cefálica-no cefálica).
c) C7 (Sistema Internacional 10-20) referido contra C7 (al nivel de la piel que cubre la apófisis de la séptima vértebra cervical, o sea, derivación cérvico-cefálica).
d) Erbc contra Erb ipsilateral (Erbi).
El ancho de banda para la primera derivación fue de 0,5-1 000 Hz y para el resto, de 100-1 000 Hz. Se empleó un tiempo de análisis de 50 ms y un retardo (delay) de 5 ms.
Variables de los PESCL
· Latencia del potencial de Erb = Erb
· Latencia de N9 = LN9
· Latencia de N13 = LN13
· Latencia de P15 = LP15
· Latencia de N20 = LN20
· Latencia de P25 = LP25
· Latencia de N30 = LN30
· Intervalo N13-N20= (TCC)
· Amplitud P15-N20 = AN20
· Amplitud N20-P25 = AP25
· Amplitud P25-N30 = AN30
· Suma de las 3 amplitudes = ACor
· Logaritmo de AN20= LnAN20
· Logaritmo de AP25= LnAP25
· Logaritmo de AN30= LnN30
· Logaritmo de Acort= LnACor
Tanto para los PEATC como para los PESCL se calcularon las variables para la estimulación de uno y otro lado, no obstante, para el análisis, sólo se tiene en cuenta el promedio de las variables para ambos lados de estimulación.
Análisis estadístico.62,66,89,99,101
Se calcula la correlación estadística existente entre las variables clínicas y las electrofisiológicas. Para esto se aplica la prueba de correlación no paramétrica de Spearman para una p<0,05. Se seleccionan entonces las variables electrofisiológicas que mejor se correlacionen con las variables clínicas (p<0,05), para aplicar un método de regresión logística y definir el valor predictivo de las variables neurofisiológicas en relación con las escalas clínicas. Para lograr esto se deben seguir varios pasos. En primer lugar, definir 2 ficheros: uno constituido con las variables neurofisiológicas del primer día de estudio con las EG del primero y del último día (fichero Días primero y final) y otro fichero en el que se consideren las variables neurofisiológicas del primer día y las escalas clínicas del primero y el segundo día de estudio (fichero Días consecutivos). El segundo paso es crear las variables diferencia de Glasgow, calculadas a partir de la diferencia entre el valor de la escalas clínicas del último día de estudio y del primero (fichero Días primero y final) y entre el segundo y el primer día de estudio (fichero Días consecutivos). Obviamente, estas diferencias arrojarán resultados mayores, menores o iguales que cero. En tercer lugar, se definirá la variable Categoría Glasgow, a la que se le asignarán valores de 0 y 1, según los resultados de esta diferencia. Como el modelo de regresión logística utilizado permite trabajar con 2 categorías (0 y 1), se aparearán las posibilidades:
mejoría= 0 empeoramiento=1
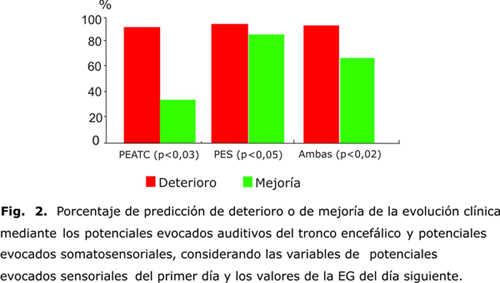
Este análisis permitirá definir las mejores variables neurofisiológicas para predecir el curso clínico de los enfermos. La aplicación del modelo de regresión logística permite demostrar que tanto los PEATC, como los PES son poderosos para predecir un deterioro o una mejoría del estado clínico, evaluado por la EG.
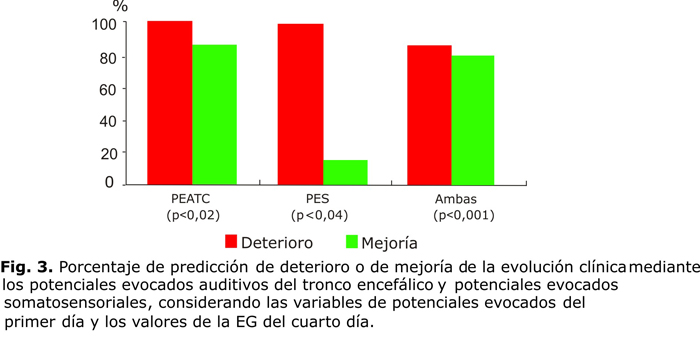
En la figura 2 se presenta el porcentaje de predicción para ambas modalidades de PE (PEATC, y PES) considerando las variables de PE para el primer día y el valor de la EG el día siguiente.62,64,99 En la figura 3 se presenta el mismo análisis para las variables de PE para el primer día de evolución clínica y la EG para el cuarto día. El modelo de regresión demostró que los PEATC fueron más potentes en la predicción, no obstante, al considerar ambas modalidades de PE en conjunto, se logró mejor valor predictivo.
Potenciales evocados multimodales y electrorretinograma como pruebas confirmatorias en el diagnóstico de la muerte encefálica
La metodología para los PEATC y los PES es la misma que se describió previamente.85,86,91 Los potenciales evocados visuales (PEV) y el ERG se obtuvieron según la siguiente metodología: los PEV y el ERG para la estimulación por LEDs se obtienen en un mismo montaje. Se aplican estímulos monoculares a una frecuencia de 2/s. Para los PEV se conforma una derivación Fz-Oz (Sistema Internacional 10-20) y para el ERG, un lente de contacto corneal (Work & Shop) se refirió a Fz. Tanto para los PEV como para el ERG se forma una derivación adicional, pero con una referencia no cefálica, o sea al nivel de la piel que cubre la apófisis de la séptima vértebra cervical (C7). El ojo estimulado se mantiene abierto por la presencia del lente corneal. Las señales registradas se amplifican (x 100 000) y se filtran entre 0,5 y 100 Hz. Se comprueba la repetibilidad de los potenciales mediante al menos 2 registros de 200 estímulos cada uno.90,91,102-104
Patrones neurofisiológicos encontrados en la ME44-48,65,75,84,85,87-91,99,102-109
Potenciales evocados auditivos de tronco encefálico
Se identificaron 3 patrones característicos para los PEATC, como se muestran respectivamente en las figuras 4, 5, y 6.
a) Ausencia bilateral de respuestas 73,34 % (fig. 4).
b) Onda I bilateral aislada 16,66 % (fig. 5).
c) Onda I unilateral aislada 10,00 % (fig. 6).
La ausencia bilateral de respuestas (fig. 4) fue el patrón de los PEATC más frecuentemente encontrado en los enfermos.
En todos los pacientes con presencia de onda I, unilateral o bilateral, la latencia de dicha onda estuvo siempre significativamente prolongada. Las ondas II, III, IV y V de los PEATC no se registraron en ningún enfermo.
Potenciales somatosensoriales de corta latencia
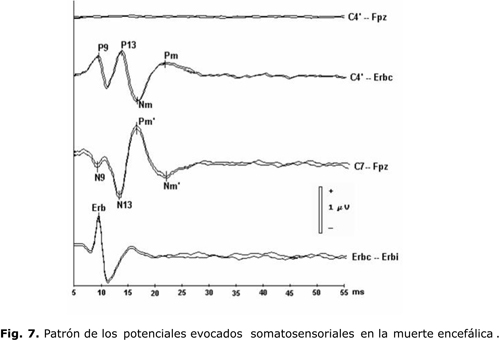
El patrón de los PESCL en la ME se ejemplifica en la figura 7: ausencia de la onda N20 y de los potenciales corticales más tardíos en la derivación C4'-Fpz, y preservación de los denominados potenciales subcorticales en el resto de los canales.
Potenciales evocados visuales y electrorretinograma
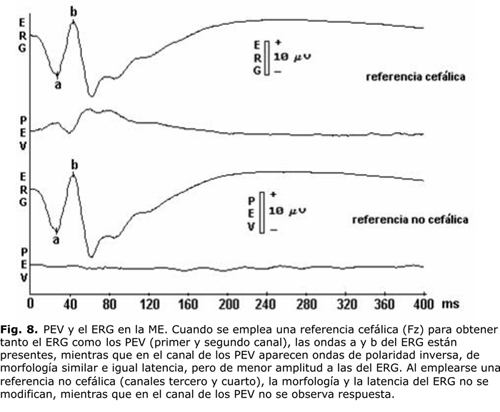
En todos los casos se encontró un patrón electrofisiológico característico (fig. 8). Cuando se empleó una referencia cefálica (Fz) para obtener tanto el ERG como los PEV (primer y segundo canal), las ondas a y b del ERG estaban presentes, mientras que en el canal de los PEV aparecían ondas de polaridad inversa, de morfología similar e igual latencia, pero de menor amplitud a las del ERG. Al emplearse una referencia no cefálica (canales tercero y cuarto), la morfología y la latencia del ERG no se modificaban, mientras que en el canal de los PEV no se observaba respuesta.
CONSIDERACIONES FINALES
Los resultados presentados en este trabajo demuestran el valor de los PE en la predicción en el curso evolutivo de un enfermo en coma, pues permite valorar que se va a producir un deterioro de la función encefálica, de modo que el médico pueda tomar en la UCI tempranas medidas terapéuticas, antes de que se establecieran lesiones encefálicas irreversibles.64,99,108 La alta resolución temporal de estas pruebas, es decir, que son capaces de detectar cambios funcionales del encéfalo en milisegundos, las hace idóneas para la neuromonitorización de los pacientes críticos.64,66,99,108,110,111 Se hace necesario además desarrollar sistemas automatizados que permitan aplicar estas técnicas en monitores junto a la cama de los enfermos en las UCI, como se monitorizan el electrocardiograma y otras variables fisiológicas.57,67,112-118
En relación con la aplicación de la batería neurofisiológica como prueba confirmatoria en el diagnóstico de la ME, se encontraron patrones característicos que indican ausencia de conducción sensorial en 3 vías diferentes, dentro de la cavidad craneana.44,89-91,118
En relación con los PEATC, la mayoría de los autores han encontrado patrones similares a los del presente trabajo: ausencia bilateral de respuestas y onda I aislada (unilateral o bilateral). La ausencia bilateral de respuestas es el patrón más frecuentemente hallado por diferentes autores al igual que por nosotros.42,44,53,60,85,91,108,119-124
De acuerdo con los resultados de los PES, en todos los enfermos se encontró un patrón característico en la MIE, consistente en la desaparición de los componentes corticales y la preservación parcial o completa de los denominados componentes subcorticales.86,87,90,91,100
En este estudio, el registro simultáneo de los PEV y del ERG nos permitió comprobar que con el empleo de una referencia no cefálica no se producían cambios ni en la morfología ni en la latencia del ERG, mientras que en el canal de los PEV no se observaba respuesta. Según este hecho, podemos afirmar que en las vías visuales de pacientes en el estado de ME sólo persiste actividad eléctrica en la retina, lo cual constituye por tanto un patrón electrofisiológico característico de este estadio. En otras modalidades de potenciales evocados se ha sugerido el empleo de ambas referencias para dilucidar los generadores de los diferentes componentes.90,91,102-104
En general, se encontraron patrones característicos para los PEM y el ERG en nuestros pacientes con el diagnóstico de ME. Para los PEATC, una ausencia de respuestas o la presencia unilateral o bilateral de las ondas I y II puede ser un indicador de la ME. Con respecto a los
PESCL, la ausencia de los potenciales corticales con la preservación total o parcial de los denominados potenciales subcorticales fue un patrón estable en todos los casos. En los PEV y el ERG, el uso de referencias cefálica y no cefálica permitió demostrar que en las vías visuales de enfermos en ME, la actividad bioeléctrica está confinada a la retina, lo que a su vez constituyó un patrón característico.85-87,91,102
Sin embargo, la aplicación de una batería de pruebas y no de técnicas aisladas indudablemente permite optimizar el estudio electrofisiológico y aumentar la confiabilidad diagnóstica. Por ejemplo, si se encuentra una ausencia bilateral de respuestas para los PEATC, que ha sido el patrón más frecuentemente hallado por diferentes autores, en un enfermo cuya anamnesis es pobre este hecho puede inspirar dudas sobre si dicho enfermo padecía previamente de una sordera o si presentaba lesiones de la cóclea y/o el nervio estatoacústico o un hemotímpano. No obstante, si en este paciente se obtienen además los patrones descritos para los PES, así como para los PEV y el ERG, entonces podemos aceptar que la ausencia bilateral de respuestas de los PEATC es un indicador de la ME.44,45,85,87
Se puede hacer un análisis similar con el resto de las pruebas, pues en el canal de los PEV se registraban ondas que demostramos se debían a la contaminación por la actividad electrorretinográfica, pero sólo se pudo comprobar combinando los PEV con el ERG. Tampoco la aplicación del ERG aisladamente es útil para el diagnóstico de la ME, pues sus componentes persisten aun después de eliminar todo soporte ventilatorio mecánico; sin embargo, en conjunto, con los PEV brinda un patrón característico de la ME. Si bien hay autores que niegan la utilidad de los PES para este diagnóstico, ya que aún se discute el origen de algunos de sus componentes, los patrones encontrados en todos nuestros casos son un indicadores de la ME, lo cual se reafirma al hallarse además los otros patrones descritos para el resto de las pruebas de la batería.44,45,87,90,91,102,103,125
Las ventajas de considerar una batería de pruebas se incrementan indudablemente por la resistencia de los PEM y el ERG a la hipotermia, al empleo de barbitúricos, anestésicos, a intoxicaciones por diferentes fármacos, a la anoxia, etc. Este hecho es de vital importancia para eliminar los tiempos de observación requeridos para establecer el diagnóstico definitivo de la ME (6 a 24 h), como es exigido por la mayoría de las escuelas para evitar errores diagnósticos, principalmente cuando no se pueden excluir las condiciones antes señaladas.51,52,95-97,126
Por todo lo anteriormente expuesto, consideramos que la aplicación de una batería de pruebas compuesta por los PEM y el ERG, como apoyo de la evaluación clínica y de otros exámenes confirmatorios, permite eliminar o reducir períodos de observación requeridos para establecer un diagnóstico definitivo de la ME, así como facilitar dicho diagnóstico en condiciones en las que el examen clínico se vea limitado. Este hecho es un requisito indispensable para la obtener órganos viables para la trasplantología y, por otro lado, está vinculado estrechamente a la dignidad misma del hombre, su derecho a vivir y a morir dignamente.64
Queremos expresar, además, que al diagnosticar la ME de una forma responsable y certera, con los recursos que nos proporciona el desarrollo tecnológico actual, se puede lograr que esos enfermos, con lesiones encefálicas irreversibles, fallecidos, se conviertan en donantes de órganos viables para otros pacientes a quienes la trasplantología sí puede brindar esperanzas reales de vida.
REFERENCIAS BIBLIOGRÁFICAS
1. Plum F, Posner JB. The diagnosis of stupor and coma. Philadelphia: FA Davis, 1980.
2. Plum P. Coma and related global disturbances of the human conscious state. En: Peters A, editor. Cerebral cortex. New York: Plenum; 1991.p. 359-425.
3. Jouvet M. Diagnostic électro-sous-cortico-graphique de la mort du système nerveux central au cours de certains comas. Electroenceph Clin Neurophysiol. 1959;11(4):805-8.
4. Daltrozzo J, Wioland N, Mutschler V, Kotchoubey B. Predicting coma and other low responsive patients outcome using event-related brain potentials: A meta-analysis. Clin Neurophysiol. 2007;118(3):606-14.
5. Horn J, Zandbergen EGJ, Koelman JHTM, Hijdra A. Prognosis for patients in a coma following cardiopulmonary resuscitation. Ned Tijdschr Geneeskd. 2008;152(6):308-13.
6. Moruzzi G, Magoun HW. Brain stem reticular formation and activation of the EEG. Electroenceph Clin Neurophysiol. 1949;1(1-4):455-73.
7. Steriade M. Brain activation, then (1949) and now: coherent fast rhythms in corticothalamic networks. Arch Ital Biol. 1995;134(1):5-20.
8. Machado C. Consciousness as a definition of death: its appeal and complexity. Clin Electroenceph. 1999;30(4):156-64.
9. Machado-Curbelo C. Do we defend a brain oriented view of death? Rev Neurol. 2002;35(4):387-96.
10. Vaitl D, Birbaumer N, Gruzelier J, Jamieson GA, Kotchoubey B, Kubler A et al. Psychobiology of altered states of consciousness. Psychol Bull. 2005;131(1):98-127.
11. Nunez A, Amzica F, Steriade M. Voltage-dependent fast (20-40 Hz) oscillations in long-axoned neocortical neurons. Neuroscience. 1992;51(1):7-10.
12. Steriade M, Amzica F, Contreras D. Synchronization of fast (30-40 Hz) spontaneous cortical rhythms during brain activation. J Neurosci. 1996;16(1):392-417.
13. Steriade M. Arousal: revisiting the reticular activating system. Science. 1996;272(5259):225-6.
14. Steriade M, Timofeev I, Durmuller N, Grenier F. Dynamic properties of corticothalamic neurons and local cortical interneurons generating fast rhythmic (30-40 Hz) spike bursts. J Neurophysiol. 1998;79(1):483-90.
15. Machado C. Death on neurological grounds. J Neurosurg Sci. 1994;38(4):209-22.
16. Korein J, Machado C. Brain death: updating a valid concept for 2004. Adv Exp Med Biol. 2004;550:1-14.
17. Steriade M, Contreras D, Amzica F, Timofeev I. Synchronization of fast (30-40 Hz) spontaneous oscillations in intrathalamic and thalamocortical networks. J Neurosci. 1996;16(8):2788-808.
18. Steriade M. Local gating of information processing through the thalamus. Neuron. 2004;41(4):493-4.
19. Steriade M. Grouping of brain rhythms in corticothalamic systems. Neuroscience. 2006;137(4):1087-106.
20. Machado-Curbelo C. Do we defend a brain oriented view of death? Rev Neurol. 2002;35(4):387-96.
21. Guidelines for the diagnosis of brain death. Canadian Neurocritical Care Group. Can J Neurol Sci. 1999;26(1):64-6.
22. Haupt WF, Hansen HC. Neurophysiological diagnostics in neurocritical care. Aktuelle Neurologie. 2008;35(3):124-30.
23. Teasdale GM. Follow-up computerized tomography (CT) scans in moderate and severe head injuries: Correlation with Glasgow coma scores (GCS), and complication rate - Comments. Acta Neurochirurgica. 1997;139(11):1047-8.
24. Wilson JTL, Pettigrew LEL, Teasdale GM. Structured interviews for the Glasgow Outcome Scale and the extended Glasgow Outcome Scale: Guidelines for their use. J Neurotr. 1998;15(8):573-85.
25. Nissen JJ, Jones PA, Signorini DF, Murray LS, Teasdale GM, Miller JD. Glasgow Head Injury Outcome Prediction Program: an independent assessment. J Neurol Neurosurg Psychiatr. 1999;67(6):796-9.
26. Teasdale GM, Murray L. Revisiting the Glasgow Coma Scale and Coma Score. Int Care Med. 2000;26(2):153-4.
27. Wilson JTL, Pettigrew LEL, Teasdale GM. Emotional and cognitive consequences of head injury in relation to the Glasgow outcome scale. J Neurol Neurosurg Psychiatr. 2000;69(2):204-9.
28. Bullock MR, Merchant RE, Choi SC, Gilman CB, Kreutzer JS, Marmarou A et al. Outcome measures for clinical trials in neurotrauma. Neurosurg Focus. 2002;13(1):ECP1.
29. Morgalla MH, Bauer J, Ritz R, Tatagiba M. Coma. Anaesthesist. 2006;55(7):760-8.
30. Robinson LR. A very bad prognosis for awakening from coma. Am J Phys Med & Rehab. 2007;86(6):512.
31. Zandbergen EGJ. Postanoxic coma: how (long) should we treat? Eur J Anaesthesiol Suppl. 2008;42:39-42.
32. Gagliardo A, Fossi S, Carrai R, Mazzeschi E, Scarpelli S, Cianchi G et al. Predicting disability in post-traumatic coma: prognostic value of somatosensory-evoked potentials. J Neurol. 2008;255:379.
33. Cobb WA, Dawson GD. The latency and form in man of the occipital potentials evoked by bright flashes. J Physiol. 1960;152:108-21.
34. Arfel G, be-Fessard D, Walter S. Evoked potentials in coma. Electroenceph Clin Neurophysiol. 1968;25(1):93-4.
35. Anziska BJ, Cracco RQ. Short latency somatosensory evoked potentials in brain dead patients. Arch Neurol. 1980; 37(4):222-5.
36. Loiselle DL, Nuwer MR. When should we warn the surgeon? Diagnosis-based warning criteria for BAEP monitoring. Neurol. 2005;65(10):1522-3.
37. Lew HL, Poole JH, Castaneda A, Salerno RM, Gray M. Prognostic value of evoked and event-related potentials in moderate to severe brain injury. J Head Traum Rehab. 2006;21(4):350-60.
38. Gonzalez-Garcia E, Vilela-Soler C, Roma-Ambrosio J, Fenollosa-Entrena B. The use of evoked potentials in the follow-up and prognosis of patients in coma following severe traumatic brain injury. Rev Neurol. 2007;44(7):404-10.
39. Wang K, Yuan Y, Xu ZQ, Wu XL, Luo BY. Benefits of combination of electroencephalography, short latency somatosensory evoked potentials, and transcranial Doppler techniques for confirming brain death. J Zhejiang University-Science B. 2008; 9(11):916-20.
40. Schorl M. Giant somatosensory evoked potentials as indicator of nonconvulsive status epilepticus. Clin Neurophysiol. 2008;119(3):726-8.
41. Amantini A, Amadori A, Fossi S. Evoked potentials in the ICU. Eur J Anaesthesiol Suppl. 2008;42:196-202.
42. Jardim M, Person OC, Rapoport PB. Brainstem auditory evoked potentials as a method to assist the diagnosis of brain death. Pro Fono. 2008;20(2):123-8.
43. Daubin C, Guillotin D, Etard O, Gaillard C, du Cheyron D, Ramakers M et al. A clinical and EEG scoring system that predicts early cortical response (N20) to somatosensory evoked potentials and outcome after cardiac arrest. BMC Cardiovasc Disord. 2008;8:35.
44. Machado C, Pumariega J, García-Tigera J, Miranda J, Coutin P, Antelo J et al. A multimodal evoked potential and electroretinography test battery for the early diagnosis of brain death. Int J Neurosciences. 1989;49:241-22. Ref Type: Journal (Full)
45. Machado C. An early approach to brain death diagnosis using multimodality evoked potentials and electroretinography. Minerva Anestesiol. 1994;60(10):573-7.
46. Guérit JM, Tourtchaninoff M De, Hantson P, Mahieu P. Miltimodality evoked potentials in the differential diagnosis of brain death. In: Machado C, editor. Brain Death (Proceedings of the Second International Symposium on Brain Death). Amsterdam: Elsevier Science, BV; 1995.p.119-26.
47. Machado-Curbelo C. A new formulation of death: definition, criteria and diagnostic tests. Rev Neurol. 1998;26(154):1040-7.
48. Facco E, Machado C. Evoked potentials in the diagnosis of brain death. Adv Exp Med Biol. 2004;550:175-87.
49. Bricolo A, Ore GD, Da PR, Faccioli F. Local cooling in spinal cord injury. Surg Neurol. 1976;6(2):101-6.
50. Markand ON, Warren C, Mallik GS, Williams CJ. Temperature-dependent hysteresis in somatosensory and auditory evoked potentials. Electroenceph Clin Neurophysiol. 1990;77(6):425-35.
51. Kadoi Y, Fujita N, Saito S, Fukura H, Fujita T. Effects of anesthetic drugs and temperature on brain stem and mid-latency evoked potentials. Masui. 1995;44(9):1213-7.
52. Zhou L, Shao Z, Ou S. Cryoanalgesia: electrophysiology at different temperatures. Cryobiol. 2003;46(1):26-32.
53. Goldie WD, Chiappa KH, Young RR, Brooks EB. Brainstem auditory and short-latency somatosensory evoked responses in brain death. Neurol. 1981;31(3):248-56.
54. Rodin E, Tahir S, Austin D, Andaya L. Brainstem death. Clin Electroenceph. 1985;16(2):63-71.
55. Tomita Y, Fukuda C, Maegaki Y, Hanaki K, Kitagawa K, Sanpei M. Re-evaluation of short latency somatosensory evoked potentials (P13, P14 and N18) for brainstem function in children who once suffered from deep coma. Brain Dev. 2003;25(5):352-6.
56. Trojaborg W, Jorgensen EO. Evoked cortical potentials in patients with "isoelectric" EEGs. Electroenceph Clin Neurophysiol. 1973;35(3):301-9.
57. Morgalla MH, Deininger M, Bitzer M, Seifert HC. Neuromonitoring: The value of somatosensory, acoustic and multimodal evoked potentials in comatose patients in the intensive care unit. Neurol Psychiatr Brain Res. 2004;11(1):7-12.
58. Fukuda S. Somatosensory evoked potential. Masui. 2006;55(3):280-93.
59. Cruccu G, Aminoff MJ, Curio G, Guerit JM, Kakigi R, Mauguiere F et al. Recommendations for the clinical use of somatosensory-evoked potentials. Clin Neurophysiol. 2008;119(8):1705-19.
60. Starr A, Achor J. Auditory brain stem responses in neurological disease. Arch Neurol. 1975;32(11):761-8.
61. Arulprakash S, Verma SP, Bhardwaj VK, Mishra SS, Chansoria M. Brain stem auditory evoked-responses and visual evoked responses in children with tubercular meningitis. Indian Pediatr. 2006;43(7):631-4.
62. Machado C, Wagner A, Coutin P, Diaz G, Cantón M, Hernández O et al. Potenciales evocados somatosensoriales de corta latencia. II- Tiempo de conducción central. Rev Hospital Psiq Habana. 1988.p.211-21.
63. Machado C. Resolution for the determination and certification of death in Cuba. Rev Neurol. 2003;36(8):763-70.
64. Machado C, Shewmon DL. Brain death and disorders of consciousness. New York: Kluwer Academics/Plenum Publishers; 2004.
65. Machado C, Abeledo M, Álvarez C, Aroche RM, Barrios I, Lasanta AM et al. Cuba has passed a law for the determination and certification of death. Adv Exp Med Biol. 2004; 550:139-42.
66. Cuspineda E, Machado C, Aubert E, Galan L, Llopis F, Avila Y. Predicting outcome in acute stroke: a comparison between QEEG and the Canadian Neurological Scale. Clin Electroenceph. 2003;34(1):1-4.
67. Hacke W. Neuromonitoring. J Neurol. 1985;232(3):125-33.
68. Fukuda S. Progress in perioperative neuromonitoring: preface and comments. Masui. 2006;55(3):264-8.
69. Walker AE. The death of a brain. Johns Hopkins Med J. 1969;124(4):190-201.
70. Walker AE. Pathology of brain death. Ann N Y Acad Sci. 1978;315:272-80.
71. Pallis C. Brain stem death—the evolution of a concept. Med Leg J. 1987;55 (Pt 2):84-107.
72. Muller HR. On the problem of a shallow cerebral current curve and the diagnosis of "cerebral death" following acute cerebral anoxia. Med Klin. 1966;61(49):1955-9.
73. Machado C, Korein J, Ferrer Y, Portela L, De la C Garcia M, Manero JM. The concept of brain death did not evolve to benefit organ transplants. J Med Ethics. 2007;33:197-200.
74. Jan MM. Brain death criteria The neurological determination of death. Neurosciences. 2008;13(4):350-5.
75. Machado C. Variability of brain death determination guidelines in leading US neurologic institutions. Neurol. 2008;71(14):1125.
76. Kretschmer E. Das apallische syndrom. Z Ges Neurol Psychiat. 1940;169:576-9.
77. Pallis C. Brainstem death. Handbook of Clinical Neurology: Head Injury. Amsterdam: Elsevier Science Publisher BV, 1990.p.441-96.
78. Machado C. The first organ transplant from a brain-dead donor. Neurol. 2005;64(11):1938-42.
79. Machado C. The declaration of Sydney on death. Neurol. 2007;68(12):A6.
80. Machado C. The concept of brain death did not evolve to benefit transplantation. Neurol. 2006;66(5):A2.
81. Machado C, Korein J, Ferrer Y, Portela L, Garcia MD, Chinchilla M et al. The declaration of Sydney on human death. J Medl Ethics. 2007;33(12):699-703.
82. Machado C. Resolution for the determination and certification of death in Cuba. Rev Neurol. 2003;36(8):763-70.
83. _____. Determination of death. Acta Anaesthesiol Scand. 2005;49(4):592-3.
84. Machado C, García-Tigera J, Coutin P. Multimodality evoked potentials and electroretinography in a test battery for the early diagnosis of brain death. Electroenceph Clin Neurophys. 1991;79(5):S19. Ref Type: Journal (Full)
85. Machado C, Valdes P, Garcia-Tigera J, Virues T, Biscay R, Miranda J et al. Brain-stem auditory evoked potentials and brain death. Electroenceph Clin Neurophys. 1991;80(5):392-8.
86. Machado C, Valdes P, Garcia O, Coutin P, Miranda J, Roman J. Short latency somatosensory evoked potentials in brain-dead patients using restricted low cut filter setting. J Neurosurg Sci. 1993;37(3):133-40.
87. Machado C. Multimodality evoked potentials and electroretinography in a test battery for an early diagnosis of brain death. J Neurosurg Sci. 1993;37(3):125-31.
88. Machado C, Santiesteban R, Garcia O, Coutin P, Beurgo MA, Roman J et al. Visual-Evoked Potentials and Electroretinography in Brain-Dead Patients. Documenta Ophthalmologica. 1993;84(1):89-96.
89. Machado C. Early prediction of the clinical course in comatose patients by evoked potentials. Neurol. 1996;46(2):2049.
90. Machado-Curbelo C, Roman-Murga JM. Usefulness of multimodal evoked potentials and the electroretinogram in the early diagnosis of brain death. Rev Neurol. 1998;27(159):809-17.
91. Machado C. Evoked potentials in brain death. Clin Neurophys. 2004;115(1):238-9.
92. Gros C, Vlahovitch B, Frerebeau P, Kuhner A, Billet M, Sahut G et al. [Arteriographic criteria of irreversible coma in neurosurgery]. Neurochirurg. 1969;15(6):477-86.
93. ten Velden GH, van Huffelen AC. Brain death criteria; guidelines by the Public Health Council. Ned Tijdschr Geneeskd. 1997;141(2):77-9.
94. Morenski JD, Oro JJ, Tobias JD, Singh A. Determination of death by neurological criteria. J Intens Care Med. 2003;18(4):211-21.
95. Hughes JR. Limitations of the EEG in coma and brain death. Ann N Y Acad Sci. 1978;315:121-36.
96. Guerit JM. Evoked potentials: a safe brain-death confirmatory tool? Eur J Med. 1992;1(4):233-43.
97. de TM, Hantson P, Mahieu P, Guerit JM. Brain death diagnosis in misleading conditions. QJM. 1999;92(7):407-14.
98. Romani A, Bergamaschi R, Versino M, Zilioli A, Callieco R, Cosi V. Circadian and hypothermia-induced effects on visual and auditory evoked potentials in multiple sclerosis. Clin Neurophys. 2000;111(9):1602-6.
99. Machado C, Román JM, García-Tigera J, García O, Miranda J. Utilidad de los potenciales auditivos de tallo encefálico y somato- sensoriales corta latencia en el neuromonitoreo. Acta Médica. 1990;1:95-108.
100. Shiogai T, Takeuchi K. Diagnostic reliability in loss of brainstem function evaluated by brainstem auditory evoked potentials and somatosensory evoked potentials in impending brain death. In: Machado C, editor. Brain Death (Proceedings of the Second International Symposium on Brain Death). Amsterdam: Elsevier Science, BV; 1995.p.111-8.
101. Machado C, Cuspineda E, Valdes P, Virues T, Llopis F, Bosch J et al. Assessing acute middle cerebral artery ischemic stroke by quantitative electric tomography. Clin Eeg Neurosc. 2004;35(3):116-24.
102. Machado C. Visual evoked potentials and electroretinography in brain-dead patients. Neurophysiol Clin. 1990;20(Suppl.):18s.
103. Machado C, Santiesteban R, García-Tigera J, García O. Potenciales evocados visuales y el electrorretinograma en la muerte encefálica. Rev Cubana Oftalmol. 1991;4[2]:117-24.
104. Machado C, Santiesteban R, Garcia O, Coutin P, Beurgo MA, Roman J et al. Visual evoked potentials and electroretinography in brain-dead patients. Doc Ophthalmol. 1993;84(1):89-96.
105. Machado C, García-Tigera J, García O, García-Pumariega J, Román J. Muerte encefálica. Criterios diagnósticos. Rev Cubana Med. 1991;30(3):181-206.
106. Machado C. Early diagnosis of brain death. Clinical Intensive care (Supp). 1992;3(2):116.
107. Machado C, Valdés P, García O, Coutin P, Miranda J, Roman J. Short latency somatosensory evoked potentials in brain-dead patients using restricted low cut filter setting. J Neurosurg Sci. 1993;37(3):133-40.
108. Facco E, Machado C. Evoked potentials in the diagnosis of brain death. Adv Exp Med Biol. 2004;550:175-87.
109. Machado C. Determination of death. Acta Anaesthesiologica Scand. 2005;49(4):592-3.
110. Machado C, Cuspineda E, Valdes P, Virues T, Llopis F, Bosch J et al. Assessing acute middle cerebral artery ischemic stroke by quantitative electric tomography. Clin EEG Neurosci. 2004;35(3):116-24.
111. Cuspineda E, Machado C, Galan L, Aubert E, Alvarez MA, Llopis F et al. QEEG prognostic value in acute stroke. Clin Eeg Neurosc. 2007;38(3):155-60.
112. Shiogai T. Evaluation of electrophysiological neuromonitoring in the diagnosis of brain death: Part III. Compressed spectral arrays. No To Shinkei. 1989;41(3):309-18.
113.Shiogai T. Evaluation of electrophysiological neuromonitoring in the diagnosis of brain death: Part I. Brainstem auditory evoked potentials. No To Shinkei. 1989;41(1):73-83.
114. Nuwer MR, Daube J, Fischer C, Schramm J, Yingling CD. Neuromonitoring during surgery. Report of an IFCN Committee. Electroenceph Clin Neurophysiol. 1993;87(5):263-76.
115. Shiogai T, Takeuchi K. Multimodal neuromonitoring in impending brain death. Min Anestesiol. 1994;60(10):583-8.
116. Meixensberger J, Jager A, Dings J, Baunach S, Roosen K. Multimodal hemodynamic neuromonitoring - Quality and consequences for therapy of severely head injured patients. Intracran Press Neuromonit Brain Inj. 1998;71:260-2.
117. Granry JC, Dube L, Terminassian A, Frebet E, Le Rolle T. Multimodal neuromonitoring in children with severe head injury. Ann Franca D Anesth Rean. 2002;21(2):148-56.
118. Machado C, Abeledo M, Alvarez C, Aroche RM, Barrios I, Lasanta AM et al. Cuba has passed a law for the determination and certification of death. En: Machado C, Shewmon DL, ed. Brain death and disorders of consciousness. New York: Springer 2004;pp;139-42.
119. Chiappa KH, Ropper AH. Evoked potentials in clinical medicine (first of two parts). N Engl J Med. 1982;306(19):1140-50.
120. Cohen SN, Potvin A, Syndulko K, Pettler-Jennings P, Potvin JH, Tourtellotte WW. Multimodality evoked potentials: clinical applications and assessment of utility. Bull Los Angeles Neurol Soc. 1982;47:55-61.
121. Sasaki M, Sakamoto T, Yamashita M, Tsutsumi H, Aruga T, Toyooka H et al. Auditory evoked brain-stem responses (ABRs) in brain dead status. No To Shinkei. 1984;36(9):917-24.
122. Ozgirgin ON, Ozcelik T, Sevimli NK. Auditory brain stem responses in the detection of brain death. Kulak Burun Bogaz Ihtis Derg. 2003;10(1):1-7.
123. Su YY, Yang QL, Pang Y, Lv XP. Evaluation of coma patients after cardiopulmonary resuscitation. Chin Med J (Engl). 2005;118(21):1808-11.
124. Avlonitis VS, Wigfield CH, Golledge HDR, Rostron AJ, Kirby JA, Dark JH. Brain stem auditory evoked response for confirmation of brain death in the rat. Transplant. 2008;86(5):745-6.
125. Machado C, Santiesteban R, Garcia O, Coutin P, Beurgo MA, Roman J et al. Visual evoked potentials and electroretinography in brain-dead patients. Doc Ophthalmol. 1993;84(1):89-96.
126. Freye E. Cerebral monitoring in the operating room and the intensive care unit - an introductory for the clinician and a guide for the novice wanting to open a window to the brain. Part II: Sensory-evoked potentials (SSEP, AEP, VEP). J Clin Monit Comput. 2005;19(1-2):77-168.
Recibido: 9 de marzo de 32009.
Aprobado: 8 de mayo de 2009.
M.D. Ph. D. Calixto Machado Curbelo. Instituto de Neurología y Neurocirugía, 29 y D, El Vedado, Ciudad de La Habana, Cuba. CP 10400 Correo electrónico: braind@infomed.sld.cu