Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina
versão On-line ISSN 1561-302X
Rev cubana med v.49 n.1 Ciudad de la Habana jan.-mar. 2010
TRABAJOS ORIGINALES
Metaplasia intestinal en pacientes con reflujo duodenogástrico y ácidos biliares totales elevados
Intestinal metaplasia en patients with duodenogastric reflux and high total bile acids
Felipe Piñol JiménezI; Manuel Paniagua EstévezII; Gloria Pérez SánchezIII; Bienvenido Gra OramasIV; Aracelis Cendán CordovíV; Elvira Borbolla BusquetsVI
IDoctor en Ciencias Médicas. Especialista de II Grado en Gastroenterología. Investigador Auxiliar. Instructor. Instituto de Gastroenterología. La Habana, Cuba.
IIDoctor en Ciencias Médicas. Especialista de II Grado en Gastroenterología. Investigador Titular. Profesor Titular. Instituto de Gastroenterología. La Habana, Cuba.
IIIEspecialista de I Grado en Gastroenterología. Instituto de Gastroenterología. La Habana, Cuba.
IVEspecialista de II Grado en Anatomía Patológica. Investigador Auxiliar. Instituto de Gastroenterología. La Habana, Cuba.
VLicenciada en Bioquímica. Instituto de Gastroenterología. La Habana, Cuba.
VIEspecialista de II Grado en Bioestadística. Instituto de Gastroenterología. La Habana, Cuba.
RESUMEN
Existen evidencias que tanto los ácidos biliares como el Helicobacter pylori en la mucosa gástrica son capaces de desencadenar un proceso inflamatorio que según su intensidad y persistencia favorecen la aparición de fallas y mutaciones en la replicación celular que se expresan desde una metaplasia, displasia hasta un cáncer. Se realizó un estudio epidemiológico observacional, descriptivo, prospectivo de corte transversal en el Instituto de Gastroenterología, en pacientes con reflujo duodenogástrico y ácidos biliares totales elevados, con el objetivo de conocer la asociación entre la metaplasia intestinal y la presencia o no de Helicobacter pylori. Al concluir la investigación se observó que la metaplasia estuvo presente en 48,7 % de los 39 pacientes estudiados, que existió una asociación estadísticamente significativa (p<0,05) en la distribución de la bacteria en los pacientes con y sin metaplasia intestinal, que los pacientes con reflujo duodenogástrico, a pesar de tener una lesión histológica, presentaron resultados negativos en cuanto a la presencia de Helicobacter pylori. En las muestras con diagnóstico histológico de gastritis crónica severa y atrófica, el 75 % presentaban Helicobacter pylori. La localización de la metaplasia intestinal fue mayor en la región antral (84,3 %). En los pacientes con reflujo duodenogástrico la presencia de Helicobacter pylori no parece estar asociada a grados intensos de metaplasia, aunque el microorganismo se encuentre en todas las categorías, mientras que cuando no hay, la metaplasia tiende a ser menos severa. En el 100 % de los casos la densidad de la bacteria fue ligera.
Palabras clave: Reflujo duodenogástrico, ácidos biliares totales, Helicobacter pylori, metaplasia intestinal.
ABSTRACT
The cytotoxic and cancerous action of bile acids on gastric mucosa is a very interesting subject within the gastroduodenal diseases due to they are able to alter the membrane, the cellular metabolism, to give rise to a inflammatory process, to increase the proliferation, the cell apoptosis and the DNA damage, that according to its intensity and persistence, favor the appearance of failures and mutations in cell replication. With the discovery and characterization of Helicobacter pylori it is considered that according to its intensity and the time of persistence in gastric mucosa provokes damages with failures and cellular mutations. In this sense, a prospective and descriptive study was conducted in the Institute of Gastroenterology in patients presenting with duodenogastric and high total bile acids to know the association between the intestinal metaplasia and the presence or not of Helicobacter pylori. Metaplasia was present in the 48.7 % of the 39 study patients, that there was a statistically significant association (p< 0.05) in Helicobacter pylori distribution in patients with and without intestinal metaplasia; that patients with duodenogastric reflux, despite of a histological lesion also had a greater frequency of negative results as regards the presence of Helicobacter pylori. In samples with histological diagnosis of severe and atrophic chronic gastritis, 75 %, respectively, had Helicobacter pylori and in consequence, there was a significant association between presence or not of microorganism and the chronic gastritis intensity. Intestinal metaplasia location was higher in antral region (84.3 %) and also with a higher ratio of microorganism positivity. In patients with duodenogastric reflux, presence of Helicobacter pylori don't seems to be associated with intense degrees of intestinal metaplasia, although the microorganism is present in all categories, but when there is not Helicobacter pylori, intestinal metaplasia to tend to develop in its less severe degrees. In all cases the Helicobacter pylori density was light.
Key words: Duodenogastric reflux, total bile acids in gastric juice, Helicobacter pylori, intestinal metaplasia.
INTRODUCCIÓN
La incidencia del cáncer gástrico ha disminuido a lo largo de este siglo de manera significativa, lo cual constituye uno de los fenómenos epidemiológicos más importantes que se ha observado en las últimas décadas. Sin embargo, según indica CP Howson,1 no se conoce con precisión el motivo de esta disminución. Se señala, por ejemplo en Japón, que es uno de los países de mayor incidencia del cáncer gástrico, que se debe a la política sanitaria, el cuerpo médico y los avances tecnológicos, que en la actualidad han logrado mejorar los aspectos epidemiológicos y clínico-terapéuticos del cáncer gástrico. Otros señalan que es resultado de un mejor manejo en cuanto a calidad de conservación y transporte de los alimentos, lo cual reduce la necesidad de consumir alimentos ahumados y salados, por consiguiente, disminuyen las posibilidades de crecimiento microbiano por contaminación, factor clásicamente considerado de riesgo para el cáncer gástrico.2
La Organización Mundial de la Salud (OMS) continúa señalando que a nivel mundial el cáncer gástrico ocupa la segunda causa más frecuente de neoplasia, con más de 470 000 casos nuevos al año, lo que representa 10 % del total de los tumores malignos registrados.3,4
En toda la literatura internacional y nacional se reportan diversos factores de riesgo del cáncer gástrico, entre estos se señalan los genéticos, los ambientales, la anemia perniciosa, la enfermedad de Menetrier, los pólipos gástricos, las operaciones de estómago, las infecciones por Helicobacter pylori, la gastritis crónica atrófica, la atrofia gástrica, la metaplasia intestinal y la presencia de ácidos biliares en el jugo gástrico (reflujo duodenogástrico). Algunos de estos factores permanecen en discusión, y otros, por el contrario, se han ido confirmando de forma cada vez más precisa.5-8
En la actualidad, diversos trabajos reflejan el gran interés y la importancia que se le concede a la presencia de reflujo duodenogástrico en la génesis del cáncer gástrico; reflujo que está constituido, fundamentalmente, por secreciones biliares y pancreáticas.9-13
Aún se desconoce cuál de los componentes del reflujo es el factor patogénico principal, pero estudios clínicos y experimentales recientes confirman el papel primordial de la concentración de ácidos biliares, enzimas pancreáticas y lisolecitina resultante de la acción de la fosfolipasa A sobre la lecitina, como agentes nocivos de la mucosa gástrica.14,15
Los ácidos biliares, la lisolecitina y la fosfolipasa A alteran el carácter del moco gástrico, provocan la citolisis de las células epiteliales, degradan la barrera mucosa gástrica, provocan la retrodifusión de hidrogeniones e inhiben la secreción de bicarbonato.14,16,17
La capacidad de los agentes descritos con anterioridad para producir daños morfológicos y cinéticos depende de la concentración, el estado de conjugación, la hidroxilación y el pH del medio intragástrico.17-19
Estas sustancias actúan como agentes agresivos al romper la barrera-mucosa gástrica y desencadenar un proceso inflamatorio agudo que, de acuerdo con la intensidad y el grado de persistencia, evoluciona hacia la cronicidad. El proceso inflamatorio va acompañado de un incremento de la proliferación celular durante el cual pueden presentarse fallas y mutaciones que favorezcan la aparición de la metaplasia intestinal.20
Es reconocido que la metaplasia intestinal constituye un factor de riesgo importante para el cáncer gástrico, pues representa el grado más avanzado de gastritis crónica.18,19
La metaplasia intestinal en el estómago se caracteriza, desde el punto de vista histológico, por la presencia en la mucosa gástrica de enterocitos o células de tipo absorbentes (intestinales) de Paneth, goblet, acompañadas o no de células caliciformes en el epitelio superficial de la mucosa gástrica o en las glándulas productoras de moco. Con frecuencia se presenta cierto grado de gastritis atrófica, expresada esta por la pérdida en mayor o menor grado de las glándulas gástricas.21-23
De acuerdo con la intensidad de la metaplasia intestinal, esta se clasifica como: mínima, leve, moderada o severa. Según el grado de diferenciación celular y la secreción de mucina, la metaplasia intestinal puede ser de tipo I, II ó III.
La metaplasia intestinal tipo III, tiene una gran prevalencia en pacientes de edad avanzada y con alto grado de intestinalización gástrica. Se caracteriza por un elevado contenido de mucina y por ser de tipo colónica, por lo cual se considera como lesión precursora del cáncer gástrico; no obstante, diversos autores establecen una asociación mayor entre la metaplasia intestinal tipo III y el adenocarcinoma tipo intestinal (80 %), y la consideran menos frecuente en el adenocarcinoma difuso (20 %) y las lesiones benignas de estómago (8 %).
Actualmente se estima que existe una fuerte asociación entre la presencia de Helicobacter pylori y la metaplasia intestinal, como agentes precursores del cáncer gástrico.23
La metaplasia intestinal puede estar presente en cualquier segmento del estómago, pero es más frecuente en el antro y la región prepilórica.20 Estas alteraciones histológicas se interpretan como el estadio inicial en el complejo proceso de degeneración maligna que finalmente lleva al establecimiento del cáncer gástrico por lo cual están consideradas como un índice de alto riesgo del cáncer estomacal.21
Entre los mecanismos fisiopatológicos del establecimiento de la gastritis atrófica y de la metaplasia intestinal también se ha considerado la existencia de reflujo duodenogástrico en la cavidad gástrica.24-26
Teniendo en cuenta la relación que existe entre la infección por Helicobacter pylori, la presencia de reflujo duodenogástrico y la aparición de metaplasia intestinal en la mucosa gástrica, y a su vez, que estos son factores de riesgo en la génesis del cáncer gástrico, realizamos un estudio descriptivo prospectivo en pacientes con reflujo duodenogástrico y ácidos biliares totales elevados, con el objetivo general de identificar la relación entre la metaplasia intestinal y la presencia o no de Helicobacter pylori, en pacientes con reflujo duodenogástrico y niveles de ácidos biliares totales elevados en el contenido gástrico; como objetivos específicos los siguientes: determinar la frecuencia de pacientes con metaplasia intestinal en el grupo estudiado y su relación con la presencia de Helicobacter pylori; determinar otros diagnósticos histológicos realizados en estos pacientes según la presencia o no de Helicobacter pylori; señalar la localización más frecuente de la metaplasia intestinal y su relación con la presencia de Helicobacter pylori; relacionar el grado de metaplasia intestinal con la presencia y densidad de Helicobacter pylori en el grupo de pacientes estudiados.
MÉTODOS
Universo: constituido por pacientes de uno u otro sexo y raza, atendidos en el Instituto de Gastroenterología, en los cuales se evidenció endoscópicamente la existencia de reflujo duodenogástrico de aspecto biliar. La investigación se realizó durante el período comprendido entre enero de 2001 y julio de 2002.
Criterios de inclusión
1. Pacientes con reflujo duodenogástrico y ácidos biliares totales elevados en contenido gástrico en ayunas.
2. Mayores de 40 años.
3. Conformidad del paciente para participar en la investigación.
4. No estar contraindicada la realización de endoscopia y biopsia.
Criterios de exclusión
1. Pacientes que al menos 30 d antes del estudio endoscópico recibieron tratamiento con bloqueadores H2 o inhibidores de la bomba de protones y antibióticos como terapéutica para la erradicación del Helicobacter pylori, o estuvieran siendo tratados con celulosa microcristalina.
2. Embarazadas.
3. Operados de estómago por las técnicas Billroth I o II.
4. Pacientes con neoplasia esofagogástrica.
5. Pacientes que se nieguen a participar en el estudio.
6. Pacientes con complicaciones como hemorragia, perforación, etcétera, en el momento del diagnóstico endoscópico inicial.
El estudio estuvo justificado desde el punto de vista ético ya que se realizó conforme a los principios establecidos en la declaración de Helsinki.27
A todos los que participaron en el estudio se les realizó esofagogastroduodenoscopia, utilizando un equipo GIF Pentax de visión frontal. Durante el estudio se examinó detenidamente toda la mucosa gastroduodenal, para valorar endoscópicamente las lesiones existentes, en especial a nivel del antro y el cuerpo gástrico, que pudieran ser compatibles con una metaplasia intestinal. Se observó si existía reflujo duodenogástrico en la luz gástrica, y cuando fue así, se extrajeron 5 cc por aspiración con una jeringuilla y un catéter de teflón introducido a través del canal de biopsia del equipo, con el objetivo de dosificar ácidos biliares totales por el método enzimático utilizando el test de 3a-esteroides deshidrogenasa. Se consideró como cifra normal hasta 0,16 mmol/L y como patológica, la que estuvo por encima de esta cifra.
Posteriormente se introdujo la pinza de biopsia a través del canal de toma de biopsia del endoscopio y se extrajeron fragmentos de las mucosas del antro y del cuerpo, pues cuando existe reflujo duodenogástrico son las zonas que con mayor frecuencia están expuestas o sometidas a la acción de las sustancias contenidas en el reflujo y donde se desencadena una respuesta inflamatoria que favorece alteraciones en la proliferación celular, conducen a la displasia y, en algunos casos, a la metaplasia intestinal.
A cada paciente se le tomaron 3 muestras para biopsia de la región antral y 2 muestras del cuerpo gástrico con el objetivo de pesquisar la frecuencia de metaplasia intestinal, es decir, presencia de enterocitos o de células de tipo absorbente, acompañadas o no de células caliciformes en el tejido superficial de la mucosa gástrica o en las glándulas productoras de moco de esta mucosa. En las zonas donde se sospechó endoscópicamente la presencia de metaplasia intestinal, cualquiera que fuera su localización, se tomó directamente la muestra para biopsia.
Los fragmentos de tejido para biopsia fueron depositados en varios frascos con formol al 10 %, debidamente rotulados, se taparon y enviaron al departamento de Anatomía Patológica, donde se procesaron y estudiaron por el patólogo de nuestra institución, quien realizó el diagnóstico histológico. Se determinó la presencia de Helicobacter pylori en estos fragmentos por el procesamiento habitual de parafina, con cortes histológicos a 5 micras, seriados, y coloración de hematoxilina-eosina; se midió su densidad y se clasificó según el Sistema Sydney.28
Variables del estudio
Las variables medidas fueron las siguientes:
1. Metaplasia intestinal
Se determinó la frecuencia de metaplasia intestinal en las muestras tomadas para biopsias y se clasificó la metaplasia según el Sistema Sydney28 en los siguientes grados:
Mínimo: Hasta 5 % de las células superficiales o glándulas con metaplasia.
Leve: De 6 a 20 % de las células superficiales o glándulas con metaplasia.
Moderado: De 21 a 50 % de las células superficiales o glándulas con metaplasia.
Severo: Más de 50 % de las células superficiales o glándulas con metaplasia.
Se tuvo en cuenta, además, su localización en el antro o en el cuerpo y se distribuyeron los pacientes de acuerdo con las zonas donde se encontraban las lesiones. Se incluyeron en otra categoría (antro-cuerpo) aquellos que la presentaron en ambas localizaciones.
2. Helicobacter pylori
En aquellas muestras de biopsia donde se observó el microorganismo, se determinó su densidad según criterios del patólogo sobre la base de las evidencias científicas de la clasificación del Sistema Sydney28 y se reflejó en una de las categorías siguientes:
Colonización ligera: Escasas bacterias en menos de la tercera parte de la superficie de la mucosa.
Colonización moderada: Grupos de bacterias que cubren la mitad del área de la superficie de la mucosa.
Colonización severa: Cuando los grupos de bacterias cubren más de 50 % de la superficie de la mucosa.
3. Otros diagnósticos histológicos
Normal: Tejido que presenta toda la integridad de sus componentes celulares.
Gastritis crónica: Se caracteriza por un infiltrado inflamatorio mononuclear evidente, con o sin polimorfonucleares neutrófilos, que pueden comprometer la mucosa del cuerpo, del antro o ambos a la vez. Utilizando la división histológica según la clasificación del Sistema Sydney,28 consideramos distintos grados de intensidad de acuerdo con la densidad del infiltrado inflamatorio (ligera, moderada, severa), siempre que este dejara indemne la capa glandular.
Gastritis atrófica: Desde el punto de vista histológico, lo más importante es la pérdida de glándulas o atrofia de estas; la cantidad de glándulas desaparecidas puede variar, se observa que las glándulas que quedan se encuentran separadas unas de otras, con acumulo de reticulina entre ellas, demostrada por coloraciones específicas; el infiltrado inflamatorio crónico sobre la base de linfocitos y plasmocitos tiende a disminuir al aumentar la atrofia.
Se distribuyó la frecuencia de pacientes para cada diagnóstico histológico.
Se confeccionó un modelo de recogida de datos donde se registraron los resultados de los indicadores de las variables medidas.
La información se procesó de forma manual utilizando una calculadora de mesa.
El análisis estadístico se realizó de forma automatizada utilizando el programa STATISTICA.
Se realizó una descripción de los resultados y se calcularon las frecuencias absolutas (N) y relativas (%). Para determinar las asociaciones entre la presencia de Helicobacter pylori y la metaplasia intestinal, se utilizó la prueba de probabilidad exacta de Fischer; para la relación entre los grados de la metaplasia intestinal y la densidad de Helicobacter pylori, se utilizó una prueba Chi cuadrado (X2). Ambas con una probabilidad a=0,05. Los resultados se presentan en tablas y gráfico.
RESULTADOS
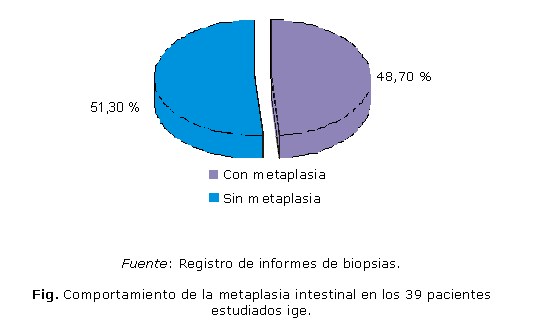
En el período estudiado se evaluaron 39 pacientes, de los cuales a 19 (48,7 %) se les diagnosticó histológicamente metaplasia intestinal, los 20 (51,3 %) restantes no presentaron metaplasia intestinal (Fig.).
En la tabla 1 se muestra la frecuencia de pacientes con metaplasia intestinal y Helicobacter pylori. De los 19 pacientes con metaplasia intestinal, 13 (68,5 %) presentaron Helicobacter pylori y los 6 restantes no (31,5 %). En el grupo sin metaplasia intestinal 7 (35 %) presentaron Helicobacter pylori y los 13 restantes (65 %) no tenían la bacteria. Existe una asociación estadísticamente significativa (p<0,05) en la distribución del Helicobacter pylori en los pacientes con y sin metaplasia intestinal.
La tabla 2 muestra otros diagnósticos histológicos según la presencia o no de Helicobacter pylori. Se puede apreciar que de 183 muestras tomadas y útiles para diagnósticos, 63 fueron histológicamente normales y en ninguna (100 %) se presentó la bacteria. Se diagnosticaron 120 muestras con gastritis crónica, de ellas en 48 (40 %) se identificó Helicobacter pylori y en 72 (60 %) no se encontró el microorganismo. Se observó una asociación estadísticamente significativa en cuanto a la distribución del Helicobacter pylori en las muestras con histología normal y en aquellas con diagnóstico de gastritis crónica (p< 0,05). Asimismo existe una asociación estadísticamente significativa en cuanto a la presencia de reflujo biliar y gastritis crónica.
En la tabla 3 se presenta la distribución de la gastritis crónica de acuerdo con el Sistema Sydney, relacionada con la presencia de Helicobacter pylori. De un total de 120 muestras tomadas, resultaron negativas 42 (75 %), que correspondieron a los pacientes con gastritis crónica ligera, y 27 (52 %) con gastritis crónica moderada. Un 75 % de los pacientes con gastritis crónica severa y gastritis crónica atrófica presentó Helicobacter pylori. Existe asociación estadísticamente significativa (p<0,05) entre la distribución de Helicobacter pylori positivo y negativo y la intensidad de la gastritis crónica.
Se aprecia en la tabla 4 que la metaplasia intestinal diagnosticada en 19 pacientes se localizó con más frecuencia en la región antral (16 pacientes), de ellos 10 (62,5 %) presentaron Helicobacter pylori y los 6 restantes (37,5 %) no tenían la bacteria. Solo 3 pacientes presentaban metaplasia intestinal en ambas regiones (antro y cuerpo), y solo en uno de ellos dio positivo el examen de Helicobacter pylori (33,3 %). No se presentó metaplasia intestinal en el cuerpo aisladamente.
La relación entre el grado de metaplasia intestinal y la presencia de Helicobacter pylori se presenta en la tabla 5. Se diagnosticaron histológicamente 19 metaplasias intestinales las cuales fueron clasificadas de la siguiente forma: 10 pacientes con metaplasia intestinal mínima, de los cuales 7 (70 %) presentaban Helicobacter pylori y 3 (30 %) no; le siguen 4 pacientes con metaplasia intestinal leve, de ellos 50 % con Helicobacter pylori. La metaplasia intestinal moderada se presentó en 2 pacientes, ambos con Helicobacter pylori (100 %). La metaplasia intestinal severa se diagnosticó en 3 pacientes y de ellos, 2 (66,6 %) presentaron Helicobacter pylori positivo. Como se puede apreciar, la frecuencia de Helicobacter pylori fue mayor que la ausencia del microorganismo en cualquiera de las categorías de intensidad de la metaplasia y, en consecuencia, no estuvo asociada a un grado de intensidad de la metaplasia en particular.
Por otra parte, al estudiar la relación entre el grado de metaplasia intestinal y la densidad de Helicobacter pylori, comprobamos que todos los pacientes tuvieron una densidad ligera de esta bacteria, independientemente del grado de metaplasia.
DISCUSIÓN
El aumento de la concentración de los ácidos biliares en la luz gástrica, por la presencia de reflujo duodenogástrico en condiciones de estómago intacto u operado, ha sido considerado como un agente agresivo para la mucosa gástrica, lo cual provoca la llamada gastritis alcalina, que en la clasificación de Sydney es considerada como gastritis reactiva.28-30
Los ácidos biliares son sustancias que actúan como agentes agresivos porque al romper la barrera mucosa gástrica, desencadenan un proceso inflamatorio agudo que puede evolucionar hacia la cronicidad, en correspondencia con el grado de intensidad y de persistencia de la acción de estos. También son capaces de incrementar la proliferación y la apoptosis de las células, en las cuales se pueden presentar fallas y mutaciones que favorecen la aparición de cambios celulares que van desde la metaplasia hasta el cáncer gástrico.31-33
En la literatura mundial se ha reportado que el reflujo duodenogástrico es uno de los factores oncogénicos que se debe tener en cuenta en pacientes con alto riesgo de cáncer gástrico.31 En la actualidad, con el descubrimiento y caracterización del Helicobacter pylori, este hecho se hace mucho más evidente, pues se conoce que la bacteria también desencadena una respuesta inflamatoria que, de acuerdo con el grado de intensidad y persistencia, conduce a la aparición de daño celular y, por consiguiente, fallas en la reparación de las células que se pueden traducir en metaplasia y desarrollar un cáncer gástrico.33-37
Al terminar nuestra investigación evaluamos un total de 39 pacientes de los cuales 19 (48,7 %) presentaron metaplasia intestinal diagnosticada histológicamente (Fig.). Estos resultados coinciden con lo reportado por varios autores que señalan que se puede presentar metaplasia intestinal en el estómago tanto cuando hay reflujo duodenogástrico como cuando está presente el Helicobacter pylori, o ambas condiciones, ya que son factores agresivos que provocan daños a nivel de la mucosa gástrica, en correspondencia con el grado de intensidad que alcancen y la persistencia de su acción.
Es conocido que la presencia de reflujo duodenogástrico, Helicobacter pylori o de ambos, en el estómago provoca un proceso inflamatorio en la mucosa gástrica que evoluciona en varias etapas, lo cual depende de las características del reflujo y de la densidad y la patogenicidad de la bacteria. Es por esto que algunos autores señalan que el daño histológico observado en las muestras de biopsia en pacientes con reflujo duodenogástrico con o sin presencia de Helicobacter pylori puede presentar características diferentes.38
Al analizar la tabla 1, podemos apreciar que cuando existen los dos factores (reflujo duodenogástrico y Helicobacter pylori) se eleva la probabilidad de que aparezcan pacientes con metaplasia intestinal (68,5 %) con mayor frecuencia y esto sucede en una población donde la prevalencia de Helicobacter pylori es muy alta. Existe, por tanto, una asociación estadísticamente significativa (p<0,05) entre la metaplasia intestinal y la presencia de Helicobacter pylori en los pacientes con reflujo duodenogástrico.
Lo anterior se explica porque ambos factores son agentes agresivos para la mucosa gástrica y al incrementar la proliferación celular se pueden presentar fallas y mutaciones que evolucionan hacia la aparición de la metaplasia. Otros autores señalan que la prevalencia de la metaplasia en pacientes que solo tienen reflujo duodenogástrico es baja, pues en pacientes con estómago intacto el reflujo es capaz de provocar gastritis de variada intensidad, pero solamente provoca metaplasia en algunos pacientes cuando su persistencia e intensidad es muy alta o se asocia con trastornos motores que impiden un vaciamiento gástrico adecuado, lo cual facilita un mayor tiempo de contacto del reflujo con la mucosa.39,40
Como se explicó anteriormente en los pacientes con reflujo duodenogástrico se desarrolla generalmente una gastritis reactiva superficial; cuando existe una coordinación adecuada entre el vaciamiento gástrico y la motilidad de la región antropilórica, como ocurre en el estómago intacto, los daños del reflujo sobre la mucosa gástrica son mínimos o nulos. Diversos autores, como MF Dixon y cols. reportan que la mucosa gástrica puede ser normal en la mayoría de las biopsias gástricas, no así cuando existe reflujo biliar asociado a un trastorno motor del estómago que motiva retardo del vaciamiento gástrico y facilita el daño de la mucosa.40
Los resultados de esta investigación refuerzan lo planteado anteriormente. Al observar que en los pacientes con reflujo biliar y Helicobacter pylori negativo, 63 (100 %) de las muestras de biopsias estudiadas fueron normales. Esto se explica porque al no existir Helicobacter pylori no hay una respuesta inflamatoria como mecanismo de defensa de la mucosa y, por otro lado, como se trata de pacientes con estómago intacto, con ausencia de trastornos motores, el estómago se vacía adecuadamente y por tanto el daño que puede causar el reflujo sobre la mucosa gástrica es menor, mientras que en las 120 muestras con diagnóstico histológico de gastritis crónica este daño pudo aparecer a causa de la agresión coincidente de reflujo biliar y Helicobacter pylori. Aunque se presentó con mayor frecuencia en el grupo donde el reflujo biliar actuó sin la presencia de Helicobacter pylori.
Aunque varios autores plantean que la existencia de reflujo biliar en el estómago disminuye la colonización de la bacteria en la mucosa, esto no impide que cuando coinciden también el microorganismo desencadene una respuesta inflamatoria que se expresa por la presencia de gastritis41 (tabla 2). Por otra parte, en los casos en que solamente hay reflujo biliar, si se asocia con un trastorno motor del estómago, el reflujo es capaz de dañar la mucosa, que es lo que suponemos que haya sucedido en los casos de Helicobacter pylori negativo y gastritis crónica.
Está bien establecido que la severidad de la gastritis crónica desde el punto de vista histológico se encuentra determinada por la intensidad de la respuesta inflamatoria y la afectación o no de las glándulas gástricas. Tanto el reflujo duodenogástrico como el Helicobacter pylori, desencadenan una respuesta inflamatoria que de acuerdo con la intensidad de la gastritis puede ser desde leve hasta la gastritis atrófica. Como ya se mencionó, el reflujo duodenogástrico generalmente provoca en la mucosa una gastritis superficial leve o moderada, mientras que la el Helicobacter pylori, en correspondencia con su densidad y su genotipo puede ser más o menos patógeno y provocar gastritis crónica de diversos grados de severidad.42
En esta investigación se encontró que las gastritis leves y moderadas fueron observadas con mayor frecuencia en las muestras con Helicobacter pylori negativo, que solo tenían el reflujo duodenogástrico como agente agresivo para la mucosa. Cuando ambos agentes (reflujo duodenogástrico y Helicobacter pylori) estuvieron presentes, la severidad de la gastritis fue mayor y llegó hasta la gastritis atrófica, lo cual coincide con lo reportado por la literatura internacional acerca de que ambos agentes son agresivos para la mucosa gástrica y a pesar de que se plantea que la colonización de la bacteria es menor en presencia de reflujo duodenogástrico, se debe de tener en cuenta que su genotipo puede variar la calidad de la agresión.38 (tabla 3).
En los estudios realizados para la localización de la metaplasia intestinal en pacientes con reflujo duodenogástrico o con Helicobacter pylori, se ha observado que la mayoría de las metaplasias intestinales se localiza en la región antral, pues es la zona que con mayor frecuencia se expone al reflujo duodenogástrico y donde el Helicobacter pylori establece su hábitat en más de 95-99 % de los casos. De manera que esta región es la más vulnerable a la acción de estos ambos agentes.4,43,44
En la presente investigación los resultados coinciden con lo reportado por la literatura internacional, pues de los 19 casos con diagnóstico histológico de metaplasia intestinal, en 11 (57,8 %) coincidió el reflujo con la presencia de Helicobacter pylori y la localización más frecuente fue la del antro con 10 pacientes (62,5 %); en los 8 (42,2 %) restantes no se detectó la bacteria y solo el reflujo fue la causa de la aparición de la metaplasia (tabla 4).
El análisis de los resultados observados en la tabla 5, arroja que la presencia de Helicobacter pylori fue mayor en cualquiera de las categorías de intensidad de la metaplasia intestinal, lo cual se explica por la asociación de la agresión del reflujo duodenogástrico con el Helicobacter pylori. Sin embargo, en estos resultados se aprecia también una alta proporción de metaplasia con categoría mínima asociada con la presencia de la bacteria, lo cual se puede explicar, como definimos anteriormente, por la variación en cuanto a la agresividad del microorganismo dependiente de su genotipo; resultados que coinciden con lo reportado por A. Zoilo y col.45
Por último, los resultados de esta investigación arrojaron que la densidad del Helicobacter pylori fue ligera en cualquiera de las categorías de la metaplasia intestinal, lo cual se explica porque la presencia del reflujo disminuye la colonización de la bacteria en la mucosa gástrica al cambiar su entorno, independientemente de su genotipo.41
Finalmente se concluye que la metaplasia intestinal estuvo presente en casi la mitad de la serie estudiada; hubo una fuerte asociación entre Helicobacter pylori y metaplasia intestinal cuando la bacteria estuvo presente, por el contrario, en los pacientes sin metaplasia intestinal fue mayor la proporción de Helicobacter pylori negativos. Cuando la muestra de biopsia no presentaba alteraciones histológicas tampoco se detectó Helicobacter pylori. En los pacientes con reflujo duodenogástrico, a pesar de tener una lesión histológica, se presentó una mayor frecuencia de resultados negativos en cuanto a Helicobacter pylori, lo que puede estar asociado con la presencia del reflujo biliar. En las muestras con diagnóstico histológico de gastritis crónica severa y atrófica hubo una mayor proporción de pacientes con la bacteria, pero en las muestras donde la intensidad de la gastritis fue leve y moderada fue mayor la proporción de resultados negativos en los estudios de Helicobacter pylori. La metaplasia intestinal se observó con mayor frecuencia en el antro, coincidiendo con una mayor proporción de positividad del microorganismo. En los pacientes con reflujo duodenogástrico no parece que haya asociación entre la presencia de Helicobacter pylori y los grados intensos de metaplasia intestinal, aunque el microorganismo se encuentre en todas las categorías. Cuando no hubo, se observó que la metaplasia intestinal tiende a presentarse en sus grados menos severos. En los pacientes con reflujo duodenogástrico la densidad de Helicobacter pylori fue ligera en todos los casos, lo que hace pensar que el daño que produce el reflujo sobre la mucosa es el mayor responsable de la aparición de lesiones en esta.
REFERENCIAS BIBLIOGRÁFICAS
1. Howson CP, Hiyama T, Winder EL. The decline in gastric cancer: epidemiology of an unplanned triumph. Epidemiol Rev. 1986;8:1-27.
2. Molina FR, Ariza AF. Epidemiología del cáncer. En: Sandorama. 2ª Serie Monográfica: Oncología. 1994. p. 23-42.
3. Gil Mary A, Beneyto Castelló F, Calatayud Garthow A, Giménez Fernández FJ, Cortina Bilaga P. Evolución de la mortalidad por cáncer de estómago en España (1951-1985). Rev Esp Enf Dig. 1990;78:61-6.
4. Boixeda D, Gisbert JP, Arocena C, Cantón R, Álvarez BI, Martín de Argila C, et al. Prevalencia de la infección por Helicobacter pylori en el adenocarcinoma gástrico. Rev Esp Enf Dig. 1996;88:403-8.
5. Rubio HW. ¿Cuál es la población de riesgo? Lesiones preneoplásicas. Acta Gastroenterol Latinoam. 1996;26:62-3.
6. Díaz Rubio M, Díaz Rubio E. Cáncer de estómago. Otros tumores del estómago. En: Estómago y duodeno. Madrid: EMISA; 1987. p. 249-63.
7. Thomson ABR, Shaffer EA, eds. First principles of gastroenterology: the basis of disease and an approach management. Alberta: Canadian Association of Gastroenterology, 1992; p. 171-4.
8. Llorens P. Tumores gástricos. Gastroenterología y hepatología. Caracas: Editorial Mediterráneo, 1996; p. 38-47.
9. Webb PM, Forman D. Helicobacter pylori as a risk factor for cancer. Baillieres Clin Gastroenterol. 1995;9:563-82.
10. Ramón JM, Serra L, Cerdón C. Dietary factors and gastric cancer risk: A case-control study in Spain. Cancer. 1993;71:1731-5.
11. Antonioli DA. Precursors of gastric carcinoma: A critical review with a brief description of early (curable) gastric cancer. Hum Pathol. 1994;25:994-1005.
12. Sjoblom SM, Sipponen P, Jarvinen H. Gastroscopic follow-up of pernicious anemia patients. Gut. 1993;34:20-32.
13. Komorowski RA, Gaya JG. Hiperplastic gastropathy: clinicopathologic correlation. Am J Surg Pathol. 1991;15:577-85.
14. Wolfsen HC, Caspenter HA, Talley NJ. Ménetrier´s disease: A form of hypertrophic gastropathy or gastritis. Gastroenterology. 1993;104:1310-9.
15. Cristallini EG, Ascani S, Bolis GB. Association between histologic type of polyp and carcinoma of the stomach. Gastrointest Endosc. 1992;38:481-4.
16. Kinoshita Y, Tojo M, Yano T. Incidence of fundic gland polyps in patients without familial adenomatous polyposis. Gastrointest Endosc. 1993;39:161-3.
17. Marcial MA, Villafaña M, Hernández-Denton J. Fundic gland polyps: Prevalence and clinicopathologic feature. Am J Gastroenterol. 1993;88:1711-3.
18. Domellof L, Eriksson S, Janunger KG. Carcinoma and possible pre-cancerous changes of the gastric stump after Billroth II resection. Gastroenterology. 1977;73:462-8.
19. Caysill CPJ, Hill MJ. Malignancy following surgery for benign disease: a review. Ital J Gastroenterol. 1992;24:218-24.
20. Lam SK. Etiology and pathogenesis of peptic ulcer. J Gastroenterol. 1994;29 (Suppl 7):39-54.
21. Axon ATR. Helicobacter pylori infection. J Antimicrob Chemother. 1993;32(Suppl A):61-8.
22. Marshall BJ. Helicobacter pylori. AM J Gastroenterol. 1994;89:116-28.
23. Wyatt JI. Gastritis and its relation to gastric carcinogenesis. Semin Diag Pathol. 1991;8:137-48.
24. Seguar DI, Montero C. Histochemical characterization of different types of intestinal metaplasia in gastric mucosa. Cancer. 1983;52:498-503.
25. Silva S, Filipe MI. Intestinal metaplasia and its variants in the gastric mucosa of Portuguese subjects. A comparative analysis of biopsy and gastrectomy material. Hum Pathol. 1986;17:955-88.
26. Houghton PW, Mortensen NJ, Thomas WE, Cooper MJ, Morgan AP, Burton P. Intragastric bile acids and histological changes in gastric mucosa. Br J Surg. 1986;73:354-6.
27. Ricthie WPJR. Alkaline reflux gastritis: postsurgical syndromes. Gastroenterol Clin North Am. 1994;23:281-94.
28. Ricthie WPJR. Role of bile acid reflux in acute hemorrhagic gastritis. World J Surg. 1981;5:189-98.
29. Kivilaakso E, Fromm D, Silen W. Effects of lysolecithin on isolated gastric mucosa. Surgery. 1978;84:616-21.
30. Ricthie WPJR. Bile acids, the barrier and reflux related clinical disorders of the gastric mucosa. Surgery. 1977;82:192-200.
31. Orchard R, Reynolds K, Fox B, Andrews R, Parkins RA, Johnson AG. Effects of lysolecithin on gastric mucosa then are conjugated bile acids. Surg Forum. 1980;31:115-7.
32. Cloud WG, Ricthie WPJR. Deconjugated bile acids are more damaging to gastric mucosa then are conjugated bile acids. Surg Forum. 1980;31:115-7.
33. O Connor HJ, Riley SE, Axon AT, Dixon MF, Girling A, Garner RC. The mutagenic activity of gastric juice. Mutat Res. 1988;206:103-13.
34. Nakamura M, Haruma K, Kamada T, Mihara M, Yoshihara M, Imagawa Y. Duodenogastric reflux is associated with antral metaplastic gastric. Gastrointest Endosc. 2001;53(1):53-9.
35. Granelli P, Bonavina L, Zennaro F, Segalin A, Siardi C. Intestinal metaplasia: what is its role in gastric carcinogenesis. Minerva Gastroenterol Dietol. 1994;40:67-77.
36. Morson BC. Intestinal metaplasia of gastric mucosa. Br J Cancer. 1955;9:365-76.
37. Morson BC. Carcinoma arising from areas of intestinal metaplasia in gastric mucosa. Br J Cancer. 1955;9:377-85.
38. Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48:1319-26.
39. Mirvish SS. The etiology of gastric cancer. J Natl Cancer Inst. 1983;71:629-47.
40. Komoto K, Haruma K, Kamada T, Yoshihara M, Sumii K, Kajiyama G, et al. Helicobacter pylori infection and gastric neoplasia: correlations with histological gastritis and tumor histology. Am J Gastroenterol. 1998;93:1271-6.
41. Paxton D, Michael FD, David J. Bile reflux and degree of gastritis in patients with gastric ulcer, before and after operation. J Surg Research. 1984;37:277-84.
42. Sobala GM, O Connor HJ, Dixon MF, Dewar EP, King RFG, Axon ATR. Bile reflux and intestinal metaplasia in gastric mucosa. J Clin Pathol. 1993;46:235-40.
43. Paniagua M, Piñol F. Nueva terapéutica de la gastritis alcalina. La Habana: Edit. Academia; 1998.
44. World Medical Association. The Declaration of Helsinki: Recomendations. Guiding Physicians in Biomedical Research Involving Human Subjects. Adopted by the 18 th World Medical Assembly, Helsinki, Finland, 1964. Revised in 29 th World Medical Assembly, Tokyo, 1965.
45. Misi Ewcz JJ. The Sydney System: a new classification of gastritis. Gastroenterol Hepatol. 1991;6:207-8.
Recibido: 30 de septiembre de 2009.
Aprobado: 16 de octubre de 2009.
Dr. Felipe Piñol Jiménez. Instituto de Gastroenterología. Calle 25 # 503 entre H e I, Vedado, CP 10 400. La Habana, Cuba. Correo electrónico: fpinol3@hotmail.com