Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina
versão impressa ISSN 0034-7523
Rev cubana med vol.52 no.2 Ciudad de la Habana apr.-jun. 2013
TRABAJO ORIGINAL
Inmunosupresión de inducción en el trasplante renal en el Hospital "Hermanos Ameijeiras" de 1984 a 2012
Induction immunosuppression in renal transplantation at "Hermanos Ameijeiras" Hospital. 1984-2012
Dr. Gerardo Borroto Díaz, Dr. Carlos Guerrero Díaz
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: la inmunosupresión de inducción es esencial en el éxito del trasplante renal. Encaminada a prevenir el rechazo agudo y la función retrasada del injerto, se diseña como estrategia para los inicios del trasplante donde son mucho más frecuentes las complicaciones.
Objetivo: exponer los diferentes protocolos de inmunosupresión de inducción utilizados por el grupo de trasplante del Hospital "Hermanos Ameijeiras", según tipo de donante (vivo o cadáver) y frecuencia de complicaciones clínicas.
Métodos: se realizó un estudio descriptivo, retrospectivo, que abarcó todos los trasplantes renales realizados desde que se inició esta actividad en marzo de 1984 hasta noviembre de 2012. Se distinguieron 4 etapas, 1984-1990, 1991-1996, 1997-2004 y 2005-2012. En las 2 primeras predominó el empleo del tratamiento con prednisona y azatioprina en el donante cadáver. Solo se utilizó la combinación de 3 drogas, ciclosporina A sandimun, prednisona y azatioprina para los trasplantes de cadáver considerados de riesgo, ambos protocolos se acompañaron de elevadas frecuencias de rechazo y necrosis tubular aguda, en el período entre 1997 y 2004.
Conclusión: la triple terapia con ciclosporina A neoral, prednisona y micofenolato mofetil proporcionó bajas tasas de rechazo y necrosis tubular aguda, tanto cuando el injerto provino de un donante vivo como de uno cadavérico; las terapias cuádruples secuenciales constituyeron un tratamiento aceptable para disminuir el rechazo en pacientes de riesgo. El tratamiento con prednisona y azatioprina y el de ciclosporina, en formulación sandimun, con prednisona y azatioprina o con prednisona, a la luz de los resultados obtenidos, no constituyen en la actualidad protocolos satisfactorios para la inmunosupresión en el trasplante renal.
Palabras clave: protocolo, inmunosupresión de inducción, trasplante renal, rechazo, necrosis tubular aguda.
ABSTRACT
Introduction: immunosuppression induction is essential in successful kidney transplant. It is aimed at preventing acute rejection and delayed graft function and is designed as a strategy for the beginning of the transplant in which complications are much more common.
Objective: to present the different protocols of immunosuppression induction used by the transplant staff of "Hermanos Ameijeiras" Hospital, according to the type of donor (alive or dead), and the frequency of clinical complications.
Methods: a descriptive retrospective study was carried out which covered all the kidney transplant done since this activity began in March 1984 until it continued to November 2012. Four stages were distinguished: 1984-1990, 1991-1996, 1997-2004 and 2005-2012. The treatment with Prednisone and Azatioprine in the dead donor predominated in the two first stages. The combination of three drugs: Cyclosporin A (Sandimmune), Prednisone and Azatioprine was only used in transplants in which dead donors were considered high risk. Both protocols were accompanied by high rejection frequencies and acute tubular necrosis in the period 1997-2004.
Conclusions: the triple therapy with Cyclosporin A (Neoral), Prednisone and Mycophenolate Mophetil provided low rejection rates and acute tubular necrosis even when the graft came from both an alive donor or a dead one. The quadruple sequential therapies constituted an accepted treatment to diminish rejection in risk patients. The treatment with Prednisone and Azatioprine and Cyclosporin in Sandimmune formulation, with Prednisone and Azatioprine, or with Prednisone, according to the results obtained, do not constitute satisfactory protocols for immunosuppression in kidney transplant at present.
Key words: protocol, immunosuppression induction, kidney transplant, rejection, acute tubular necrosis.
INTRODUCCIÓN
La historia del trasplante renal (TR) y sus logros está pautada, entre otras muchas condicionales, por el tratamiento inmunosupresor (TI) de inducción, los protocolos iniciales utilizaron esteroides a altas dosis, acompañados de azatioprina o ciclofosfamida,1 hasta que en la década de los 80 irrumpió en el arsenal terapéutico del TR la ciclosporina A y revolucionó los resultados al incrementar de manera considerable la supervivencia del injerto al primer año, lo que disminuyó las tasas de rechazo agudo (RA).2 Con el advenimiento de nuevos y potentes inmunosupresores como las globulinas antilinfocíticas policlonales o monoclonales, nuevas formulaciones de ciclosporina, el micofenolato mofetil, el tacrolimus, los inhibidores de la mamalian target of rapamicin [MTOR] (sirolimus y everolimus), etc., han permitido disminuir la incidencia del RA, mayor supervivencia del injerto, además de lograr ajustar el TI de inducción según las características que rodean el TR y disminuir así los efectos no deseados o, lo que es igual, individualizar el TI de inducción.3
Los objetivos fundamentales del TI de inducción son: evitar la reacción inmunológica de RA y la aparición de la necrosis tubular aguda (NTA),4 complicaciones frecuentes y que impactan negativamente la evolución ulterior del injerto al ser ambas factores de progresión hacia la nefropatía crónica del trasplante renal, que es, a su vez, la segunda causa de pérdida del injerto en la literatura universal5 y la primera en nuestro grupo.6
El objetivo de la presente investigación es caracterizar el uso de los diferentes protocolos de inmunosupresión de inducción utilizados por el grupo de trasplante del Hospital Clinicoquirúrgico "Hermanos Ameijeiras", en relación con el tipo de donante (vivo o cadáver) y la frecuencia de complicaciones clínicas, como el rechazo y la NTA de acuerdo con el TI utilizado. Los resultados permitirán evaluar el empleo de estos medicamentos en las condiciones que caracterizan nuestro trabajo y servirán, además, de referencia para otros grupos dedicados a esta importante actividad en el país con vistas a escoger estrategias de inmunosupresión en el futuro.
MÉTODOS
Se realizó un estudio descriptivo, retrospectivo, que abarcó todos los TR realizados en dicho hospital desde que se inició esta actividad en marzo de 1984 hasta noviembre de 2012.
La información se recogió de la base de datos de trasplante del Servicio de Nefrología, de la que se tuvieron en cuenta las variables siguientes:
- Año de realización del trasplante.
- Protocolo de inmunosupresión utilizado: es la asociación de drogas empleadas al inicio del TR para evitar el RA, se agrupó en:
· Prednisona + azatioprina (P + A).
· Prednisona + ciclosporina A sandimun (P + Cs).
· Prednisiona + ciclosporina A sandimun + azatioprina (P + Cs + A).
· Prednisona + ciclosporina A neoral + micofenolato mofetil (P + Cn + M).
· IORT3 + prednisona + azatioprina + ciclosporina A sandimun (I + P + Cs + A).
· Daclizumab + prednisona + azatioprina + ciclosporina A (puede ser sandimun o neoral) (D + P + C + A).
· Globulina antitimocítica (ATG) + prednisona + ciclosporina A neoral + micofenolato mofetil (ATG + P + Cn + M).
- Tipo de donante: vivo o cadáver.
- Presencia de NTA: sí o no.
La necrosis tubular aguda es la ausencia de función del injerto con necesidad de diálisis en el postrasplante inmediato, descartadas otras causas.
- Presencia de RA: sí o no.
El diagnóstico de rechazo confirmado histológicamente mediante biopsia del injerto.
Se determinó la frecuencia de utilización del TI en diferentes períodos, 1984-1990, 1991-1996, 1997-2004 y 2005-2012, de acuerdo con el tipo de donante.
Se estimó la frecuencia de NTA según protocolo de inmunosupresión de inducción utilizado en el TR de donante cadáver, no en el de donante vivo por lo infrecuente de esta complicación en este tipo de trasplante, así como la relación entre el TI y la aparición de RA, tanto en uno como en el otro tipo de donante.
RESULTADOS
La tabla 1 muestra los protocolos de inmunosupresión de inducción utilizados en el trasplante renal de donante cadáver, en diferentes etapas: en la primera, de 1984 a 1990, se empleó doble terapia con prednisona (P) y azatioprina (A) en la mayoría de los enfermos, 22,4 % de los pacientes recibieron triple terapia con ciclosporina A sandimun (Cs), prednisona y azatioprina, uno solo, en 1990, recibió terapia cuádruple secuencial con anticuerpo monoclonal IORT3. En la segunda etapa: de 1991 a 1996, predominó también el uso de la doble terapia (P + A) y triple tratamiento con Cs + P + A, los protocolos de Cs + P y el de I + P + A + Cs fueron impuestos a 7 enfermos. En los años 1997 al 2004, se invirtió esta relación y el protocolo más utilizado fue el de Cs + P + A, en 98 enfermos. A finales de este período aparecieron la ciclosporina A neoral (Cn), el micofenolato mofetil (M), las globulinas policlonales (ATG) y el daclizumab (D), que se emplearon en combinación con otras drogas inmunosupresoras en un número pequeño de enfermos. Desde el 2005 hasta el 2012, en los enfermos que reciben un injerto de cadáver, ha predominado el empleo de la triple terapia con Cn + P + M, seguido de la cuádruple terapia secuencial a base de ATG + P + Cn + M.
La triple terapia con Cs + P + A fue la medicación más empleada en la inducción en el trasplante renal de donante vivo en las 3 primeras etapas en que se dividió este estudio, después, en los años 2005-2012, con el advenimiento de la Cn y el M, estos inmunosupresores, en combinación con P, se emplearon en 91,6 % de los trasplantes de donantes vivos, nunca se han utilizado protocolos de inmunosupresión cuádruple secuenciales con globulinas antilinfocíticas en los TR de donante vivos realizados en este centro. Los 7 primeros trasplante de donante vivo se hicieron con P + A y uno con igual medicación en el año 1991 (tabla 2).
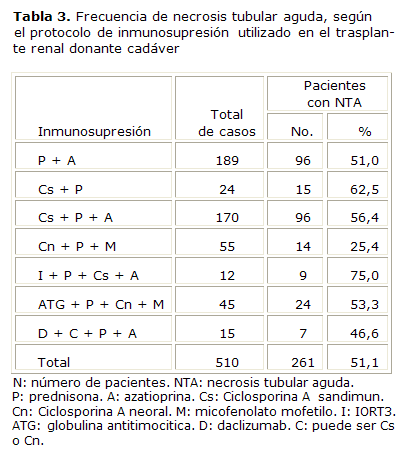
La frecuencia de NTA, según el protocolo de inmunosupresión empleado, se plasma en la tabla 3. Esta complicación es muy elevada en nuestra serie para cualquier variante de tratamiento utilizada (51,1 %), los protocolos que incluyen Cs presentan frecuencias más altas, la menor incidencia de esta complicación se presentó en la terapia triple con Cn + P + M que fue 25,4 %.
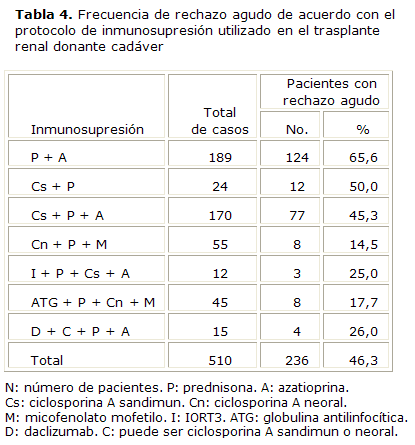
La relación existente entre la reacción de RA y el TI de inducción utilizado se detalla en los trasplantes renales de donantes cadáveres expuestos en la tabla 4. La frecuencia de esta temida complicación es alta en el estudio (46,3 %), pero a expensas de los primeros tiempos de trasplante en los que se usó la terapia dual con P + A, donde el rechazo se presentó en 65,6 % de los TR, y fue alta también con el uso de la Cs, en combinación con P, o en triple terapia, Cs + P + A, en el tratamiento a base de Cn + P + M, o en terapias cuádruples secuenciales con IORT3, ATG o daclizumab, las frecuencias fueron aceptables.
Esta misma relación, pero en el TR de donante vivo, arrojó que los 8 primeros trasplantes de donantes vivos que se hicieron con inducción de prednisona y azatioprina no presentaron rechazo, esta complicación fue elevada en los enfermos medicados con Cs + P, intermedia en aquellos que utilizaron triple terapia con Cs + P + A y baja en la variante de Cn + P + M, para un total de 28 enfermos con rechazo, de los 123 TR con dadores vivos realizados por nuestro grupo (tabla 5).
DISCUSIÓN
En la primera etapa del estudio, 1984-1990, predominó el uso de la terapia dual con prednisona y azatioprina en el trasplante renal de donante cadáver (TRDC), por ser los fármacos existentes en esos momentos en nuestro medio; se utilizó tratamiento triple con ciclosporina, prednisona y azatioprina al final del período en el TRDC considerado de riesgo, entre los que se incluían los enfermos diabéticos, los hiperinmunizados, los de retrasplante y los de trasplante renal de donante vivo (TRDV).
Esta situación se mantuvo en los años comprendidos entre 1991 y 1996, en esta etapa apareció el anticuerpo monoclonal IORT3 de fabricación cubana, que se empleó en algunos pacientes que recibían terapia cuádruple secuencial con introducción tardía de la ciclosporina A, 72 h antes de suspender el IORT3. En estos años se utilizó una variante, para aquellos enfermos con antecedentes de hepatopatías, que permitía prescindir de la azatioprina, de conocido efecto hepatotóxico, y fue la asociación de ciclosporina A sandimun con prednisona.
Ya en la tercera etapa, con el advenimiento de la ciclosporina A de manufactura cubana, se logró el uso de la triple terapia con esta droga en todos los TRDC, lo cual sin dudas fue un salto de calidad en la terapia inmunosupresora de inducción, al final de este período se diversificó nuestro arsenal inmunosupresor con la ciclosporina A en microemulsión (neoral), el micofenolato mofetil, las globulinas antilinfocíticas, para terapia cuádruple secuencial, tanto monoclonales (IORT3 y daclizumab), como policlonales (ATG). Poder contar con estas drogas proporcionó una inmunosupresión de alto nivel y permitió individualizar el tratamiento de acuerdo con las condicionales que rodean al trasplante, circunstancias estas que matizaron el tratamiento inmunosupresor de inducción en el período del 2005 al 2012.
Nuestro grupo ha empleado mayoritariamente la triple terapia con ciclosporina, prednisona y un antimetabolito (azatioprina o micofenolato mofetil) en el TRDV, nunca terapias cuádruples secuenciales con globulinas antilinfocíticas, al realizarse siempre el trasplante con donantes familiares de primer orden (hermanos, padres o hijos), lo cual lleva inherente un alto grado de histocompatibilidad y, por ende, menor riesgo de rechazo,7 además, generalmente es precoz o anticipado, o sea, antes de entrar el receptor a métodos de diálisis y se disminuyen considerablemente los tiempos de isquemia, lo que minimiza la aparición de función retardada del injerto,8 complicación prácticamente inexistente en nuestra casuística con la utilización de estos donantes.
Al asociar el protocolo de inducción utilizado con la presencia de NTA, se evidenció alta frecuencia de esta complicación con todas las variantes utilizadas. Aquellos con ciclosporina A en formulación sandimun presentaron mayor NTA, por los conocidos efectos de esta droga, que produce vasoconstricción de la arteriola aferente glomerular, lo cual facilita y perpetúa el daño isquémico del injerto generado en las etapas de selección y mantenimiento del donante, así como la extracción y preservación del injerto.9,10 Otro inconveniente de la ciclosporina A es su nefrotoxicidad, que puede adicionarse al daño isquémico.11
Llama la atención en nuestra serie que el uso de las terapias cuádruples secuenciales con globulinas antilinfocíticas, diseñadas para evitar con la introducción tardía del anticalcineurínico (ciclosporina A o FK 506), la NTA, presentaron alta incidencia de esta complicación, lo que puede estar dado porque precisamente nuestro grupo utilizó estos protocolos en enfermos que partían desde el trasplante con alto riesgo de NTA, propiciado por tiempos de isquemia fría superiores a 24 h, más de 60 min de isquemia caliente secundaria, donantes y receptores mayores de 60 años, o donantes con posibilidades de daño renal al ser diabéticos, hipertensos, con antecedentes de enfermedades renales, fallecidos por accidentes vasculares encefálicos, o creatinemias preextracción superiores a 1,5 mg/dL.12,13 En otras ocasiones se emplearon en terapia de conversión, al primer o segundo día del trasplante, cuando el injerto salía del acto quirúrgico sin función inmediata.
Los mejores indicadores en cuanto a la presencia de NTA se lograron con triple terapia con ciclosporina A en microemulsión (neoral), prednisona y micofenolato mofetil, el uso de esta última droga, que es un inmunosupresor más potente y específico que la azatioprina, nos permitió disminuir las dosis de ciclosporina A, además, la formulación neoral de la ciclosporina es mucho menos nefrotóxica que la anterior (sandimun) y mejora considerablemente su biodisponibilidad y absorción, permitiendo lograr niveles terapéuticos adecuados con dosis menores.14
La complicación más temida en la evolución del trasplante renal es la reacción inmunológica de rechazo, para su profilaxis en los primeros días de vida del injerto, cuando es más frecuente su aparición, se diseñan los protocolos de inducción. En la primera etapa de la historia del trasplante renal donde se usaba terapia dual con prednisona y azatioprina, la frecuencia de rechazo era muy alta y de aparición precoz en la primera semana del trasplante,15 lo cual coincide con nuestros resultados. La introducción de la ciclosporina A revolucionó los resultados incrementando la supervivencia del injerto al año, por la reducción de la incidencia de rechazo agudo, al ser un inmunosupresor más potente.16 En el presente estudio, el uso de esta droga en formulación lipofílica (sandimun) no se acompañó de la disminución esperada de la frecuencia de rechazo, la que fue alta al compararla con la de este protocolo en otros grupos.14
Como era de esperar, el uso de las globulinas policlonales o monoclonales en terapias cuádruples, al ser una enérgica inmunosupresión, mostró en este trabajo una incidencia de rechazo acorde con los reportes para estas asociaciones,4 sobre todo si se tiene en cuenta que en el estudio estos protocolos de tratamientos de inducción se asociaron a elevadas frecuencias de NTA, como ya se comentó, y el daño isquémico del injerto propicia la reacción inmunológica aguda al facilitar el reclutamiento inflamatorio y exponer los antígenos HLA clase II por la descamación de la célula tubular dañada.17
El empleo de la ciclosporina A neoral y el micofenolato mofetil, tanto en tratamiento triple con prednisona, como en terapia cuádruple secuencial con prednisona y ATG, mostró baja frecuencia de rechazo agudo, acorde con los reportes de los centros trasplantadores de alto nivel.18,19
Estas mismas consideraciones pueden hacerse para los resultados obtenidos en el TRDV de esta investigación, que fueron muy satisfactorios, bajas tasas de rechazo, para la triple terapia con neoral y micofenolato y alta frecuencia de rechazo para la utilización de la ciclosporina A sandimun en doble terapia con prednisona (receptores con antecedentes de daño hepático) y triple con prednisona y azatioprina al compararla con lo expuesto en la literatura.16 En el TRDV, la frecuencia de reacción inmunológica aguda fue menor que en el TRDC.
En conclusión, la triple terapia con ciclosporina A neoral, prednisona y micofenolato mofetil, resultó un protocolo con resultados satisfactorios, con bajas tasas de rechazo y necrosis tubular aguda, tanto cuando el injerto provino de un donante vivo como de un cadáver, las terapias cuádruples secuenciales que incluyen globulinas antilinfocíticas e introducen tardíamente la ciclosporina, constituyeron un tratamiento aceptable para disminuir el rechazo en pacientes de riesgo.
El uso de tratamiento dual con prednisona y azatioprina y de ciclosporina en formulación sandimun en triple terapia con prednisona y azatioprina o doble terapia con prednisona, a la luz de los resultados obtenidos, no constituyen en la actualidad protocolos de inducción satisfactorios para la inmunosupresión en el trasplante renal por la alta frecuencia de rechazo y necrosis tubular aguda que los acompañan.
REFERENCIAS BIBLIOGRÁFICAS
1. Curtis J. Corticosteroids and kidney transplantation. Clin J Am Soc Nephrol. 2006;1:907-8.
2. Porta B, Pérez RJ, Jiménez NV, Crespo J. Estrategias para la individualización posológica de la ciclosporina en pacientes con trasplante renal. Nefrología. 2004;24(5):395-409.
3. Bestard O, Campistol JM, Morales JM, Sánchez FA, Cabello M, Cabello V, et al. Avances en la inmunosupresión para el trasplante renal. Nuevas estrategias para preservar la función y reducir el riesgo cardiovascular. Nefrología. 2012;32(3):374-84.
4. Oppenheimer F, Arias M. Individualización de la inmunosupresión en el rechazo agudo. Nefrología. 2009;29(Sup Ext 2):49.
5. Pascual J, Pérez-Saiz MJ, Mir M, Crespo M. Chronic renal allograft injury: early detection, accurate diagnosis and management. Transplantation Rev. 2012;26:280-90.
6. Borroto DG, Tsuno LH, Mérida AO, Guerrero DC, Barceló AM. Frecuencia y factores de riesgo de la hipertrofia ventricular izquierda como marcador de daño cardiovascular en el trasplante renal. Rev Cubana Med. 2012;51(2). [citado 20 Ene. 2012] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232012000200004&lng=es&nrm=iso&tlng=es
7. Pascual SJ, Hernández MD. Inmunosupresión del receptor de donante vivo. Nefrología. 2010;30(Suppl 2):804.
8. Oppenheimer F. Seguimiento del donante vivo a corto, medio y largo plazo. Nefrología. 2010;30(Suppl 2):1004.
9. Klein IH, Abrahams A, Van E de T, Hene RJ, Koomans HA, Ligtenberg G. Different effects of tacrolimus and cyclosporine on renal hemodynamics and blood pressure in healthy subjects. Transplantation. 2002;73:732-6.
10. Mourad G, Vela C, Ribstein J, Mimran A. Long term improvement in renal function after cyclosporine reduction in renal transplant recipient with histologically proven chronic cyclosporine nephropathy. Transplantation. 1998;65:661-7.
11. Tsang WK, Ho YW, Tong Chan WH, Chan A. Safety, tolerability, and pharmacokinetics of Sandimmun Neoral: conversion study in stable renal transplant recipients. Transplant Proc. 1996;28:1330-2.
12. Borroto DG, Guerra BG, Guerrero DC, Infante SA, González ÁM. Trasplante renal como opción terapéutica para enfermos con insuficiencia renal crónica de 60 años o más. Rev Cubana Med. 2008;47(3). [citado 20 En. 2012] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232008000300006&lng=es&nrm=iso&tlng=es
13. Borroto DG, Guerrero DC. Uso de riñones provenientes de donantes de 55 años o más para trasplante renal. Rev Cubana Med. 2011;50(2):167-78. citado 20 Ene. 2012] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232011000200007&lng=es&nrm=iso&tlng=es
14. International Neoral Renal Transplantation Study Group. Cyclosporine microemulsion (Neoral®) absorption profiling and sparse-sample predictors during the first 3 months after renal transplantation. Am J Transplant. 2002;2:148-56.
15. Meier-Kriesche HU, Schold JD, Srinivas TR, Kaplan B. Lack of improvement in renal allograft survival despite a marked decrease in acute rejection rates over the most recent era. Am J Transplant. 2004;4:378-83.
16. Albrechtsen D, Leivestad T, Brekke I, Fauchald P, Pfeffer P, Thorsby E, Oslo Kidney Transplant Group. Experience with cyclosporine in 1519 kidney transplantations from living donors in a national transplant programme, 1983-2002. Transplant Proc. 2004;36(2S):89S-93S.
17. Gonwa TA, Mai ML, Smith LB, Levy MF, Goldstein RM, Klintmalm GB. Immunosuppression for delayed or slow graft function in primary cadaveric renal transplantation: use of low dose tacrolimus therapy with post-operative administration of anti-CD25 monoclonal antibody. Clin Transplant. 2002;16:144-9.
18. Brennan DC, Daller JA, Lake KD, Cibrik D, Del Castillo D. Thymoglobulin Induction Study Group. Rabbit antithymocyte globulin versus basiliximab in renal transplantation. N Engl J Med. 2006;355(19):1967-77.
19. Cravedi P, Codreanu I, Satta A, Turturro M, Sghirlanzoni M, Remuzzi G, et al. Cyclosporine prolongs delayed graft function in kidney transplantation: are rabbit anti-human thymocyte globulins the answer? Nephron Clin Pract. 2005;101:65-71.
Recibido: 4 de enero de 2013.
Aprobado: 21 de enero de 2013.
Dr. Gerardo Borroto Díaz. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. gborroto@infomed.sld.cu