Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523
Rev cubana med vol.53 no.1 Ciudad de la Habana ene.-mar. 2014
TRABAJO ORIGINAL
Marcadores de trombosis en pacientes con trombofilia
Markers of thrombosis in patient with thrombophilia
Lic. Marlem Castañeda Travieso,I Dra. Tania Isabel Carballo Treto,I Dra. Maiyurik Gómez León,I Dr. Wilfredo Torres Yibar,I Dr. Kali Cepero LLauger,II Dr. Obdulio González HernándezII
I Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
II Hospital Clinicoquirúrgico "Cmdte. Manuel Fajardo". La Habana, Cuba.
RESUMEN
Introducción: la trombofilia es una condición clínica que se caracteriza por una tendencia exagerada al tromboembolismo arterial o venoso, producido por diferentes causas, incluyendo factores genéticos, adquiridos y asociaciones entre ellos, lo que provoca elevadas morbilidad y mortalidad.
Objetivos: caracterizar el comportamiento de los marcadores de trombogénesis en los pacientes trombofilia, determinar la asociación de estos con la aparición de la enfermedad trombótica y la asociación entre los marcadores genéticos y genéticos-adquiridos con la recurrencia de esas complicaciones.
Métodos: la muestra quedó constituida por 107 pacientes de ambos sexos, con edades inferiores a 45 años, en el período comprendido entre febrero de 2011 y septiembre de 2012, atendidos en la Consulta de Trombofilia del Hospital "Hermanos Ameijeiras" y 110 sujetos supuestamente sanos del banco de sangre del hospital. Como parte del perfil trombofílico, se estudiaron la antitrombina (AT), las proteínas C y S (PC, PS) y el anticoagulante lúpico (AL) mediante estudios cromogénicos y coagulométricos. Las alteraciones genéticas: factor V Leiden (FVL) y factor II G20210 A (PG20210A) se evaluaron mediante la reacción en cadena de la polimerasa.
Resultados: predominó la raza blanca en el desarrollo de enfermedad trombótica, hubo mayor número de pacientes con marcadores trombogénicos y combinaciones entre ellos para esta etnia (x2=19,52 y p=0,001). Ambos sexos presentaron igual probabilidad de desarrollar complicaciones trombóticas (X² =0,512 para p=0,4750). La aparición de accidentes vasooclusivos venosos y recurrencia de estos, fue más frecuente en los pacientes (X²=59,16 p=0,000 y X²=8,7 p=0,003, respectivamente) y esta frecuencia aumentó al asociarlo a factores de riesgo adquiridos (x2=18,13 y p=0,000). El marcador génico prevalente en pacientes con trombosis fue FVL X²=16,2 p=0,000, para OR=11,9; IC=2,72 52,5.
Conclusiones: los resultados son de gran importancia predictiva para tomar las medidas profilácticas y terapéuticas necesarias en pacientes con trombofilia y prevenir la recurrencia de trombosis.
Palabras clave: trombofilia.
ABSTRACT
Introduction: thrombophilia is a clinical condition characterized by an excessive tendency to arterial or venous thromboembolism due to diverse reasons, included genetic and acquired causes, as well as their interactions. It produces high morbidity and mortality. Key words: thrombophilia.
Objective: to characterize the behavior of thrombogenesis markers in patients diagnosed with thrombophilia, to determine the association of these with the occurrence of thrombotic complications and to determine the association between genetic markers and genetic-acquired recurrence of these complications.
Method: 107 patients fromed the sample (males and females, ages younger than 45). They were assisted in the thrombophilia consultation at Hermanos Ameijeiras Hospital, from February 2011 to September 2012. As part of the thrombophilic profile, antithrombin (AT), proteins C and S (PC, PS), and lupus anticoagulant (LA) were assessed by chromogenic and coagulometric studies. The genetic disorders such as Factor V Leiden (FVL) and and Factor II G20210 A (PG20210A) were studied by polymerase chain reaction.
Results: a prevalence of white race was seen for developing thrombotic events, with a higher number of patients with thrombogenic markers and combinations for this ethnic group (x2=19.52 and a p=0.001). Both genders had equal probability to develop thrombotic events (x2=0.512 and a p=0.4750). The appearance of vein occlusive events and their recurrence was more frequent in the studied patients (x2=59.16 and a p=0.000 and an x2=8.7 and a p=0.003 respectively) and this frequency increased, when associated to acquired risks (x2=18.13 and a p=0.000). The prevalent genetic marker in patients with thrombosis was FLV x2=16.2 and a p=0.000 for an OR=11.9; IC=2.72-52.5.
Conclusions: these results are very important in predicting the recurrence of thrombotic events so as to take the prophylactic and therapeutic measures needed in patients with thrombophilia.
INTRODUCCIÓN
La fisiopatología de la trombosis fue postulada desde el siglo XIX (1860) en la tríada de Virchow,1 que incluía como principales factores o causas: daño en la pared vascular, alteraciones en el flujo de sangre y activación de la coagulación (hipercoagulabilidad). Actualmente este concepto parece casi profético, porque a más de 2 siglos conserva su vigencia por la importancia y la etiología multifactorial de cada uno de sus componentes.2
Hoy se conoce que los mecanismos anticoagulantes regulatorios actúan para neutralizar los procesos procoagulantes en la vasculatura y que una excesiva activación de la coagulación o inhibición de los mecanismos anticoagulantes llevan a un estado de hipercoagulabilidad y trombosis.3
Actualmente se plantea un modelo celular con una vía única de explicar la coagulación in vivo, con gran relevancia de las superficies celulares en el proceso de la coagulación sanguínea.4,5 Un sistema hemostático eficiente requiere la acción cooperativa de distintos componentes: sistema vascular íntegro, función plaquetaria correcta, sistema de la coagulación óptimo y fibrinolítico adecuado, estos componentes en delicado equilibrio, logran limitar y localizar el proceso hemostático. El enorme potencial del sistema de la coagulación de la sangre requiere ser controlado de una forma muy estricta para evitar la coagulación inapropiada de la sangre y la formación de trombos. Para ello existe un sistema de vigilancia que incluye a los anticoagulantes fisiológicos antitrombina y el sistema de la proteína C.
Las afectaciones más frecuentes de la hemostasia en la práctica clínica son las trombosis, ellas provocan elevadas morbilidad y mortalidad por lo que se han convertido en un serio problema de salud al nivel mundial. Es la causa de muerte más común en muchos países incluyendo Estados Unidos y Europa. Por el desarrollo logrado en la Salud Pública y los índices alcanzados, Cuba se encuentra entre los países desarrollados en el estudio de la enfermedad tromboembólica, porque también en nuestro país constituye un problema de salud.
Hablamos de trombofilia cuando existe alteración en el sistema de la hemostasia, que predispone a la trombosis y es primaria cuando se repite al nivel familiar (hereditaria) o secundaria, cuando se asocia a un factor de riesgo adquirido, que puede ser transitorio o permanente, comúnmente asociado a otra enfermedad de base.6,7
Hasta la fecha se han reconocido como las principales causas de trombofilia hereditaria: las deficiencias de antitrombina, de proteína C y proteína S, la resistencia a la proteína C activada, el factor V Leiden, la mutación G20210 A del gen de la protrombina (PG20210A). Un factor adquirido que habitualmente se explora en el estudio de laboratorio, junto a los anteriores, es la presencia de anticoagulante lúpico.8 Las causas mencionadas corresponden aproximadamente a 40 %-60 % de las causas de trombofilia. Varias de ellas han sido reconocidas sólo en los últimos años, por lo que se presume que nuevos factores hereditarios de riesgo se sumarán en el futuro.9
Las enfermedades tromboembólicas venosas (ETV) constituyen la tercera causa de muerte cardiovascular tras la cardiopatía isquémica y los accidentes cerebrovasculares. Su permanente actualidad radica en la frecuencia de su presentación, gravedad (embolia pulmonar), secuelas (síndrome postrombótico y/o restricción del árbol pulmonar y discapacidad motora) y sus implicaciones socioeconómicas. Las trombofilias hereditarias (congénitas) son las de mayor interés en la actualidad porque los factores genéticos pueden estar implicados en la patogenia de, al menos, 30 % de las trombosis venosas profundas (TVP).10
Estudios internacionales sugieren que las trombosis venosas profundas y los tromboembolismos arteriales en los cuales no se encuentra un factor desencadenante evidente, serían originadas por una trombofilia, en una proporción variable entre distintas poblaciones, especialmente si se trata de menores de 45 años y con episodios trombóticos a repetición o en sitios inusuales.11
Actualmente, con la incorporación de nuevos métodos analíticos, el laboratorio de hemostasia está en capacidad de mostrar diversas condiciones protrombóticas, así como facilitar, según el tipo de alteración, la individualización de medidas profilácticas y terapéuticas.
Nos trazamos como objetivo de este trabajo caracterizar el comportamiento de los marcadores trombogénicos estudiados en pacientes con trombofilia, determinar la asociación de estos con la aparición de trombosis y determinar la asociación entre los marcadores genéticos y genéticos-adquiridos con la recurrencia de complicaciones trombóticas.
MÉTODOS
Se realizó un estudio observacional, longitudinal y prospectivo sobre el comportamiento de los marcadores de trombogénesis a una muestra de 107 pacientes de la Consulta de Trombofilia del Hospital "Hermanos Ameijeiras" y 110 sujetos supuestamente sanos del banco de sangre del hospital, en el período comprendido de febrero a diciembre de 2011 y de enero a septiembre de 2012. Para la obtención de la muestra se realizó un muestreo aleatorio simple. Se incluyeron pacientes con: trombosis antes de los 45 años, historia familiar de trombosis, trombosis recurrente, trombosis en sitios anatómicos inusuales, resistencia a la terapia antitrombótica convencional y/o pérdidas recurrentes de embarazo. Se estudiaron variables cuantitativas como: sexo, raza, trombosis venosa (TV), trombosis arterial (TA), deficiencias de antitrombina (AT), de proteína C (PC) y proteína S (PS), factor V Leiden (FVL), mutación G20210 A del gen de la protrombina (PG20210A), anticoagulante lúdico (AL). Los estudios de PC y PS se realizaron por el método coagulométrico, con plasma pobre en plaquetas (PPP) en un coagulómetro automatizado STA Compact. La determinación de AT se realizó por ensayo cromogénico para la actividad funcional, utilizando PPP en el mismo equipo que las determinaciones anteriores. El AL se determinó también con PPP en un coagulómetro semiautomatizado ST4. La mutación del gen del factor V Leiden y la protrombina G20210A se evaluaron por método genético basado en la reacción en cadena de la polimerasa (PCR). Los estudios se realizaron según los métodos de laboratorios utilizados y recomendados para el diagnóstico de trombofilia, utilizando sus respectivos juegos de reactivos. Los valores de referencia fueron tomados de la bibliografía consultada.12 Para el procesamiento de los datos se utilizó el programa de procesamiento de datos SPSS 11.5. El análisis estadístico fue realizado utilizando la prueba del chi-cuadrado de Pearson, las diferencias fueron consideradas estadísticamente significativas cuando el valor de p fue menor que 0,05.
Cuando relacionamos variables comparándolas en 2 grupos, sanos y enfermos, utilizamos el estadígrafo OR (oportunidad de riesgo) que nos permite ver cuánto es más probable la aparición de determinada situación en un grupo respecto al otro. De la misma forma se trabajó para una confianza de 95 %, prefijándose un error máximo alfa de 0,05.
RESULTADOS
En el universo de estudio (107 pacientes) se observó diferencias entre las etnias, con un predominio de la raza blanca para ambos sexos, un porcentaje mucho menor, aproximadamente 20 %, en los mestizos y por debajo de 9 % en los negros (tabla 1). No se encontraron diferencias significativas con respecto al sexo. X² =0,512 para p= 0,4750.
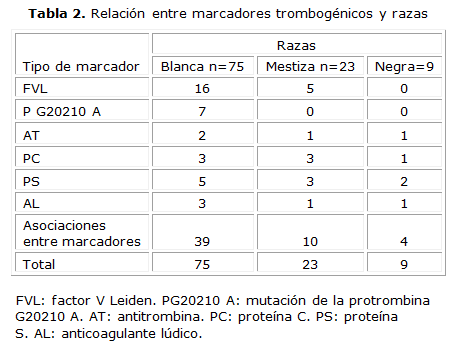
En la tabla 2 se muestra la relación entre los marcadores biológicos estudiados según la raza, los resultados muestran que existen diferencias significativas entre la presencia de marcadores trombogénicos y sus asociaciones en los pacientes con trombosis para la raza blanca, para x2=19,52 y p=0,001. No se aprecian diferencias significativas entre los marcadores y las asociaciones entre ellos, para los pacientes con trombosis de la raza mestiza y negra (Mestiza: x2=6,98 y p=0,22 y Negra: x2=3,09 y p=0,68).
La TV fue la más frecuente (tabla 3), de 106 pacientes que presentaron trombosis, 81 desarrollaron TV y solo 25 TA, por lo que hubo diferencias significativas, a favor de la venosa (x2= 59,16 y p=0,000). De igual forma fue más frecuente la recurrencia en la TV (X² =8,7 y p=0,003).
En la tabla 4 se observa que mayor número de pacientes con TV y TA recurrente presentan factores de riesgo adquiridos asociados. De 50 pacientes con TV recurrente, 42 (84 %), y de los 7 con TA recurrente 6 (85,8 %) estaban asociados a estos factores como: traumatismos, inmovilización, cirugía, síndrome antifosfolípido (SAF), uso de anticonceptivos orales (ACO) y embarazo.
El análisis estadístico desarrollado, muestra que existen diferencias significativas en cuanto a la aparición de la trombosis venosa recurrente ante el hecho de poseer o no un factor adquirido (tabla 5). Es más frecuente la recurrencia de TV ante la presencia de factores adquiridos (x2=18,13 y p=0,000). En el caso de los pacientes con TA recurrente, existen diferencias significativas en cuanto a la aparición de la enfermedad, ante el hecho de poseer un factor adquirido y no poseerlo (x2= 3,15 y p=0,007).
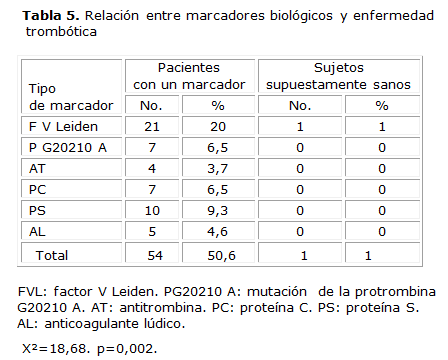
Al relacionar los diferentes marcadores trombogénicos en pacientes con trombosis y en sujetos no seleccionados se evidenció que existen diferencias significativas (X²=18,68 p=0,002) entre la presencia de marcadores biológicos y la aparición de la enfermedad trombótica en los pacientes estudiados con respecto a los sujetos supuestamente sanos del banco de sangre, el más frecuente fue el FVL (20 %). Se evidencia la baja prevalencia de estos marcadores en sujetos supuestamente sanos (1 %).
De 53 pacientes con un marcador, solo en 12 hubo recurrencia de la trombosis y de los 53 que presentaban asociaciones entre marcadores, 45 desarrollaron complicaciones trombóticas recurrentes (tabla 6), las diferencias fueron significativas (x2=13,47 y p=0,0002).
Al estudiar la relación entre los pacientes con trombosis y el grupo de sujetos sanos con las mutaciones FVL y P G20210A, se observaron resultados significativos estadísticamente (tabla 7), la oportunidad de riesgo (OR) y el X² para ambas mutaciones en los 2 grupos estudiados demostró que es más probable 11,9 veces la aparición de la mutación FVL en los pacientes con trombosis. De igual forma, es 7 veces más probable que exista la mutación P 20210 A en los pacientes con eventos trombóticos que en los sujetos supuestamente sanos.
DISCUSIÓN
En esta investigación se observó un mayor número de pacientes con trombosis en la raza blanca, con diferencia estadística significativa. Coincidiendo con investigaciones que plantean que la incidencia de TV varía con el ancestro étnico, y que es más alta entre los caucasianos y afroamericanos, intermedia entre los hispanoamericanos y más baja entre los asiáticos americanos.13 El Dr. Wilfredo Torres señaló que en la composición genética del cubano es determinante la presencia de genes españoles y africanos, con la influencia de ambas.14
La literatura mundial reporta resultados controversiales con respecto a la incidencia de esta enfermedad en los sexos, algunos estudios indican mayor frecuencia en hombres y otros muestran predominio en mujeres. Coincidiendo con los resultados de nuestro trabajo, en estudios desarrollados por algunos autores se plantea que afecta a ambos sexos por igual.15 Sin embargo, la verdadera incidencia de TV es difícil de establecer para los sexos, porque es una enfermedad multifactorial, donde confluyen una serie de factores genéticos y ambientales y de asociaciones entre ellos, para el desarrollo de esta entidad y dependiendo de la confluencia de los factores referidos en cada sexo así será mayor o menor la incidencia de la enfermedad. Con respecto a los marcadores biológicos estudiados según la raza, encontramos diferencias significativas entre la presencia de estos y sus asociaciones en los pacientes con trombosis para la raza blanca, no así para las mestiza y negra.
La trombosis afecta con mucha frecuencia arterias y venas y es prevalente, compleja y multifactorial, resultado de interacciones entre factores genéticos y ambientales. Se han identificado numerosos polimorfismos en genes involucrados en su etiología, fundamentalmente en la TV y las asociaciones entre los polimorfismos y los factores ambientales están vinculadas con la recurrencia de la enfermedad. En conjunto, la contribución individual de estos polimorfismos a la trombosis arterial es modesta, mientras que interacciones gen-gen y gen-factores de riesgo parecen ser más relevantes en el desarrollo de la trombosis arterial.
Los factores de riesgo no son los mismos para la trombosis arterial que para la venosa y la historia natural de la evolución de estas entidades también es diferente. Desde hace algunos años, diferentes datos epidemiológicos, farmacológicos y genéticos, sugieren que ambas enfermedades pueden tener una base común. En el proyecto GAIT-1(Análisis Genético de Trombofilia Idiopática) se plantea, que la base genética a la susceptibilidad a la trombosis venosa y a la arterial es la misma, estos resultados fueron replicados años más tarde en un grupo de familias de EE. UU.16
Se le atribuye a la trombofilia hereditaria una contribución en la patogenia de la trombosis arterial, aunque existen datos contradictorios en la literatura, no se establece claramente y se le otorga una participación menor a los diferentes marcadores genéticos en el desarrollo de esta enfermedad. Otros autores sugieren que deficiencias de algunos inhibidores de la coagulación como la PC y PS incrementan el riesgo a desarrollar complicaciones trombóticas arteriales en jóvenes, mientras que otros plantean que los déficits de AT, PC y PS, FVL y la P20210A se asocian a trombosis venosa y solo de forma mínima con la arterial.17 El SAF parece ser uno de los pocos marcadores que se asocian tanto con la trombosis venosa como con la arterial, en ocasiones de forma simultánea en un mismo paciente y dentro de este síndrome, el AL se plantea que está vinculado fundamentalmente con la aparición de afecciones trombóticas venosas, la TVP y el embolismo pulmonar son los más frecuentes.18
Los factores de riesgo para el desarrollo de la primera trombosis no son los mismos que para la recurrencia y su alcance durante mucho tiempo ha sido desconocido. Se plantea que el único factor de riesgo claro para la recurrencia, es la aparición de una primera trombosis, seguida de otros como: cirugía y traumatismos, entre otros y la asociación entre factores de riesgo congénitos y adquiridos (lo cual dobla el riesgo de la repetición de la enfermedad, se conoce como doble recurrencia). 19
Los pacientes con alteraciones trombofílicas congénitas que se someten a situaciones de riesgo trombogénico alto (embarazo, uso de anticonceptivos orales o cirugía ortopédica), también tienen un riesgo más elevado de presentar ETV recurrente. Se plantea que los factores adquiridos más vinculados con la aparición de TA son la HTA, el tabaquismo, la diabetes mellitus y la hiperlipidemia y que cuando estos aparecen, la probabilidad de recurrencia es mayor.20 En este estudio, de 7 pacientes con trombosis arteriales recurrentes, 6 estaban afectados por factores de riesgo adquiridos, la recurrencia de la enfermedad es más probable en aquellos con factores de riesgo asociados.
El FVL se convierte en el factor genético de riesgo trombótico más prevalente, ya que las deficiencias de ATIII, PC y PS, P G20210A no llegan al 10 %.21 La prevalencia de esta mutación en pacientes con trombosis varía de 10 % a 20 %, y de 3 % a 8 % en la población control sana, lo que coincide con lo encontrado en este estudio. La prevalencia de este factor en heterocigóticos de las poblaciones no seleccionadas europeas, israelitas, árabes, canadienses e indias, se encuentra entre los rangos de 1 % a 8,5 %. La mayoría de los estudios europeos informan las proporciones globales entre 5 % y 8 %.8 El predominio es más alto en Grecia, Suecia y Líbano donde, aproximadamente, es de 15 %, en algunas áreas. En la muestra estudiada solamente un paciente, masculino, asintomático, no desarrolló trombosis y era portador del FVL, pero no tenía factores de riesgo asociados, se detecta por un estudio familiar. Los estudios familiares son de gran importancia ya que permiten tomar las medidas profilácticas y terapéuticas adecuadas, para prevenir la aparición de complicaciones trombóticas y su recurrencia. El riesgo trombótico general de los homocigóticos sería 11 veces mayor que para los heterocigóticos y 80 veces mayor que para los individuos normales. Hasta 60 % de las trombosis venosas tienen como sustrato determinante esta alteración genética.22 En este trabajo, los portadores de este marcador son heterocigóticos para la mutación y se evidencia además que la trombosis recurrente es más probable al existir una combinación entre marcadores.
En nuestra investigación se comprueba que la presencia de múltiples factores genéticos y adquiridos, así como la asociación entre ellos no solo inducen la aparición de complicaciones trombóticas, sino que contribuyen a su recurrencia; son muchos los autores que han descrito que la concurrencia de varias alteraciones se asocia con un aumento de la incidencia de recurrencias.10
Los enfermos que heredan las mutaciones Leiden del gen del FV y G20210A del gen de la protrombina tienen 2 veces el riesgo para ETV recurrente en comparación con los portadores de solo el FV Leiden. Resultados similares a los nuestros señalan que existen asociaciones estadísticamente significativas entre pacientes con trombosis venosa y la presencia de estas mutaciones, el FVL es predominante.23,24 En un metaanálisis que involucra 120 000 casos y 180 000 controles, desarrollado por Reya Gohil y otros,13 se muestran resultados equivalentes para el FVL (OR 9,45; 95 % CI 6,7213,30, p<0,0001) y para la protrombina G20210A, (OR 3,17; 95 % CI 2,193,46, p<0,00001).
Se concluye que la presencia de marcadores trombogénicos hereditarios y adquiridos en los pacientes estudiados son más frecuentes en la raza blanca para ambos sexos y están asociados con la aparición de trombosis; que el marcador genético prevalente es el FVL y que es más frecuente la aparición de complicaciones vasooclusivas venosas y recurrencia de estos y esta frecuencia aumenta cuando existen asociaciones entre marcadores genéticos y genéticos-adquiridos.
REFERENCIAS BIBLIOGRÁFICAS
1. Virchow RLK. Cellular pathology as based upon physiological and pathohistology. American. 1860;(7):236-40.
2. Bagot CN, Arya R. Virchow and his triad: a question of attribution. Br J HaematoL. 2008;143(2):18090.
3. Torres IW, Colina RA. Trombofilias. En: Suardíaz JH, Cruz CL, Colina RA. Laboratorio Clínico. La Habana: Editorial Ciencias Médicas. 2004;30:349-61.
4. Izaguirre-AR. A un siglo de la teoría clásica de la coagulación sanguínea. Haematologica. 2006;29(2):116-23.
5. Kordich LC. Concepto actual del sistema de coagulación. Invest Clin. 2009;50(Sup.2):35-8.
6. Agutter PS. The Aetiology of Deep Venous Thrombosis: A Critical, Historical and Epistemological Survey. Berlin: Springer; 2008:84-6.
7. Lane DA, Mannucci PM, Bauer KA, Bertina R et al. Inherited thrombophilia. part. 1. Thromb Haemost. 1996;76:651-2.
8. Majluf-CM, ALarrañaga EF. Fisiopatología de la trombosis. Gac Méd Méx. 2007;143(Supl1):11-14.
9. Soria JM, Fontcuberta J. New approaches and future prospects for evaluating genetic risk of thrombosis. Haematologica. 2005;90:212-22.
10. Rosendaal FR. Risk factors for venous thrombosis: genes and lifestyle. Haematologica (edición española). 2009;94:242-4.
11. Ageno W, Dentali F. Venous thromboembolism and arterial thromboembolis. Many similarities, far beyond thrombosis per se. Thromb Haemost. 2008;100:181-3.
12. Stéffano de PB. Fundamento de los métodos usados para la evaluación en el laboratorio de Hemostasia. Invest Clin. 2009;50(sup 2):38- 40.
13. Gohil R, Peck G, Sharma P. The genetics of venous thromboembolism: a meta-analysis involving ~120,000 cases and 180,000 controls. Thromb Haemost. 2009;102:360-70.
14. Torres YW. Trombofilia hereditaria en Cuba. Rev Cubana Hematol Inmunol Hemoter. 2009;25(sup):89-112.
15. Nieto AJ, Ruiz RMD. Tromboembolia pulmonar. Luces y sombras. Rev Esp Cardiol. 2008;61:229-32.
16. Albánez S. Frecuencia de ocho polimorfismos protrombóticos en pacientes con trombosis venosa profunda. Un estudio caso-control en Venezuela. Investigación Clinica. 2009;50(Sup 2):135-37.
17. Mahmoodi BK, Brouwer JL, Veeger NJ. Hereditary deficiency of protein C or protein S confers increased risk of arterial thromboembolic events at a young age: results from a large family cohort study. Circulation. 2008 14;118(16):1659-67.
18. Lim W. Antiphospholipid antibody syndrome. Hematology. 2009;25(10):2333-9.
19. Christiansen SC, Cannegieter SC, Koster T. Thrombophilia, clinical factors, and recurrent venous thrombotic events. JAMA. 2005;293:2352-61.
20. Franchini M, Mannucci PM. Venous and arterial thrombosis: different sides of the same coin? Eur J Intern Med. 2008;19:476-81.
21. Agredo DK. Caracterización y manejo del paciente con sospecha de trombosis venosa profunda en una clínica de segundo nivel de Popayán, Cauca. Facultad Popayán. Colombia: Ciencias de la Salud, Universidad del Cauca; 2007:1-8.
22. Corral J, Roldán V, Vicente V. Deep venous thrombosis or pulmonary embolism and factor V Leiden: enigma or paradox. Haematologica. 2010;95(6):863-6.
23. Bezemer ID, van der Meer FJ, Eikenboom JC. The value of family history as a risk indicator for venous. Arch Intern Med. 2010; 169:610-5.
24. Crim MT. Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. JAMA. 2009;301(23):2472-85.
Recibido: 27 de Julio de 2013.
Aprobado: 16 de agosto de 2013.
Lic. Marlem Castañeda Travieso. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10 300.