Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina
versão impressa ISSN 0034-7523
Rev cubana med vol.53 no.3 Ciudad de la Habana jul.-set. 2014
TRABAJO ORIGINAL
Efecto del tratamiento con extracto de propóleos rojo oral en la esteatohepatitis no alcohólica
Effect of treatment with oral red propolis extract on nonalcoholic teatohepatitis
Dra. Dayamí Fernández Vega, Dr. Pedro Evelio Velbes Marquetti, Dr. Alfredo Nasiff Hadad, Dr. Carlos Domínguez Álvarez, Dr. Jossane Soto Matos, Dra. Teresa Giral Rivera
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: la esteatohepatitis no alcohólica es frecuente y puede evolucionar hacia la cirrosis. Sus opciones de tratamiento farmacológico son poco eficaces. Se conoce que los propóleos tienen acción antioxidante y antiinflamatoria y se han reportado efectos beneficiosos de los propóleos.
Objetivo: identificar los cambios histológicos hepáticos en pacientes con esteatohepatitis tratados con extracto hidroalcohólico al 5 % de propóleos rojo oral cubano durante un año.
Métodos: se realizó un ensayo clínico aleatorizado, a doble ciegas, con grupo control, en 40 individuos de ambos sexos, entre 20 y 65 años, con índice de Kleiner entre 6 y 8, divididos en 2 grupos: propóleos y placebo. Las pruebas estadísticas aplicadas fueron chi-cuadrado y la prueba no paramétrica.
Resultados: el Kleiner total en el grupo propóleos se redujo de 6 ± 0,65 a 3,15 ± 071 y en el grupo placebo de 6 ± 0,65 a 6,1 ± 0,97. En el grupo propóleos se redujeron la esteatosis, inflamación, balonamiento y fibrosis y los cambios en las enzimas hepáticas y las lipoproteínas plasmáticas fueron favorables.
Conclusiones: el propóleos rojo puede ser una alternativa terapéutica para detener la progresión de la esteatohepatitis.
Palabras clave: esteatohepatitis no alcohólica, propóleos, propóleos rojo cubano, índice de Kleiner.
ABSTRACT
Introduction: nonalcoholic steatohepatitis is a common condition which may lead to cirrhosis. The existing drug therapy options are not very effective. It is a well known fact that propolis has an antioxidant and antiinflammatory effect. Reports on the benefits of propolis may be found in the literature.
Objective: identify histological hepatic changes in patients with steatohepatitis treated with 5% hydroalcoholic oral extract of Cuban red propolis for a year.
Methods: a double-blind randomized controlled clinical trial was conducted with 40 patients of both sexes aged 20-65 with 6-8 Kleiner index, who were divided in 2 groups: propolis and placebo. Statistical analysis was based on chi-square and nonparametric tests.
Results: total Kleiner decreased from 6 ± 0.65 to 3.15 ± 071 in the propolis group and from 6±0.65 to 6.1±0.97 in the placebo group. In the propolis group there was also a decrease in steatosis, inflammation, ballooning and fibrosis. Changes in liver enzymes and plasmatic lipoproteins were favorable.
Conclusions: red propolis may be a therapeutic alternative to stop the progress of esteatohepatitis.
Key words: nonalcoholic steatohepatitis, propolis, Cuban red propolis, Kleiner index.
INTRODUCCIÓN
La enfermedad hepática por depósito de grasa (EHDG) no alcohólica es una enfermedad inflamatoria de carácter crónico que engloba un espectro de patologías que van desde la esteatosis hepática hasta fases finales de la enfermedad como la cirrosis, pasando por la esteatohepatitis no alcohólica (EHNA) y la fibrosis.1-4
Constituye una de las primeras causas de morbilidad y mortalidad en el mundo, unas 3 veces más común que la diabetes mellitus tipo 2 y unas 5-10 veces más que la hepatitis C. La verdadera incidencia y prevalencia de la enfermedad al nivel mundial son difíciles de determinar, se estima en 5,1/100 000 hab5 la prevalencia y en aproximadamente 1/100 000 hab/año,5 su incidencia.
La esteatosis hepática se revela como una situación compleja en la que actúan procesos metabólicos (señales extrahepáticas) entre los que se destacan la obesidad, la resistencia a la acción periférica de la insulina y la hiperlipidemia por incremento de los ácidos grasos circulantes como generadores de un desequilibrio de la homeostasis, al que se asocian factores intrahepáticos como el estrés oxidativo, el estrés de retículo endoplasmático, la disfunción mitocondrial, el descenso en la expresión de genes de supervivencia así como la peroxidación lipídica, la activación de células estrelladas o de Ito y la liberación anormal de citoquinas que favorecen la progresión de la enfermedad.6,7
El propóleos es una mezcla compleja de resinas, ceras, aceites esenciales, polen y microelementos, de consistencia viscosa y de color variado en dependencia de su origen botánico.8 La composición química del propóleos rojo cubano es sui generis por la presencia de quinonas y triterpenos no informada hasta el momento en propóleos de otras latitudes.9,10 Dentro de sus propiedades biológicas se destacan las antiinflamatorias, las antioxidantes y las hepatoprotectoras. En otros países como Chile y China se ha demostrado su capacidad para disminuir la expresión del hígado graso alcohólico y no alcohólico.11
El objetivo del presente estudio es identificar las modificaciones histológicas hepáticas en pacientes del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" de La Habana, Cuba, atendidos por padecer esteatohepatitis no alcohólica, tratados con extracto de propóleos rojo oral e identificar los efectos adversos durante el período de tratamiento.
MÉTODOS
Se realizó un ensayo clínico a doble ciegas, con grupo control paralelo, aleatorizado y monocéntrico discutido y aprobado por el Comité de Ética y Científico del hospital por la realización de 2 biopsias hepáticas una al inicio del estudio y otra al concluirlo. La muestra quedó constituida por 40 pacientes los cuales fueron atendidos en una Consulta de Protocolo creada para ello, se les entregó un documento en el que se exponían los requisitos del estudio y la necesidad de la realización de 2 biopsias hepáticas, para que emitieran su consentimiento a participar en el estudio.
Fueron divididos al azar en 2 grupos, control y experimental, integrados por 20 pacientes cada uno. Ambos grupos fueron atendidos con una frecuencia mensual durante un año, se llevaba control trimestral de pruebas de funcionamiento hepático y se le entregó a cada paciente el tratamiento, ya fuera el placebo o el propóleos, con una dosis de 6 mL, 2 veces al día, diluidos en 100 mL de agua para ambos productos, según el grupo control o experimental, así como orientaciones dietéticas.
Procesamiento y análisis de la información
Se utilizaron variables, las cuales se operacionalizaron, números absolutos y porcentajes, y se calculó el promedio y su desviación estándar. Por tratarse de un estudio tipo ensayo clínico donde hubo manipulación a 2 grupos de pacientes tratados con diferentes esquemas, fue necesario contrastar la hipótesis de homogeneidad. Se empleó el test estadístico de Ji-cuadrado (variables cualitativas) y la prueba no paramétrica de comparación de promedios entre grupos independientes (variables cuantitativa). Se empleó la prueba no paramétrica de comparación de promedios para muestras relacionadas. Se utilizó un nivel de significación α= 0,05. La información se presenta en tablas y gráficos estadísticos.
RESULTADOS
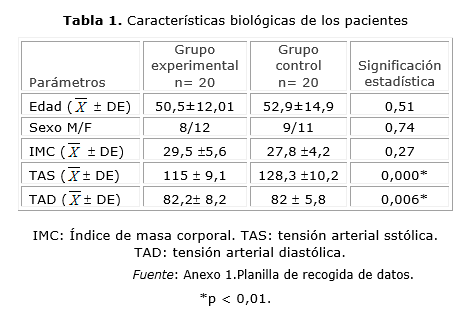
En la tabla 1 se recogen las características de ambos grupos de pacientes. La homogeneidad de los grupos se corresponde con la edad, el sexo y el índice de masa corporal. La edad media global de 52,9 (DE ± 14,9) para el control y 50,5 (DE ± 12,01) para el experimental. El sexo que presentó un ligero predominio de la muestra asignada fue el femenino 11 y 12 pacientes, respectivamente. En cuanto al índice de masa corporal promedio (IMC), encontramos que los pacientes estaban sobrepeso con 27,8 (DE ± 4,2) el control y 29,5 (DE ± 5,6), el experimental.
Histología
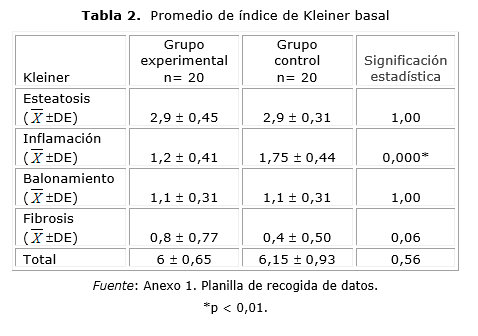
La primera biopsia hepática efectuada antes de iniciar el tratamiento, con un puntaje según índice de Kleiner (basal promedio) de 6,15 (DE ± 0,93) para el grupo control y 6 (DE ± 0,65), para el experimental, se comportó de manera similar en ambos (tabla 2).
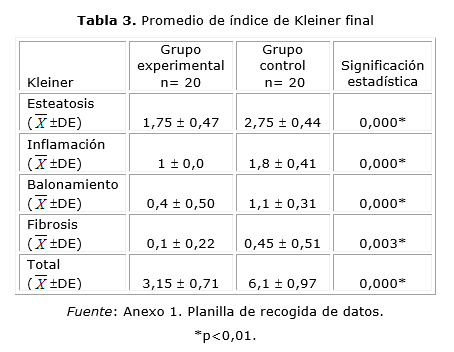
Respecto al índice de Kleiner final promedio (final), una vez concluido el tratamiento podemos observar que todos los parámetros que este engloba resultaron ser menores en el grupo experimental con respecto al control. Con un Kleiner de 3,15 (DE ± 0,71) y 6,1 (DE ± 0,97), respectivamente. Estas diferencias entre los distintos acápites tuvieron relación estadísticamente significativa (p= 0,000, p= 0,003), según se muestra en la tabla 3 y la figura 1.
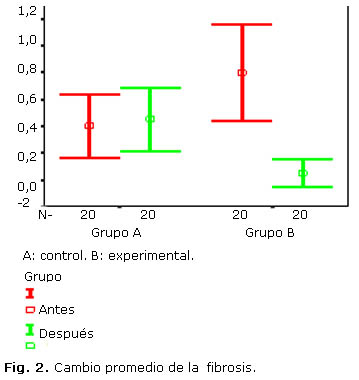
En la tabla 4 se comparan ambos grupos en cuanto al cambio promedio del patrón histológico que muestran que las variables histológicas en el grupo experimental tuvieron significación estadística (p= 0,000) - (p= 0,042): mientras que en el grupo control no se observó significación estadística en ninguno de ellos (Fig. 2).
Variables bioquímicas
En la tabla 5 podemos constatar que los valores promedio de la transaminasa glutámico pirúvica (TGP), a los 3 meses, 6 meses y 12 meses fueron menores en el grupo experimental; hubo una asociación estadísticamente significativa, se obtuvieron similares resultados con la transaminasa glutámico oxalacética (TGO), fosfatasa alcalina (FAL), triglicéridos y lipoproteínas de baja densidad.
DISCUSIÓN
El hígado graso no alcohólico es una enfermedad emergente de gran importancia en el momento actual. Su prevalencia y gravedad están en relación con variables como el índice de masa corporal, cintura, hiperinsulinemia, hipertrigliceridemia y resistencia a la insulina. En Estados Unidos reportan que es la enfermedad hepática más frecuente de la actualidad y se asocia con el notable aumento de la obesidad y la diabetes mellitus tipo 2.12 Se ha hecho más evidente en el sexo femenino aunque en los últimos años existe una tendencia a afectar ambos sexos de igual forma. En el estudio de Maier, Garcia Rochet y otros,13 obtuvieron un marcado predominio del sexo femenino con 32 casos, para 66,66 %, así como un promedio de edad superior a los 63 años ± 9. De hecho, la edad (> 45 años) se ha identificado como un factor predictivo de fibrosis, lo cual probablemente refleja el tiempo de la esteatosis y, por tanto, la susceptibilidad a un segundo impacto responsable de los cambios histológicos irreversibles involucrados en la patogenia de la enfermedad. Entre 39 y 100 de los pacientes con EHNA tienen sobrepeso (índice de masa corporal > 25 kg/m2) u obesidad. Lo cual coincide con los resultados hallados en este estudio. Dentro de los factores de mal pronóstico en el hígado graso se encuentran 4 que pueden actuar combinados o solos: edad > 45 años, obesidad, diabetes mellitus tipo 2 y dislipidemias.13
El gold standar en el diagnóstico de esta entidad lo constituye la biopsia hepática.13,14 Los hepatólogos recomiendan la realización de una biopsia hepática en todos los pacientes con el presunto diagnóstico de EHDG no alcohólica. Ello, permitirá un mejor conocimiento de la historia natural de la enfermedad y valorar la influencia de las diferentes terapias. El estadiaje semicuantitativo más aceptado en estos momentos es el índice de Kleiner,14 que clasifica la esteatosis y la actividad inflamatoria en grados de 0 a 3, el balonamiento de 0 a 2 y la fibrosis en grados, de 0 a 4. Diversos autores indican que el diagnóstico de esteatosis hepática por biopsia de hígado alcanza el 100 %, con un alto índice de confiabilidad. En un estudio realizado en el 2005, por el Servicio de Gastroenterología del Hospital "Hermanos Ameijeiras" y el Instituto de Gastroenterología se evidenció que en caso de que se presente fibrosis, balonamiento de hepatocitos, inflamación y cuerpos de Mallory, existe riesgo de que se evolucione hacia estadios avanzados de EHNA,15 los resultados hallados en el presente trabajo coinciden con los de dichos estudios.
Es conocido que puede darse una mejoría histológica tras adelgazar, puede detectarse una disminución de la inflamación y de los cuerpos de Mallory, incluso de la fibrosis perisinusoidal, sobre todo si la pérdida de peso es gradual y se asocia la dieta con el ejercicio físico.16 Resultados similares a los descritos encontramos en nuestro estudio en el grupo que se sometió a tratamiento con el propóleos rojo, lo que permite afirmar que el medicamento, como se plantea en otros trabajos, tiene propiedades antioxidantes, antiinflamatorias y hepatoprotectoras.
Los exámenes bioquímicos que evalúan el comportamiento de las enzimas como las transaminasas, fosfatasa alcalina y gama glutamil transpeptidasa, sirven al médico como orientación para establecer el grado de daño producido.17 En el grupo sometido a tratamiento con propóleos rojo dichas variables normalizan sus valores a medida que se reduce la fibrosis y mejora el patrón histológico en general. En nuestro estudio podemos observar que el propóleos contiene propiedades que logran modificar la fibrosis y controlar la progresión de la enfermedad.
Se concluye que el propóleos rojo, en dosis de 12 mL diarios de solución hidroalcohólica al 5 %, demostró ser eficaz en la regresión de los cambios histológicos de la EHDG no alcohólica en etapas avanzadas. Como resultado colateral, demostró efecto beneficioso sobre las lipoproteínas del plasma al reducir los niveles de LDLc y los triglicéridos y elevar los niveles de HDLc.
No se observaron efectos adversos durante el tratamiento en ninguno de los grupos.
REFERENCIAS BIBLIOGRÁFICAS
1. Adams LA, Talwalkar JA. Diagnostic evaluation of nonalcoholic fatty liver disease. J Clin Gastroenterol. 2006;40(3).S34-8.
2. Farrell GC , Larter CZ. Nonalcoholic fatty liver disease. from steatosis to cirrhosis. Hepatol Res. 2006;34(2):92-8.
3. Feldstein AE, Charatcharoenwitthaya PST, Benson JT, Enders FB, Angulo P. The Natural History of Nonalcoholic Fatty Liver Disease in Children. A Follow-Up Study For Up To 20 Years. Hepatology. 2008;48(3):64A.
4. Herrera GA, Nasiff HA, Arus SE, Cand HC, León N. Hígado graso. Enfoque diagnóstico y terapéutico. Rev Cubana Med. 2007;46(1):11-4.
5. Clark M. The epidemiology of nonalcoholic fatty liver disease in adults. J Clin Gastroenterol. 2006;40(3):S5-10.
6. Carter-Kent C, Zein NN, Feldstein AE. Cytokines in the pathogenesis of fatty liver and disease progression to steatohepatitis. implications for treatment. Am J Gastroenterol. 2008;103:1036-42.
7. Rafiq N, Bai C, Fand Y, Srishord MK, McCullough AJ, Younossi ZM. Over twenty five years of follow up for a Non-Alcoholic Fatty Liver Disease Cohort. Gastroenterology. 2008;134:A754.
8. Bracho JC, Tabío C, Valdés G, Gil J, Dominguez A, Mendoza L. Control de la calidad de propóleos (Características cualitativas y cuantitativas). Apitec. nov. 1996;4(3):15-6.
9. Cuesta-Rubio O, Piccinelli AL, Fernández M, Hernández I, Rosado A, Rastrelli L. Chemical characterization of Cuban propolis by HPLC-PDA, HPLC-MS, and NMR. the brown, red, and yellow Cuban varieties of propolis Instituto de Farmacia y Alimentos. Journal of Agricultural and Food Chemistry. 2007;55(18):7502-9.
10. Campo Fernández M, Cuesta-Rubio O, Rosado Pérez A, Montes de Oca Porto R, Márquez Hernández I, Piccinelli AL, et al. GC-MS determination of isoflavonoids in seven red Cuban propolis samples. J Agr Food Chem. 2008;56(23):9927-32.
11. Mani F, Damasceno HCR, Novelli ELB, Sforcin JM. Biochemical determinations of propolis-treated rats. effects of different concentrations, extracts and intake period. Biosáude. 2008;10:3-16.
12. Campos GM, Bambha K, Vittinghoff E, Rabl C, Posselt AM, Ciovica R, et al. A clinical scoring system for predicting nonalcoholic steatohepatitis in morbidly obese patients. Hepatology. 2008;32(8):976-84.
13. García Rochet C, Balbuena E, Domínguez E. Esteatosis hepática en diabéticos, comportamiento en el Hospital Saturnino Lora durante un año [tesis]. Santiago de Cuba: Instituto Superior de Ciencias Médicas Santiago de Cuba; 2005.
14. Hisamitsu M, Tatsuki I, Kazuhiko N, Hiroshi Y, Ryuji F, Kazuo O, et al. Clinicopathological study of nonalcoholic fatty liver disease in Japan. the risk factors for fibrosis. Clinical Studies. 2007;21(3):1478-3223.
15. Adams LA, Paul A. Role of liver biopsy and serum markers of liver fibrosis in non-alcoholic fatty liver disease. Clin Liver Dis. 2007;11:25-35.
16. Guatemala Martínez ML, Velbes Marquetti Pedro E, Gra Oramas B. Factores predictivos de fibrosis hepática en pacientes con hígado graso no alcohólico [tesis]. La Habana: Hospital Clinicoquirúrgico "Hermanos Ameijeiras"; 2005.
17. Sreenivasa BC, Alexander G, Kalyani B, Pandey R, Rastogi S, Pandey A. Effect of exercise and dietary modification on serum aminotransferase levels in patients with nonalcoholic steatohepatitis. J Gastroenterol Hepatol. 2006;21:191-8.
Recibido: 30 de dicembre de 2013.
Aceptado: 24 de abril de 2014.