Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med vol.54 no.2 Ciudad de la Habana abr.-jun. 2015
TRABAJO ORIGINAL
Niveles séricos de magnesio en pacientes oncológicos tratados con nimotuzumab
Serum magnesium levels in oncologic patients treated with nimotuzumab
Dr. Raymed Antonio Bacallao Méndez,I Dra. Tania Crombet Ramos,II Dr. José Manuel Dávalos Iglesias,I Dr. Reynaldo Mañalich Comas,I Dra. Betsy Llerena Ferrer,I Dr. Francisco Gutiérrez GarcíaI
I Instituto de Nefrología "Dr. Abelardo Buch López". La Habana, Cuba.
II Centro de Inmunología Molecular. La Habana, Cuba.
RESUMEN
Introducción: con el empleo de anticuerpos monoclonales anti-receptor del factor de crecimiento epidérmico (EGFR), se reportan efectos adversos, entre ellos hipomagnesemia e hipocalcemia. El nimotuzumab, anti-EGFR de producción nacional, tiene otras particularidades en su mecanismo de acción.
Objetivo: analizar si la administración de este fármaco causa hipomagnesemia e hipocalcemia secundaria, como el resto de los anti-EGFR.
Métodos: los pacientes del estudio provienen del ensayo clínico controlado: Uso del anticuerpo monoclonal nimotuzumab en el tratamiento de pacientes con carcinoma de células escamosas de cabeza y cuello, en estadios avanzados. De cada uno de los dos grupos de tratamiento del ensayo fueron seleccionados, mediante muestreo simple aleatorio, 12 pacientes. Se registraron las variables demográficas y antropométricas; se realizaron las determinaciones de calcio y magnesio, utilizando muestras de suero obtenidas durante el ensayo clínico y conservadas a –86 °C. La información fue procesada automatizada; paquete estadístico SPSS 15.0. Para determinar cambios en las concentraciones de Ca y Mg se utilizaron, respectivamente, los test de Friedman y de rangos con signos de Wilcoxon. En la comparación entre grupos se empleó el test de Wilcoxon-Mann-Whitney.
Resultados: los dos grupos de sujetos mostraron características semejantes. En el grupo tratado con nimotuzumab, las medias de las concentraciones de Mg fueron de 2,06; 2,17 y 2,11 mg/dL, al inicio, a las 3 sem y al final del tratamiento (p= 0,72). No existieron diferencias al comparar los cambios en las concentraciones de Mg y Ca entre ambos grupos (p= 0,07 y p= 0,86).
Conclusión: no existen evidencias para plantear que el nimotuzumab produzca hipomagnesemia e hipocalcemia secundarias, en cursos de tratamiento de 200 mg semanales por 6 sem.
Palabras clave: nimotuzumab, hipomagnesemia, receptor de factor de crecimiento epidérmico, anticuerpo monoclonal.
ABSTRACT
Introduction: some adverse effects have been reported with the use of monoclonal antibodies against Epidermal Growth Factor Receptor (EGFR), including hypomagnesaemia and hypocalcaemia. Nimotuzumab is a Cuban anti-EGFR antibody with a particular mechanism of action, so it is important to know if Nimotuzumab causes these adverse effects.
Objective: assess whether the administration of this drug causes hypomagnesemia and secondary hypocalcemia, like other anti-EGFR.
Methods: patients on this study came from the controlled clinical assay: Use of Monoclonal Antibody Nimotuzumab in Treatment of Patients with Squamous-Cell Carcinoma of the Head and Neck In Advance Stages. 12 patients were taken by simple random sampling from each group of treatment of clinical assay (total 24). Demographic and anthropometric variables were recorded and mensuration of calcium and magnesium were done from serum samples obtained during clinical assay and preserved at –86 °C. Information was processed using statistical package SPSS 15.0. Friedman test and Wilcoxon test were used to assess changes in Ca and Mg concentrations. Wilcoxon-Mann-Whitney test was used to compare the groups.
Results: both groups of subjects had similar characteristics. In the group of patients treated with nimotuzumab, Magnesium concentrations mean were 2.06, 2.17 and 2.11 mg/dL, at the beginning, after three weeks and at the end of treatment, respectively (p=0.72). There were not differences in Mg and Ca concentration changes along the study between groups (p= 0.07 y p= 0.86).
Conclusions: there are not evidences to establish that nimotuzumab causes hypomagnesaemia and secondary hypocalcaemia in treatment of 200 mg a week during six weeks.
Key words: nimotuzumab, hypomagnesaemia, epidermal growth factor receptor, monoclonal antibody.
INTRODUCCIÓN
En enero de 2005 se presenta en el encuentro de Oncología Gastrointestinal de la Sociedad Americana de Oncología Clínica, desarrollado en Hollywood, Florida, el trabajo: Terapia con cetuximab e hipomagnesemia sintomática, el cual luego aparece como comunicación breve en agosto de ese año en Journal of The National Cancer Institute.1 En esta investigación se evidencia en un paciente afecto de cáncer colo-rectal la aparición de hipomagnesemia severa y aumento de la excreción urinaria de Mg con la utilización de cetuximab, un anticuerpo monoclonal quimérico contra el Receptor de Factor de Crecimiento Epidérmico (EGFR) que presenta una afinidad por el EGFR 10 veces mayor que su ligando natural.
A partir de este caso índice, se investigan otros 34 pacientes tratados, con la misma enfermedad, en quienes se habían realizado mensuraciones de Mg sérico, y se hallaron 8 pacientes con hipomagnesemia severa. En esta investigación se sugiere que el bloqueo del EGFR pudiera interferir en la reabsorción tubular de Mg.1 Sin embargo, para esa fecha no estaban disponibles otras investigaciones que permitirían definitivamente probar la relación existente entre el bloqueo del EGFR y la reabsorción tubular de Mg. Luego han aparecido múltiples reportes de hipomagnesemia en relación con la utilización de medicamentos de esta clase (anticuerpos contra EGFR).2,3
A la luz de los estudios actuales se conoce que el transporte de Mg difiere del de la mayoría de los iones, pues el túbulo proximal no es el sitio donde se produce la mayor parte de su reabsorción. Alrededor de 80 % del Mg plasmático es filtrado en el glomérulo y de un 15 a un 20 % del Mg filtrado es reabsorbido pasivamente en el túbulo proximal, mientras en el asa de Henle tiene lugar aproximadamente el 75 % de su reabsorción tubular por vía paracelular.4,5
El túbulo contorneado distal (TCD) aunque solo es responsable del 5 al 10 % de la reabsorción de Mg, es el sitio en que se regula de forma fina la reabsorción y la excreción renal de Mg. A este nivel, la reabsorción de Mg ocurre de forma transcelular (a través de la célula); el Mg entra a las células del TCD a favor de su gradiente electroquímico a través de los canales transient receptor potential melastatin 6 (TRPM6)6,7 y luego es transportado a la membrana basolateral, aunque los mediadores moleculares de este último proceso aun no son bien conocidos. Tampoco eran bien conocidos los mecanismos por los que era regulada la actividad de los canales TRPM6; sin embargo, esto se modificó cuando Groenestege y colaboradores publican, en 2007, que una mutación en el gen del precursor del factor de crecimiento epidérmico (pro-EGF) era responsable de una forma de hipomagnesemia renal autosómica recesiva.8 Luego, este mismo grupo demostró que el EGF al unirse a su receptor estimula la actividad y la expresión de los TRPM6.9 De este modo se establece que el EGF actúa como un regulador autocrino y paracrino de la reabsorción renal de Mg, de forma que el EGF actúa como hormona magnesiotrópica. Así, no es de extrañar que la utilización terapéutica de anticuerpos contra el EGFR determine la aparición de hipermagnesuria e hipomagnesemia. Además, la hipomagnesemia provoca hipocalcemia secundaria pues impide la secreción de hormona paratiroidea (PTH) y la movilización de calcio del hueso.10 La hipomagnesemia y la hipocalcemia causan debilidad severa y pueden incluso desencadenar la ocurrencia de arritmias cardiacas, por lo que resultan de gran interés clínico.2
Todos estos elementos hacen pensar que la hipomagnesemia es un efecto adverso de clase, o sea que todos los medicamentos de esta clase (anticuerpos contra EGFR) la producirán. De este modo se ha reportado algún grado de hipomagnesemia en el 97 % de los pacientes que han llevado tratamiento con cetuzimab, panitumumab y matuzumab.2 Sin embargo, existen diferencias ostensibles entre los diferentes miembros de esta clase de medicamentos y la frecuencia de presentación de los distintos efectos adversos difiere de forma manifiesta entre ellos.11,12
El nimotuzumab, previamente conocido como h-R3, es un anticuerpo monoclonal humanizado IgG1, de producción nacional, dirigido contra el EGFR, cuya baja frecuencia de toxicidad cutánea parece deberse a una menor afinidad por el EGFR; se ha demostrado que cuando existe una baja densidad de EGFR, tal como sucede en las células normales, el nimotuzumab se une al EGFR de forma monovalente y transitoria, con una menor acumulación hística, lo que parece explicar su escasa toxicidad. Por el contrario, cuando existe una sobreexpresión de EGFR, tal como ocurre en las células tumorales, el nimotuzumab se une fuertemente (unión bivalente) al EGFR y lo inhibe de modo semejante al resto de los anticuerpos anti-EGFR.13-16
Al tomar en consideración las particularidades del mecanismo de acción del nimotuzumab antes explicadas, surge la interrogante de si este fármaco causa hipomagnesemia e hipocalcemia secundaria como el resto de los anti-EGFR. Para dar respuesta a esta interrogante se desarrolla la presente investigación en un grupo de pacientes afectos de cáncer de cabeza y cuello que forman parte de un ensayo clínico fase II/III. El conocimiento de este elemento resulta trascendente para identificar la necesidad de suplementación con sales de Mg en estos pacientes.
MÉTODOS
Los pacientes incluidos en este estudio provienen del ensayo clínico multicéntrico, aleatorizado, controlado a doble ciegas, Fase II/III denominado “Uso del anticuerpo monoclonal nimotuzumab en el tratamiento de pacientes con carcinoma de células escamosas de cabeza y cuello, en estadios avanzados (registro: IIC RD-EC0113)”; en el que fueron incluidos 106 pacientes con tumores de células escamosas de cabeza y cuello en estadios III o IV, comprobados por estudio histológico o citológico. Los pacientes que cumplían los criterios de selección del ensayo clínico fueron incluidos y divididos en 2 grupos de tratamiento; uno recibió tratamiento con radioterapia más nimotuzumab, mientras el segundo recibió tratamiento con radioterapia más un placebo. Fueron aplicadas 6 dosis por vía endovenosa del medicamento o del placebo con una frecuencia semanal que, en el caso del grupo tratado con nimotuzumab, correspondía a una dosis de 200 mg semanales. Todos los pacientes fueron irradiados con 60cobalto en dosis de 200 cGy una vez al día, 5 d por semana, por 6 sem, con una dosis total de 6 000 a 6 600 cGy.17
Durante el ensayo se tomaron 3 muestras de sangre, de 3 mL cada una, a todos los pacientes. La primera se tomó inmediatamente antes de iniciar el primer ciclo de tratamiento, la segunda, a las 3 sem de tratamiento y la tercera, al concluir el tratamiento. Las muestras de sangre fueron inmediatamente centrifugadas, se tomó 1,5 mL de plasma (se aseguró la ausencia de hemólisis) y se almacenaron en viales eppendorf a –86 °C para su posterior análisis en el laboratorio.
Del total de pacientes del ensayo fueron excluidos de la presente investigación aquellos que presentaban un aclaramiento de creatinina (CrCl) calculado por fórmula de Cockroft y Gault18 y corregido para la superficie corporal (SC) ≤ 60 mL/min/1,73 m2 SC, los que utilizaban fármacos que influyen en el manejo del Mg por el organismo (diuréticos, cisplatino, glucósidos cardíacos, anfotericim B, ciclosporina y tacrolimus), pacientes alcohólicos, así como los que padecían de alguna nefropatía perdedora de Mg o tenían antecedentes de diarreas crónicas. De los pacientes que cumplieron los criterios anteriores en cada uno de los grupos de tratamiento, de manera independiente, se seleccionaron mediante muestreo simple aleatorio, 12 pacientes y resultaron incluidos 12, tratados con radioterapia más nimotuzumab (grupo 1) y 12, tratados con radioterapia más placebo (grupo 2). Se recogieron los datos de la edad, sexo, peso, talla y color de la piel de los pacientes incluidos en la investigación. A partir del peso y la talla se calculó el índice de masa corporal (IMC).19
A partir de las muestras de suero conservadas a –86 °C se hicieron las siguientes mensuraciones. A las primeras muestras (pre-tratamiento) se les hizo determinación de creatinina, Ca, Mg y albúmina; a las segundas muestras (a las 3 sem de tratamiento) se les determinó solo Mg y a las terceras muestras (postratamiento), se les mensuró Ca, Mg y albúmina. Todas las mensuraciones fueron realizadas en un autoanalizador espectrofotométrico Huma Star80 de Human Gesellschaft für Biochemnica und Diagnostica mblt. Max-Planck-Ring 21-D-65205 Wiesbaden, Alemania, con los kit comerciales de esta firma.
Las mensuraciones de creatinina fueron realizadas para estimar el CrCl. Las mediciones de los niveles de albúmina, fueron utilizadas para corregir las cifras de Ca sérico para el nivel de albúmina, de acuerdo a la fórmula:20
[Ca] corregido= [Ca] total medido + ( 0,8 × (4,5 - [albúmina] ) )
Análisis estadístico
La totalidad de la información fue procesada de forma automatizada. Se utilizó el paquete estadístico Statistical Package for Social Sciences (SPSS) versión 15.0.
Inicialmente, para comparar los 2 grupos de pacientes y asegurar la no existencia de diferencias significativas entre ambos, fue utilizado el test de Wilcoxon Mann-Whitney (variables cuantitativas) y el test exacto de Fisher (variables cualitativas). Posteriormente, fueron comparados, en cada grupo de forma independiente, los promedios de los valores de las 3 mensuraciones de Mg y de las 2 de Ca, para determinar si existían cambios en las concentraciones de los cationes a lo largo del estudio. Para el Mg se utilizó el test no paramétrico para muestras pareadas de Friedman y en el caso del Ca, el test de rangos con signos de Wilcoxon.
Como último paso del análisis, se compararon las modificaciones en las concentraciones de los cationes entre ambos grupos de estudio; para ello se calcularon las medias de las diferencias entre las determinaciones iniciales y finales de Mg y de Ca, en ambos grupos de pacientes, y luego, entre los grupos, se compararon mediante el test no paramétrico de Wilcoxon Mann-Whitney para muestras independientes.
Para todas las pruebas de hipótesis se fijó un nivel de significación α=0,05.
RESULTADOS
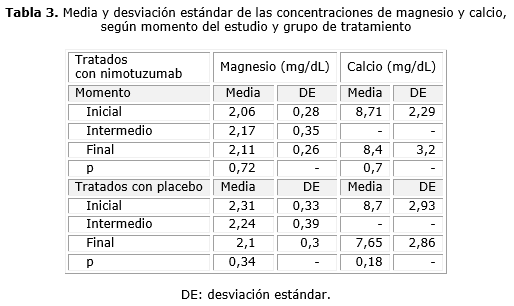
Las características antropométricas, demográficas y de función renal de ambos grupos de pacientes fueron absolutamente superponibles; no se halló ningún desbalance entre ellos como puede apreciarse en las tablas 1 y 2.
De forma general, se pudiera caracterizar a los individuos que formaron parte del estudio como sujetos mayores de 60 años, con predomino de hombres blancos, con una valoración nutricional normal y de superficie corporal mediana.
El ClCr corregido para la superficie corporal, como marcador de función renal, en ambos grupos mostró valores promedios por encima de 85 mL/min/1,73 m2 SC.
Al comparar los niveles de Mg en los pacientes del grupo 1 (tratados con nimotuzumab) a lo largo del estudio (tabla 3), se evidencia que sus valores no se modificaron de forma significativa; del inicio a las 3 sem de tratamiento hubo un ligero incremento en el promedio de los valores de 2,06 a 2,17 mg/dL, que luego disminuyó a 2,11 mg/dL al final del tratamiento. Estas ligeras modificaciones numéricas fueron intrascendentes estadísticamente (p= 0,72).
El Ca tuvo un comportamiento semejante en los pacientes del grupo 1 (tabla 3); al comparar los niveles iniciales, con aquellos al concluir el tratamiento, se observa una muy ligera disminución de la media de los valores, de 8,71 a 8,4 mg/dL, que no tuvo significación estadística (p= 0,70).
Cuando se analizan las modificaciones experimentadas por las concentraciones de Ca y Mg a lo largo del estudio en los pacientes del grupo 2 (tratados con placebo) (tabla 3), se encontró una ligera disminución en los valores de Mg y algo mayor para el Ca, sin que las diferencias entre las medias de concentración de los cationes en los diferentes momentos del estudio tuviera significación estadística (p= 0,34, p= 0,18, respectivamente).
A lo largo de toda la investigación no se registraron valores de Mg por debajo de 1,5 mg/dL, ni de Ca por debajo de 6 mg/dL, en ninguno de los 2 grupos de tratamiento.
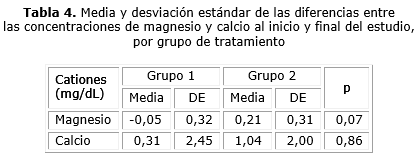
Aun cuando no se encontraron modificaciones en las concentraciones de Mg y Ca a lo largo del estudio en ninguno de los grupos de tratamiento, se compararon las diferencias en las concentraciones iniciales y finales de ambos cationes entre los dos grupos de tratamiento (tabla 4).
Tal como ocurrió en cada grupo de tratamiento, no existieron diferencias entre los grupos, en los cambios experimentados por las concentraciones de Mg y Ca en el tiempo; numéricamente fue algo mayor para el caso del grupo 2 (pacientes tratados con placebo), pero sin diferencias significativas (p= 0,07, p= 0,86, respectivamente).
DISCUSIÓN
El resultado más llamativo de este estudio es la ausencia de hipomagnesemia con el uso de nimotuzumab a una dosis de 200 mg semanales, por espacio de 6 sem. Esto no se corresponde con los resultados hallados en estudios anteriores desarrollados con otros anti-EGFR,2,3,21 que señalan que la hipomagnesemia es un efecto adverso de clase, común a todos los anti-EGFR, aun cuando se plantea que la incidencia y severidad puede variar entre los diferentes anti-EGFR.
Existe una serie de factores que pueden influir en la ausencia de hipomagnesemia con el uso de este medicamento. Se ha encontrado que a medida que se prolonga el tratamiento con anti-EGFR es más probable la ocurrencia de hipomagnesemia y esta suele ser de mayor severidad. El hecho de que la administración del nimotuzumab en el ensayo clínico a partir del que se hizo el presente estudio solo durara 6 sem, pudo estar en relación con la ausencia de hipomagnesemia en los 2 primeros meses, lo cual deja abierta la posibilidad de su aparición con una utilización más prolongada del fármaco, aunque en reportes anteriores desarrollados con otros anti EGF-R, la aparición de la hipomagnesemia tiene lugar tempranamente.2,3 Así, se ha hallado que la pendiente de la caída de las concentraciones séricas de Mg con el uso de los anti EGFR tiene una distribución normal; esto ha permitido que a partir de 3 puntos (concentraciones al inicio, a las 4 sem y 8 sem de tratamiento) se pueda predecir la pendiente de la caída de las concentraciones de Mg de los sujetos en el tiempo.2 En el presente estudio en que las mediciones de Mg se hicieron al inicio, a las 3 sem y a las 6 sem de tratamiento (un período solo algo más breve que el modelo para predecir la pendiente de la caída) no se encontró una disminución de las concentraciones de Mg que permitieran presuponer una caída ulterior de la magnesemia con el uso continuado del fármaco.
Además, se ha encontrado una mayor disminución en los niveles de Mg en la medida que los sujetos tienen mayor edad;2 el hecho que la edad media de los pacientes tratados con nimotuzumab supere los 65 años hace pensar que la población tratada tenía un riesgo elevado de hipomagnesemia y aun así no la desarrolló. Del mismo modo, la ausencia de disfunción renal en los participantes permite plantear que los cambios de las concentraciones de Ca y Mg a lo largo del estudio, no están lastradas por el deterioro funcional renal.
Estos elementos hacen creer que ciertas características del fármaco y de su interacción con su diana, que se explicarán a continuación, pudieran tener relación con la ausencia de hipomagnesemia. El nimotuzumab es un anticuerpo monoclonal, que fue originalmente aislado como un anticuerpo murino IgG2, el cual luego fue humanizado con lo que se consiguió disminuir su inmunogenicidad y enlentecer su aclaramiento del organismo.22 Este anticuerpo inhibe el EGFR al unirse al dominio III de la región extracelular del EGFR, con una constante de disociación (Kd) de 4,51 × 10-8 M.23 Su capacidad de inhibición del EGFR depende del nivel de expresión de los EGFR en los tejidos.24 Esto parece ser debido a que el nimotuzumab requiere para su acción de una unión bivalente (con ambos brazos) a las células tumorales con una expresión de EGFR por encima de cierto umbral; de este modo, el nimotuzumab presenta una unión preferente a aquellas células con una expresión moderada a alta de EGFR.16
Esta característica de unión preferente a aquellas células con alta expresión de EGFR, se ha utilizado para explicar la pobre toxicidad cutánea de este medicamento con respecto al resto de los de su clase.14,15
En el riñón, el EGFR se expresa en la membrana basolateral de las células tubulares, particularmente en el TCD, donde al unirse al EGF, determina un incremento en el número y actividad de los TRPM6 (canales de Mg) al nivel de la membrana luminal de la célula, lo que resulta en un aumento en la reabsorción tubular de Mg; la forma en la que la unión del EGFR a su ligando determina su efecto sobre los TRPM6 no está bien dilucidada, aunque se han involucrado numerosas cascadas de señalización que incluyen la kinasa regulada por señales extracelulares, proteína kinasa A, proteína kinasa C, las vías de las fosfolipasas C y D, entre otras.9 Se debe tener en cuenta que la expresión de EGFR al nivel del TCD normal parece encontrarse por debajo del umbral necesario para que ocurra una unión robusta del nimotuzumab al epítope de EGFR que reconoce e impida la expresión luminal de los TRPM6.14,15
Otra explicación viene dada por el hecho que el nimotuzumab al unirse al EGFR impide la unión de este a su ligando (EGF) y con ello evita la activación del EGFR dependiente de su unión al EGF; sin embargo, existe un nivel de activación del EGFR que es independiente de su unión a su ligando, la cual no es inhibida por el nimotuzumab, pues permite que el EGFR adopte una conformación activa, de modo que el nimotuzumab parece no interferir con los niveles basales de señalización dependientes del EGFR,25 lo que garantizaría una expresión adecuada de TRPM6 a nivel de la membrana luminal del TCD y con ello una reabsorción apropiada de Mg.
Debido a la ausencia de hipomagnesemia hallada en este trabajo, no parece recomendable la suplementación con Mg en el tratamiento con nimotuzumab, tal como se ha recomendado con el uso de otros anti-EGFR. Además, el nimotuzumab parece un buen candidato para terapias combinadas que incluyan el uso de cisplatino u otros medicamentos que influyan en el manejo renal del Mg, pues no favorecería la ocurrencia de hipomagnesemia propiciada por estos otros fármacos.
Se ha planteado que los anti-EGFR pueden ejercer su efecto antitumoral, no solo al inhibir la vía del EGFR, sino también al inducir hipomagnesemia, pues la disminución del Mg inhibe la angiogénesis actuando directamente al nivel de las células endoteliales e indirectamente, al afectar la señalización a partir del EGFR que permite la producción de moléculas angiogénicas.26 Esto ha llevado a algunos investigadores a cuestionarse si es recomendable o no el tratamiento de la hipomagnesemia no severa en los pacientes con cáncer.27 Sin embargo, la ausencia de hipomagnesemia con el uso de nimotuzumab hace que no se pueda plantear este mecanismo de acción para el nimotuzumab, pues con tratamientos por un período no mayor de 6 sem, tal como el de nuestro estudio en que no se ha encontrado hipomagnesemia, el nimotuzumab ha demostrado fehacientemente su actividad antitumoral.13,28
Otro resultado de esta investigación es la ausencia de hipocalcemia, la cual habitualmente en el contexto del uso de anti-EGFR ocurre de forma secundaria a la hipomagnesemia (sobre todo severa) que impide la secreción de PTH y la movilización de calcio del hueso.2 Resulta evidente que en ausencia de hipomagnesemia no era de esperar la ocurrencia de hipocalcemia secundaria en este estudio, aunque se debe hacer notar que este trabajo también muestra la ausencia de efectos directos del nimotuzumab sobre el metabolismo del calcio.
Este estudio, si bien tiene la limitación de haber sido desarrollado en pacientes que llevaron tratamiento con nimotuzumab por 6 sem, que es un período relativamente corto, muestra la ausencia de hipomagnesemia e hipocalcemia secundaria con su utilización.
Se concluye que no hay evidencias para plantear que el nimotuzumab cause hipomagnesemia e hipocalcemia secundaria en cursos de tratamiento de 200 mg semanales por 6 sem. La ausencia de hipomagnesemia pudiera corresponder a causas relacionadas con las características del fármaco y de la unión a su diana.
REFRENCIAS BIBLIOGRÁFICAS
1. Schrag D, Chung KY, Flombaum C, Saltz L. Cetuximab therapy and symptomatic hypo magnesemia. J Natl Cancer Inst. 2005;97:1221-4.
2. Tejpar S, Piessevaux H, Claes K, Piront P, Hoenderop JG, Verslype C, Van Cutsem E. Magnesium wasting associated with epidermal-growth factor receptor-targeting antibodies in colorectal cancer: a prospective study. Lancet Oncol. 2007;8:387-94.
3. Wilding G, Lombardo J. Cetuximab-induced hypomagnesemia in patients with colorectal cancer. Clin Colorectal Cancer. 2006;6:152-6.
4. Jahnen-Dechent W, Ketteler M. Magnesium basics. Clin Kidney. J 2012;5(Suppl 1):i3-i14.
5. Houillier P. Mechanisms and regulation of renal magnesium transport. Annual review of physiology. 2014;76:411-30.
6. Ferre S, Hoenderop JG, Bindels RJ. Insight into renal Mg2+ transporters. Curr Opin Nephrol Hypertens. 2011;20:169-76.
7. Geiger H, Wanner C. Magnesium in disease. Clin Kidney J. 2012;5(Suppl 1):i25-i38.
8. Groenestege WM, Thebault S, van der Wijst J, van den Berg D, Janssen R, Tejpar S, et al. Impaired basolateral sorting of pro-EGF causes isolated recessive renal hypomagnesemia. J Clin Invest. 2007;117:2260-7.
9. Thebault S, Alexander RT, Groenestege WM, Hoenderop JG, Bindels RJ. EGF Increases TRPM6 Activity and Surface Expression. J Am Soc Nephrol. 2009;20:78-85.
10. Quinn SJ, Thomsen AR, Pang JL, Kantham L, Bräuner-Osborne H, Pollak M, et al. Interactions between calcium and phosphorus in the regulation of the production of fibroblast growth factor 23 in vivo. Am J Physiol Endocrinol Metab. 2013;304(3):E310-E320.
11. Rivera F, Vega-Villegas ME, López-Brea MF, Márquez R. Current situation of Panitumumab, Matuzumab, Nimotuzumab and Zalutumumab. Acta Oncológica. 2008;47:9-19.
12. Allan DG. Nimotuzumab: Evidence of clinical benefit without rash. Oncologist. 2005;10:760-1.
13. Crombet T, Osorio M, Cruz T, Roca C, del Castillo R, Mon R, et al. Use of the humanized anti-epidermal growth factor receptor monoclonal antibody h-R3 in combination with radiotherapy in the treatment of locally advanced head and neck cancer patients. J Clin Oncol. 2004;22:1646-54.
14. Boland WK, Bebb G. Nimotuzumab: a novel anti-EGFR monoclonal antibody that retains anti-EGFR activity while minimizing skin toxicity. Expert Opin Biol Ther. 2009;9(9):1199-206.
15. Garrido G, Rabasa A, Gracia E. Binding properties of the anti-EGFR monoclonal antibody, Nimotuzumab, limit its interaction with the EGFR in renal and epidermal cells. AACR 100th Annual Meeting, 2009 (abstract 2763). [citado 26 Abr 2014]. Disponible en: http://www.ymbiosciences.com/upload_files/nimo_poster_AACR2009.pdf
16. Tikhomirov I, Garrido G, Rabasa A, Pérez R. Differences in clinical safety profiles of Nimotuzumab and cetuximab, EGFR-targeting antibodies, as a consequence of divergent monovalent/bivalent binding profiles of these agents. Annals of Oncology. 2009;20(Suppl 3):iii32–iii35.
17. Osorio Rodríguez M, Cruz Rivero T, del Castillo Bahi R, Roca Muchuli C, Azcue Bilbao M, Neninger Vinageras E, et al. Nimotuzumab plus radiotherapy for unresectable squamous-cell carcinoma of the head and neck. Cancer Biology & Therapy. 2010;9:343-49.
18. Cockroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16:31-41.
19. Garrow JS, Webster J. Quetelet's index (W/H2) as a measure of fatness. Int J Obes. 1985;9:147-53.
20. Bushinsky DA, Monk RD. Electrolyte quintet: Calcium. Lancet. 1998;352:306.
21. Van Cutsem E, Peeters M, Siena S. Panitumumab significantly improves progression-free survival in patients with metastatic colorectal cancer. Ann Oncol. 2006;17:vi19–vi27 (O 027).
22. Mateo C, Moreno E, Amour K. Humanization of a mouse monoclonal antibody that blocks the epidermal growth factor receptor: recovery of antagonistic activity. Immunotechnology. 1997;3(1):71-81.
23. Arteaga ME, Ledón N, Casacó A. Systemic and skin toxicity in Cercopithecus aethiops sabaeus monkeys treated during 26 weeks with a high intravenous dose of the anti-epidermal growth factor receptor monoclonal antibody Nimotuzumab. Cancer Biol Ther. 2007;6(9):1390-5.
24. Akashi Y, Okamoto I, Iwasa T. Enhancement of the antitumor activity of ionising radiation by nimotuzumab, a humanised monoclonal antibody to the epidermal growth factor receptor, in non-small cell lung cancer cell lines of differing epidermal growth factor receptor status. Br J Cancer. 2008;98:749-55.
25. Talavera A, Friemann R, Gómez-Puerta S. Nimotuzumab, an Antitumor Antibody that Targets the Epidermal Growth Factor Receptor, Blocks Ligand Binding while Permitting the Active Receptor Conformation. Cancer Res. 2009;69:(14):5851-9.
26. Vincenzi B, Santini D, Tonini G. Biological interaction between anti-epidermal growth factor receptor agent cetuximab and magnesium. Expert Opin Pharmacother. 2008;9(8):1267-9.
27. Wolf FI, Trapani V, Cittadini A, Maier JA. Hypomagnesaemia in oncologic patients: to treat or not to treat? Magnesium Research. 2009;22(1):5-9.
28. Reddy BK, Vidyasagar M, Shenoy K. BIOMAb EGFRTM (Nimotuzumab/h-r3) in combination with standard of care in squamous cell carcinoma of head and neck (SCCHN). Int J Radiat Oncol Biol Phys. 2007;69(3):S450.
Recibido: 29 de diciembre de 2014.
Aceptado: 6 de mayo de 2015.
Dr. Raymed Antonio Bacallao Méndez. Instituto de Nefrología “Dr. Abelardo Buch López”, Ave. 26 y Boyeros, Municipio Plaza. La Habana, Cuba.
Correo electrónico: raymed@infomed.sld.cu