Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med vol.55 no.3 Ciudad de la Habana jul.-set. 2016
TEMA ACTUALIZADO
Inhibidores de la dipeptidil peptidasa 4 y una nueva estrategia farmacológica en la diabetes mellitus tipo 2
Inhibitors of dipeptidil peptidase 4 new pharmacologic strategic in the diabetes mellitus type 2
Ernesto Alfonso Figueredo, Félix Andrés Reyes Sanamé, María Luisa Pérez Álvarez, Yoannis Batista Acosta, Yudith Peña Garcell
Hospital General Docente "Dr. Guillermo Luis Fernández Hernández Baquero". Moa, Holguín, Cuba.
RESUMEN
La diabetes mellitus sigue siendo una enfermedad temible. El uso adecuado de la farmacoterapia para el control metabólico, ayudaría a disminuir la incidencia de complicaciones. Actualmente se dispone de variados grupos farmacológicos para el control temporal de las cifras de glucemias de pacientes con diabetes mellitus tipo 2, entre ellos están los inhibidores de la dipeptidil peptidasa 4 caracterizados por estimular el aumento de la concentración del péptido similar a glucagón tipo 1 GLP-1 y la secreción de insulina en la célula beta del islote pancreático. La eficacia, en términos de hemoglobina glucosilada, ha mostrado ser inferior a la de la insulina, pero sin el potencial del peligro de hipoglucemia, así como el efecto neutro o la disminución del peso corporal. Se realizó esta revisión bibliográfica con el objetivo de actualizar los conocimientos sobre el papel de las sustancias con acción incretinas en el control metabólico de los pacientes con diabetes mellitus tipo 2 y específicamente la acción de los IDPP4, ya que es creciente el problema de dicha enfermedad y se requiere, cada vez más, una mejor información de los fármacos a utilizar, aunque en el futuro los datos obtenidos concluirán su efectividad.
Palabras clave: diabetes mellitus de tipo 2; incretinas; dipeptidil peptidasa 4; péptido relacionado con el glucagón 1 (Glp-1).
ABSTRACT
Diabetes mellitus remains a fearsome disease. Proper use of pharmacotherapy for metabolic control, would help reduce the incidence of complications. Currently there are various pharmacological groups for temporary control of blood glycemia of patients with diabetes mellitus type 2. One of them is dipeptidyl peptidase-4 inhibitor characterized by stimulating increased concentration like peptide glucagon type 1 GLP -1 and insulin secretion in pancreatic islet beta cell. The effectiveness in terms of glycosylated hemoglobin has shown to be less than that of insulin, but without the potential danger of hypoglycaemia and the neutral effect or decrease in body weight. These facts prompt this literature review which was conducted to update the knowledge on the role of substances with incretin action in the metabolic control of patients with diabetes mellitus type 2, specifically the action of IDPP4, as this disease is an growing problem requiring better information on drug use.
Keywords: diabetes mellitus type 2; incretins; dipeptidyl peptidase 4; glucagon-related peptide 1 (Glp-1).
INTRODUCCIÓN
La diabetes mellitus tipo 2 (DM2) es una enfermedad crónica, con una alta prevalencia. Las complicaciones microvasculares y macrovasculares incrementan la morbilidad y la mortalidad relacionadas con la enfermedad, reducen la calidad de vida de los pacientes y generan un elevado gasto para el Sistema Nacional de Salud (SNS).1
Es una enfermedad de carácter degenerativo, aún sin curación, pero controlable. Desafortunadamente, la frecuencia por esta causa está creciendo de manera muy importante en todas las edades y sobre todo en países en vías de desarrollo por los incrementos del sobrepeso y de la obesidad, además del sedentarismo. Se estima que existen aproximadamente 170 millones de personas en todo el mundo con diabetes (90 a 95 % de los casos de diabetes son DM2) y se espera que ese número aumente aproximadamente a 366 millones para el 2030.2
En la patogenia de la diabetes mellitus tipo 2 intervienen múltiples defectos, hecho que ha dado lugar a que continúen investigándose sustancias que sean capaces de corregir estos defectos y mejorar el control de la glucemia. A medida que transcurre el tiempo, la cronicidad de la diabetes mellitus tipo 2 se acompaña de la declinación progresiva en la función de la célula β. En consecuencia, los fármacos convencionalmente prescritos para el tratamiento de los pacientes diabéticos pierden eficacia y exhiben gradualmente un amplio número de limitaciones, incluidos el aumento en el riesgo de episodios de hipoglucemia, efectos cada vez más prominentes en la ganancia de peso corporal y la inducción de eventos adversos de tipo gastrointestinal, edema e incluso insuficiencia cardiaca.3
Sin lugar a dudas, existe una "dimensión epidémica" de la DM2 en las últimas décadas, para convertirse en un auténtico problema de salud e importante reto asistencial por su elevado impacto en el uso de los recursos sanitarios requeridos en su tratamiento, así como en la prevención y el cuidado de las complicaciones propias de esta enfermedad, las cuales constituyen causa principal de su morbilidad y mortalidad.4,5
Se estima que, en Latinoamérica, el número de personas con diabetes aumentará un 67 % en el período 2010 - 2030. En Cuba existe casi medio millón de pacientes con DM2; se considera la segunda enfermedad crónico-degenerativa que más afecta a los adultos.6,7
En el variado arsenal terapéutico de la DM2, se encuentran los que consiguen reproducir o potenciar el efecto de las incretinas. Estos novedosos fármacos han sido autorizados para el tratamiento, solos o en combinación con otros antidiabéticos orales, sin embargo, se necesita realizar ensayos clínicos que intenten demostrar si este grupo de medicamentos pudiera tener cierta eficacia en prevenir la aparición de la diabetes en las personas con estados de prediabetes.8 Las incretinas son hormonas intestinales liberadas al torrente circulatorio en respuesta a la ingestión de nutrientes. Participan en la homeostasia de la glucemia, regulando la secreción de insulina y glucagón de manera dependiente de la glucosa.9
El concepto de incretinas surgió a inicios del siglo XX cuando Bayliss y Starling publicaron, en 1902, el artículo titulado "El mecanismo de la secreción pancreática".10
Ante esta situación, el papel del médico de familia se antoja más importante que nunca. Se encuentra frente a un importante vademécum para el tratamiento de la diabetes, donde novedades terapéuticas han ido enriqueciendo las posibilidades de individualización basadas fundamentalmente en la comorbilidad de cada paciente.11
Estar al tanto de todos los grupos farmacológicos que se utilizan en esta enfermedad constituye un reto para el profesional que atiende día a día a estos enfermos en las diferentes unidades de salud, la necesidad de conocer la existencia de nuevos grupos de medicamentos como los inhibidores de la dipeptidil peptidasa 4 (IDPP4) favorecería el tratamiento de este padecimiento.12 Se pretende, entonces, que esta revisión constituya una fuente de información para actualizar a todo profesional de salud que enfrenta cada día esta terrible enfermedad.
DESARROLLO
Se realizó una búsqueda, en español e inglés, en las bases de datos Scielo, EBSCO, PudMed, Clinical Key y CUMED donde se analizó la situación actual del tratamiento de la DM2 y se halló que existe un gran arsenal de fármacos para su control, sin embargo, las evidencias indican que los fármacos IDPP4 presentan un futuro prometedor en el tratamiento de esta compleja enfermedad. El desarrollo de los inhibidores de la enzima dipeptidil peptidasa tipo 4 GLP-1 (DPP-4), ha revolucionado durante la década actual el tratamiento de la DM2, debido a que estos agentes son eficaces para disminuir la glucosa, de manera que es improbable que produzcan hipoglucemia y, en modelos animales, se ha demostrado que pueden evitar la declinación progresiva en la función de la célula β y preservar la capacidad secretora de insulina. Además, no elevan el riesgo de hipoglucemia o de incremento del peso corporal. Estas características hacen de los inhibidores de la DPP-4 agentes idóneos para el tratamiento de estos pacientes, a largo plazo.13
La diabetes es el paradigma de las enfermedades crónicas, por su larga evolución, por su asociación a otros trastornos metabólicos y por la complejidad de su tratamiento que precisa la colaboración activa del paciente.14
El objetivo de la terapia en el diabético tipo 2 se ha definido de acuerdo a la HbA1c, que es un reflejo de la hiperglucemia crónica. La terapia debe ajustarse según el nivel presentado por el paciente.15
La elección del tratamiento farmacológico depende principalmente de su potencia en el control glucémico y de los factores de riesgo cardiovascular, así como de las complicaciones y del riesgo de efectos adversos (EA) que presente.1
LA DIPEPTIDIL PEPTIDASA 4
La DPP-4 es una glucoproteína de 766 aminoácidos transmembrana, también conocida como adenosina desaminasa o CD26. Los inhibidores de la DPP-4 son cianopirrolidinas con interacciones clave con el complejo de la DPP-4 que permiten la inhibición competitiva. La DPP-4 se expresa en la superficie de varios tipos de células, incluyendo monocitos y linfocitos. Es una enzima aminopeptidasa sérica que inactiva la GLP-1, el GIP y otras proteínas in vivo a través de la escisión del dipéptido aminoácido N-terminal. La dimerización de la proteína es necesaria para la actividad catalítica y la función de la enzima depende de su glucosilación.16
Son varios los sustratos de la DPP-4 e incluyen péptidos que contienen prolina o alanina, tales como factores de crecimiento, quimioquinas, neuropéptidos y péptidos vasoactivos. La inhibición de la enzima DPP-4 también modula la actividad de varios factores cardioactivos, neuropéptidos y células estromales derivadas del factor-1 (SDF-1). Por su afinidad para una amplia gama de sustratos, la DPP-4 no es específica para GLP-1 y, por lo tanto, tiene el potencial para mediar una amplia gama de efectos pleiotrópicos (tanto positivos como negativos), independientes de GLP-1. Otros ejemplos de enzimas con actividad similar a DPP-4 incluyen la proteína de activación de fibroblastos, DPP-2, DPP-8 y DPP-9; por lo tanto, se cree que los inhibidores de la DPP-4 son selectivos para esta, pero que además podrían ser inhibidores de otras enzimas similares a la DPP-4.17
Estos fármacos deben reservarse para sus afecciones primarias y no ser utilizados específicamente para reducir la resistencia insulínica.18
LOS INHIBIDORES DE LA DIPEPTIDIL PEPTIDASA 4
- Mecanismo de acción
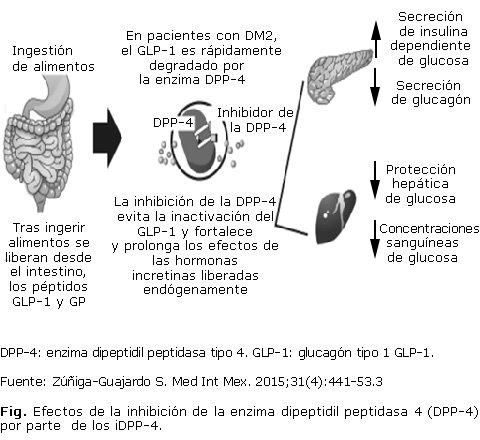
Estos fármacos se unen a la enzima DPP-4 e inhiben de una forma reversible la hidrólisis de las incretinas endógenas, con el consiguiente aumento tanto de GIP como de los niveles de GLP-1 plasmático, así como la potenciación de su acción, lo que produce un aumento de la respuesta insulínica y una disminución de la secreción de glucagón.
Por consiguiente, el aumento de la concentración de GLP-1 en plasma es el efecto farmacológico de los IDPP-4, que finalmente se traduce en lo siguiente: al nivel de las células β del páncreas aumenta la síntesis de insulina, estimula el crecimiento de esta célula y evita la apoptosis.19
En esencia, su mecanismo de acción consiste en inhibir competitivamente la enzima DPP-4, con lo que logra concentraciones fisiológicas en sangre y, por ende, aumenta los niveles de las hormonas incretinas.8,17 Evita la inactivación de GLP-1 para, de ese modo, potenciar y prolongar los efectos de la liberación endógena de esta hormona, además de incrementar la exposición a ella y, por tanto, sus efectos en el islote pancreático. Como resultado del efecto inhibidor de tal enzima.20
- Efectos biológicos (fig.)
Se logró demostrar que los inhibidores de los DPP4 disminuyen los eventos de riesgo cardiovascular cuando se emplean por tiempo prolongado en contraste con los fármacos de uso habitual como las sulfonilureas, tiazolidinedionas (roziglitazona) e insulina.21
Ejercen cambios sobre el perfil de lípidos (disminución de triglicéridos) y cambios mínimos o neutros en la presión arterial.22
Disminuyen la producción de glucagón e incrementan las concentraciones de insulina y de péptido C de tal manera que estos efectos se traducen en disminución de la concentración de glucosa plasmática de ayuno y de glucosa plasmática posprandial y tienen como resultado una reducción en la HbA1c.23
Mejoran sustancialmente el control glucémico en ayuno y posprandial.24 A diferencia del tratamiento con tales agentes convencionales, los IDPP-4 parecen ser eficaces para evitar la progresiva declinación en la función de la célula β, preservar la capacidad secretora de insulina y no afectar el peso corporal. Estas características los convierten en agentes idóneos para el tratamiento a largo plazo de los pacientes con DM2.12
- Efectos extraglucémicos
En diferentes estudios, los IDPP-4 han demostrado efectos antioxidantes y antiinflamatorios, atenúan las complicaciones cardiovasculares de la diabetes; linagliptina y alogliptina son los IDPP-4 que han demostrado mayor potencia vasodilatadora directa.12
En general, los IDPP-4, el grupo farmacológico en el que se ubica linagliptina, tienen pocas o nulas interacciones medicamentosas; no alteran significativamente la farmacocinética de los agentes con los que actúan, y viceversa.25
- Acciones 20,26
• Reducción de la hemoglobina glucosilada (HbA1) en 0,5 - 0,8 %.
• Aumentan los niveles basales y prandiales de GLP-1.
• Reducen la glucosa basal y prandial.
• Mejoran la función beta y alfa pancreática en la DM2.
• Incrementan la masa de células beta (en animales de experimentación).
• Aumentan la sensibilidad a la insulina.
• No incrementan el peso.
• Bajo riesgo de hipoglucemia.
• Potenciales efectos beneficiosos cardiovasculares.
Principales efectos adversos
Pueden aparecer molestias gastrointestinales, como náuseas, y reacciones de hipersensibilidad, entre las que se cuentan la urticaria, el edema facial, el angioedema e, incluso, se ha descrito la aparición del síndrome de Stevens-Johnson.26
Con base en sus respectivas estructuras moleculares, los IDPP-4 pueden clasificarse en los que imitan a la molécula de DPP-4 (peptidomiméticos: vildagliptina y saxagliptina) y los que no la imitan (no peptidomiméticos: linagliptina, sitagliptina y alogliptina).27
FÁRMACOS IDPP4
Sitagliptina 19,28-31
Es un IDPP-4 altamente selectivo, fue aprobado por la FDA en el año 2006 y está disponible la presentación oral sola o combinada con metformina.
- Farmacodinamia y farmacocinética
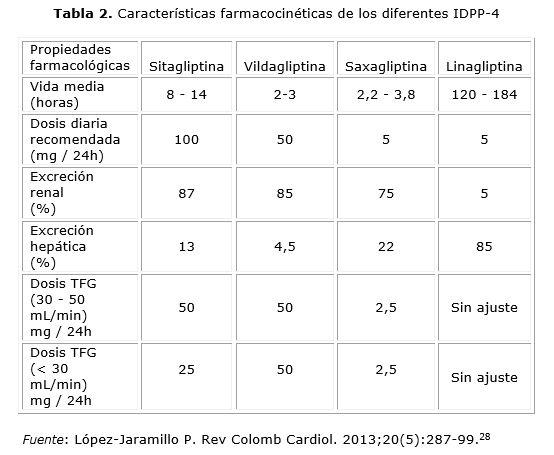
La acción inhibitoria sobre la DPP-4 es dosis dependiente. Tiene una biodisponibilidad del 87 %, unión a proteínas del 34 - 46 %, una vida media de 10 -12 horas, la eliminación es principalmente renal (75 - 80 %) y el resto es metabolizado por los citocromo (CYP): CYP3A4 y CYP2C8; por lo que presenta interacción medicamentosa con algunos fármacos, entre los que se encuentran: macrólidos, antirretrovirales, antidepresivos, bloqueadores de canales de calcio, esteroides, entre otros). En pacientes con deterioro de la función renal la sitagliptina requiere ajuste de dosis; por tanto, el clínico debe calcular la tasa de filtración glomerular (TFG) por medio de la fórmula de Cockroft y Gault. En el caso de TFG de 30 - 50 mL/min se disminuye 50 % de la dosis y si es menor de 30 mL/min, 25 %. En el caso de insuficiencia hepática leve a moderada (Child-Pugh A o B) su farmacocinética no se altera y podría utilizarse con precaución en la insuficiencia severa.
- Efectividad clínica
Se han desarrollado varios estudios para evaluar la efectividad de la sitagliptina en monoterapia o en combinación con otros agentes antidiabéticos. Como monoterapia contra placebo, se ha mostrado que disminuye de manera estadísticamente significativa los valores de HbA1c, glucemia basal y posprandial las 12, 18 y 24 sem; en tanto que el mayor beneficio se evidenció en pacientes con HbA1c por encima de 9 %. Al evaluar la sitagliptina en terapia combinada con metformina vs. metformina sola, se encontró que ambas intervenciones disminuyen los valores de HbA1c, glucosa en ayunas y posprandial; no obstante, el efecto era mayor en los paciente que recibían terapia combinada, de igual manera, en pacientes que recibían pioglitazona al adicionar sitagliptina, se logró llevar a la meta de HbA1c < 7 % a más sujetos. Asimismo, al comparar la metformina vs. la sitagliptina en un meta-análisis, esta última demostró ser inferior en mejorar la sensibilidad a la insulina, pero los dos medicamentos tienen efecto similar en control de peso, disminución de la HbA1c, y la función de la célula β. La reducción de HbA1c como monoterapia puede ser de hasta 0,94 % y puede haber una reducción adicional hasta 1,1 % cuando se usa en terapia combinada con insulina. Además, la sitagliptina ha sido comparada con vildagliptina y algunos estudios sugieren superioridad de esta última en desenlaces como control glucémico circadiano con disminución significativa de hiperglucemias.
- Seguridad y efectos adversos
La sitagliptina es segura y bien tolerada con bajo riesgo de hipoglucemia y efecto nulo en el peso. Se han reportado pocos efectos adversos como: nasofaringitis, infecciones del tracto respiratorio superior, cefalea, lumbalgia, osteoartritis, dolor en extremidades, aumento del conteo leucocitario, de los niveles de ácido úrico y discreta disminución de la fosfatasa alcalina. Sin embargo, esto no ha representado un mayor riesgo de hospitalización por todas las causas en estudios retrospectivos, aunque aún hay controversia en la posible asociación del uso de sitagliptina con mayor riesgo de hospitalización por falla cardiaca .Entre 2006 y 2009, se reportaron 88 casos de pancreatitis, en los que no hay claridad sobre el mecanismo fisiopatológico; sin embargo, un meta-análisis evidenció que con el uso del fármaco el efecto adverso de pancreatitis es igual en frecuencia que el que alcanzaron quienes emplearon un placebo.
En este sentido, se han reportado reacciones de hipersensibilidad como: angioedema, condiciones cutáneas exfoliativas, anafilaxis y hay un reporte de caso de reacción medicamentosa con eosinofilia y síntomas sistémicos.
En resumen, la sitagliptina no es superior a la metformina disminuyendo la HbA1c, pero se puede administrar en caso de enfermedad renal crónica (ERC) con ajuste de dosis y en insuficiencia hepática, sin ajuste, tiene efecto nulo en el peso, tiene efecto positivo sobre la célula β y es importante tener en cuenta la interacción medicamentosa dado su metabolismo por el CYP450. Se están llevando a cabo estudios para evaluar la seguridad cardiovascular.
Sitagliptina, puede disminuir el remodelamiento y la disfunción cardíaca posterior a infarto.
Vildagliptina 27,32-37
La vildagliptina es un IDPP-4 selectivo. Fue aprobado por la agencia europea de medicamentos en el año 2008 y pertenece al grupo de las cianopirrodilidionas y los péptido-miméticos.
- Farmacodinamia y farmacocinética
Con respecto a la farmacodinamia, la vildagliptina tiene acción sobre otras enzimas DPP como la 8, 9 y la proteína activadora de fibroblastos. Además, produce una inhibición reversible de la DPP-4, al formar un enlace covalente sobre el residuo de serina. Se administra por vía oral, en aproximadamente 1,5 horas; tiene una biodisponibilidad del 85 %; con dosis de 100 mg a los 45 min bloquea el 95 % de la actividad de la DPP-4 durante 12 horas. El volumen de distribución es aproximadamente de 71 L y se une a proteínas en 9,3 %. En pacientes con función renal normal, la vida media es de 2 a 3 horas, pero el efecto del medicamento perdura durante más tiempo, dado el bloqueo competitivo y de la disociación lenta sobre la enzima. Adicional a esto, se metaboliza a través de la hidrólisis, con poca participación del CYP-450, lo cual es atractivo para uso en pacientes poli-medicados. Hasta el momento no se han encontrado interacciones medicamentosas con los antidiabéticos tradicionales, antihipertensivos o medicamentos de rango terapéutico estrecho como la warfarina o la digoxina. Su excreción se produce principalmente a nivel renal, con un porcentaje de eliminación hepática del 13 %. En cuanto a la farmacocinética, en pacientes con ERC se encontró que la concentración de vildagliptina no aumenta con el deterioro renal, como sí lo hace su metabolito inactivo hidrolizado, el LAY 151. Por lo que se recomienda la utilización de una sola dosis de 50 mg / día en pacientes con TFG por debajo de 50 mL/min. En un estudio retrospectivo con 15 pacientes sometidos a diálisis peritoneal y hemodiálisis, el uso de vildagliptina estuvo asociado a una reducción, significativamente estadística, de HbA1c y albúmina glucosilada; sin embargo, no se midieron eventos adversos. Por otra parte, un meta-análisis de vildagliptina en monoterapia o terapia combinada, en pacientes con ERC, no encontró aumento de los efectos adversos en esta población. De hecho, se han realizado comparaciones aleatorizados de vildagliptina contra placebo en pacientes con ERC de diferentes estadios, sin encontrar una asociación entre su uso y un mayor número de reacciones adversas. Ahora bien, en insuficiencia hepática de leve a severa no hay alteración de los parámetros farmacocinéticas, ni mayor grado de reacciones adversas; sin embargo, no se ha probado su uso, dado el antecedente de elevación de transaminasas en casos aislados.
- Efectividad clínica
La eficacia clínica de la vildagliptina ha sido demostrada tanto en monoterapia como en terapia combinada con antidiabéticos orales e insulina. Existen tres estudios que evalúan la efectividad de vildagliptina como monoterapia, en ellos se demostró una reducción de la HbA1c de aproximadamente 1 %, sin evidencia de aumento de peso o hipoglucemia. Asimismo, se intentó evaluar la no inferioridad en relación con la metformina, pero no se obtuvieron resultados concluyentes. La reducción de la HbA1c fue del 1 % en promedio para vildagliptina y 1,4 % para la metformina. De igual manera, no se ha encontrado que sea inferior a las tiazolindenionas o sulfonilureas.
En cuanto a la terapia combinada, la adición de vildagliptina al tratamiento de pacientes no controlados en monoterapia -con metformina, glimepiride, pioglitazona o insulina- resultó en una disminución adicional de la HbA1c. Estos hallazgos son congruentes con el estudio EDGE, el cual evaluó de forma prospectiva, en más de 45 000 pacientes, la efectividad de la adición de vildagliptina como segunda línea de tratamiento y se observó disminución de la HbA1c en todas las combinaciones. Seguridad y efectos adversos vildagliptina es un medicamento seguro, no hay reportes de eventos adversos graves. Se ha asociado a angioedema en pacientes que consumen inhibidores de la enzima convertidora de angiotensina II (IECA), sin reportes de anafilaxia. Existe una alerta de seguridad en pacientes con elevación de las transaminasas, por lo que en insuficiencia hepática su prescripción está en entredicho. En un meta-análisis de estudios clínicos aleatorizados no se encontró asociación de vildagliptina con desenlaces cardiovasculares mayores; está pendiente la publicación del estudio Effect of Vildagliptin on Left Ventricular Functionin Patients With Type 2 Diabetes and Congestive Heart Failure (VIVID), para valorar los efectos de vildagliptina en pacientes con falla cardiaca.
Por otra parte, este medicamento no ha sido asociado a pancreatitis ni al desarrollo de neoplasias. En síntesis, este IDPP-4 es una opción en pacientes con DM2, tanto en primera como en segunda línea de tratamiento, polimedicados, con variabilidad glucémica y en ERC. Se debe evitar su uso en pacientes con insuficiencia hepática y monitorizar aquellos que consumen IECA.
La buena tolerancia, adherencia y satisfacción a la terapia con vildagliptina, representa una ventaja terapéutica de esta clase de drogas.
Saxagliptina 2,29,38-40
Esta gliptina fue descubierta en el año 2005 y aprobada por la FDA en el año 2009. Al igual que la vildagliptina inhibe DPP-VIII, DPP-IX y la proteína de activación de los fibroblastos.
- Farmacodinamia y farmacocinética
La saxagliptina tiene una biodisponibilidad del 60 %. Esta es metabolizada hepáticamente por el CYP-450 específicamente por la enzima CYP 3A4/5, a un metabolito activo llamado 5hidroxisaxagliotina, este metabolito es también un inhibidor selectivo, reversible y competitivo de la DDP-4. Después de dos semanas, la inhibición de la DPP-4 por saxagliptina es de aproximadamente 50 a 79 %, dependiendo de la dosis. Las propiedades farmacocinéticas han sido estudiadas en pacientes con ERC, donde se demostró un perfil de seguridad del medicamento, con un ajuste de dosis a 2,5 mg / día en sujetos con TFG menor de 60 mL / min. Dado el metabolismo hepático, se debe tener en cuenta las interacciones farmacológicas con múltiples medicamentos que son sustrato del CYP-450 como: simvastatina, diltiazem, Ketoconazol, rifampicina, entre otros; sin embargo, los estudios hasta ahora sugieren que en enfermedad hepática no se requiere ajuste de dosis.
- Eficacia clínica
Este fármaco en monoterapia no es superior a metformina en cuanto a la disminución de la HbA1c, como se muestra en reportes de ensayos clínicos, donde tiene efecto de reducción hasta del 0,9 % de la HbA1c. Por su parte, en combinación con metformina por 24 sem mostró una disminución hasta del 2,5 % de HbA1c, reducción que es superior a la de cada fármaco en monoterapia.
- Seguridad y efectos adversos
La saxagliptina es generalmente segura y bien tolerada, presenta bajo riesgo de hipoglucemia. Incluso algunos estudios han reportado un riesgo igual al placebo. Con respecto a otros eventos adversos, como la pancreatitis, un meta-análisis reciente sobre la seguridad reportó igual riesgo que el placebo. Sin embargo, el estudio Saxagliptin Asses sment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus-Thrombolysis in Myocardial Infarction) demostró una relación con el aumento de hospitalización por falla cardiaca en pacientes con historia previa de ésta, ERC y péptido natriurético elevado, aunque la fisiopatología de esta asociación no está clara.
De otro lado, se ha reportado una mayor incidencia de infección urinaria e infecciones del tracto respiratorio, pero hasta el momento no hay datos que demuestren alteración del sistema inmune por ningún IDPP-4. Otros efectos son la cefalea y las reacciones dermatológicas.
Finalmente, la saxagliptina no es superior a la metformina en la disminución de la HbA1c, pero al combinarlas son más efectivas. Tiene beneficios por la farmacocinética en caso de ERC, disminución en eventos de hipoglucemia, efecto nulo en el peso y efecto positivo sobre la célula β. Además, es importante tener en cuenta el aumento en hospitalizaciones por falla cardiaca en los pacientes con este riesgo y la interacción medicamentosa dado su metabolismo por el CYP-450.
Linagliptina 41-43
La linagliptina es el más reciente de los IDPP-4, fue descubierto en el 2007 y aprobado por la FDA en el año 2011. Se encuentra disponible en algunos países para uso en pacientes adultos con DM2 para mejorar el control glucémico, ya sea como monoterapia o en asociación con metformina, sulfonilureas o tiazolidinedionas o en asociación con metformina + sulfonilureas.
- Famacodinámica y farmacocinética
Se trata de un inhibidor altamente selectivo, competitivo y reversible de la DPP-4, provee una inhibición hasta del 80 % de la enzima, es el IDDP-IV más selectivo. Se encuentra disponible en presentación oral con dosis de 5 mg (en dosis única diaria), en monoterapia o combinada con metformina. La linagliptina tiene una biodisponibilidad del 30 %, una vida media de 131 horas, debido a su unión a proteínas plasmáticas. Se elimina principalmente por vía hepática en un 85 % y en un 5 %, por vía renal, con un volumen de distribución de 1,110 L. Este medicamento no tiene variación en su farmacocinética en pacientes con ERC (incluso avanzada), por lo que no se requiere ajustar la dosis. Además, presenta metabolismo hepático mínimo, es convertida a un metabolito inactivo llamado CD1790. Como este medicamento inhibe la enzimaCYP-3A4 del CYP-450, con efecto mínimo a moderado, no tiene interacciones significativas, a excepción de la rifampicina que aumenta el metabolismo de la linagliptina.
- Efectividad clínica
La linagliptina como monoterapia mostró disminución de la HbA1c en 0,69 %, la glucemia en ayunas en 23,3 mg / dL a los 6 meses y la posprandial, 33,5 mg / dL. Cuando se utiliza en terapia combinada con metformina se logra una disminución adicional de 0,64 % de la HbA1c y de la glucemia en ayunas de 21,1 mg / dL. En combinación con pioglitazona, sulfonilureas e insulina también se obtuvo una disminución de HbA1c > 0,5 %. Asimismo, el efecto de linagliptina sobre el peso es neutro.
- Seguridad y efectos adversos
La linagliptina tiene un perfil de seguridad similar al placebo y bajo riesgo de hipoglucemia. Los eventos adversos más frecuentes reportados en 22 estudios aleatorizados fueron: cefalea (3,1 %), nasofaringitis (5,8 %) e infección del tracto respiratorio superior (3,3 %). Menos de 2,5 % de los IDPP-4: 264 personas que recibieron al menos una dosis de linagliptina reportaron tos, hiperlipidemia o aumento en el peso. Aunque aún no se disponen estudios de mortalidad o desenlaces cardiovasculares a largo plazo, en los estudios realizados hasta ahora, no se han evidenciado cambios en valores de la presión arterial ni de la frecuencia cardiaca. En un meta análisis el riesgo de eventos cardiovasculares no aumento; sin embargo, dado que se requieren más estudios, actualmente se está desarrollando el estudio CAROLINA, que compara de manera prospectiva la seguridad cardiovascular del medicamento comparado con glimepiride y el estudio CARMELINA, que evalúa desenlaces cardiovasculares y renales con linagliptina en pacientes con DM2 con alto riesgo vascular. También se estudió la incidencia de pancreatitis, la cual fue comparable cuando los pacientes fueron tratados con placebo. En resumen, linagliptina es el más reciente de los IDPP-4, tiene una vida media larga y por su metabolismo de predominio hepático es de elección en pacientes con disminución de la TFG, el medicamento aunque no es superior a metformina, para disminuir la HbA1c mantiene un efecto neutro en el peso, es relativamente seguro aunque están pendientes estudios sobre su riesgo cardiovascular. En la práctica clínica, definitivamente los IDPP-4 están indicados como monoterapia y terapia combinada de segunda y tercera líneas en pacientes mayores de 18 años con DM2 de acuerdo a las guías clínicas de la Asociación Americana de Diabetes (ADA) 2015 y la Federación Internacional de Diabetes (IDF) en las guías clínicas del 2015 y 2014, respectivamente. A continuación se presentan algunos escenarios especiales en los que los IDPP-4 pueden optimizar el control glucémico de los pacientes, para ello mostramos indicadores clínicos para su prescripción (tabla 1 ), así como las características farmacocinéticas de los diferentes IDPP-4 (tabla 2).
Los inhibidores de la DPP-4 disponibles en la actualidad incluyen sitagliptina, saxagliptina, linagliptina, vildagliptina y los más recientes, alogliptina y teneligliptina. Los tres primeros se aprobaron en los Estados Unidos y en gran parte del mundo para el tratamiento de la DM2. Ya ha sido aprobado el uso de la vildagliptina en Europa y América Latina y de la alogliptina y la teneligliptina, en Japón. Otros miembros de esta clase de medicamentos se encuentran en fase III de ensayos clínicos e incluyen dutogliptina y gemigliptina.12
Se concluye que el tratamiento con las drogas IDPP4, al producir escasos efectos adversos y una gran tolerancia por los pacientes así como un perfil favorable sobre el peso corporal, constituyen una opción terapéutica eficaz en el tratamiento de la DM2. Aunque aún se necesitan estudios y resultados en la práctica clínica que avalen el papel exacto de este grupo farmacológico como opción disponible en el tratamiento y control de esta impactante enfermedad parecen un grupo seguro en la amplia gama farmacológica con la que se cuenta en estos momentos.
Declaración de conflicto de intereses
Los autores declaran que no existe conflicto alguno para la realización ni la publicación del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Abad Paniagua EJ, Casado Escribano P, Fernández Rodríguez JM, Morales Escobar FJ, Betegón Nicolás L. Análisis de coste-efectividad de dapagliflozina en comparación con los inhibidores de la DPP4 y otros antidiabéticos orales en el tratamiento de la diabetes mellitus tipo 2 en España. Aten Primaria. 2015[citado 20 Ene 2016];47(8):505-13. Disponible en: http://www.sciencedirect.com/science/article/pii/S0212656714003904
2. Martínez Goñi K, Díaz Salazar J. Combinación en dosis fijas: una nueva opción terapéutica para la diabetes mellitus tipo 2. Med Int Mex. 2012[citado 20 Ene 2016]; 28(5):483-90. Disponible en: http://www.medigraphic.com/pdfs/medintmex/mim-2012/mim125k.pdf
3. Zúñiga-Guajardo S, Rodríguez-Gutiérrez R, Yamamoto-Cuevas J, Citlali Juárez-Comboni S. Comparación de la eficacia de los idPP-4 actualmente disponibles y ventajas anti hiperglucemiantes de linagliptina en pacientes con diabetes mellitus 2. Med Int Mex. 2015[citado 20 Ene 2016];31(4):441-53. Disponible en: http://www.medigraphic.com/pdfs/medintmex/mim-2015/mim154k.pdf
4. Lazo Roblejo Y, Lores Delgado D. Las incretinas: nueva alternativa terapéutica para el control glucometabólico de la diabetes mellitus de tipo 2. Medisan. 2012[citado 20 Ene 2016]; 16(3):445. Disponible en: http://scielo.sld.cu/pdf/san/v16n3/san15312.pdf
5. Quintero C-Cadavid CA, Otero-Regino W, Franco-Vega R. Vaciamiento gástrico y diabetes mellitus tipo 2. Rev Fac Med. 2015[citado 20 Ene 2016];63(2):271-8. Disponible en: http://www.scielo.org.co/pdf/rfmun/v63n2/v63n2a12.pdf
6. Castro-Sansores CJ, Franco-Marín AC, Martínez-Díaz G. Efecto de liraglutida en pacientes con diabetes mellitus tipo 2 no controlada con hipoglucemiantes orales. 2015[citado 20 Ene 2016];31(2):[aprox. 6 p] Disponible en: http://www.medigraphic.com/pdfs/medintmex/mim-2015/mim152c.pdf
7. Elgart JF, González L, Caporale JE, Valencia JE, Gagliardino JJ. Evaluación económica del tratamiento de diabetes tipo 2 con saxagliptina en Colombia. Medwave. 2012[citado 20 Ene 2016];2(2): [aprox. 6 p]. Disponible en: http://www.medwave.cl/medios/medwave/febrero2012/PDF/10.5867medwave.2012.02.5306.pdf
8. González Álvarez C, Muñoz Jackson G. Las hormonas incretinas y su relación con la diabetes. Rev Médica de Costa Rica y Centroamérica. 2014[citado 25 enero 2016];LXXI(612):629-35. Disponible en: http://www.medigraphic.com/pdfs/revmedcoscen/rmc-2014/rmc144c.pdf
9. Mendioza-Contreras JR, García-Álvarez J. Mecanismos neuroendocrinos de la cirugía metabólica en el tratamiento de la diabetes mellitus tipo 2. Rev Hosp Jua Mex. 2012 [citado 20 Ene 2016];79(3):187-92. Disponible en: http://www.medigraphic.com/pdfs/juarez/ju-2012/ju123i.pdf
10. Burgos LAM. Rol de las incretinas. Rev Hosp Clín Univ Chile. 2012[citado 20 Ener 2016];23(2):213-8. Disponible en: http://redhcuch.redclinica.cl/Portals/0/Users/014/14/14/Publicaciones/Revista/rol_incretinas.pdf
11. González Hidalgo E, Fagundo Becerra EM. A propósito del tratamiento actual de la diabetes mellitus en Atención Primaria. Rev Clín Med Fam. 2013[citado 20 Ene 2016]; 6(3): 120-122. Disponible en: http://scielo.isciii.es/pdf/albacete/v6n3/01_editorial.pdf
12. Reyes Sanamé FA, Pérez Álvarez ML, Alfonso Figueredo E, Céspedes Cuenca Y, Ardevol Proenza E. Las incretinas como nueva opción terapéutica en la diabetes mellitus tipo 2. Rev Cubana Med. 2015[citado 20 Ene 2016];54(2):151-66. Disponible en: http://scielo.sld.cu/pdf/med/v54n2/med06215.pdf
13. Zúñiga-Guajardo S, Rodríguez-Gutiérrez R, Yamamoto-Cuevas J, Citlali Juárez-Comboni S. Comparación de la eficacia de los idPP-4 actualmente disponibles y ventajas antihiperglucemiantes de linagliptina en pacientes con diabetes mellitus 2. Med Int Mex. 2015[citado 20 Ene 2016];31(4):441-53. Disponible en: http://www.medigraphic.com/pdfs/medintmex/mim-2015/mim154k.pdf
14. Vidal Puig A, Figuerola Pino E, Reynols de Blasis M. Diabetes mellitus tipo 2. En: Farreras/Rozman. Tratado de Medicina Interna. 17a ed. España: Elsevier; 2012. p.1771.
15. Araya QV. Diagnóstico actual y alternativa de tratamiento médico en diabetes mellitus tipo 2. Rev Hosp Clín Univ Chile. 2012[citado 20 Ene 2016];23(2):197-203. Disponible en: http://www.redclinica.cl/Portals/0/Users/014/14/14/Publicaciones/Revista/diagnostico_actual_diabetes.pdf
16. Ta NN, Schuyler CA, Li Y, Lopes-Virella MF, Huang Y. DPP-4 (CD26) Inhibitor Alogliptin Inhibits Atherosclerosis in Diabetic Apolipoprotein E-Deficient Mice. J Cardiovasc Pharmacol. 2011 [citado 20 Ene 2016];58(2):157-66. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3155015/pdf/nihms-294762.pdf
17. Dicker D. DPP-4 Inhibitors. Impact on glycemic control and cardiovascular risk factors. Diabetes Care. 2011[citado 26 ener 2016];34(Suppl 2):s276-278. Disponible en:http://care.diabetesjournals.org/content/34/Supplement_.full.pdf+html
18. Pollak F, Caaraya V, lanas A, SaPunar J. II Consenso de la Sociedad Chilena de Endocrinología y Diabetes sobre resistencia a la insulina. Rev Med Chile. 2015[citado 26 ener 2016];143(5):627-50. Disponible en: http://www.scielo.cl/pdf/rmc/v143n5/art12.pdf
19. Agudelo-Zapata Y, Burgos-Cárdenas AJ, Díaz-Martínez AJ, Pinilla-Roa AE. Inhibidores de dipeptidil peptidasa-IV: de la teoría a la práctica. Rev Fac Med. 2015[citado 26 ener 2016];63(2):259-70. Disponible en: http://www.scielo.org.co/pdf/rfmun/v63n2/v63n2a11.pdf
20. Brown DX, Evans M. Choosing between GLP-1 Receptor Agonist and DPP-4 Inhibitors: A Pharmacological Perspective. J Nutr Metabol. 2012 [citado 26 Ene 2016]; 20(2) 1-10. Disponible en: http://www.hindawi.com/journals/jnme/2012/381713/
21. Harshal P, Firas Al Badarin, Hamza Al Shami, Salman B. Meta-analysis of effect of dipeptidyl peptidase-4 inhibitors on cardiovascular risk in type 2 diabetes Mellitus. Am J Cardiol. 2012 [citado 26 Ene 2016];110(2):826-33. Disponible en:http://www.sciencedirect.com/science/article/pii/S0002914912013446
22. Cobble M. differentiating among incretin-based therapies in the management of patients with type 2 diabetes mellitus. Diabetology and Metabolic Syndrome. 2012 [citado 26 Ene 2016]; 4(1): 1-10. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3310739/
23. Carrera Boada CA, Martínez-Moreno JM. Current medical treatment of diabetes type 2 and long-term morbidity: how to balance efficacy and safety? Nutr Hosp. 2013 [citado 26 ener 2016]; 28(Supl 2):3-13. Disponible en: http://scielo.isciii.es/pdf/nh/v28s2/02articulo01.pdf
24. Prieto MÁ, Comas-Samper JM, Escobar-Cervantes C, Gasull-Molinera V. Seguridad cardiovascular de los antidiabéticos no insulínicos; posicionamiento científico SEMERGEN. Semergen. 2014[citado 26 Ene 2016];40(1):261-73. Disponible en: http://dialnet.unirioja.es/servlet/articulo?codigo=4756877
25. Scheen AJ. Dipeptidylpeptidase-4 inhibitors (gliptin): focus on drug-drug interactions. Clin Pharmacokinet. 2010[citado 26 Ene 2016];49(1):573-88. Disponible en: http://link.springer.com/article/10.2165/11532980-000000000-00000#page-1
26. Inzucchi SE, Sherwin RS. Diabetes mellitus tipo 2. En: Cecil y Golman. Tratado de Medicina Interna. 24a ed. España: Elsevier; 2013. p.1500.
27. Gupta V, Kalra S. Choosing a gliptin. Indian J Endocrinol Metab. 2011[citado 26 Ene 2016];15:298-308. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3193779/
28. López-Jaramillo P, Velandia C, Castillo G, Sánchez T, Álvarez J. Análogos de incretina e inhibidores de la DPP-4: ¿qué papel desempeñan en la prevención primaria de las enfermedades cardiovasculares? Rev Colomb Cardiol. 2013 [citado 26 Ene 2016]; 20(5):287-99. Disponible en: http://www.scielo.org.co/pdf/rcca/v20n5/v20n5a6.pdf
29. Storino-Farina MA, Contreras-Zambrano MA. Insulino-resistencia y corazón: nuevos conceptos - nuevas estrategias. Avances Cardiol. 2013[citado 26 Ene 2016]; 33(4):260-265.Disponible en: http://www.svcardiologia.org/es/images/documents/Avance_Cardiologico/2013/AC_33_284_29_2013.pdf#page=54
30. Hernández Yero A, Torres Herrera O, Carrasco Martínez B, Nasiff Hadad A, Castelo Elías-Calles L, Pérez Pérez L, et al. Tratamiento farmacológico de la prediabetes. Rev Cubana Endocrinol. 2011 [citado 26 Ene 2016];22(1):36-45. Disponible en: http://scielo.sld.cu/pdf/end/v22n1/end080111.pdf
31. Fadini GP, Boscaro E, Albiero M, Menegazzo I, Frison V, Kreutzenberg S, et al. The oral dipeptidyl peptidase-4 inhibitor sitagliptin increases circulating endothelial progenitor cells in patients with type 2 diabetes. Diabetes Care. 2010 [citado 26 Ene 2016];33(7):1607-9.Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2890368/pdf/zdc1607.pdf
32. Gonzalo Godoy J G, Gutiérrez V, Montesinos M, Yenes A. Evaluación del perfil de eficacia y seguridad de vildagliptina en vida real de pacientes chilenos con diabetes mellitus tipo 2. Rev Med Chile. 2015[citado 26 Ene 2016];143(1):63-8. Disponible en: http://www.scielo.cl/pdf/rmc/v143n1/art08.pdf
33. Cox ME, Rowell J, Corsino L, Green JB. Dipeptidyl peptidase-4 inhibitors in the management of type 2 diabetes: safety, tolerability, and efficacy. Drug, Healthcare and Patient Safety. 2010 [citado 26 Ene 2016];2(1):7-19. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3108711/pdf/dhps-2-007.pdf
34. Mkele G. Dipeptidyl peptidase-4 inhibitors: their role in the management of type 2 diabetes. S Afr Fam Pract. 2013[citado 26 Ene 2016];55(6):508-10. Disponible en: http://www.tandfonline.com/doi/pdf/10.1080/20786204.2013.10874407
35. Rivas Alpizar E, Zerquera Trujillo G, Hernández Gutiérrez C, Vicente Sánchez B. Manejo práctico del paciente con diabetes mellitus en la Atención Primaria de Salud. Revista Finlay. 2011 [citado 26 Ene 2016];1(3):229-51. Disponible en: http://revfinlay.sld.cu/index.php/finlay/article/view/69/1232
36. López G. Diabetes mellitus: tratamiento. Medwave. 2010 [citado 26 Ene 2016];10(2):1-7. Disponible en: http://www.medwave.cl/medios/medwave/febrero2010/PDF/1/10.5867medwave.2010.02.4406.pdf
37. Schweizer A, Dejager S, Foley JE, Couturier A, Ligueros-Saylan M, Kothny W. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes, Obes Metab. 2010 [citado 26 Ene 2016];12(6):485-94.Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1463-1326.2010.01215.x/pdf
38. Álvarez Guisasola F. Actualización sobre la última familia de fármacos orales comercializados para el tratamiento de la diabetes tipo 2: los inhibidores de la DPP-4. Aportaciones respecto a las otras familias de antidiabéticos orales. Atención Primaria. 2010[citado 26 Ene 2016];42(Supl 1):33-40. Disponible en: http://ac.els-cdn.com/S0212656710700068/1-s2.0-S0212656710700068-main.pdf?_tid=0c9be1e8-8630-11e4-a423-00000aab0f26&acdnat=1418850345_19a4ee9aac2a7b0353615cdc75c188d2
39. Orlandi Gonzales N, Álvarez Seijas E, Gonzales Calero TM, Gonzales Padilla K. Guías de prácticas clínicas. Diabetes Mellitus tipo 2. La Habana: Editorial de Ciencias Médicas; 2012.
40. Vicente Peña E, Rodríguez Porto AL, Sánchez Zulueta E, Quintana López L, Riverón Gonzales JM, et al. Diabetes mellitus .En: Diagnóstico y tratamiento en medicina interna. La Habana: Ciencias Médicas; 2012. p.391-407.
41. Gallwitz B. Linagliptin -A novel dipeptidyl peptidase inhibitor for type 2 diabetes therapy. Clin Med Ins Endocrinol Diabetes. 2012 [[citado 26 Ene 2016];5(1):1-11. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3411498/pdf/cmed-5-2012-001.pdf
42. Johansen OE, Neubacher D, Von Eynatten M, Patel S, Woerle HJ. Cardiovascular safety with linagliptin in patients with type 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovascular Diabetology. 2012[citado 26 Ene 2016];11(3):1-10. Disponible en: http://www.biomedcentral.com/content/pdf/1475-2840-11-3.pdf
43. López-López J. ¿Existe un espacio para los análogos de la incretina como terapia para el sobrepeso, la obesidad y la prevención de la enfermedad cardio-metabólica? Rev Colomb Cardiol. 2016. [citado 26 Ene 2016]. Disponible en: http://www.sciencedirect.com/science/article/pii/S0120563315002211
Recibido: 1 de febrero de 2016.
Aceptado: 22 de abril de 2016.
Ernesto Alfonso Figueredo . Hospital General Docente "Dr. Guillermo Luis Fernández Hernández Baquero". Reparto Caribe. Moa, Holguín, Cuba. sander20@moa.hlg.sld.cu