Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina
versão impressa ISSN 0034-7523versão On-line ISSN 1561-302X
Rev cubana med vol.56 no.1 Ciudad de la Habana jan.-mar. 2017
ARTÍCULO ORIGINAL
Estudio de agregación plaquetaria con diferentes agonistas. Valores de referencia
Platelet aggregation study using different agonists. Reference values
Leandro Mesa González, Marlem Castañeda Travieso, Marlenis Montero López, Xiomara Mojena López, Nuris Ricardo Ricardo, Mileidys Jiménez Sosa
Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: los estudios de agregación plaquetaria permiten identificar pacientes con trastornos de función y el monitoreo de terapias antiplaquetarias, estableciéndose patrones clásicos. Debido a que no está establecido un acuerdo acerca del establecimiento de los rangos de referencia, existen numerosos esfuerzos actualmente para mejorar la estandarización de esta prueba.
Objetivos: establecer los valores de referencia para los estudios de agregación plaquetaria con diferentes agonistas en el Hospital "Hermanos Ameijeiras" comparándolos con los preestablecidos en la literatura. Identificar la influencia de las variables: sexo, hábito de fumar y consumo de alcohol.
Métodos: se realizó un estudio observacional, descriptivo, de corte transversal, de agregación plaquetaria utilizando diferentes agonistas, en el laboratorio clínico del Hospital "Hermanos Ameijeiras" entre septiembre de 2009 y septiembre de 2015. La población de estudio estuvo integrada por 192 donantes del banco de sangre, utilizados como control. Los rangos de referencia de la agregación plaquetaria con los diferentes agonistas se obtuvieron utilizando los percentiles 2.5 (P2.5) y 97.5 (P97.5) y para comparar la media poblacional de este estudio con la media muestral prestablecida en la literatura se empleó la prueba de t para una muestra.
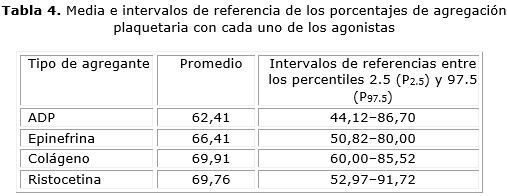
Resultados: la media del porcentaje de agregación que se obtuvo en nuestro estudio con cada agonista fue: ADP: 62,4 %, epinefrina: 66,4 %, colágeno: 69,9 % y ristocetina: 69,7 %. Los intervalos de referencia en la investigación con cada agonista fueron los siguientes: ADP: 44,1-86,7 %, epinefrina: 50,8-80,0 %, colágeno: 60,0-85,5 % y ristocetina: 52,9-91,7 %.
Conclusiones: Las variables sexo, hábito de fumar y consumo de alcohol no influyeron en los resultados del estudio de agregación plaquetaria. Los resultados de la población para el estudio de agregación plaquetaria presentaron diferencias estadísticamente significativas al compararlos con los valores de agregación preestablecidos en la literatura.
Palabras clave: agregación plaquetaria; valores de referencia.
ABSTRACT
Introduction: Platelet aggregation studies allow the identification of patients with functional disorders and the monitoring of antiplatelet therapies, establishing classic patterns. Because there is no agreement on the establishment of reference ranges, numerous efforts are currently being made to improve the standardization of this test.
Objectives: To establish reference values for platelet aggregation studies with different agonists by comparing them with those preset in the literature, at Hermanos Ameijeiras Hospital. To identify the influence of the variables sex, smoking habits and alcohol consumption.
Methods: An observational, descriptive, cross-sectional study of platelet aggregation using different agonists was performed in the clinical laboratory of Hermanos Ameijeiras Hospital, between September 2009 and September 2015. The study population consisted of 192 donors from the blood bank, used as control group. The reference ranges of platelet aggregation with the different agonists were obtained using the 2.5 (P2.5) and 97.5 (P97.5) percentiles. In order to compare this study's population mean with the sample mean preset in the literature, we used the T-test for one sample.
Results: The mean of aggregation percentage obtained in our study with each agonist was ADP (62.4 %), epinephrine (66.4 %), collagen (69.9 %), and ristocetin (69.7 %). The reference ranges in the research with each agonist were the following: ADP (44.1-86.7 %), epinephrine (50.8-80.0 %), collagen (60.0-85.5 %), and ristocetin (52.9-91.7 %).
Conclusions: The variables gender, smoking and alcohol consumption did not influence the results of the platelet aggregation study. The results of the population for the platelet aggregation study presented statistically significant differences when compared with the values of aggregation preset in the literature.
Keywords: platelet aggregation; reference values.
INTRODUCCIÓN
La integridad de la hemostasia primaria debe ser evaluada primero a través de un examen físico y un historial minucioso. El análisis de laboratorio será dependiente del grado de tecnología disponible, como mínimo se debe realizar un recuento completo de sangre con frotis de sangre periférica. Para evaluar la función plaquetaria se pueden emplear otras pruebas de laboratorio como el tiempo de sangría y pruebas de función plaquetaria, utilizando agregómetros que emplean plasma rico en plaquetas o sangre total.1,2
Los agonistas comunes empleados en los análisis de la función plaquetaria incluyen ADP, epinefrina, colágeno, ácido araquidónico, ristocetina y trombina.3-5 En general se han establecido correlaciones entre las respuestas de las plaquetas a cada uno de los agonistas y los defectos específicos en sus funciones. Actualmente, no hay consenso en como el ensayo de función plaquetaria debe ser llevado a cabo para evaluar a los pacientes. Cada institución sigue sus propias prácticas. No existen estándares unificados para la toma de muestra, procesamiento, desarrollo del ensayo, valores de referencia e interpretación de los resultados.6
Existen diversos factores que pueden afectar los perfiles de agregación plaquetaria, entre ellos: la temperatura, la lipemia, la toma de la muestra, el intervalo desde la venipuntura y la preparación del plasma rico en plaquetas.7 La agregación por transmisión de luz (ATL) es el método más comúnmente usado por los laboratorios clínicos y de investigación para evaluar la función plaquetaria y es considerado el estándar de oro. En esta técnica la sangre se centrifuga a una fuerza suficientemente baja para obtener plasma rico en plaquetas (PRP), el cual se agita en una cubeta a 37 ºC entre la fuente de luz y una fotocelda de medición. Tras la adición de un agonista, las plaquetas se agregan; aumenta la transmisión de la luz (es decir provocan la reducción de la turbidez del PRP) lo cual se detecta y se registra como una función del tiempo después de la adición del reactivo. Estos cambios reflejan la formación de agregados de plaquetas relativamente grandes, que son a su vez derivados de microagregados.8
Según la definición de la IFCC, los valores de referencia se miden en una población bien caracterizada de individuos seleccionados de acuerdo con criterios predefinidos como la edad, sexo, raza, estado nutricional y dieta. Además, se presume que los individuos de referencia estén sanos.9 Los procedimientos paso a paso para la determinación a priori de un intervalo de referencia con los detalles del procedimiento se dan en las directrices C28-A3 IFCC-CLSI.10-12
A diferencia de otros exámenes de laboratorio que cuentan con procedimientos estandarizados, con rangos de referencia establecidos y ampliamente aceptados para interpretaciones diagnósticas, la agregación por transmisión de luz (ATL) aún no se ha logrado estandarizar pese a los esfuerzos realizados por organismos internacionales como la International Society of Thrombosis and Hemostasis (ISTH). La recomendación "los laboratorios clínicos deben determinar sus intervalos de referencia para el porcentaje de agregación máxima, específico para cada agonista evaluado", alcanzó 96 % de consenso entre los 45 laboratorios canadienses y de los Estados Unidos participantes en la elaboración de las Guías Norteamericanas sobre la materia publicadas en 2010.13 Esta recomendación se basa en dos aspectos: primero, la adecuada evaluación de los resultados de laboratorio es parte esencial en el proceso de decisión clínica, y en segundo lugar, pero no menos importante, en el consenso existente entre expertos sobre la necesidad de que cada laboratorio clínico informe sus intervalos de referencia, pero la información sobre la metodología y el cálculo de estos en ATL es limitada.14
El objetivo de este trabajo es establecer los valores de referencia para los estudios de agregación plaquetaria con diferentes agonistas en el Hospital "Hermanos Ameijeiras" comparándolos con los preestablecidos en la literatura. Identificar la influencia de las variables: sexo, hábito de fumar y consumo de alcohol.
MÉTODOS
Se realizó un trabajo de investigación y desarrollo consistente en un estudio observacional, descriptivo, de corte transversal, acerca de los resultados de la agregación plaquetaria utilizando diferentes agonistas, en el laboratorio clínico del Hospital "Hermanos Ameijeiras" entre septiembre de 2009 y septiembre de 2015. La población de estudio estuvo integrada por todos los donantes supuestamente sanos empleados como control y sometidos al estudio de agregación plaquetaria utilizando diferentes agonistas, que acudieron al banco de sangre del Hospital. En total la muestra de estudio estuvo formada por 192 elementos.
A todos los donantes sanos sin tratamiento farmacológico al menos 10 días antes de la toma de muestra, se les realizaron las extracciones de sangre venosa, en ayunas, en la región anterolateral del brazo para determinar la agregación plaquetaria con cada uno de los agonistas.
Método de agregación según técnica de Born.15 El estudio de la agregación plaquetaria está basado en el método turbidimétrico que revela la variación de la transmitancia que se obtiene del plasma rico en plaquetas (PRP), después se une a la sustancia agregante (ADP, adrenalina, colágeno, ristocetina). Estas sustancias determinan la formación de los agregados plaquetarios, con el consiguiente aumento de la transmitancia que viene monitoreada en el tiempo.
El agregómetro registra de forma continua esta variación y se obtiene la impresión que da la curva de la agregación plaquetaria. El valor de agregación plaquetaria resulta ser el valor máximo de la curva medido con una escala en una regla que acompaña al equipo. La agregación plaquetaria se realizó en un agregómetro Clot 2S.
Para determinar la posible influencia de las variables sexo, hábito de fumar y consumo de alcohol sobre los valores de agregación con los diferentes agonistas se emplearon pruebas estadísticas de comparación de medias: prueba de Mann-Whitney para las variables no paramétricas y para la paramétrica, se realizó la prueba de t en muestras independientes. Los rangos de referencia de la agregación plaquetaria con los diferentes agonistas se obtuvieron con el estudio de frecuencias utilizando los percentiles 2.5 (P2.5) y 97.5 (P97.5) y para comparar la media poblacional de este estudio con la media muestral prestablecida en la literatura, se empleó misma prueba de t.
RESULTADOS
En el estudio realizado sobre valores de referencia en la agregación plaquetaria, el predominio de edad estuvo representado por los sujetos entre 30 y 59 años. No hubo elementos muestrales en los sujetos supuestamente sanos de 60 y más años ni menores de 18 años. Con relación al sexo predominó ampliamente el sexo masculino (87,5 %). Estos hallazgos podrían explicarse por las características socioculturales de nuestra población. Es necesario recordar que se trata de individuos escogidos del banco de sangre del centro, y aunque no encontramos literatura que describa esta composición, nos informamos de que es la frecuencia de sexos habitual en los donantes. Existió una representación similar entre blancos y no blancos (mestizos y negros). En este acápite es importante tener en cuenta la intensa mezcla racial que caracteriza a nuestro país, la cual se ha multiplicado durante decenas de generaciones.
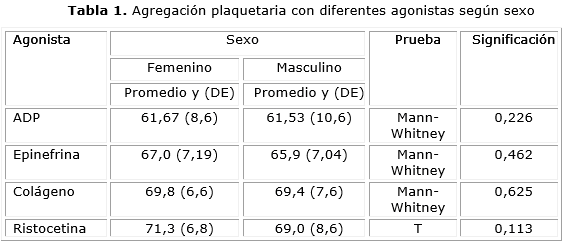
No encontramos diferencias estadísticamente significativas al analizar el comportamiento de la agregación plaquetaria con los agonistas según el sexo (tabla 1).
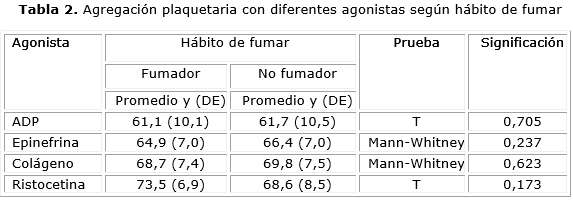
En nuestro estudio no se encontraron diferencias significativas en los resultados de la agregación con los diferentes agonistas al comparar fumadores con no fumadores, lo que no se corresponde con lo encontrado por otros autores (tabla 2).
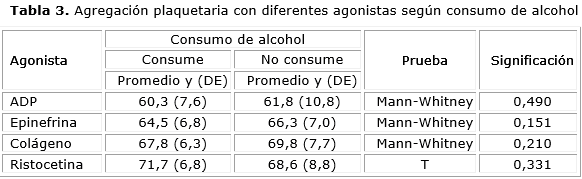
Al analizar la relación entre consumo de alcohol y agregación plaquetaria no encontramos diferencias estadísticamente significativas entre los dos grupos. La clasificación del consumo de alcohol se realizó según declaración del donante durante la entrevista (tabla 3).
Para establecer los valores de referencia se tuvieron en cuenta los pasos recomendados por la IFCC en el artículo C28-A3 (ISBN 1-56238-682-4).USA, 200810 (tabla 4).
Existen diferencias estadísticamente significativas entre las medias obtenidas y las prestablecidas por el fabricante del equipo Clot 2S16 para todos los agonistas estudiados (tabla 5).
DISCUSIÓN
Al analizar la agregación plaquetaria con diferentes agonistas según sexo, los resultados se corresponden con el estudio realizado por Ayala y otros, quienes no encontraron tampoco diferencias significativas en la agregación en las muestras basales realizadas en ambos sexos, antes de la administración del medicamento omega 3.17 Encontramos otro trabajo interesante donde se evaluó la agregación plaquetaria con diferentes agonistas durante el ciclo menstrual en 16 mujeres y se comparó con los resultados en un número similar de hombres, concluyendo que la actividad de agregación fue superior en las mujeres y que la asociación entre la agregación y la fase del ciclo varía con el tipo de agonista.18
El tabaquismo es uno de los más importantes factores de riesgo para el desarrollo de enfermedades vasculares y se asocia a agregación plaquetaria espontánea y biosíntesis disfuncional de óxido nítrico. A través de diversas investigaciones se conoce que la nicotina favorece la agregación plaquetaria a partir del aumento de la concentración de catecolaminas y de la alteración de la función de la membrana de las plaquetas. Además, el aumento de la trombina por el tabaco induce la agregación plaquetaria, especialmente en los sitios de estenosis vascular o ruptura de placa. 19-21 A pesar de lo anterior, en nuestro estudio no se encontraron diferencias significativas en los resultados de la agregación con los diferentes agonistas al comparar fumadores con no fumadores lo que no se corresponde con lo encontrado por como Bracho y otros, los cuales realizaron una investigación en 18 personas jóvenes fumadores habituales y observaron un aumento significativo en la velocidad inicial de agregación, cuando se estimularon con los activadores plaquetarios.22 También se analizó el trabajo de Fusegawa y Handa y los resultados confirmaron que la agregabilidad plaquetaria está aumentada en fumadores y que los fumadores con mayor tiempo de exposición podrían aumentar la sensibilidad de las plaquetas a la epinefrina y al ADP.23
La Organización Mundial de la Salud define el alcoholismo como la ingestión diaria de más de 50 g de alcohol en las mujeres y más de 70 g en los hombres, estas cantidades producirán en muchos casos hepatopatía alcohólica. El organismo tolera sin problemas dosis moderadas de alcohol las cuales son consideradas entre 10-30 g diarios.24 El alcohol per se tiene efectos antiagregantes. El mecanismo por el cual el alcohol actúa disminuyendo la agregación plaquetaria podría ser por inhibición de la liberación de TXB2 o por aumento de PGI2 ya que el acetaldehído debido a la acción de la enzima alcohol deshidrogenasa aumenta los niveles de PGI2, por consiguiente el efecto neto del alcohol residiría en un desbalance de la relación PGI2/TXB2 que llevaría a una inhibición de la agregación con disminución del riesgo de enfermedad trombótica.
Se ha reportado inhibición de la agregación plaquetaria inducida por ristocetina y de la formación de trombos al inhibir la interacción de la GPIb con el FvW con el uso de flavonoides. 25,26 Barrantes y colaboradores realizaron un trabajo relacionado con la agregación plaquetaria en pacientes con hepatopatía alcohólica, encontrando que 2 pacientes tuvieron deficiente agregación plaquetaria con ADP y Ristocetina, 1 con ADP y 4 con ristocetina, es importante tener en cuenta que algunos pacientes con enfermedad hepática pueden tener una causa adicional que va a incidir sobre la hemostasia, y por lo tanto en un aumento de predisposición al sangrado, pues cualquier interferencia con la agregación plaquetaria, junto a la deficiencia de factores de coagulación, puede ser de considerable trascendencia clínica.27 En el estudio realizado se muestran los resultados de la agregación plaquetaria con diferentes agonistas según consumo de alcohol. En este estudio no encontramos diferencias estadísticamente significativas entre los dos grupos. Es necesario señalar que la clasificación del consumo de alcohol en este se realizó según declaración del donante durante la entrevista. En el trabajo realizado por Domínguez, A y colaboradores se encontró que en su grupo de 15 sujetos existió inhibición de la agregación de las plaquetas en plasma rico en plaquetas medida con la técnica de agregometría luego del consumo moderado (13 g) de alcohol comercial, de manera aguda, con una concentración sanguínea media de 0,2133 g/L. La inhibición fue significativa (p = 0,05) en los casos de los agonistas epinefrina, ristocetina y ADP (13 %; 7,3 %; 4,8 %; respectivamente). Ellos plantearon que la importancia de su estudio radicó en que el consumo de bajas dosis de alcohol podría contribuir a la prevención de procesos tromboembólicos que generan infarto agudo de miocardio o isquemia cerebral.28
Para establecer los valores de referencia se tuvieron en cuenta en primer lugar los pasos recomendados por la IFCC en el artículo C28-A3 (ISBN 1-56238-682-4).USA, 2008 10 los cuales se exponen a continuación:
- Documentación de los factores de variación preanalíticos, analíticos y biológicos.
- Establecimiento de los criterios de inclusión y exclusión.
- Selección del número adecuado de personas de referencia.
- Recolección y procesamiento de las muestras.
- Análisis de las muestras con un método de control de calidad.
- Revisión y análisis de los datos.
También se realizó una revisión sobre las guías de consenso norteamericanas para laboratorios que realizan e interpretan estudios de función plaquetaria usando agregómetros de transmisión de luz. En estas guías se reconoce que los estudios de agregación plaquetaria aportan información diagnóstica más específica que el tiempo de sangramiento y tienen mayor sensibilidad para el diagnóstico de los trastornos caracterizados por sangramientos cuando se realizan por métodos estandarizados con intervalos de referencia validados.29
Se observaron diferencias estadísticamente significativas entre las medias obtenidas y las prestablecidas por el fabricante del equipo Clot 2S16 para todos los agonistas estudiados. Resulta evidente la diferencia entre ambos grupos de intervalos; los nuevos valores de referencia para ADP, Colágeno y Epinefrina son más estrechos, de forma que se reportarán como patológicos algunos casos que antes pasaban inadvertidos; en el caso de la epinefrina, además el nuevo intervalo está formado por valores de agregación menores. Para la ristocetina, contrariamente, el intervalo encontrado es más amplio y su límite inferior es apreciablemente menor. Un trabajo similar de intervalos de referencia para la agregación en individuos sanos en Venezuela, fue desarrollado por Falcone y otros.30 Estos investigadores utilizaron adenosín difosfato (ADP), colágeno y adrenalina como agonistas. Participaron 63 individuos con un rango de edad 18 a 66 años y 79,4 % el sexo femenino. Los valores de agregación plaquetaria obtenidos fueron: ADP P2,5=49 % y P97,5 =87 %; colágeno P2,5=43 % y P97,5=86 %; adrenalina P2,5=42 % y P97,5=85 %. Los nuevos intervalos de referencia se adaptan mucho mejor a la clínica de los pacientes.
CONCLUSIONES
La media del porcentaje de agregación que se obtuvo en este estudio con cada agonista fue: ADP: 62,4 %. epinefrina: 66,4 %, colágeno: 69,9 % y ristocetina: 69,7 %. Los intervalos de referencia obtenidos en la investigación con cada agonista fueron los siguientes: ADP: 44,1-86,7 %, epinefrina: 50,8-80,0 %, colágeno: 60,0-85,5 % y ristocetina: 52,9-91,7 %. Las variables sexo, hábito de fumar y consumo de alcohol no influyeron en los resultados del estudio de agregación plaquetaria. Los resultados de la población para el estudio de agregación plaquetaria presentaron diferencias estadísticamente significativas al compararlos con los valores de agregación preestablecidos en la literatura.
REFERENCIAS BLIBLIOGRÁFICAS
1. Harrison P, Lawrence LK L, Stephen A Landaw. Platelet function testing. Am Heart J. 2011;19:13.
2. Quiroga T, Goycoolea M, Matus V. Diagnosis of mild platelet function disorders. Reliability and usefulness of light transmission platelet aggregation and serotonin secretion assays. Br J Haematol. 2009;147:729.
3. Seyfert UT, Haubelt H, Vogt A, Hellstern P. Variables influencing Multiplate (TM) whole blood impedance platelet aggregometry and turbidimetric platelet aggregation in healthy individuals. Platelets. 2011;18:199.
4. Sibbing D, Braun S, Morath T. Platelet reactivity after clopidogrel treatment assessed with point-of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol. 2013;53:849.
5. Jilma-Stohlawetz P, Hergovich N, Homoncik M. Impaired platelet function among platelet donors. Thromb Haemost. 2012;86:880.
6. Zhou L, Schmaier A. Platelet Aggregation Testing in Platelet Rich Plasma. Description of Procedures with the aim to develop standards in the field. Am J Clin Pathol. 2015;123:17283.
7. Rivera J, Navarro L, Lozano ML, Marinez C, Corral J. Valor diagnóstico de las pruebas de función plaquetaria. Hematológica. 2007;92(extra 1):48-62.
8. Cattaneo M, Hayward CP, Moffat KA, Pugliano MT, Liu Y, Michelson AD. Results of a worldwide survey on the assessment of platelet function by light transmission aggregometry: a report from the platelet physiology subcommittee of the SSC of the ISTH. J Thromb Haemost. 2009;7(6):1029.
9- Walton RM. Establishing reference intervals: health as a relative concept. Semin Avian Exotic Pet Ped. 2011;10:67-71.
10. Horowitz G, Altaie S, Boyd J, Ceriotti F, Garg P, Horn P, et al. Clinical and Laboratory Standards Institute. Defining, Establishing and Verifying Reference Intervals in the Clinical Laboratory-Third Edition CLSI documente C28-A3 (ISBN 1-56238-682-4).USA. 2008.
11. Jennen-Steinmetz C, Wellek S. A new approach to sample size calculation for reference interval studies. Stat Med. 2015;24(20):3199-212.
12. Ricos C, Domenech MV, Perich C. Analytical quality specifications for common reference intervals. Clin Chem Lab Med. 2014;42:858-62.
13-Hayward C, Moffat K, Raby A, Israels S, Plumhoff E, Flynn G, et al. Development of North American Consensus Guidelines for medical laboratories that perform and interpret platelet function testing using Light Transmission Aggregometry. AJCP. 2010;134:955-63.
14. Linnemann B, Schwonberg J, Mani H, Prochnow S, Lindhoff-Last E. Standardization of light transmittance aggregometry for monitoring antiplatelet therapy: an adjustment for platelet count is not necessary. J Thromb Haem. 2008;6(4):677-83.
15. Born GV, Cross MJ. The aggregation of blood platelets. J Physiol. PubMed 1963;168:178-95.
16. Manuale D uso. Software ver.1.1. Seac Radim Group. Cod 53872201. Calenzano-Firenze. Italia. 2007.
17. Ayala J, López C, Hong A. Efecto de los ácidos grasos poliinsaturados (omega 3) sobre la agregación plaquetaria. Rev Latinoam hipertens. 2012;[cited 21 dec 2016]4(3). Disponible en: http://www.redalyc.org/articulo.oa?id=170216837003
18. Melamed N, Yogev Y, Bouganim T, Altman E, Calatzis A, Glezerman M. The effect of menstrual cycle on platelet aggregation in reproductive-age women. Platelets. 2013;21(5);343-7.
19. Müller FW. El tabaquismo mata. Sus trampas. En: Müller FW (ed). MEDEF, entrenamiento médico para la cesación del tabaquismo. Editorial Polemos. Buenos Aires. 2004:29-36.
20. Zipes D. Braunwald. Tratado de cardiología. 7a ed. Barcelona: España, Elsevier Saunders; 2006. Tomo I, p.367-90.
21. Blann A, Kirkpatrick U, Devine C. The influence of acute smoking on leucocytes, platelets and endothelium. Atheroesclerosis. 2010;141:133-39.
22. Bracho M, Luzardo A, Manzol S, Diez de Ewald M. Efecto del cigarrillo en la agregación plaquetaria de personas jóvenes. Invest Clín. 2011;22(1):3-12.
23. Fusegawa Y, Handa S. Platelet aggregation induced by ADP or epinephrine is enhanced in habitual smokers. Thromb. Res. 2014;97(5):287-95.
24. Consumer Eroski. Alcohol en la alimentación, afecta al organismo más de lo que creemos. Revista Nº 61. España. 2012. [cited 21 dec 2016] Disponible en: http://revista.consumer.es/web/es/20021201/alimentacion/54776.php
25. Zhang QH, S Das S, Siddiqui AM. Effects of Acute, Moderate Ethanol Consumption on Human Platelet Aggregation in Platelet Rich Plasma. 2010.
26. Mruk JM, Webster M, Heras J, Reid D, Grill, J Chesebro. Flovone-8-acetic acid profoundly reduces platelet-dependent thrombosis and vasoconstriction after deep arterial injury in vivo. Circulation. 2010;101(3):324.
27. Barrantes A, Martén A, Montero C, Cordero R. Agregación plaquetaria en enfermedad hepática inducida por alcohol. Act Méd COSI. 2013;23(3):223-28.
28. Domínguez A, Bethancourt G, Young J. Efectos del alcohol sobre la agregación plaquetaria. Tecnociencia. 2015;[cited 21 dec 2016]7(1). Disponible en: https://www.readkong.com/page/efectos-del-alcohol-sobre-la-agregacion-plaquetaria-resumen-1822374
29. Henny J, Hyltoft PP. Reference values: from philosophy to a tool for laboratory medicine. Clin Chem Lab Med. 2004;42:686-91.
30. Falcone M, Granero R. Intervalos de referencia para agregación plaquetaria en individuos sanos. Acta Bioquím Clín Latinoam. 2012;[cited 21 dec 2016]46(4). Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572012000400008
Recibido: 2 de marzo de 2016.
Aprobado: 18 de noviembre de 2016.