Introducción
La asociación entre insuficiencia renal crónica y enfermedades hepáticas es un problema común en los pacientes con enfermedad renal crónica terminal (ERCT), y en aquellos bajo tratamientos de sustitución de la función renal como la hemodiálisis (HD) y el trasplante renal (TR).
La prevalencia de anticuerpos contra el virus de la hepatitis C (anti VHC) detectados en pacientes en diálisis, estimada por ELISA, varía entre 3-10 % en países desarrollados y entre 15-75 % en países en vías de desarrollo.1 La variación de esta prevalencia depende de muchos factores los cuales incluyen el medio donde el paciente es tratado, la etnia, el área geográfica, el tipo y la duración de la diálisis, el número de trasplante (retrasplante), el número de transfusiones, la frecuencia de abuso de drogas por vía endovenosa y la reactividad ante el antígeno del core de la hepatitis B.2
La mayoría de los receptores de trasplante adquieren la infección por el virus de la hepatitis C (VHC) como resultado de su tratamiento de hemodiálisis. La infección por VHC es menos frecuentemente adquirida a través de transfusiones de sangre o el órgano trasplantado.3
La infección por el VHC es la causa más frecuente de enfermedad hepática después del trasplante renal y resulta en un incremento del riesgo de cirrosis, hepatocarcinoma y muerte.1,2,3 Es, además, un factor de riesgo independiente para la pérdida del injerto y se asocia con proteinuria, rechazo crónico, glomerulopatía del trasplante, diabetes postrasplante y glomerulonefritis asociada al VHC.2
El TR en los enfermos VHC positivo se ha planteado que progresa sin las complicaciones inmediatas, y que las alteraciones clínicas y patológicas pueden manifestarse a largo plazo. Así no se ha relacionado la infección viral con la aparición de función renal retardada por necrosis tubular aguda (NTA), ni tampoco un impacto negativo en la mayor frecuencia de complicaciones quirúrgicas. No obstante existe la creencia que el estado inflamatorio sistémico generado por la infección viral puede predisponer al daño isquémico del injerto.3,4
El efecto del VHC en el riesgo de rechazo agudo es controversial.2 La infección por VHC induce un estado de immunodeficiencia, dado por una reducción en el número de linfocitos T auxiliadores y una alteración en las respuestas proliferativas de linfocitos T auxiliadores a mitogenos.5 Estas alteraciones deben correlacionarse con una disminución de la incidencia de rechazo agudo.
Otro estudio que compara a pacientes que recibieron un trasplante del órgano entre 1990 y 1994 con una cohorte de pacientes que recibieron el trasplante entre 1998 y 2002, la incidencia de rechazo agudo era significativamente más alta (p=0,01) en los pacientes positivo para anti-VHC que recibieron el trasplante en el primer período (25 %) comparado con la cohorte en el segundo período (20,6 %). Esta diferencia podría explicarse por el número más alto de retrasplante y pacientes hiperinmunizados en el grupo VHC-infectado en el primer estudio.6
Un meta-análisis identificó un riesgo aumentado de diabetes de nuevo-inicio después del trasplante (DMPT) en los receptores con la infección por VHC.7) La asociación entre VHC y DMPT también está influenciada por la presencia de factores de riesgo tradicionales, como la obesidad, vejez, etnicidad, y síndrome metabólico.8
Las lesiones glomerulares se han descrito en riñones nativos y trasplantados, en pacientes con infección por VHC.9 La crioglobulinemia de novo o recurrente, la glomerulonefritis membrano proliferativa no crioglobulinémica, la glomerulopatía membranosa, la glomerulopatía del trasplante y la microangipatía trombótica asociada al síndrome anti cardiolipinas, se han descrito en pacientes trasplantados con VHC positivo.10,11
Un estudio retrospectivo ha demostrado que los pacientes con infección por VHC experimentan más baja supervivencia del injerto que los pacientes que no tienen VHC.12
Las complicaciones asociadas al VHC que contribuyen a la disminuida supervivencia del injerto después del trasplante renal, y al desarrollo de proteinuria son la nefropatía crónica, la glomerulopatía asociada al VHC y glomerulopatía del trasplante.13,14,15
La enfermedad cardiovascular es la causa de muerte más prevalente en pacientes positivos para los anticuerpos anti VHC y la infección crónica por VHC se ha identificado adicionalmente como un factor de riesgo para la ateroesclerosis.16
Los receptores de trasplantes de órganos con una infección por VHC activa tienen una frecuencia aumentada de sepsis con peligro para la vida, del sistema nervioso central, pulmones, y el torrente sanguíneo después de la cirugía, comparado a los receptores sin infección por VHC.17 Las infecciones secundarias son la segunda causa de muerte después de la enfermedad cardiovascular en pacientes infectados con VHC que reciben un trasplante renal.18
La infección por el VHC es frecuente en los servicios de HD, por lo que muchos de estos enfermos esperan y reciben un trasplante renal cuando su hepatopatía está controlada, el uso de la imprescindible inmunosupresión en ocasiones desencadena una reactivación del proceso viral y esto se convierte en un factor de riesgo importante para la aparición de complicaciones. Además, puede deteriorar la supervivencia del paciente y los injertos, por lo que conocer cómo es la evolución de los enfermos con estas condicionales facilitará la identificación de factores e individuos de riesgo, lo cual permitirá establecer medidas de pesquizaje, control y tratamiento en esta población de enfermos.
El objetivo de este trabajo fue caracterizar la evolución clínica de los pacientes trasplantados de riñón con virus de la hepatitis C positivo y determinar la evolución de este grupo de enfermo de acuerdo a variables demográficas, clínicas y de supervivencia.
Métodos
Se realizó un estudio analítico, transversal, retrospectivo, que abarcó todos los trasplantes renales realizados, durante el período de tiempo del 1 de enero de 2005 hasta el 31 de junio de 2017.
La muestra se conformó con todos los trasplantes renales que cumplieron con los criterios de elegibilidad.
Los criterios de inclusión fueron edad superior a los 15 años. Y los de exclusión: trasplantes renales realizados en otros centros y seguidos en el hospital, trasplantes combinados (páncreas-riñón e hígado-riñón), trasplantes dobles (implante de dos riñones a un solo receptor), retrasplantes (realización de un segundo trasplante al haberse ya perdido la función de un primer injerto), cuando no sea posible obtener en las fuentes de información por pérdida o deterioro, todos los datos establecidos en la investigación.
La positividad al virus de la hepatitis C estuvo determinada por los antecedentes del enfermo de anticuerpo para virus C positivo desde su época de métodos dialíticos.
La muestra quedó dividida en dos grupos:
Grupo I: pacientes trasplantados renales con virus de la hepatitis C positivo.
Grupo II: pacientes trasplantados renales con virus de la hepatitis C negativo.
Se tuvieron en cuenta las siguientes variables:
Edad del receptor y donante, en valores de media y desviación estándar.
Sexo del receptor y del donante.
Tratamiento inmunosupresor utilizado: Es el protocolo de drogas inmunosupresoras empleado en el postrasplante inmediato para prevenir el rechazo, diferenciándose en:
Dos drogas: esteroides + antimetabólitos (azatioprina o micofenolato mofetil)
Tres drogas: esteroides + antimetabólitos + anticalcineurínicos (ciclosporina A o tacrolimus)
Cuatro drogas: esteroides + antimetabólitos + anticalcineurínicos + globulinas antilinfociticas [monoclonales (IORT3, basiliximab o daclizumab) o policlonales (linfoglobulna y timoglobulina]
Presencia de necrosis tubular aguda: Es la ausencia de función del injerto con necesidad de diálisis en el pos trasplante inmediato. Sí o No.
Presencia de rechazo: Es la aparición de disfunción del injerto por una reacción inmunológica aguda, confirmada con estudio histológico (biopsia del injerto). Sí o No
Función del injerto: dado por las cifras de creatinina sérica al año de realización del trasplante renal, expresados en valores de media +/- desviación estándar de cada grupo y en unidades de µmol/L.
Presencia de proteinuria: dado por cifras de proteínas en orina superiores a:
Presencia de diabetes mellitus postrasplante: Sí o No. El diagnóstico de la DMPT se hizo siguiendo los criterios de la ADA (Asociación de Diabetes Americana)19
Supervivencia del injerto: Tiempo que va desde la realización del trasplante (día/mes/año) hasta la pérdida del mismo ya sea volviendo a la diálisis o falleciendo el enfermo (día/mes/año).
Supervivencia del paciente: Tiempo que va desde que se realiza el TR (día/mes/año) hasta el fallecimiento del enfermo (día/mes/año).
Causa de pérdida del injerto: Se categorizó debida a:
Causa de muerte del paciente. Diferenciada según sea por:
Se revisaron las historias clínicas de los pacientes, las pancartas y la base de datos de trasplante, ubicada en la jefatura del servicio de nefrología del hospital.
La información se recopiló en una base de datos utilizando el sistema Excel para Windows 10. El análisis estadístico se realizó a través del programa SPSS versión 17.
Las variables siguientes: categorización de edad de los receptores y donantes, sexo del receptor y donante, tipo de donante, tratamiento inmunosupresor utilizado, presencia de necrosis tubular aguda, rechazo, proteinuria, elevación de transaminasas y DMPT, se resumieron en números absolutos y porcentajes. Utilizando para establecer diferencias entre grupos la prueba de Ji cuadrado.
Para buscar asociación entre los grupos respecto a: edad de los donantes y receptores, valores de creatinina al año, expresadas en valores de media +/- desviación estándar, se realizó a través de la prueba T student para muestras independientes.
Para determinar la supervivencia del injerto y del paciente, al ser ambas censuradas por culminar el estudio antes de que todos los pacientes perdieran el injerto o fallecieran y no tener todos los mismos tiempos de seguimiento, se utilizaron las curvas de probabilidad de conservar el injerto o fallecer. El tiempo mediante el método de Kaplan y Meier y el análisis estadístico de las estas utilizando un test de rango logarítmico.
Las causas de pérdida de los injertos y pacientes se plasmaron de forma descriptiva por lo disperso de la muestra.
En todos los casos se consideró resultados significativos cuando el valor de la p sea ≤ 0,05.
Resultados
La muestra quedó constituida por 156 pacientes, de estos 102 (65 %) con VHC positivo y 54 (35 %) con VHC negativo.
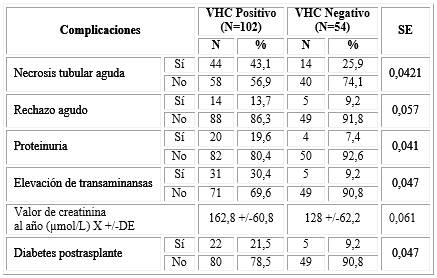
La tabla 1 presenta las variables generales en correspondencia con la presencia o no de virus positivo a la hepatitis C en los pacientes trasplantados (receptor) y de sus donantes. La edad media del receptor con VHC positivo fue de 41,9 años y con VHC negativo fue de 40,4 años. La edad media del donante con VHC positivo fue de 41,9 años y con VHC negativo de 38,4 años. Se observó un predominio del género masculino, tanto en los receptores con VHC positivo (62,8 %) como con VHC negativo (63,0 %) y también en los donantes con VHC positivo (65,7 %) y con VHC negativo (63,0 %). En ninguna de las comparaciones se alcanzó significación estadística.
En el grupo VHC positivo, 56,7 % de los pacientes utilizaron terapias con cuatro drogas; muy similar a lo encontrado en el grupo con VHC negativo (53,8 %).
En relación al tipo de donante utilizado con el estatus al VHC del receptor, esta mostró que la mayoría de las donaciones procedieron de cadáveres (en 91,2 % de los receptores VHC positivo y en 82,3 % de los receptores VHC negativo). No obstante, cabe destacar que el empleo de un dador vivo fue superior en los enfermos con serología negativa al VHC 17,7 % vs 8,8 %. No significación estadística, p=0,383.
Tabla 1 Variables generales en correspondencia con la presencia o no de virus positivo a la hepatitis C
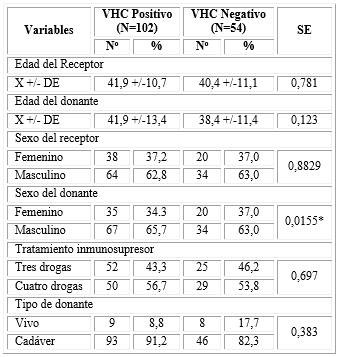
SE: significación estadística, X+/- DE: valores de media y desviación estándar
El grupo de los VHC positivo presentó una mayor incidencia de NTA, 43,1 % y de rechazo agudo, 13,7 %, al compararlos con el grupo de los VHC negativo que fue de 25,9 % para la NTA y 9,2 % de rechazo agudo. Estas diferencias resultaron significativas desde el punto de vista estadístico para la NTA p=0,0421 y no lo llegó a ser para el rechazo (tabla 2). El 19,6 % de los receptores VHC positivo presentó proteinuria, significativamente superior al del otro grupo de estudio, p =0,041, 30,4 % tuvo elevación de transaminansas, 21,5 %, p=0,047 presentó diabetes postrasplante. En el grupo de los VHC negativo estas complicaciones representaron 7,4 %; 9,2 % y 9,2 %, respectivamente.
La media de creatinina al año para los receptores VHC positivo fue de 162,8 µmol/L y para los VHC negativo fue de 128 µmol/L. A pesar de lo elocuente de estas diferencias, la comparación de los valores medios no llegó a tener significación estadística (tabla 2).
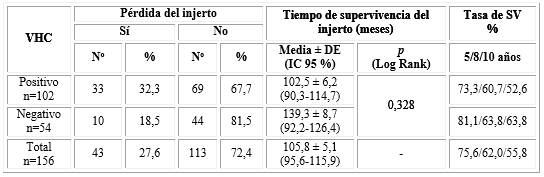
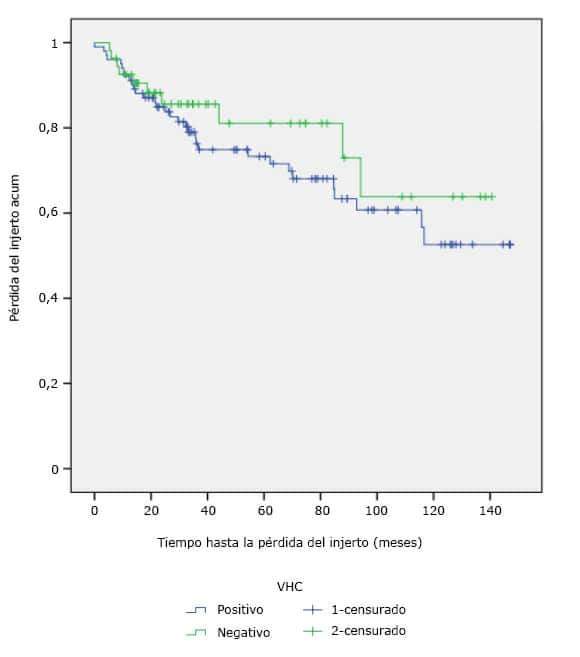
La tabla 3 muestra pérdida del injerto en 43 pacientes (27,6 % del total de la muestra). De los 102 receptores VHC positivo la pérdida ocurrió en 33 pacientes (32,3 %); de los 54 VHC negativo la pérdida se presentó en 10 (18,5 %). La media del tiempo de supervivencia del injerto (fig. 1) fue de 102,5 meses (8,5 años) y 139,3 meses (11,6 años) para los receptores VHC positivo y negativo respectivamente; sin diferencia significativa (p=0,328). Las tasas de supervivencia a los 5 y 8 años fueron de 81,1 % y 63,8 % (subgrupo VHC negativo) vs 73,3 % y 60,7 % (subgrupo VHC positivo). La tasa de supervivencia a los 10 años bajó a 52,6 % en receptores VHC positivos pero se mantuvo igual en los positivos (63,8 %).
La tabla 4 muestra que en el grupo de receptores VHC positivo, 90,2% de los pacientes sobrevivieron; al igual que 94,5 % de los VHC negativo. De forma global, solamente fallecieron 13 pacientes para un 8,3 % del total de pacientes trasplantados. La media del tiempo de supervivencia del paciente (fig. 2) después de recibir el trasplante, no mostró diferencias estadísticamente significativas (p=0,586) con 133,8 meses (11,1 años) y 141,5 meses (11,7 años) para los portadores y no portadores de VHC, respectivamente. La tasa de supervivencia a los 5 años fue similar para ambos subgrupos (92,8 % y 92,0 %); la tasa a los 8 años fue de 86,1 % y 92,0 % (VHC positivo vs negativo) y estas se mantuvieron iguales hasta los 10 años.
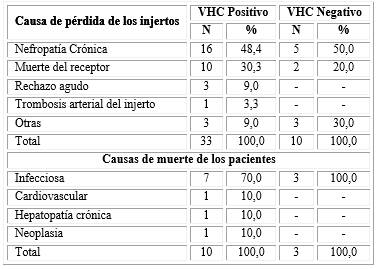
En 48,4 % de los trasplantados con VHC positivo la pérdida del injerto se debió a nefropatía crónica, 30,3 % a la muerte del receptor; 9,0 % fue a causa de rechazo; en 3,0 % fue por TAI y en otro 9,0 % fue debido a otras causas. En el caso de los VHC negativo 50,0 % perdió los injertos a causa de nefropatía crónica; 20,0 % a causa de la muerte del receptor y 30,0 % de las pérdidas se debió a otras causas (tabla 5).
La causa de muerte más frecuente fue la infecciosa en ambos subgrupos. En el grupo de los VHC positivo representó el 70,0% y en el grupo de los VHC negativo el 100,0%. El resto de las causas ocurrió en un paciente cada una. Debido al escaso número de la muestra fue imposible aplicar análisis estadístico.
Discusión
Durante un período de trece años se recogió la información correspondiente a 156 pacientes con trasplantes renales. Al analizar la prevalencia del VHC en ellos se encontró que esta fue alta, dato que se corresponde con otros estudios tanto nacionales como internacionales.1,3,4,20
En el contexto cubano, un estudio realizado en la provincia de Camagüey por Millet y otros20 en 137 receptores informó una prevalencia similar (63 %) a la encontrada en la presente investigación.
Yu y otros21 en un estudio de nueve años realizado en Taiwán, encontraron una prevalencia notablemente alta de infección crónica por el VHC que alcanzó 46,3 %; pero inferior a la encontrada en la presente serie de pacientes.
Respecto a las características sociodemográficas de los pacientes trasplantados predominó el sexo masculinos con similar frecuencia en ambos subgrupos de pacientes (VHC positivo o negativo). Este resultado está en correspondencia con lo notificado por Millet y otros20¡Error! Marcador no definido. en el que 64,2 % de los pacientes correspondieron al género masculino. Pero fue mayor que lo informado por Yu y otros21 en el cual el predominio del género masculino representó 53,8 % de la muestra.
La media de edad del presente estudio fue menor que la comunicada por Lin y otros23 Estos investigadores encontraron una media de 60 años con un rango entre 34 y 70 años.
El tratamiento inmunosupresor utilizado en los inicios del trasplante para la prevención del rechazo agudo fue otra de las variables diferenciadas en el estudio de acuerdo a la presencia o no de infección por el VHC. En ambos grupos predominó la inducción con drogas antilinfocíticas en un protocolo con 4 medicamentos, esto obedece a la tendencia universal actual de utilizar las terapias cuádruples, secuenciales o concomitantes , con el empleo de los inhibidores de los receptores de interleuquina 2 (basiliximab o daclizumab), así como las globulinas policlonales anti timocíticas, que sin dudas han impactado satisfactoriamente en la evolución posterior del trasplante, disminuyendo la frecuencia de rechazo agudo.24,25 No obstante, esto pudiera ser expresión de falta de individualización del tratamiento inmunosupresor de inducción de acuerdo a la positividad o no del VHC y las circunstancias que circundan a estos pacientes.
La frecuencia de utilización del donante cadáver fue superior en ambos grupos de estudio, con valores que se comportan dentro de los estándares que reporta la literatura26 para países donde no existen creencias religiosas, socioculturales o de tipo organizativas que entorpecen la práctica de la donación de cadáver. Es de señalar que la realización del trasplante con un dador vivo fue inferior en los enfermos con VHC quizás debido a factores como: la creencia de una evolución inferior posterior al trasplante de los enfermos con VHC, el menor grado de actitud para trasplante de los portadores de VHC que están en métodos de diálisis y el hecho de que los enfermos con VHC que se trasplantan han transitado un mayor tiempo en diálisis para recibir un injerto, lo que se sabe incrementa el riesgo de contraer la infección por el virus y como es de conocimiento en la comunidad nefrológica, la donación por una persona en vida a su familiar ocurre en los inicios del receptor a la diálisis donde se dan las condiciones sentimentales y psicológicas para que esta se realice.27
El presente estudio analizó las complicaciones clínicas que aparecieron en la evolución de estos enfermos. La NTA fue más frecuente y con confirmación estadística en el grupo portador del VHC, lo cual coincide con la literatura revisada. La mayor frecuencia de NTA en el grupo con VHC, pudiera explicarse por el estado inflamatorio sistémico que propicia la infección viral, lo cual facilita la producción y liberación de citocinas, así como de mediadores vasoconstrictores. Además, el virus puede activar las células sanguíneas y los factores procoagulantes, lo que facilita y perpetúa el daño isquémico del injerto en condiciones propicias para esto.28
Similar influencia puede tener en la aparición de rechazo agudo el estado inflamatorio crónico presente en los pacientes VHC positivos, la activación previa del sistema inmunitario por la infección viral y el mayor daño isquémico demostrado en estos enfermos por la frecuencia más alta de NTA, incrementan la expresión de los antígenos HLA clase II, activan la proliferación de linfocitos T y la producción de anticuerpos, todo lo cual influye en la aparición de rechazo.29 Otro elemento no menos importante favorecedor a la reacción inmunológica es la disminución de la inmunosupresión que se realiza en ocasiones en estos enfermos por el miedo a los efectos tóxicos hepáticos de estas drogas.
Scornik JC30 encontró una frecuencia estadísticamente significativa mayor de rechazo en pacientes con VHC positivo, otros no comparten estos hallazgos y explican que aquellos pacientes infectados por el VHC tienen menos rechazo debido a que la disminución del funcionamiento hepático como resultado de la afectación viral, incrementa los niveles de las drogas inmunosupresoras que se metabolizan a nivel del hígado, sobre todo anticalcineurínicos y antimetabolitos, lo cual los protege ante el daño inmunológico, pero a su vez los hace más sensible a los efectos secundarios de estos medicamentos.31
Este estudio expuso una frecuencia superior de proteinuria en trasplantados renales con VHC al compararlos con aquellos con serología negativa a este virus. La proteinuria relacionada con la infección por el VHC puede obedecer a disimiles causas etiológicas como: La aparición de una afección glomerular ya sea una glomerulonefritis membranoproliferativa (más frecuentemente), glomerulopatía membranosa, crioglobulinemia o de otro tipo. Otra causa de elevación de proteínas en estos enfermos es el desarrollo de un rechazo crónico o agudo por mecanismos ya comentados.32
Una investigación muy similar Suárez M, reportó la asociación del VHC con proteinuria y glomerulonefritis membranoproliferativa.33
Otros han demostrado una prevalencia mayor de proteinuria en este grupo de enfermos, incluso como un factor de progresión al daño terminal del injerto, en el contexto de una nefropatía crónica.34
Como indicador de función hepática en la investigación se tomó la elevación de transaminasas, así como el tiempo en que se produjo el incremento de las enzimas glutámico oxalacética y glutámico pirúvica. Como era de esperar los pacientes que parten con serología positiva para el virus C presentaron una frecuencia muy superior y estadísticamente significativa de elevación de estas enzimas.
La elevación enzimática en los enfermos VHC positivos, debe corresponder a un incremento de la replicación viral facilitada por el uso de la inmunosupresión de inducción, a lo que pudiera sumarse también el ya mencionado efecto tóxico hepático medicamentoso.
Mención especial merece la diabetes mellitus que aparece después del trasplante renal, diversos estudios proveen fuertes evidencias de que la infección con VHC estimula la resistencia a la insulina como resultado de la interferencia con la cascada de señalización intracelular de la insulina (lo cual disminuye la captación hepática de glucosa y la génesis de glucógeno), incrementa las citocinas proinflamatorias o regula negativamente el transportador de glucosa 4 y 2 en el músculo esquelético y en el hígado.35 Además, el virus induce fibrosis hepática, lo cual por sí mismo facilita la resistencia a la insulina, y tiene un efecto citopático directo sobre las células beta del páncreas disminuyendo la secreción insulínica.36
La diabetes pos trasplante fue el doble en pacientes con VHC, respecto a los pacientes no portadores del VHC. Estos resultados coinciden con lo descrito por múltiples investigaciones de Borroto y otros que sitúan a la HVC como un factor de riesgo para el desarrollo de la DMPT y los trastornos metabólicos visto en esta población de enfermos, aseveraciones confirmadas en la literatura internacional.37,38
Como marcador de función renal se escogió en el estudio los valores de creatinina sérica al año de vida del injerto, los enfermos con VHC positivo mostraron una función inferior dada por cifras mayores de creatinina al año. Esto coincide con los reportes internacionales de Yu21 y de estudios anteriores realizados por el grupo de trasplante del Hospital Clínico Quirúrgico “Hermanos Ameijeiras”.39
En el estudio de Lin y otros23 los pacientes con VHC tuvieron una creatinina media al año de 1,2 mg/dL (105,6 mmol/L), lo que está por debajo de la media de la investigación que detallamos.
Se encontró una supervivencia menor del injerto en enfermos VHC positivos no obstante, estos resultados no tuvieron significación estadística.
La causa fundamental de la pérdida de los injertos, tanto para pacientes portadores de VHC como los no portadores, fue la nefropatía crónica con frecuencias relativas similares. Pero la muerte del receptor, el rechazo del injerto y la trombosis arterial del injerto fueron más frecuentes en los pacientes con VHC. Contrario a estos resultados, la muerte del paciente con injerto funcionante se ha planteado que es la primera causa de pérdida del trasplante en etapa tardía.
Al analizar la supervivencia de los pacientes fue ligeramente inferior y no estadísticamente significativa en los enfermos con VHC, pero por lo escaso de la muestra no es conveniente establecer conclusiones.
La principal causa de fallecimiento de los receptores, con VHC positivo o no, se debió a las infecciones adquiridas. Pero el fallecimiento por causas cardiovasculares, hepatopatía crónica y neoplasia, aunque en muy baja frecuencia solo ocurrió en los pacientes portadores de VHC. En casi todos los estudios consultados, el fallecimiento por afecciones hepáticas se sitúa entre la cuarta y quinta causa de defunción en esta población con una frecuencia relativa de 8-28 %.20,40 Específicamente, en el meta-análisis de estudios observacionales realizado por Fabrizi12 se encontró una correlación significativa entre el efecto del VHC con el riesgo de mortalidad asociada a enfermedad hepática y cardiovascular con una razón de odds de 11,6 y 2,15; respectivamente.
Debe considerarse en esta investigación como posible limitación el hecho que se trata de un estudio retrospectivo.